Новый вид антибиотика открыт в ходе изучения соплей
- Джеймс Галлахер
- Обозреватель Би-би-си по науке и здравоохранению
Автор фото, Thinkstock
Анализируя бактерии, живущие внутри человеческого носа, ученые открыли новый вид антибиотиков.
Как сообщает журнала Nature, исследователи нашли соединение «лугдунин», которое может бороться с инфекциями, порождаемыми супербактериями.
Последний раз новый класс антибиотиков был открыт в 1980-х годах.
Практически все антибиотики до этого были обнаружены в колониях почвенных бактерий, однако ученые из Тюбингенского университета в Германии впервые решили обратиться в своих исследованиях к человеческому телу. Они полагают, что наше тело — неисчерпаемый источник новых лекарств.
Страшные супербактерии
Наше тело не слишком похоже на поле боя, но на микроскопическом уровне внутри него постоянно идет борьба между конкурирующими видами бактерий.
И, как давно догадывались ученые, одно из оружий, которое применяется в этой борьбе, — это антибиотики.
Среди бактерий, которые любят брать штурмом человеческий нос, есть золотистый стафилококк. А также его супервид — метициллинрезистентный золотистый стафилококк (MRSA), устойчивый к большинству антибиотиков.
Он живет в носу 30% всех людей. Но как насчет остальных 70%?
Автор фото, SCIENCE PHOTO LIBRARY
Подпись к фото,Так под микроскопом выглядит бактерия золотистого стафилококка, живущая в носу у многих людей
Ученые обнаружили, что люди с конкурирующей бактерией Staphylococcus lugdunensis, живущей в их носах, с меньшей вероятностью будут атакованы опасным золотистым стафилококком.
Затем они использовали несколько штаммов генетически модифицированной Staphylococcus lugdunensis, чтобы выяснить, какая именно часть ее генетического кода оказалось решающей в борьбе за место в носу.
Именно так произошло важное открытие — один решающий ген содержал информацию, которую ученые использовали для создания нового антибиотика, получившего имя «лугдунин».
Опыты на лабораторных мышах показали, что лугдунин способен лечить кожные инфекции, вызванные супербактериями, включая метициллинрезистентный золотистый стафилококк и фекальный энтерококк.
«Некоторые из подопытных животных были полностью излечены — на них не осталось ни одной клетки бактерии. В других случаях количество бактерий сократилось, часть из них осталась, но мы также увидели, что это соединение проникло вглубь ткани и действовало на более глубоких слоях кожи», — рассказывает один из ученых, Бернхард Крисмер.
Прежде чем лугдунин будет предложен пациентам, должны пройти годы исследований, которые, кроме всего прочего, могут показать, что новый антибиотик не обладает заявленной эффективностью.
Но в любом случае, открытие новых антибиотиков необходимо. Медики по всему миру все чаще сталкиваются с тем, что инфекции вырабатывают устойчивость к имеющимся препаратам, а значит, рано или поздно могут стать неизлечимыми.
Богатое на открытия человеческое тело
Профессор Андреас Пешел считает, что человеческое тело должно быть исследовано на предмет новых видов антибиотиков.
«Лугдунин может стать первым примером таких антибиотиков — и мы уже запустили программу соответствующих исследований», — говорит он.
Пешел полагает, что в будущем люди будут лечиться от инфекций путем искусственного заражения генетически-модифицированными бактериями.
«Путем введения лугдунина в безобидные виды бактерий мы надеемся разработать новый тип превентивных антибиотиков, которые смогут уничтожать болезнетворные организмы», — поясняет профессор.
«Кажется удивительным, что часть человеческой микробиоты — всех бактерий, населяющих тело, — может быть источником антибиотиков, — замечают профессор Ким Льюис и доктор Филипп Штрандвиц из центра противомикробных исследований Северно-Восточного университета в США. — Тем не менее, микробиота состоит из более чем тысячи видов бактерий, многие из которых сражаются за питательные вещества и пространство внутри человеческого тела, и конкуренция с соседствующими бактериями очень высока».
«Изменение баланса бактерий внутри тела путем производства натуральных антибиотиков может быть в итоге использовано для борьбы с бактериальными инфекциями, — считает профессор Колин Гарнер, глава британского Центра исследования антибиотиков. — Вполне возможно, что это исследование — первое в череде многих, доказывающих, что бактерии внутри нашего организма могут производить новые антибиотики с новыми химическими структурами».
«Например, недавно был опубликован доклад о том, что у мужчин с бородой меньше болезнетворных микроорганизмов (включая метициллинрезистентный золотистый стафилококк), чем у мужчин, которые бреются. Это дает основания рассматривать открытие лугдунина в том же контексте, что и наличие растительности на лице — как защищающее нас от инфекций», — добавляет профессор.
Ученые нашли новый антибиотик в человеческом носу. — Наука
Антибиотики — главное оружие человечества в борьбе с инфекционными заболеваниями, однако их эффективность постепенно падает. Дело в том, что многие патогены выработали устойчивость к антибиотикам, а некоторые — даже мультирезистентноcть, невосприимчивость к целому набору лекарств. По прогнозу Всемирной организации здравоохранения, в ближайшие десятилетия смертность от них может превысить смертность от рака. Чтобы выиграть это противостояние, ученые постоянно ищут новые антибиотики и порой находят их в неожиданных местах, например в рецепте средневековой мази.
Дело в том, что многие патогены выработали устойчивость к антибиотикам, а некоторые — даже мультирезистентноcть, невосприимчивость к целому набору лекарств. По прогнозу Всемирной организации здравоохранения, в ближайшие десятилетия смертность от них может превысить смертность от рака. Чтобы выиграть это противостояние, ученые постоянно ищут новые антибиотики и порой находят их в неожиданных местах, например в рецепте средневековой мази.В поисках антимикробных препаратов авторы новой работы изучали микрофлору слизистой носа человека. Они заметили, что золотистый стафилококк Staphylococcus aureus редко «соседствует» в человеческом носу со своим родственником — Staphylococcus lugdunensis. Тот же результат удалось воспроизвести на чашках Петри: присутствие S.lugdunensis подавляло рост золотистого стафилококка. «Вырезая» отдельные части генома бактерии, ученые определили, какой участок в нем отвечает за синтез нового пептидного антибиотика — лугдунина.
Затем исследователи проверили эффективность лугдунина против человеческих патогенов: нескольких штаммов антибиотикорезистентных золотистых стафилококков и устойчивых к ванкомицину энтерококков. На все патогены лугдунин оказывал бактерицидное действие, даже в небольших концентрациях. Кроме того, эксперименты на мышах, зараженных золотистым стафилококком, показали, что лугдунин убивал практически все клетки S.aureus. При этом даже длительное применение лугдунина не вырабатывало у стафилококка устойчивость.
На все патогены лугдунин оказывал бактерицидное действие, даже в небольших концентрациях. Кроме того, эксперименты на мышах, зараженных золотистым стафилококком, показали, что лугдунин убивал практически все клетки S.aureus. При этом даже длительное применение лугдунина не вырабатывало у стафилококка устойчивость.
Авторы работы отмечают, что раньше антибиотики выделяли, как правило, из почвенных бактерий и грибов, но не представителей микрофлоры человека. Пример лугунина показывает, что в будущем стоит рассматривать ее как источник новых антимикробных веществ.
Исследование ученых из Тюбингского университета в Германии опубликовано в журнале Nature.
В носу у людей нашли уникальный антибиотик, побеждающий золотистый стафилококк
Найден сильнейший новый антибиотик, убивающий золотистый стафилококк.
Фото: GLOBAL LOOK PRESS
ОПАСНОСТЬ, КОТОРАЯ ПОДСТЕРЕГАЕТ КАЖДОГО ТРЕТЬЕГО
Золотистый стафилококк — один из самых «вредных» микробов. По оценкам экспертов, он живет в организме у 25 — 40% населения планеты, то есть у каждого третьего — четвертого человека на Земле. Пациенты, у которых эта бактерия обнаружилась в анализах (слюне, мазках из носа и др.), в курсе: извести инфекцию невероятно сложно. Золотистый стафилококк прочно поселяется у нас внутри, затаивается, а как только наступит кризисная ситуация — сильные стрессы, ослабление иммунных сил, травмы и т.п. — активизируется в полную силу. И может причинить немало бед. Этот микроб отвечает за многие нарушения здоровья — от угрей и фурункулов на коже, хронических ринитов (мучительная заложенность носа) до повреждения оболочек головного мозга (менингитов), болезней сердечно-сосудистой системы и пневмоний, которые практически не поддаются лечению большинством современных антибиотиков.
По оценкам экспертов, он живет в организме у 25 — 40% населения планеты, то есть у каждого третьего — четвертого человека на Земле. Пациенты, у которых эта бактерия обнаружилась в анализах (слюне, мазках из носа и др.), в курсе: извести инфекцию невероятно сложно. Золотистый стафилококк прочно поселяется у нас внутри, затаивается, а как только наступит кризисная ситуация — сильные стрессы, ослабление иммунных сил, травмы и т.п. — активизируется в полную силу. И может причинить немало бед. Этот микроб отвечает за многие нарушения здоровья — от угрей и фурункулов на коже, хронических ринитов (мучительная заложенность носа) до повреждения оболочек головного мозга (менингитов), болезней сердечно-сосудистой системы и пневмоний, которые практически не поддаются лечению большинством современных антибиотиков.
Словом, поиск нового действенного оружия против золотистого стафилококка — один из самых актуальных вызовов для ученых и врачей сегодня.
КТО НА СЛИЗИСТОЙ ЖИВЕТ?
Новость о прорыве пришла из лаборатории немецкого ученого Александра Ципперера (Университет Тюбингена). Исследователи опубликовали в авторитетном международном научном журнале Nature революционные итоги своей работы: найден сильнейший новый антибиотик, убивающий золотистый стафилококк. По просьбе «КП» оригинал исследования изучил эксперт по прикладным биомедицинским технологиям Андрей Гаража.
Исследователи опубликовали в авторитетном международном научном журнале Nature революционные итоги своей работы: найден сильнейший новый антибиотик, убивающий золотистый стафилококк. По просьбе «КП» оригинал исследования изучил эксперт по прикладным биомедицинским технологиям Андрей Гаража.
— Сотрудники Университета Тюбингена во главе с Александром Ципперером обнаружили, что у человека в носу, на слизистой, может жить «собрат» золотистого стафилококка — бактерия того же семейства, но другого вида: Staphylococcus lugdunensis, — поясняет ученый. — Этот микроб условно патогенный, то есть в некоторых случаях вызывает заболевания, но, как правило, является безобидным сожителем человека.
Однако, как выяснилось, для золотистого стафилококка lugdunensis — настоящий смертельный враг!
УБИТЬ БАКТЕРИЙ-КОНКУРЕНТОВ
— Разумеется, бактерии осознанно не воюют друг с другом, чтобы сделать лучше для людей, — улыбается Андрей Гаража. – У них идёт постоянная борьба за ресурсы, за территорию, на которой можно жить и размножаться. В данном случае этой территорией является слизистая оболочка носа человека. Команда Цеперрера обследовала почти 200 добровольцев, и выяснилось: у 60 человек (32%) в носу «живет» золотистый стафилококк, у 17 человек (10%) обитает Staphylococcus lugdunensis. И при этом только у одного из этих 17-ти обнаруживается золотистый стафилококк. Исследователи предположили, что lugdunensis каким-то образом подавляет, выживает своего «золотистого собрата». Эту гипотезу проверили в различных лабораторных опытах, в том числе на животных.
– У них идёт постоянная борьба за ресурсы, за территорию, на которой можно жить и размножаться. В данном случае этой территорией является слизистая оболочка носа человека. Команда Цеперрера обследовала почти 200 добровольцев, и выяснилось: у 60 человек (32%) в носу «живет» золотистый стафилококк, у 17 человек (10%) обитает Staphylococcus lugdunensis. И при этом только у одного из этих 17-ти обнаруживается золотистый стафилококк. Исследователи предположили, что lugdunensis каким-то образом подавляет, выживает своего «золотистого собрата». Эту гипотезу проверили в различных лабораторных опытах, в том числе на животных.
Эксперт «КП» по прикладным биомедицинским технологиям Андрей Гаража
— Оказалось, что в ходе борьбы за выживание Staphylococcus lugdunensis вырабатывает вещество, которое действует как успешное оружие, уничтожающее золотистый стафилококк, — продолжает наш эксперт. — А вещество, которое один тип бактерий выделяет для уничтожения другого типа бактерий, есть не что иное, как антибиотик. Открытую субстанцию — по сути, новое антимикробное лекарство — назвали лугдунином.
Открытую субстанцию — по сути, новое антимикробное лекарство — назвали лугдунином.
Ученые смогли химически синтезировать его, испытали на мышах и хомяках, зараженных золотистым стафилококком: у подопытных животных лугдунин показал высокую эффективность и смог побороть инфекцию!
СТАТЬ УСТОЙЧИВЫМИ МИКРОБАМ БУДЕТ НЕПРОСТО
Дальнейшие лабораторные опыты на клеточных культурах показали: лугдунин также убивает и другие штаммы болезнетворного золотистого стафилококка, которые встречаются у людей. Кроме того, новый антибиотик, похоже, обладает повышенной защитой от резистентности, то есть способности вредных микробов приспосабливаться и выживать, «наплевав» на лекарства.
Выяснилось, что лугдунин действует комплексно сразу на несколько жизненно-важных мишеней золотистого стафилококка, поэтому стать устойчивыми микробам будет непросто. Тестирование в лаборатории показало, что резистентность к лугдунину не возникает даже в наиболее «выгодных» для золотистого стафилококка условиях.
ВАЖНО
— Фактически это один из первых, подтвержденных публикацией в авторитетном научном журнале методов «извлечения» антибиотика из бактерии, живущей в человеке, а не где-то на глубине океана или в слое почвы, — отмечает эксперт по прикладным биомедицинским технологиям Андрей Гаража. – До этого был известен только антибиотик лактоциллин, который вырабатывается бактериями, живущими на слизистой влагалища. Если дальнейшие исследования подтвердят эффективность и безопасность лугдунина, то смело можно будет говорить о том, что открыта новая эра поиска и создания лекарств-антибиотиков: их «добывания» из микробиома человека, то есть совокупности микроорганизмов, живущих внутри нас и на поверхности нашего тела. Такой подход позволит относительно быстро, дешево и успешно находить новые варианты для борьбы с болезнетворными бактериями, вырабатывающими устойчивость к современным антибиотикам.
В человеческом носу нашли новый антибиотик
Одна из бактерий, обитающих в слизистой носа, избавляется от соседей-конкурентов с помощью противомикробного «химического оружия».
Бактерии умеют очень хорошо приспосабливаться к антибиотикам, и сейчас часто можно услышать о самой настоящей гонке вооружений между микробами и людьми.
Лекарственно-устойчивый штамм MRSA золотистого стафилококка. (Фото NIAID / www.flickr.com/photos/niaid/5614218718.)‹
›
В поисках новых лекарств, которые преодолели бы бактериальную устойчивость к антибиотикам, медики и биологи идут на всё более хитроумные уловки: на предмет новых антибактериальных веществ исследуются микроорганизмы, которые вообще невозможно выращивать в лаборатории, предпринимаются попытки создать лекарство, похожее на вирус, и т. д.
Новый, совсем уж удивительный источник противомикробных средств описывают в своей статье в
По статистике, у каждого третьего человека в носовой полости можно найти золотистого стафилококка Staphylococcus aureus, который, просто сидя на коже или на слизистой, ведёт себя прилично, но, попав в организм, может вызывать самые разные заболевания, от фурункулов до пневмонии и сепсиса.
Кроме того, золотистый стафилококк известен штаммом MRSA, обладающим множественной лекарственной устойчивостью. «Супербактерия» MRSA давно стала головной болью для медиков: так, в США от устойчивого к антибиотикам стафилококка ежегодно умирают около 10 тыс. человек; понятно, почему S. aureus пользуется повышенным вниманием со стороны медиков и биологов.
И вот Бернхард Крисмер (Bernhard Krismer), Андреас Пешель (Andreas Peschel) и их коллеги захотели узнать, почему эта бактерия встречается не в каждом носу. Оказалось, что всё дело в конкуренции между разными микробами. В слизистой носа живут и другие стафилококки, не только стафилококк золотистый. Однако среда обитания здесь скудна питательными веществами, так что бактерии всё время ищут способ избавиться от конкурентов. Одно из таких веществ, синтезируемое стафилококком S. lugdunensis, получило название люгдунин (lugdunin): с его помощью S. lugdunensis вытесняет из слизистой носа S. aureus.
aureus.
По словам авторов работы, люгдунин подавлял рост золотистого стафилококка и в культуре клеток, и на коже мышей, и, что особенно важно, он был эффективен не только против обычного
Антибиотики в большинстве случаев представляют собой химическое оружие, с помощью которого одни бактерии (или грибы) борются с другими. Люгдунин тут не исключение: S. lugdunensis весьма эффективно использует его против S. aureus – из 187 людей, у которых проанализировали состав микрофлоры носа, у 60 человек был золотистый стафилококк, у 17 – S. lugdunensis, и только у одного – обе бактерии вместе.
Возможно, когда мы узнаем механизм действия нового антибиотика, его тоже можно будет сделать мощнее. Саму бактерию S. lugdunensis использовать в качества лекарства не выйдет, поскольку, как считается, она связана с инфекциями глаз, кожи, суставов и даже сердца.
Самое необычное здесь то, откуда достали очередное антибактериальное вещество – не из почвенных бактерий, не из подземных пещер, а из собственной микрофлоры человека. Сообщества микроорганизмов, которые живут у нас в носу, на коже, в слизистой глаза, на протяжении долго времени учились бороться с конкурентами, так что на исключено, что наши собственные микробы могут стать свежим источником ещё не испробованных антибиотиков.
Впрочем, не стоит забывать, что в принципе использование антибиотиков в последнее время сталкивается с растущим скептицизмом: способность бактерий приспосабливаться к ним кажется безграничной, и пусть тот же золотистый стафилококк не смог стать устойчивым к люгдунину за тридцать дней – он станет таким через полгода или через год.
Так что параллельно с поиском новых антибиотиков лучше искать и какие-то другие, принципиально иные способы бороться с бактериальными инфекциями.
Посев на золотистый стафилококк с определением чувствительности к антибиотикам (нос, зев, пазухи и др.
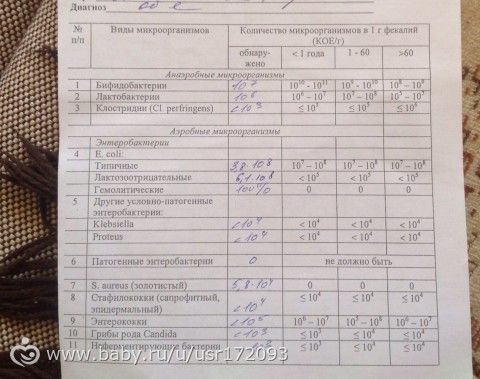 )
)Медицинский центр
8(495)741-10-01
м. «Алексеевская», Проспект Мира, 102, стр. 23
ежедневно
08:00 — 20:00
Посев отделяемого из глаз, ушей, верхних дыхательных путей на золотистый стафилококк с определением чувствительности к антибиотикам – проводится для диагностики стафилококковой инфекции глаз, ушей, верхних дыхательных путей.
Дополнительно рекомендуемые тесты: посев отделяемого глаз, ушей верхних дыхательных путей на аэробные и факультативно-анаэробные бактерии; посев отделяемого глаз, ушей верхних дыхательных путей на анаэробные бактерии; посев отделяемого глаз, ушей верхних дыхательных путей на дрожжевые грибы.
Показания к проведению исследования
- Подозрение на стафилококковую инфекцию глаз, ушей, верхних дыхательных путей.

- Контроль эффективности лечения.
Подготовка к исследованию
- Взятие биоматериала на исследование должно проводиться до применения антибиотиков и других химиотерапевтических препаратов или после их отмены через 2-3 дня. Материал собирается в стерильную пробирку с транспортной средой Амиес.
Факторы, влияющие на результат исследования
Нарушение правил взятия биоматериала; нарушение температурного режима хранения и доставки биоматериала в лабораторию; нарушение сроков доставки биоматериала в лабораторию.
Срок исполнения: 3 — 7 дней
Материал для анализа: отделяемое глаз, ушей, верхних дыхательных путей
Записаться на приём
Ниже указаны приёмные дни и часы специалиста. После того, как вы оставите заявку, мы свяжемся с вами для уточнения записи.
Все права защищены. ООО «АКУШЕРСТВО»
Москва, № ЛО-77-01-016464 от 7 августа 2018 г.
Учредитель — Чак Арина Александровна
Юридический адрес —
129626, г. Москва, Мира пр-кт, д.102, стр.23
Посев из раны на золотистый стафилококк (S. aureus) с определением чувствительности к антимикробным препаратам и бактериофагам
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
кожи (карбункулам, импетиго, фолликулиту),
молочных желез (маститу),
дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии),
мочевыводящих путей (уретриту, циститу, пиелонефриту),
пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу),
костно-суставной системы (остеомиелиту, артриту).
В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т. к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 103. Однако более высокие показатели говорят нам о золотистом стафилококке как о причине заболевания, и это уже далеко не бессимптомное носительство.
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
Лечение больных стафилококковой болезнью препаратами пенициллина или другими давно применяемыми антибиотиками часто остаётся безрезультатным, поскольку такие препараты нередко только усугубляют тяжесть течения инфекции. Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.
Для чего используется исследование?
Для определения целесообразности лечения.
Для дифференциации бактерионосительства и опасного инфицирования.
Для контроля за состоянием пациента после проведенного лечения.
Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Необходимость исследования биологического материала, полученного пр хирургических вмешательствах определяется врачом и производится в условиях стационара квалифицированным персоналом.
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нормальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы. Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Посев на золотистый стафилококк без определения чувствительности к антибиотикам (нос)
В верхних дыхательных путях содержатся разнообразные микроорганизмы — представители нормальной микрофлоры. Нормальная микрофлора полости рта и глотки представлена: Streptococcus spp., Haemophilus spp., Lactobacillus spp., Neisseria spp., Staphylococcus spp., Treponema spp., Candida spp. и другими.
Стафилококки — неподвижные грамположительные кокки, широко распространены в окружающей среде. Золотистый стафилококк (Staphylococcus aureus) относится к патогенным микроорганизмам, но данный микроорганизм чрезвычайно распространён среди людей и может быть обнаружен у 15-30% здоровых лиц. S.aureus часто колонизирует у человека слизистую оболочку носа.

Материал для исследования следует брать до начала антибактериальной терапии, включая различные полоскания, или через 12-14 дней после завершения курса лечения.
Взятие биоматериала проводится натощак или не ранее, чем через 2 часа после приема пищи с помощью стерильных зондов медицинским персоналом по инструкции. Перед манипуляциями полоскание рта не проводится.
Исследование обычно проводится при подозрении на носительство золотистого стафилококка (Staphylococcus aureus) и других рекомендаций специалистов. Представленные данные не могут быть использованы пациентом для самодиагностики и самолечения. Правильный диагноз ставит только лечащий врач на основании результатов лабораторных исследований, клинической картины заболевания и инструментального обследования. В соответствии с поставленным диагнозом лечащий врач назначает лечение.
В соответствии с поставленным диагнозом лечащий врач назначает лечение.
Влияние лечения мупироцином на носительство Staphylococcus aureus через нос, глотку и промежность у здоровых взрослых
РЕЗЮМЕ
Носительство через нос Staphylococcus aureus является важным фактором риска заражения S. aureus . Мазь для носа с мупироцином в настоящее время является препаратом выбора для деколонизации передних носовых ходов. Однако недавние клинические испытания показывают ограниченную пользу от профилактики мупироцином в предотвращении внутрибольничных инфекций S. aureus , вероятно, из-за (повторной) колонизации из мест экстраназального носительства.В связи с этим мы изучили эффективность лечения назальной мазью мупироцином на динамику носительства S. aureus через нос и через нос. У 20 не-носителей, 26 прерывистых носителей и 16 постоянных носителей были взяты пробы из носа, горла и промежности за 1 день до и через 5 недель после лечения мупироцином (два раза в день в течение 5 дней) и проведена оценка роста S. aureus . Идентичность культивируемых штаммов оценивали по полиморфизму длин рестрикционных фрагментов генов коагулазы и протеина А.Общая частота носителей (носительство через нос, глотку, промежность или их комбинация) значительно снизилась после лечения мупироцином с 30 до 17 носителей ( P = 0,003). Из 17 носителей 10 (60%) все еще были колонизированы своим старым штаммом, 6 (35%) были колонизированы экзогенным штаммом, а 1 (5%) был колонизирован обоими. Двое не являющихся носителями стали носителями после лечения. Приобретение экзогенных штаммов после лечения мупироцином — обычное явление. Это открытие подтверждает использование мупироцина только у проверенных носителей для целей деколонизации.В целом мупироцин эффективен при деколонизации носовых носителей, но менее эффективен при деколонизации экстраназальных участков.
aureus . Идентичность культивируемых штаммов оценивали по полиморфизму длин рестрикционных фрагментов генов коагулазы и протеина А.Общая частота носителей (носительство через нос, глотку, промежность или их комбинация) значительно снизилась после лечения мупироцином с 30 до 17 носителей ( P = 0,003). Из 17 носителей 10 (60%) все еще были колонизированы своим старым штаммом, 6 (35%) были колонизированы экзогенным штаммом, а 1 (5%) был колонизирован обоими. Двое не являющихся носителями стали носителями после лечения. Приобретение экзогенных штаммов после лечения мупироцином — обычное явление. Это открытие подтверждает использование мупироцина только у проверенных носителей для целей деколонизации.В целом мупироцин эффективен при деколонизации носовых носителей, но менее эффективен при деколонизации экстраназальных участков.
У человека нос является основным резервуаром S. aureus (6, 7). Примерно 30% здорового населения носят в носу S. aureus , что является важным фактором риска заражения S. aureus (6). Носители S. aureus через нос имеют в три раза повышенный риск нозокомиальной бактериемии S. aureus по сравнению с не носителями (16).Приблизительно 80% инвазивных нозокомиальных инфекций S. aureus имеют эндогенное происхождение у носителей через нос (14, 16).
aureus (6). Носители S. aureus через нос имеют в три раза повышенный риск нозокомиальной бактериемии S. aureus по сравнению с не носителями (16).Приблизительно 80% инвазивных нозокомиальных инфекций S. aureus имеют эндогенное происхождение у носителей через нос (14, 16).
Мазь для носа с мупироцином эффективна для временного уничтожения S. aureus из носа. Сообщается, что при нанесении мупироцина в нос два раза в день в течение 5 дней подряд уровень его выведения составляет 91% сразу после терапии, 87% через 4 недели и 48% через 6 месяцев (2). Однако, несмотря на эти высокие темпы выведения, три недавних клинических исследования показали незначительную эффективность мупироцина в предотвращении нозокомиального S.aureus (5, 9, 18).
Чтобы определить влияние лечения мупироцином на носительство S. aureus в экстраназальных участках, мы изучили влияние лечения мупироцином на различные типы носителей: постоянные, прерывистые и неназальные носители S. aureus. Глоточное носительство S. aureus также оценивалось, поскольку назальное применение мупироцина приводит к низким концентрациям препарата в глотке (13, 15). Кроме того, оценивалось перинеальное носительство, поскольку известно, что носители промежности распространяют более S.aureus в окружающую среду (10). Также были включены не-носители, чтобы можно было определить, может ли применение мупироцина у не-носителей привести к носительству из-за потери устойчивости к колонизации (12). Чтобы оценить роль мест экстраназального носительства в реколонизации носа после лечения мупироцином, все штаммы были генотипированы.
aureus. Глоточное носительство S. aureus также оценивалось, поскольку назальное применение мупироцина приводит к низким концентрациям препарата в глотке (13, 15). Кроме того, оценивалось перинеальное носительство, поскольку известно, что носители промежности распространяют более S.aureus в окружающую среду (10). Также были включены не-носители, чтобы можно было определить, может ли применение мупироцина у не-носителей привести к носительству из-за потери устойчивости к колонизации (12). Чтобы оценить роль мест экстраназального носительства в реколонизации носа после лечения мупироцином, все штаммы были генотипированы.
МАТЕРИАЛЫ И МЕТОДЫ
Популяция исследования и общий дизайн исследования. Здоровые взрослые добровольцы ( n = 165) были проверены на носительство S.aureus как минимум пять раз с интервалом в 1 неделю. Участника считали постоянным носителем, если по крайней мере 80% культур были положительными на S. aureus , как неносителя, если все назальные культуры были отрицательными на S. aureus , и как прерывистый носитель во всех остальных случаях. В исследование были включены только участники, которые посетили все культурные мероприятия.
aureus , и как прерывистый носитель во всех остальных случаях. В исследование были включены только участники, которые посетили все культурные мероприятия.
Лечение и последующее наблюдение. Участники, давшие информированное согласие, самостоятельно вводили 2% назальную мазь с мупироцином (SmithKline Beecham, Rijswijk, Нидерланды) два раза в день в течение 5 дней в соответствии с рекомендациями производителя.Образцы из носа, глотки и промежности брали непосредственно перед лечением мупироцином и один раз через 5 недель после лечения. Неудача терапии была определена как наличие положительного посева из носа на S. aureus через 5 недель после окончания лечения. Культуру из носа брали путем четырехкратного вращения стерильного тампона в передних носовых ходах (Transwab; Medical Wire and Equipment Co. Ltd., Коршам, Англия). Все мазки были обработаны в один день. Мазок помещали на среду для чашек с кровяным агаром Columbia (Becton-Dickinson, Etten-Leur, Нидерланды) и погружали в бульон с фенол-красным маннитом. Планшеты считывали через 1 и 2 дня инкубации, а бульоны считывали через 3 дня инкубации при 35 ° C. Бульоны с изменением цвета с красного на оранжево-желтый пересевали на чашки с кровяным агаром. Идентификация S. aureus была основана на морфологии колонии, окраске по Граму, тесте на каталазу и тесте латексной агглютинации (Staphaurex Plus; Murex, Дартфорд, Великобритания).
Планшеты считывали через 1 и 2 дня инкубации, а бульоны считывали через 3 дня инкубации при 35 ° C. Бульоны с изменением цвета с красного на оранжево-желтый пересевали на чашки с кровяным агаром. Идентификация S. aureus была основана на морфологии колонии, окраске по Граму, тесте на каталазу и тесте латексной агглютинации (Staphaurex Plus; Murex, Дартфорд, Великобритания).
Генотипирование. Генотипирование проводили на последнем штамме S. aureus , культивированном до обработки мупироцином, и на тех штаммах, которые культивировались после обработки мупироцином. ДНК S. aureus получали по методу Boom et al. (1). Полиморфизм длины рестрикционных фрагментов (ПДРФ) генов коагулазы и протеина А определяли для типирования всех культивируемых штаммов S. aureus , как описано ранее (3, 4). Гель-электрофорез в импульсном поле проводился для подтверждения результатов, полученных с помощью ПДРФ, при необходимости, в соответствии с ранее описанными методами (8). Штаммы считались неродственными, если образец ПДРФ гена коагулазы или гена протеина А отличался от такового у другого штамма.Картины гель-электрофореза в импульсном поле сравнивали с использованием критериев Tenover et al. (11).
Штаммы считались неродственными, если образец ПДРФ гена коагулазы или гена протеина А отличался от такового у другого штамма.Картины гель-электрофореза в импульсном поле сравнивали с использованием критериев Tenover et al. (11).
Статистический анализ. Волонтеры были классифицированы, как описано выше, как стойкие, прерывистые и неназальные носители с использованием результатов по меньшей мере пяти скрининговых культур. Для каждого типа носительства эффективность мупироцина оценивалась путем сравнения результатов культивирования образцов, взятых непосредственно перед обработкой мупироцином, с результатами культивирования образцов, взятых через 5 недель после обработки мупироцином.Терапия мупироцином считалась неэффективной, если у человека в носу находилось S. aureus , независимо от экстраназального носительства. При необходимости использовались непараметрические парные тесты. P Значения , двусторонние, <0,05 считались значимыми.
РЕЗУЛЬТАТЫ
По крайней мере, по пять серийных культур каждая была получена от 62 человек из исходной когорты 165 добровольцев.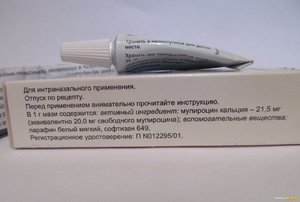 Двадцать добровольцев не являлись носителями (32%), 26 были прерывистыми носителями (42%) и 16 были постоянными носителями (26%) (таблица 1), и все они принимали участие в интервенции мупироцином.Никаких серьезных побочных эффектов не наблюдалось, и все добровольцы завершили лечение. Общая частота носителей (носительство через нос, глотку, промежность или их комбинация) значительно снизилась после лечения с 30 до 16 носителей ( P = 0,003) (Таблица 1).
Двадцать добровольцев не являлись носителями (32%), 26 были прерывистыми носителями (42%) и 16 были постоянными носителями (26%) (таблица 1), и все они принимали участие в интервенции мупироцином.Никаких серьезных побочных эффектов не наблюдалось, и все добровольцы завершили лечение. Общая частота носителей (носительство через нос, глотку, промежность или их комбинация) значительно снизилась после лечения с 30 до 16 носителей ( P = 0,003) (Таблица 1).
Изменение участков носительства непосредственно до и через 5 недель после лечения мупироцином
Мупироцин значительно снижает носительство в носу у постоянных носителей. Из 16 постоянных носителей у 1 носителя был отрицательный посев в носу непосредственно перед лечением мупироцином.Пять носителей (31%) потерпели неудачу в терапии через 5 недель после лечения мупироцином (таблица 1). Четыре оставались колонизированными одним и тем же штаммом, все из которых имели по крайней мере одно место экстраназального носительства (три глотки; одна промежность). Один доброволец приобрел новый штамм и никогда не переносил S. aureus в экстраназальные участки. У постоянных носителей мупироцин был эффективен при деколонизации S. aureus из носа через 5 недель после лечения ( P = 0,002), но не был эффективен при деколонизации горла и носительства в промежности ( P = 0.69 и P = 0,5 соответственно).
Один доброволец приобрел новый штамм и никогда не переносил S. aureus в экстраназальные участки. У постоянных носителей мупироцин был эффективен при деколонизации S. aureus из носа через 5 недель после лечения ( P = 0,002), но не был эффективен при деколонизации горла и носительства в промежности ( P = 0.69 и P = 0,5 соответственно).
После лечения мупироцином значительного снижения носительства у прерывистых носителей в носу не произошло. Из 26 прерывистых носителей 11 (42%) несли S. aureus непосредственно перед лечением. Трое из них (27%) потерпели неудачу в лечении. Два оставались колонизированными тем же штаммом, один из которых был носителем промежности до лечения. Из тех, кто не был носителем S. aureus непосредственно перед лечением, двое стали колонизированными после лечения, один из которых был комбинированным носителем через глотку и промежность непосредственно перед лечением.В целом, лечение мупироцином не привело к значительному снижению носительства в носу ( P = 0,11), глотке ( P = 0,29) и промежности ( P = 1,0) в этой подгруппе прерывистых носителей.
Редкое приобретение экзогенного S. aureus после лечения мупироцином у неназальных носителей. В группе, не являющейся носителем ( n = 20), до лечения мупироцином был обнаружен один явный носитель горла. После обработки два не носителя были колонизированы S.aureus (10%), один из которых до лечения переносил S. aureus в экстраназальных участках. Глоточный носитель оставался глоточным носителем того же штамма.
Особое внимание уделяется глоточному носительству ( n = 16) и промежностному носительству ( n = 5) . В целом, до лечения было 16 носителей через глотку, независимо от носительства в других местах (12 также носили через нос). У 5 из 12 носителей через нос (42%) деформация глотки отличалась от деформации носа.После лечения шесть (38%) остались носителями горла, один из которых приобрел новый штамм, что привело к значительному снижению носительства в горле после лечения мупироцином ( P = 0,002). Интересно, что из тех, кто не был носителем горла до лечения ( n = 46), пять (11%) стали колонизированными в горле S. aureus . Четыре из этих новых носителей горла были носителями до лечения, а один — не носителями.
Интересно, что из тех, кто не был носителем горла до лечения ( n = 46), пять (11%) стали колонизированными в горле S. aureus . Четыре из этих новых носителей горла были носителями до лечения, а один — не носителями.
Было пять носителей промежности (четыре были носителями носа) до лечения и трое после лечения (незначительное снижение).Только один носитель в промежности оставался носителем после лечения мупироцином с идентичным штаммом. Два неперинеальных носителя стали перинеальными носителями после лечения, один из них имел эндогенный штамм.
ОБСУЖДЕНИЕ
Наши результаты показали эффективность мупироцина при деколонизации носа через 5 недель после лечения, аналогичную той, о которой сообщалось в предыдущих исследованиях (2). Мы обнаружили, что S. aureus элиминация носительства составляет 69% у постоянных носителей и 58% у прерывистых носителей.Неэффективность терапии вряд ли связана с резистентностью к мупироцину, поскольку распространенность устойчивых к мупироцину штаммов в Нидерландах очень низка: ни одного не было обнаружено у> 1000 штаммов (18). Только один штамм оказался устойчивым к мупироцину после терапии в нашем исследовании (данные не показаны). Хотя распространенность метициллин-устойчивого S. aureus очень низка в Нидерландах, результаты этого исследования могут быть экстраполированы на эндемический метициллин-устойчивый S. aureus , если штаммы чувствительны к мупироцину (17). ).
Только один штамм оказался устойчивым к мупироцину после терапии в нашем исследовании (данные не показаны). Хотя распространенность метициллин-устойчивого S. aureus очень низка в Нидерландах, результаты этого исследования могут быть экстраполированы на эндемический метициллин-устойчивый S. aureus , если штаммы чувствительны к мупироцину (17). ).
Мазь для носа с мупироцином также оказала значительное влияние на деколонизацию носительства в глотке S. aureus , но не на носительство в промежности. Эффективность мупироцина в снижении частоты перинеального носительства в этой когорте была низкой из-за нового приобретения S. aureus в этом месте. В отличие от носительства через нос, где эффективность намного выше, мупироцин, по-видимому, не оказывает профилактического действия на носительство в промежности S. aureus . Хотя нос является основным резервуаром для S.aureus , как мы видели в нашем исследовании, местное нанесение мупироцина на нос напрямую не влияет на промежность. Применение местного антибиотика или дезинфицирующего средства на промежности может быть вариантом оптимальной деколонизации.
Применение местного антибиотика или дезинфицирующего средства на промежности может быть вариантом оптимальной деколонизации.
Интересно, что 10 добровольцев стали колонизироваться на новых участках через 5 недель после лечения мупироцином, 5 из них — с экзогенными штаммами (2 не были носителями). Более того, два носителя колонизировали экзогенными штаммами на своих старых участках после обработки.В целом, мы можем констатировать, что из 17 носителей на любом участке после обработки 10 (60%) были колонизированы их старыми штаммами, 6 (35%) были колонизированы экзогенным штаммом, а 1 (5%) был колонизирован обоими штаммами. старые и экзогенные штаммы. Следовательно, приобретение экзогенных штаммов после лечения мупироцином — обычное явление. Обнаружение того, что два человека, не являющихся носителями, стали носителями после лечения (17% всех неудач терапии), подтверждает использование мупироцина только у проверенных носителей для целей деколонизации.Мупироцин также уничтожает коагулазонегативные стафилококки и коринебактерии, которые могут присутствовать у лиц, не являющихся носителями, и это изменение носовой флоры может способствовать колонизации S. aureus за счет устранения бактериального вмешательства (12).
aureus за счет устранения бактериального вмешательства (12).
Мы пришли к выводу, что мупироцин в целом эффективен при деколонизации носовых носителей, но менее эффективен при деколонизации экстраназальных участков. Эти экстраназальные участки могут быть источниками инфекций S. aureus . Большинство S.aureus у тех, кто остается колонизированными через 5 недель после лечения, были эндогенными, но происходит приобретение экзогенных штаммов S. aureus , что гарантирует выполнение деколонизации только у проверенных носителей. Кроме того, пациенты, получавшие мупироцин, должны получить последующие посевы для определения неэффективности лечения, что уже было введено для пациентов на диализе.
СНОСКИ
- Получено 19 июля 2004 г.
- Возвращено на доработку 11 октября 2004 г. highwire.org/Journal» hwp:start=»2004-11-30″> Принято 30 ноября 2004 г.
- Авторское право © 2005 Американское общество микробиологов
ССЫЛКИ
- 1.↵
Бум, Р., Си Джей Сол, М.М. Салиманс, К.Л. Янсен, П.М. Вертхайм-ван Диллен и Дж. Ван дер Нурдаа. 1990. Быстрый и простой метод очистки нуклеиновых кислот. J. Clin. Microbiol.28 : 495-503.
- 2.↵
Doebbeling, B. N., D. L. Breneman, H.К. Ной, Р. Али, Б. Г. Янгко, Х. П. Холли, младший, Р. Дж. Марш, М. А. Пфаллер, Дж. Э. Макгоуэн, младший, Б. Е. Скалли и др. 1993. Устранение носительства Staphylococcus aureu через нос у медицинских работников: анализ шести клинических испытаний с мазью мупироцина кальция. Clin. Заразить. Дис.17 : 466-474.
- 3.↵
Frenay, H.M., J.P. Theelen, L.M.Schouls, C.M Vandenbroucke-Grauls, J. Verhoef, W.J.
 van Leeuwen и F.R. Mooi. 1994. Различение эпидемических и неэпидемических метициллин-устойчивых штаммов Staphylococcus aureus на основе полиморфизма гена протеина А. J. Clin. Microbiol.32 : 846-847.
van Leeuwen и F.R. Mooi. 1994. Различение эпидемических и неэпидемических метициллин-устойчивых штаммов Staphylococcus aureus на основе полиморфизма гена протеина А. J. Clin. Microbiol.32 : 846-847. - 4.
Го, С. Х., С. К. Бирн, Дж. Л. Чжан и А. В. Чоу.
- 5.↵
Kalmeijer, M. D., H. Coertjens, P. M. Van Nieuwland-Bollen, D. Bogaers-Hofman, G. A. De Baere, A. Stuurman, A. Van Belkum, J. A. Kluytmans. 2002. Инфекции в области хирургического вмешательства в ортопедической хирургии: эффект назальной мази с мупироцином в двойном слепом рандомизированном плацебо-контролируемом исследовании. Clin. Заразить. Дис.35 : 353-358.
- 6.↵
Kluytmans, J., A.
 van Belkum и H. Verbrugh. 1997. Носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски.Clin. Microbiol. Версия 10 : 505-520.
van Belkum и H. Verbrugh. 1997. Носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски.Clin. Microbiol. Версия 10 : 505-520. - 7.↵
Lowy, F. 1998. Staphylococcus aureus инфекций. N. Engl. J. Med. 339 : 520-532.
- 8.↵
Murchan, S., ME Kaufmann, A. Deplano, R. de Ryck, M. Struelens, CE Zinn, V. Fussing, S. Salmenlinna, J. Vuopio-Varkila, N. Эль Солх, К. Куни, В. Витте, П. Т. Тассиос, Н. Легакис, В. ван Леувен, А. ван Белкум, А. Виндел, И. Лаконча, Дж.Garaizar, S. Haeggman, B. Olsson-Liljequist, U. Ransjo, G. Coombes и B. Cookson. 2003. Гармонизация протоколов гель-электрофореза в импульсном поле для эпидемиологического типирования штаммов метициллин-устойчивого Staphylococcus aureus : единый подход, разработанный консенсусом в 10 европейских лабораториях, и его применение для отслеживания распространения родственных штаммов.
 J. Clin. Microbiol.41 : 1574-1585.
J. Clin. Microbiol.41 : 1574-1585. - 9.↵
Perl, T. M., J.Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Интраназальный прием мупироцина для профилактики послеоперационных инфекций Staphylococcus aureus . N. Engl. J. Med. 346 : 1871-1877.
- 10.↵
Solberg, C.O. 2000. Распространение Staphylococcus aureus в больницах: причины и профилактика. Сканд. J. Infect. Dis.32 : 587-595.
- 11.↵
Теновер, Ф. К., Р. Д. Арбейт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol.33 : 2233-2239.

- 12.↵
Уэхара Ю., Х. Накама, К. Агемацу, М. Учида, Ю. Каваками, А.С. Абдул Фаттах и Н. Маручи. 2000. Бактериальное вмешательство среди обитателей носа: уничтожение Staphylococcus aureus из носовых полостей путем искусственной имплантации Corynebacterium sp.J. Hosp. Инфекция 44 : 127-133.
- 13.↵
van der Vorm, E.R., and E.H. Groenendijk. 2003 г. Двое сотрудников больницы с горлом носительства метициллин-устойчивого Staphylococcus aureus , которым необходимо было лечить системными антибиотиками. Нед. Tijdschr. Geneeskd.147 : 1079-1081.
- 14.↵
фон Эйфф, К., К. Беккер, К. Машка, Х. Штаммер и Г. Петерс. 2001. Назальное носительство как источник бактериемии Staphylococcus aureus .N. Engl. J. Med. 344 : 11-16.
- 15.↵
Ватанабэ, Х.
 , Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать развитию устойчивости к мупироцину у метициллин-резистентного Staphylococcus aureus . J. Clin. Microbiol.39 : 3775-3777.
, Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать развитию устойчивости к мупироцину у метициллин-резистентного Staphylococcus aureus . J. Clin. Microbiol.39 : 3775-3777. - 16.↵
Wertheim, H.Ф., М. К. Вос, А. Отт, А. Белкум, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Риск и исход нозокомиальной бактериемии Staphylococcus aureus у носителей через нос по сравнению с не носителями. Lancet364 : 703-705.
- 17.↵
Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004 г.Низкая распространенность метициллинрезистентного Staphylococcus aureus (MRSA) при госпитализации в Нидерландах: значение поиска и уничтожения и ограничительного использования антибиотиков.
 J. Hosp. Заражение 56 : 321-325.
J. Hosp. Заражение 56 : 321-325. - 18.↵
Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных Staphylococcus aureus инфекций у нехирургических пациентов: рандомизированное исследование.Анна. Междунар. Мед. 140 : 419-425.
Нос знает, как убить MRSA: Nature News & Comment
WIN-Initiative / Getty
Человеческий нос больше не является просто источником крупных слизистых шариков.
Новый антибиотик оказался прямо у нас под носом, вернее, в них. Вырабатываемая бактерией, живущей в носу человека, эта молекула убивает потенциально смертоносный метициллин-устойчивый стафилококк aureus (MRSA) у мышей и крыс.
Staphylococcus aureus обитает в носу у 1 из 3 человек, не вызывая проблем. MRSA — штамм S. aureus , устойчивый ко многим антибиотикам, — встречается у 2 из 100. В небольшом проценте случаев бактерия проникает в кровоток, вызывая инфекцию. Только в Соединенных Штатах MRSA ежегодно убивает 11 000 человек.
MRSA — штамм S. aureus , устойчивый ко многим антибиотикам, — встречается у 2 из 100. В небольшом проценте случаев бактерия проникает в кровоток, вызывая инфекцию. Только в Соединенных Штатах MRSA ежегодно убивает 11 000 человек.
Потенциальным новым бойцом в борьбе с MRSA является молекула под названием лугдунин, продуцируемая бактерией Staphylococcus lugdunensis , сообщают Андреас Пешель и его коллеги из Тюбингенского университета, Германия, 27 июля в журнале Nature .
В выборке из 187 пациентов больницы люди, чьи носы в природе содержали S. lugdunensis , имели в шесть раз меньше шансов иметь S. aureus , чем люди, у которых в носу не было S. lugdunensis , как выяснила команда Пешеля. Это говорит о том, что S. lugdunensis способен бороться с ростом проблемной бактерии. Это означает, что антибиотик, продуцируемый бактерией, может быть разработан в качестве профилактического средства — например, назальный спрей — для сохранения S. aureus из носа людей. Около 9% людей являются естественными носителями S. lugdunensis .
aureus из носа людей. Около 9% людей являются естественными носителями S. lugdunensis .
Новая надежда
Подавляющее большинство антибиотиков — это небольшие молекулы, которые атакуют бактериальные ферменты, белки, которые организуют химические реакции внутри клетки. Исследователи обнаружили, что лугдунин необычен тем, что он намного больше, а механизм действия, затрагивающий клеточную мембрану, до конца не изучен.Этот новый способ действия мог быть причиной того, что бактериальные штаммы S. aureus не смогли развить устойчивость к антибиотику в 30-дневных испытаниях в пробирке. «Мы никогда не находили спонтанных мутантов», — говорит Пешель.
Джон Пауэрс, врач-инфекционист из Университета Джорджа Вашингтона в Вашингтоне, округ Колумбия, надеется, что лугдунин в конечном итоге может стать полезным противобитическим средством для человека. Но он хотел бы увидеть, как антибиотик действует на людей, поскольку испытания в пробирках, проведенные командой Пешеля, не могут предсказать, разовьется ли у людей устойчивость к антибиотикам.
В микробиоме человека пока обнаружено лишь несколько антибиотиков, например, лактоциллин, который поступает из вагинальных бактерий. Почвенные бактерии — типичный источник новых антибиотиков.
Когда Пешель и его команда наткнулись на лугдунин, они не искали новый антибиотик. Они изучали S. aureus в естественной среде, в человеческом носу. «Если вы хотите держать бактерии под контролем, вам нужно понимать их образ жизни», — говорит он.«И чтобы понять это, мы также посмотрели на его конкурентов». Они проверили 90 бактерий из носа человека и обнаружили, что только S. lugdunensis убивают MRSA.
Когда команда Пешеля заразила кожу мышей S. aureus , мазь лугдунина убила инфекцию как на поверхности, так и в более глубоких слоях кожи. S. lugdunensis также снижал количество S. aureus при попадании в нос хлопковых крыс ( Sigmodon hispidus ).
Помимо MRSA, лугдунин убил S. aureus , устойчивый к гликопептиду антибиотика, и устойчивый к ванкомицину Enterococcus spp .
«Впервые исследователи смогли окончательно связать производство антибиотика в бактерии с подавлением конкурента в микробиомном сообществе», — говорит Ким Льюис, микробиолог из Северо-Восточного университета в Бостоне, штат Массачусетс. Льюис является соавтором комментария, сопровождающего это исследование.
«Это было немного удивительно», — говорит он. «Обычно мы не думаем об антибиотиках как о важном инструменте, который бактерии могут использовать для конкуренции в микробиоме».
Пешель говорит, что в настоящее время они ведут переговоры с компаниями, заинтересованными в разработке лугдунина в качестве лекарства для людей.
Золотистый стафилококк в носу: факты, которыми стоит поделиться с пациентами
Стафилококк — это группа бактерий, некоторые из которых могут вызывать ряд заболеваний в результате инфицирования различных тканей тела.Инфекции могут быть вызваны особым типом стафилококков, который называется S taphylococcus aureus . Заболевания и инфекции, связанные со стафилококком, могут быть от легких до тяжелых и, возможно, со смертельным исходом.
Заболевания и инфекции, связанные со стафилококком, могут быть от легких до тяжелых и, возможно, со смертельным исходом.
Исследования показывают, что 20% населения являются постоянными носителями и до 60% могут быть периодическими носителями Staphylococcus aureus в носу. В большинстве случаев бактерии не вызывают болезни; однако открытые поражения или раны на коже или другие повреждения кожи могут позволить бактериям расти и развиваться инфекциям.
Золотистый стафилококк вызывает инфекции в больнице и за ее пределами. Он может вызывать фурункулы, пневмонию, импетиго и является основной причиной инфекций в области хирургического вмешательства (SSI) в Соединенных Штатах. Статистика показывает, что у 1–3 человек из каждых 100 человек, перенесших операцию, развиваются инфекции, связанные с стафилококком. (http://www.cdc.gov/hai/pdfs/ssi/ssi_tagged.pdf)
Определенные группы людей могут подвергаться большему риску, особенно те, у кого ослаблена иммунная система, новорожденные, кормящие женщины и люди с хроническими заболеваниями и состояниями.
Семьи и отдельные лица, которые посещают детские сады, тренажерные залы, тренажерные залы и игровые площадки, должны знать о Staph, поскольку в этих местах повышен риск передачи инфекции от кожи к контакту с кожей или с кожей к контакту с оборудованием.
Инфекции, вызванные стафилококком, заразны и могут передаваться при прямом контакте с инфицированной областью и перевязками или через предметы личной гигиены, такие как бритва. Раны, которые кажутся красными, опухшими, имеют дренаж и сопровождаются лихорадкой, могут быть инфицированы.
Фактором риска заражения Staph. Может быть колонизация кожи и носовая полость патогеном Staph aureus. Примерно каждый третий человек может быть носителем Staph aureus в носу. Многие больницы принимают профилактические меры с помощью таких продуктов, как мазь с антибиотиком, тампоны с йодом и антисептик Nozin® Nasal Sanitizer®, не содержащий антибиотиков, чтобы помочь добиться деколонизации носа у пациентов и медицинских работников. Лечение антибиотиками может осложняться развитием резистентных штаммов Staphylococcus aureus (например, MRSA), что приводит к повышению показателей смертности, увеличению продолжительности пребывания в больнице и увеличению затрат.(http://www.ncbi.nlm.nih.gov/pubmed/19135916)
Лечение антибиотиками может осложняться развитием резистентных штаммов Staphylococcus aureus (например, MRSA), что приводит к повышению показателей смертности, увеличению продолжительности пребывания в больнице и увеличению затрат.(http://www.ncbi.nlm.nih.gov/pubmed/19135916)
Все раны, порезы и царапины должны быть чистыми и закрытыми. Так как стафилококк может передаваться от одной части тела к другой, например, от носа к руке к открытой ране, поддержание хорошей гигиены рук и носа важно для всех, от дома до больницы.
Родители должны немедленно позаботиться о порезах и обратить внимание детей на важность гигиены рук. Необходимо следить за появлением признаков инфекции и немедленно устранять неровности или волдыри, чтобы предотвратить распространение инфекции.
Тем, кто работает в медицинском учреждении или идет в больницу по поводу болезни или процедуры, медицинские работники рекомендуют Nozin® Nasal Sanitizer® для уменьшения носительства Staph aureus в носу, что может помочь снизить риск заражения.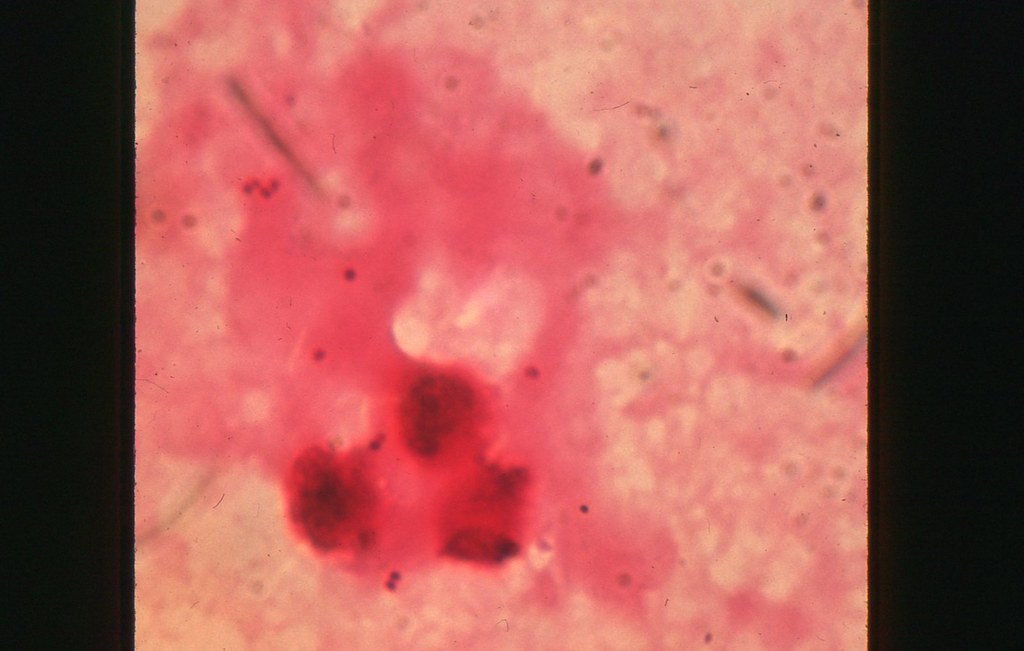 Запросите консультацию у одного из наших консультантов по Nozin.
Запросите консультацию у одного из наших консультантов по Nozin.
Бактерии в носу человека выделяют антибиотик, убивающий MRSA
Человек и микробы, живущие внутри нас, могут стать источником антибиотиков следующего поколения.
Немецкие исследователи только что открыли антибиотик, вырабатываемый бактериями, населяющими наш нос. Этот новый антибиотик может убить MRSA, образец лекарственной устойчивости и виновника самых пагубных внутрибольничных инфекций стафилококка.
«Наше исследование может помочь понять, что мы можем сделать для искоренения этих патогенов в микробиоте здоровых людей», — сказал Андреас Пешель, ведущий автор исследования, опубликованного в среду в журнале Nature.
объявление
Вот как это работает: представьте себе наши тела как грядки, а бактерии — как растения.Раньше мы думали, что все бактерии — это сорняки, вторгающиеся в нас и вызывающие болезни. Чтобы избавиться от бактерий, мы просто все взломали.
«Мы использовали в основном« сплошной »подход к лечению болезней — просто поразите их всех и надейтесь, что произойдет что-то хорошее», — сказал Майкл Гилмор, профессор микробиологии Гарвардской медицинской школы, который рецензировал исследование и является экспертом. в устойчивости к антибиотикам и открытии лекарств.
в устойчивости к антибиотикам и открытии лекарств.
объявление
Вместо этого произошло что-то плохое: чрезмерное употребление и несоблюдение режима привели к устойчивости к антибиотикам.Инфекция MRSA, вызванная стафилококком, который не реагирует на метициллин, ежегодно убивает около 20 000 человек. Около 30 процентов людей сейчас имеют в носу бактерии, в том числе MRSA, S. aureus. Авторы отмечают, что нос — это обычный путь проникновения MRSA в организм человека.
«Некоторые люди предрасположены к инфекциям стафилококка, а другие относительно устойчивы», — сказал Гилмор. «Частью этого является наша иммунная система, а частью — другие микробы, которые мы носим с собой.”
И именно те другие микробы, как выяснили немецкие ученые, поражают MRSA.
Аборигенный вид Ученые из Тюбингенского университета высосали сопли, содержащие бактерии, у 37 здоровых людей и культивировали различные виды бактерий, которые они обнаружили в своих образцах. Чтобы выяснить, поможет ли какая-либо из обнаруженных бактерий удерживать MRSA подальше, они посадили S. aureus вместе с другими видами соплей и наблюдали, как они растут.
Чтобы выяснить, поможет ли какая-либо из обнаруженных бактерий удерживать MRSA подальше, они посадили S. aureus вместе с другими видами соплей и наблюдали, как они растут.
Победитель, другой вид стафилококка, названный S.lugdunensis убивал S. aureus. Его любимое оружие? Небольшое соединение, получившее название лугдунин.
Когда исследователи протестировали новое соединение на мышах, они смогли лечить стафилококковые инфекции. Автор исследования Бернхард Крисмер отметил, что «соединение проникло в ткани, а также действовало в более глубокие слои кожи», что является полезным приемом для лечения глубоко укоренившихся инфекций стафилококка, которые являются отличительной чертой MRSA.
И когда они оставили S. aureus и лугдунин вместе на месяц, S. aureus все еще не выработал к нему устойчивости, что говорит о том, что лугдунин действительно трудно победить, сказал Крисмер.
Затем исследователи проверили сопли госпитализированных пациентов. Из 187 образцов все, кроме одного, были колонизированы либо S. aureus, либо S. lugdunensis, но не обоими. Исследователи думают, что где растет один вид, другой не может.
aureus, либо S. lugdunensis, но не обоими. Исследователи думают, что где растет один вид, другой не может.
И все дело в лугдунине. Когда исследователи испортили ген лугдунина у S. lugdunensis, у S. aureus не было проблем с выращиванием.
Другими словами, в человеческих садах есть местное растение, которое убивает потенциально смертельный сорняк.
Немецкие исследователи, проводившие исследование, подали патент на лугдунин и надеются сотрудничать с фармацевтическими компаниями для его разработки.
Супер баги и супер героиВ клинике прямо сейчас «мы используем пероральные биодоступные препараты широкого спектра действия, которые разрушают наш собственный микробиом, для лечения зубной или ушной инфекции», — сказал Гилмор.
Гилмор считает, что пора переосмыслить нашу противомикробную стратегию. По его словам, это исследование природы является многообещающим.
«Я думаю, что следующая эра, и я думаю, что мы сходим с ума, — это эффективное управление связью между микробами и людьми как в отношении здоровья, так и болезней», — сказал он.
Например, врачи могли бы больше сосредоточиться на применении антибиотиков локально только в инфицированной области, особенно в случае легко доступных инфекций, таких как пародонтоз и ушные инфекции. Избирательно лечив только серьезные инфекции, мы могли бы предотвратить следующий виток сопротивления.
Немецкие исследователи полагают, что существует множество бактерий с секретными способностями, которые ждут своего открытия — супергероев для борьбы с супербактериями. Один происходит от бактерий, которые естественным образом населяют вагинальную слизь.
Но новейшая работа идет дальше, показывая, что S. lugdunensis может вообще блокировать укоренение MRSA в организме. «Это большое дело, — сказал Майкл Фишбах, исследователь UCSF, который руководил исследованием вагинальной слизи, — поскольку предотвращение роста S. aureus в ноздре является важной задачей в предотвращении стафилококковых инфекций». (Фишбах работает с несколькими биофармацевтическими компаниями и входит в совет директоров Achaogen, компании, разрабатывающей антибиотики. )
)
Помимо попытки разработать лугдунин в качестве антибиотика, новые результаты показывают, что мы могли бы засеять определенные части нашего тела комменсальными бактериями в форме пробиотиков.
В настоящее время безрецептурные пробиотики производятся из бактерий, которые обычно не обитают в организме человека, поэтому они перевариваются. С другой стороны, пробиотик, сделанный из комменсальных бактерий, может оставаться в течение длительного времени и изменять флору любой части тела, которая вышла из строя.Это идея фекальной трансплантации.
Однако Пешель сказал: «С. lugdunensis сам по себе, возможно, не идеальные пробиотические бактерии, которые вы хотели бы размножить в носу пациента с ограниченным иммунитетом, «потому что этот вид иногда вызывает у людей заболевание».
Чтобы обойти это, потребуется несколько уловок. Например, немецкие исследователи планируют создать ГМО, объединяющий гены S. lugdunensis и другой, более доброкачественной бактерии.
Например, немецкие исследователи планируют создать ГМО, объединяющий гены S. lugdunensis и другой, более доброкачественной бактерии.
Хотя нам еще далеко до того, чтобы увидеть, как какие-либо из этих естественных убийц или пробиотиков воплотятся в жизнь в клинике, будущее гораздо менее мрачное, чем предполагалось ранее.
С другой стороны, это может стать еще одной быстрой передышкой в продолжающейся гонке вооружений между бактериями и антибиотиками.
В то время как исследователи взволнованы мыслью о местных пробиотиках, другие обеспокоены тем, что после применения таких методов лечения патогенные бактерии узнают, как победить и эти антибиотики.
«Я бы не стал делать ставку против такой коварной бактерии, как S. aureus», — сказал Фишбах, исследователь UCSF.
Симптомы, стадии, причины, лечение, заразность
Что такое стафилококковая инфекция кожи?
Инфекция стафилококка вызывается бактериями Staphylococcus (или «стафилококком»). На самом деле около 25% людей обычно носят стафилококк в носу, рту, гениталиях или анальной области и не имеют симптомов инфекции. Нога также очень склонна собирать бактерии с пола. Инфекция часто начинается с небольшого пореза, в который попадают бактерии. Это может выглядеть как медово-желтая корка на коже.
На самом деле около 25% людей обычно носят стафилококк в носу, рту, гениталиях или анальной области и не имеют симптомов инфекции. Нога также очень склонна собирать бактерии с пола. Инфекция часто начинается с небольшого пореза, в который попадают бактерии. Это может выглядеть как медово-желтая корка на коже.
Эти стафилококковые инфекции варьируются от простого фурункула до инфекций, устойчивых к антибиотикам, и инфекций, вызывающих поедание плоти. Разница между всем этим заключается в силе инфекции, том, насколько глубоко она распространяется, как быстро распространяется и насколько поддается лечению антибиотиками.Инфекции, устойчивые к антибиотикам, чаще встречаются в Северной Америке из-за чрезмерного использования антибиотиков.
Один из видов стафилококковой инфекции, поражающей кожу, называется целлюлитом и поражает более глубокие слои кожи. Лечится антибиотиками.
Этот тип инфекции очень распространен среди населения в целом, но чаще и тяжелее у людей со слабой иммунной системой. Особенно склонны к развитию целлюлита люди, страдающие диабетом или ослабленным иммунитетом.
Особенно склонны к развитию целлюлита люди, страдающие диабетом или ослабленным иммунитетом.
Каковы симптомы инфекции кожи стафилококком?
Целлюлит, вызванный стафилококком, обычно начинается с небольшой болезненности, припухлости и покраснения. Иногда начинается с открытой болячки. В других случаях на коже нет явного разрыва.
Признаками целлюлита являются любые воспаления — покраснение, тепло, отек и боль. Любая кожная язва или кожная язва с этими признаками может вызывать целлюлит. Если инфекция стафилококка распространяется, у человека может подняться температура, иногда с ознобом и потоотделением, а также отек в этой области.
Другие стафилококковые инфекции кожи включают импетиго, болезненную, заразную сыпь, фурункулы, а у младенцев и маленьких детей — стафилококковый синдром ошпаривания кожи, вызывающий сыпь, волдыри и лихорадку.
Как лечить инфекцию стафилококка?
Антибиотики используются для лечения стафилококковой инфекции. Но эффективность этих антибиотиков постепенно изменилась.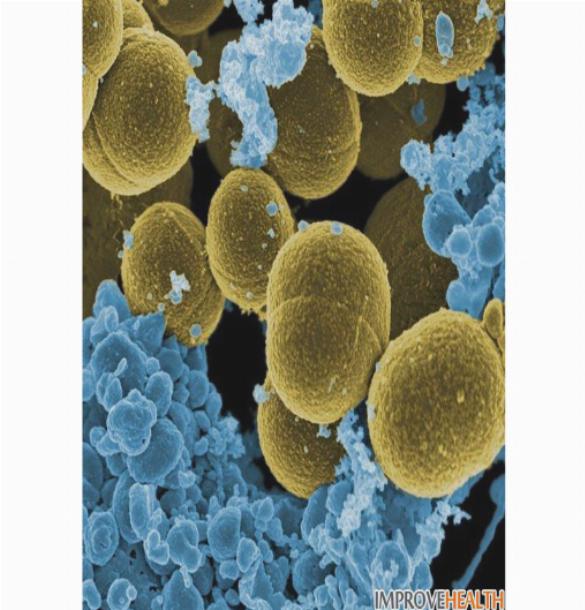 В то время как большинство стафилококковых инфекций лечилось пенициллином, сейчас используются более сильные антибиотики.
В то время как большинство стафилококковых инфекций лечилось пенициллином, сейчас используются более сильные антибиотики.
Продолжение
Однако примерно в 50% случаев наблюдается резистентность даже к этим более сильным антибиотикам. Эти случаи больше не происходят просто в больницах, как раньше, а теперь происходят в обществе в целом. Это было проблемой. Многие врачи привыкли использовать определенные антибиотики, но затем они не работают из-за устойчивости к антибиотикам. Сейчас есть еще несколько сильнодействующих антибиотиков, но врачи должны знать, когда их использовать, чтобы предотвратить дальнейшую устойчивость к антибиотикам.
Есть другое лечение, которое иногда используется при инфекциях стафилококка. Если инфекция заходит настолько глубоко, что затрагивает мышцы или волокна, окружающие мышцы, ее необходимо очистить хирургическим путем.
Можно ли предотвратить заражение стафилококком?
Несколько недавних вспышек среди футболистов начались, когда у одного члена команды был фурункул, и инфекция распространилась на других членов команды. Вы можете принять меры, чтобы предотвратить заражение стафилококком. Каждый раз, когда у вас есть порез или повреждение кожи, мойте его водой с мылом, безрецептурной хлорноватистой кислотой или хлоргексадином, держите его чистым и сухим и держите под крышкой.Ванна с разбавленным отбеливателем два раза в неделю может помочь предотвратить кожные инфекции стафилококка.
Вы можете принять меры, чтобы предотвратить заражение стафилококком. Каждый раз, когда у вас есть порез или повреждение кожи, мойте его водой с мылом, безрецептурной хлорноватистой кислотой или хлоргексадином, держите его чистым и сухим и держите под крышкой.Ванна с разбавленным отбеливателем два раза в неделю может помочь предотвратить кожные инфекции стафилококка.
Продолжение
Инфекция стафилококка заразна, если рана мокнет или истощается, а люди пользуются полотенцами или другими зараженными предметами. Ношение покрытий для ног в раздевалках и других часто используемых местах может помочь предотвратить заражение.
Если язва становится необычно болезненной или красной, немедленно обратитесь за медицинской помощью. Если появляются красные линии, это означает, что инфекция распространяется и требует немедленной медицинской помощи.
Staph. Инфекции? Нос знает, как с ними бороться
МАНЧЕСТЕР, Англия. Человеческий нос — не самое лучшее место для бактерий. В нем мало места и пищи для микробов. Тем не менее, там могут жить более 50 видов бактерий. Один из них — золотистый стафилококк , наиболее известный как стафилококк. Эта ошибка может вызвать серьезные инфекции кожи, крови и сердца. В больницах он может трансформироваться в супербактерий под названием MRSA , который очень трудно вылечить.Теперь ученые обнаружили, что человеческий нос может удерживать не только стафилококк, но и его естественного врага.
В нем мало места и пищи для микробов. Тем не менее, там могут жить более 50 видов бактерий. Один из них — золотистый стафилококк , наиболее известный как стафилококк. Эта ошибка может вызвать серьезные инфекции кожи, крови и сердца. В больницах он может трансформироваться в супербактерий под названием MRSA , который очень трудно вылечить.Теперь ученые обнаружили, что человеческий нос может удерживать не только стафилококк, но и его естественного врага.
Этот враг — еще один микроб. И это делает соединение, которое однажды может быть использовано в качестве нового лекарства для борьбы с MRSA.
Учителя и родители, подпишитесь на шпаргалку
Еженедельные обновления, которые помогут вам использовать Science News для студентов в учебной среде
«Мы не ожидали найти это», — говорит Андреас Пешель.Он изучает бактерии в Тюбингенском университете в Германии. «Мы просто пытались понять экологию носа, чтобы понять, как S. aureus вызывает проблемы». Пешель выступил на брифинге 26 июля здесь, во время открытого форума EuroScience.
aureus вызывает проблемы». Пешель выступил на брифинге 26 июля здесь, во время открытого форума EuroScience.
Человеческое тело полно микробов. Действительно, в организме больше микробов, чем клеток человека. Внутри носа обитает множество различных видов микробов. Там они сражаются друг с другом за ограниченные ресурсы. И они в этом мастера.Так что изучение носовых бактерий может стать для ученых хорошим способом поиска новых лекарств, сказал Пешель. Молекулы, которые микробы используют для борьбы друг с другом, могут стать инструментами медицины.
Существуют огромные различия в микробах в носу от одного человека к другому. Например, S. aureus обитает в носу примерно у 3 из 10 человек. Остальные 7 из 10 не проявляют никаких признаков этого.
Попытка объяснить эту разницу привела Пешеля и его коллег к изучению того, как соседи микробов взаимодействуют внутри носа.Они подозревали, что у людей, не переносящих стафилококк, могут быть другие микробы, которые мешают росту стафилококка.
Чтобы проверить это, команда собирала жидкости из носов людей. В этих образцах они обнаружили 90 различных типов, или штаммов , Staphylococcus . Один из них, S. lugdunensis , убил S. aureus , когда они были выращены вместе на блюде.
Следующим шагом было выяснить, как S. lugdunensis делает это.Исследователи мутировали ДНК микроба-убийцы, чтобы получить множество различных версий его генов . В конце концов, они получили один мутировавший штамм, который больше не убивал плохой стафилококк. Когда они сравнили его гены с генами штаммов-убийц, они обнаружили разницу. Эта уникальная ДНК в типах убийц создала антибиотик. Это было совершенно новым для науки. Исследователи назвали его лугдунин.
Одна из самых смертоносных форм стафилококка известна как MRSA (произносится «МУР-су»).Его инициалы являются сокращением от метициллин-устойчивого Staphylococcus aureus. Это бактерия, которую не могут убить обычные антибиотики. Но Лугдунин мог . Многие бактерии развили способность противостоять эффекту уничтожения микробов одним или несколькими важными антибиотиками. Так что все — например, новый лугдунин — способное уничтожить эти микробы, становится очень привлекательным для медицины. Действительно, новые исследования показывают, что лугдунин также может убить устойчивый к лекарствам штамм бактерий Enterococcus .
Но Лугдунин мог . Многие бактерии развили способность противостоять эффекту уничтожения микробов одним или несколькими важными антибиотиками. Так что все — например, новый лугдунин — способное уничтожить эти микробы, становится очень привлекательным для медицины. Действительно, новые исследования показывают, что лугдунин также может убить устойчивый к лекарствам штамм бактерий Enterococcus .
Затем группа исследовала микробов S. lugdunensis против микробов S. aureus в пробирках и на мышах. Каждый раз новая бактерия побеждала вредные микробы стафилококка.
Когда исследователи взяли образцы носов 187 пациентов больницы, они обнаружили, что эти два типа бактерий редко жили вместе. S. aureus присутствовал у 34,7% людей, не являющихся носителями S. lugdunensis. Но только 5,9% людей с S. lugdunensis в носу также имели S.aureus.
Группа Пешеля описала эти результаты 28 июля в Nature .
Лугдунин вылечил кожную инфекцию стафилококка у мышей. Но не совсем понятно, как работает это соединение. Это может повредить внешние клеточные стенки плохого стафилококка. Если это правда, значит, он может повредить и человеческие клетки. И это может ограничить его использование у людей лекарством, которое наносят на кожу, говорят другие исследователи.
Пешель и соавтор Бернхард Крисмер также предполагают, что сама бактерия может быть хорошим пробиотиком .Этот микроб помогает предотвратить новые инфекции, а не бороться с существующими. Они думают, что врачи могли бы поместить S. lugdunensis в нос уязвимым больным пациентам, чтобы предотвратить заражение стафилококком.
Ким Льюис изучает антибиотики в Северо-Восточном университете в Бостоне, штат Массачусетс. В целом он согласен с тем, что изучение микробов в носу может помочь ученым найти новые потенциально новые лекарства. Бактерии и другие микробы внутри и на теле человека вместе называются нашим микробиомом (MY-kro-BY-ohm). Но до сих пор, говорит Льюис, ученые обнаружили лишь несколько потенциальных новых антибиотиков, изучая микробиом человека. (Один из них называется лактоциллин.)
Но до сих пор, говорит Льюис, ученые обнаружили лишь несколько потенциальных новых антибиотиков, изучая микробиом человека. (Один из них называется лактоциллин.)
Льюис считает, что лугдунин может быть полезен для использования вне организма. Но он может не работать как лекарство, которое лечит инфекции всего тела. Он добавляет, что это те виды антибиотиков, которые врачи используют чаще всего.
Деколонизация золотистого стафилококка в здравоохранении: взгляд на дерматологию
Бактерия Staphylococcus aureus вызывает значительную заболеваемость, смертность и финансовое бремя в здравоохранении.Он легко колонизирует восприимчивых пациентов и может вызывать рецидивирующие инфекции, особенно в группах риска. Помимо лечения последствий инфекций, появляется все больше литературы, направленной на деколонизацию восприимчивых пациентов с целью предотвращения инфекции, а также предотвращения распространения. Такие стратегии широко используются в хирургии, реанимации и госпитализации. Золотистый стафилококк вовлекается в патогенез и устойчивость многих дерматологических заболеваний, которые лечат в амбулаторных условиях.Этот обзор служит для обобщения текущих данных по ведению Staphylococcus aureus пациентов с колонией, а также имеющихся данных по деколонизации. Мы также охарактеризуем роль, которую колонизация может играть в атопическом дерматите, рецидивирующих инфекциях, экземе рук, кожной Т-клеточной лимфоме, а также в хирургических инфекциях после операции Моса.
Золотистый стафилококк вовлекается в патогенез и устойчивость многих дерматологических заболеваний, которые лечат в амбулаторных условиях.Этот обзор служит для обобщения текущих данных по ведению Staphylococcus aureus пациентов с колонией, а также имеющихся данных по деколонизации. Мы также охарактеризуем роль, которую колонизация может играть в атопическом дерматите, рецидивирующих инфекциях, экземе рук, кожной Т-клеточной лимфоме, а также в хирургических инфекциях после операции Моса.
1. Роль
Staphylococcus aureus в здравоохранении Staphylococcus aureus считается нормальной флорой здоровых млекопитающих.У людей нос и глотка являются типичными местами колонизации, а преддверие носа является основным резервуаром [1, 2] . Общая частота носителей у здоровых людей колеблется от 20 до 50%. Исследования показали, что колонизирующие штаммы S. aureus такие же, как и штаммы, выделенные из местных инфекций кожи и мягких тканей (SSTI) [3]. Покинув место колонизации, S. aureus может инфицировать любую часть тела или систему органов. Это наиболее распространенный патоген, вызывающий ИМТП, в настоящее время он является наиболее распространенным инвазивным патогеном в США [4], а также является причиной 2% госпитализаций [5].Факторы риска колонизации и / или инфицирования S. aureus включают воздействие в больнице или доме престарелых, иммунодефицит, хронические заболевания, плохую гигиену, работу со свиньями и совместное проживание в семье колонизированного человека [6]. Из-за его распространенности, сопутствующей заболеваемости и легкости передачи вмешательство является полезным с индивидуальной, эпидемиологической и финансовой точек зрения. Все больше литературы посвящено попыткам деколонизации людей для достижения этой цели.Если мы сможем избавить носителя от колонизирующего стафилококка , мы сможем снизить заболеваемость, распространение болезни и связанное с этим финансовое бремя.
Покинув место колонизации, S. aureus может инфицировать любую часть тела или систему органов. Это наиболее распространенный патоген, вызывающий ИМТП, в настоящее время он является наиболее распространенным инвазивным патогеном в США [4], а также является причиной 2% госпитализаций [5].Факторы риска колонизации и / или инфицирования S. aureus включают воздействие в больнице или доме престарелых, иммунодефицит, хронические заболевания, плохую гигиену, работу со свиньями и совместное проживание в семье колонизированного человека [6]. Из-за его распространенности, сопутствующей заболеваемости и легкости передачи вмешательство является полезным с индивидуальной, эпидемиологической и финансовой точек зрения. Все больше литературы посвящено попыткам деколонизации людей для достижения этой цели.Если мы сможем избавить носителя от колонизирующего стафилококка , мы сможем снизить заболеваемость, распространение болезни и связанное с этим финансовое бремя.
Одной из основных проблем при лечении S. aureus является устойчивость к антибиотикам. Вскоре после своего клинического дебюта метициллин и пенициллин стали неэффективными против метициллин-резистентного Staphylococcus aureus (MRSA) [7]. В настоящее время MRSA поражает по крайней мере 60% изолятов стафилококка из отделений интенсивной терапии.Предполагается, что текущие усилия по деколонизации могут оказаться не столь эффективными при работе конкретно с MRSA [8]. При поступлении в больницу пациенты после часто подвергались мазку из носа для выявления носителей MRSA, но эта процедура может пропустить до 50% носителей колонизации экстраназальных участков [9]. Многие агенты, используемые при деколонизации, считаются невосприимчивыми к устойчивости к бактериям, что дает некоторые преимущества при попытках деколонизации MRSA. Литература богата метаанализами и систематическими обзорами по лечению колонизации Staphylococcus у пациентов, находящихся на диализе [10], ортопедической хирургии [11, 12], кардиохирургии [13, 14], пластической хирургии [15] и общей хирургии [ 16, 17].
aureus является устойчивость к антибиотикам. Вскоре после своего клинического дебюта метициллин и пенициллин стали неэффективными против метициллин-резистентного Staphylococcus aureus (MRSA) [7]. В настоящее время MRSA поражает по крайней мере 60% изолятов стафилококка из отделений интенсивной терапии.Предполагается, что текущие усилия по деколонизации могут оказаться не столь эффективными при работе конкретно с MRSA [8]. При поступлении в больницу пациенты после часто подвергались мазку из носа для выявления носителей MRSA, но эта процедура может пропустить до 50% носителей колонизации экстраназальных участков [9]. Многие агенты, используемые при деколонизации, считаются невосприимчивыми к устойчивости к бактериям, что дает некоторые преимущества при попытках деколонизации MRSA. Литература богата метаанализами и систематическими обзорами по лечению колонизации Staphylococcus у пациентов, находящихся на диализе [10], ортопедической хирургии [11, 12], кардиохирургии [13, 14], пластической хирургии [15] и общей хирургии [ 16, 17]. На сегодняшний день в дерматологии не опубликовано ни одного обзора по этой теме. Этот обзор призван обобщить роль, которую носительство S. aureus может играть в распространенных дерматологических состояниях, а также то, какие данные доступны дерматологам при рекомендации протоколов деколонизации.
На сегодняшний день в дерматологии не опубликовано ни одного обзора по этой теме. Этот обзор призван обобщить роль, которую носительство S. aureus может играть в распространенных дерматологических состояниях, а также то, какие данные доступны дерматологам при рекомендации протоколов деколонизации.
2.
Staphylococcus Колонизация в дерматологииКолонизация S. aureus участвует в патогенезе или сохранении многих кожных заболеваний, для которых врачи часто рекомендуют режимы деколонизации.К сожалению, в литературе отсутствуют рандомизированные контролируемые испытания (РКИ), изучающие роль деколонизации при этих заболеваниях, и нет единого мнения относительно идеального протокола деколонизации. Мы суммировали ключевые моменты того, что было показано до сих пор в литературе в отношении обычных кожных заболеваний, которые были связаны с колонизацией стафилококками.
2.1. Атопический дерматит
Атопический дерматит (АД) — относительно частое заболевание кожи, по недавним оценкам распространенность которого составляет 15–20% у детей и 2–10% у взрослых [18]. Существуют сильные ассоциации между рецидивирующими кожными инфекциями, тяжестью заболевания и колонизацией S. aureus [19, 20]. Люди с AD имеют более высокую концентрацию S. aureus , колонизирующую их кожу [21]. Колонизация кожных поражений при БА может не только приводить к кожным инфекциям у этих пациентов, но также может обострять заболевание, в дальнейшем приводя к инфекции и тем самым способствуя хроническому заболеванию и частым обострениям [22, 23]. Исследования показали, что не менее 80% пациентов с БА колонизируются S.aureus , причем до 30% колонизирующих штаммов составляют MRSA [24, 25]. Недавний систематический обзор объединил 95 исследований и пришел к выводу, что 70% пораженной кожи колонизированы, по сравнению с 39% неповрежденной кожи, и что 62% пациентов с БА имеют носовую колонизацию. Кроме того, они также коррелировали распространенность колонизации с тяжестью заболевания [26]. Проспективное исследование, в котором наблюдали за 605 беременными женщинами, стремилось определить, может ли колонизация S.
Существуют сильные ассоциации между рецидивирующими кожными инфекциями, тяжестью заболевания и колонизацией S. aureus [19, 20]. Люди с AD имеют более высокую концентрацию S. aureus , колонизирующую их кожу [21]. Колонизация кожных поражений при БА может не только приводить к кожным инфекциям у этих пациентов, но также может обострять заболевание, в дальнейшем приводя к инфекции и тем самым способствуя хроническому заболеванию и частым обострениям [22, 23]. Исследования показали, что не менее 80% пациентов с БА колонизируются S.aureus , причем до 30% колонизирующих штаммов составляют MRSA [24, 25]. Недавний систематический обзор объединил 95 исследований и пришел к выводу, что 70% пораженной кожи колонизированы, по сравнению с 39% неповрежденной кожи, и что 62% пациентов с БА имеют носовую колонизацию. Кроме того, они также коррелировали распространенность колонизации с тяжестью заболевания [26]. Проспективное исследование, в котором наблюдали за 605 беременными женщинами, стремилось определить, может ли колонизация S. aureus предсказать развитие БА.Они обнаружили, что у младенцев, у которых развился БА, наблюдается заметное увеличение колонизации S. aureus в возрасте 3 месяцев, а также более высокая распространенность за 2 месяца до постановки диагноза БА, что позволяет предположить, что S. aureus может иметь роль в развитии и начале AD в дополнение к его известной роли в обострении AD [27].
aureus предсказать развитие БА.Они обнаружили, что у младенцев, у которых развился БА, наблюдается заметное увеличение колонизации S. aureus в возрасте 3 месяцев, а также более высокая распространенность за 2 месяца до постановки диагноза БА, что позволяет предположить, что S. aureus может иметь роль в развитии и начале AD в дополнение к его известной роли в обострении AD [27].
Хотя патогенез БА многофакторный, пациенты в целом остаются в группе повышенного риска инфекций кожи и мягких тканей из-за изменений кожи, которые делают их более восприимчивыми.К таким изменениям относятся снижение уровня барьерных липидов [28, 29], повышение локальных сывороточных протеаз [30] и уменьшение количества антимикробных пептидов, таких как бета-дефенсин [31, 32]. Другой важной молекулой, которая, по-видимому, участвует во взаимодействии S. aureus -AD, является филаггрин (FLG). FLG связывает кератин и важен для защиты барьера. Он оказывает свое действие, способствуя образованию рогового слоя, уменьшая потерю воды и регулируя pH [33]. Некоторые пациенты с AD имеют мутации в FLG и в конечном итоге имеют более тяжелое заболевание.Лица с мутациями FLG были связаны с колонизацией S. aureus и тяжестью заболевания, что подчеркивает взаимосвязь между генетикой и микробиомом кожи [34, 35]. S. aureus также способен модулировать среду хозяина, в основном за счет суперантигенов, которые разрушают кожный барьер, увеличивая продукцию провоспалительных цитокинов кератиноцитами [36]. Окружающая среда хозяина AD, по-видимому, способствует бактериальной колонизации, и, в свою очередь, бактерии усугубляют болезнь, распространяя патогенный цикл.Следовательно, разрыв этого цикла с использованием методов деколонизации может способствовать уменьшению тяжести БА.
Некоторые пациенты с AD имеют мутации в FLG и в конечном итоге имеют более тяжелое заболевание.Лица с мутациями FLG были связаны с колонизацией S. aureus и тяжестью заболевания, что подчеркивает взаимосвязь между генетикой и микробиомом кожи [34, 35]. S. aureus также способен модулировать среду хозяина, в основном за счет суперантигенов, которые разрушают кожный барьер, увеличивая продукцию провоспалительных цитокинов кератиноцитами [36]. Окружающая среда хозяина AD, по-видимому, способствует бактериальной колонизации, и, в свою очередь, бактерии усугубляют болезнь, распространяя патогенный цикл.Следовательно, разрыв этого цикла с использованием методов деколонизации может способствовать уменьшению тяжести БА.
Гипохлорит натрия, или отбеливатель, веками использовался в медицине в качестве антисептика [37]. Отбеливатель обладает антимикробным действием широкого спектра действия, включая покрытие MRSA, и не несет риска устойчивости к противомикробным препаратам [37, 38]. Ванны с разбавленным отбеливателем — это основная рекомендация дерматологов при лечении атопического дерматита. Считается, что отбеливающие ванны могут уменьшить колонизацию и рецидивирующие кожные инфекции у людей с БА, тем самым уменьшая тяжесть заболевания и улучшая качество жизни [39].Отбеливатель также привлекателен своей невысокой стоимостью, легкостью доступа и переносимостью [37]. Несмотря на первоначальные исследования, показавшие многообещающие результаты, в модифицированном Кокрановском обзоре оценивались рандомизированные контролируемые исследования, в которых изучалась возможность клинического улучшения АД с помощью антистафилококковой терапии, и был сделан вывод о том, что такие вмешательства, как отбеливающие ванны и местные антисептики, не дают клинической пользы для людей, не имеющих доказательств текущей инфекции. [40]. Из 26 проанализированных РКИ () многие из них имели ограничения дизайна исследования, связанные с отсутствием описания метода рандомизации, небольшими размерами выборки или отсутствием описания исходной тяжести БА.
Ванны с разбавленным отбеливателем — это основная рекомендация дерматологов при лечении атопического дерматита. Считается, что отбеливающие ванны могут уменьшить колонизацию и рецидивирующие кожные инфекции у людей с БА, тем самым уменьшая тяжесть заболевания и улучшая качество жизни [39].Отбеливатель также привлекателен своей невысокой стоимостью, легкостью доступа и переносимостью [37]. Несмотря на первоначальные исследования, показавшие многообещающие результаты, в модифицированном Кокрановском обзоре оценивались рандомизированные контролируемые исследования, в которых изучалась возможность клинического улучшения АД с помощью антистафилококковой терапии, и был сделан вывод о том, что такие вмешательства, как отбеливающие ванны и местные антисептики, не дают клинической пользы для людей, не имеющих доказательств текущей инфекции. [40]. Из 26 проанализированных РКИ () многие из них имели ограничения дизайна исследования, связанные с отсутствием описания метода рандомизации, небольшими размерами выборки или отсутствием описания исходной тяжести БА. Несмотря на это, их систематический обзор не оспаривает, что противомикробные вмешательства успешно снижают бактериальную нагрузку при БА и что эта нагрузка действительно играет роль в патогенезе.
Несмотря на это, их систематический обзор не оспаривает, что противомикробные вмешательства успешно снижают бактериальную нагрузку при БА и что эта нагрузка действительно играет роль в патогенезе.
В одно рандомизированное контролируемое исследование был включен 31 пациент с БА, имевший клинические признаки вторичной бактериальной инфекции. Их лечили отбеливающими ваннами два раза в неделю и интраназальным мупироцином два раза в день в течение 5 дней каждый месяц. Органы управления получили автомобиль в одиночку. Через 3 месяца у лиц, принимавших участие в лечении, наблюдалось значительное уменьшение площади пораженной поверхности тела и снижение тяжести БА [41].В аналогичном РКИ, в котором участвовали 200 пациентов с инфекциями кожи и мягких тканей, сравнивалась способность к деколонизации только интраназального мупироцина в течение 5 дней и интраназального мупироцина плюс ежедневные ванны с разбавленным отбеливателем в течение 5 дней. Через 4 месяца исследование показало, что комбинированное лечение уничтожило колонизацию S. aureus у 71% пациентов по сравнению с 48% в группе, получавшей только мупироцин [42]. Это исследование также включало контрольную группу «только для обучения». Все контрольные и лечебные группы прошли обучение по вопросам гигиены, в котором особое внимание уделялось выбрасыванию лосьонов в банках, замене лосьонов на помпы или бутылочек, отказу от совместного использования личных вещей, таких как бритвы или полотенца, и стирке постельного белья не реже одного раза в неделю и полотенец после каждого использования.Сообщается, что 38% людей в группе «только для обучения» были очищены от колонизирующих бактерий. Хотя кажется, что комбинация интраназальных ванн с мупироцином и отбеливателями может быть эффективной для снижения бактериальной колонизации, сама по себе надлежащая санитария может играть важную роль в деколонизации. Учитывая обширный фонд знаний о взаимодействии микробиома с БА, было бы полезно, если бы в будущих исследованиях коррелировали противомикробные препараты и тяжесть заболевания со степенью колонизации.
aureus у 71% пациентов по сравнению с 48% в группе, получавшей только мупироцин [42]. Это исследование также включало контрольную группу «только для обучения». Все контрольные и лечебные группы прошли обучение по вопросам гигиены, в котором особое внимание уделялось выбрасыванию лосьонов в банках, замене лосьонов на помпы или бутылочек, отказу от совместного использования личных вещей, таких как бритвы или полотенца, и стирке постельного белья не реже одного раза в неделю и полотенец после каждого использования.Сообщается, что 38% людей в группе «только для обучения» были очищены от колонизирующих бактерий. Хотя кажется, что комбинация интраназальных ванн с мупироцином и отбеливателями может быть эффективной для снижения бактериальной колонизации, сама по себе надлежащая санитария может играть важную роль в деколонизации. Учитывая обширный фонд знаний о взаимодействии микробиома с БА, было бы полезно, если бы в будущих исследованиях коррелировали противомикробные препараты и тяжесть заболевания со степенью колонизации.
2.2. Рецидивирующие инфекции кожи и мягких тканей
Продолжает расти заболеваемость инфекциями, ассоциированными с Staphylococcus , [43]. К SSTI относятся абсцессы, фурункулез и целлюлит, и эта группа теперь включена в 10 наиболее частых причин госпитализации [44]. Стратегии деколонизации часто рекомендуются как способ предотвращения повторного ИМТП. Обычные схемы снова включают в себя отбеливающие ванны, интраназальное мытье тела с мупироцином и хлоргексидином. Опрос медицинских работников показал, что большинство (53%) поставщиков лечили рецидивирующие SSTI тем же антибиотиком, который ранее применялся в течение того же периода времени; Поставщики взрослых пациентов отдавали предпочтение триметоприм-сульфаметоксазолу (TMP-SMX), а детям — клиндамицину.Что касается рекомендаций по деколонизации, в тройку лучших антимикробных препаратов вошли мупироцин (88%), антисептическое средство для мытья тела (79%) и отбеливающие ванны (34%) [45].
Ранее упомянутое исследование, которое показало, что интраназальный мупироцин с отбеливающими ваннами превосходит интраназальный мупироцин или только образование для уменьшения колонизации, было сосредоточено на лицах с SSTIs [42]. Одним из ограничений этого исследования было то, что во всех группах лечения 20% пациентов сообщили о рецидиве ИМТ через месяц после лечения.Еще одним ограничением было отсутствие деколонизации дома. Вполне вероятно, что наблюдаемые преимущества могли быть сохранены, если бы обработка деколонизации проводилась на регулярной основе или если бы члены домохозяйства также могли участвовать в этом процессе. Факторы риска колонизации Staphylococcus включают домашний контакт с кем-то, кто недавно перенес SSTI [46, 47]. РКИ с участием 183 человек с недавним абсцессом S. aureus было направлено на сравнение эффективности индивидуальной деколонизации и деколонизации в домашних условиях на носительство Staphylococcus и рецидивирующие SSTI [48].После двукратного интраназального введения мупироцина и ежедневного промывания хлоргексидином в течение 5 дней авторы не обнаружили разницы в скорости колонизации, но они отметили, что через 12 месяцев было меньше сообщений о SSTI у тех, кто подвергался деколонизации в домашних условиях (52% против 72%).
Одним из ограничений этого исследования было то, что во всех группах лечения 20% пациентов сообщили о рецидиве ИМТ через месяц после лечения.Еще одним ограничением было отсутствие деколонизации дома. Вполне вероятно, что наблюдаемые преимущества могли быть сохранены, если бы обработка деколонизации проводилась на регулярной основе или если бы члены домохозяйства также могли участвовать в этом процессе. Факторы риска колонизации Staphylococcus включают домашний контакт с кем-то, кто недавно перенес SSTI [46, 47]. РКИ с участием 183 человек с недавним абсцессом S. aureus было направлено на сравнение эффективности индивидуальной деколонизации и деколонизации в домашних условиях на носительство Staphylococcus и рецидивирующие SSTI [48].После двукратного интраназального введения мупироцина и ежедневного промывания хлоргексидином в течение 5 дней авторы не обнаружили разницы в скорости колонизации, но они отметили, что через 12 месяцев было меньше сообщений о SSTI у тех, кто подвергался деколонизации в домашних условиях (52% против 72%). ), что свидетельствует о долгосрочной пользе деколонизации домохозяйств.
), что свидетельствует о долгосрочной пользе деколонизации домохозяйств.
В одном исследовании была предпринята попытка искоренить колонизацию Staphylococcus у пациентов с рецидивирующими ИППП путем лечения пролонгированным курсом промывки хлоргексидином два раза в день в течение 60 дней и 30 дней одним пероральным антибиотиком, как определил клиницист.Хотя они сообщили о впечатляющих показателях клиренса до 90% через 4 месяца наблюдения, в этом исследовании не было контрольной группы, а также не удалось стандартизировать режим перорального приема антибиотиков для субъектов [49]. Авторы также признают, что их курс лечения длиннее, чем у других изученных схем, но что это может быть оправдано при лечении рецидивирующих стафилококковых ИППП. Деколонизация с целью уменьшения SSTI широко изучалась среди военнослужащих, так как новобранцы подвергаются высокому риску развития SSTI [50].SSTI является основной причиной госпитализации в первые два года военной карьеры новобранца. Одно исследование с участием более 33000 новобранцев, прошедших 13-недельный курс обучения, продемонстрировало, что 5-6 раз душ с промыванием хлоргексидином смог снизить частоту ИМТП [51]. Это контрастировало с другим исследованием, в котором участвовало более 30 000 новобранцев, которые еженедельно использовали промывание хлоргексидином, которое не продемонстрировало какой-либо пользы [52]. В последнем исследовании новобранцев не промывали хлоргексидином по прибытии, что может объяснить различия в исследованиях.Вторичный анализ последнего исследования коррелировал со сниженной колонизацией носовых ходов MRSA с теми, кто часто использовал промывание хлоргексидином, несмотря на то, что первоначальное исследование не продемонстрировало снижение SSTI [53].
Одно исследование с участием более 33000 новобранцев, прошедших 13-недельный курс обучения, продемонстрировало, что 5-6 раз душ с промыванием хлоргексидином смог снизить частоту ИМТП [51]. Это контрастировало с другим исследованием, в котором участвовало более 30 000 новобранцев, которые еженедельно использовали промывание хлоргексидином, которое не продемонстрировало какой-либо пользы [52]. В последнем исследовании новобранцев не промывали хлоргексидином по прибытии, что может объяснить различия в исследованиях.Вторичный анализ последнего исследования коррелировал со сниженной колонизацией носовых ходов MRSA с теми, кто часто использовал промывание хлоргексидином, несмотря на то, что первоначальное исследование не продемонстрировало снижение SSTI [53].
Представление человека с абсцессом кожи или мягких тканей — обычная ситуация, с которой сталкиваются в отделениях неотложной помощи. Руководящие принципы Американского общества инфекционистов по лечению неосложненного абсцесса — это только разрез и дренирование (I&D). Хотя использование антибиотиков в дополнение к I&D является спорным и рассмотрено в другом месте [54], два РКИ, посвященных лечению абсцесса с I&D с антибиотиком TMP-SMX или без него, не выявили различий в процентном соотношении неудач лечения или рецидивирующих инфекций, что свидетельствует о не меньшей эффективности.Тем не менее, эти исследования наблюдали пациентов в течение длительного периода времени и предполагают, что антибактериальная терапия после I&D предотвращала повторное формирование абсцесса на новом, отдельном участке. В ходе педиатрического исследования пациенты были обследованы через 10 дней после лечения и обнаружили, что у 12,9% тех, кто получал антибиотики, развился новый абсцесс по сравнению с 26,4% в группе плацебо [55]. В другом исследовании наблюдали взрослых пациентов в течение 30 дней после I&D и обнаружили, что 9% тех, кто получал TMP-SMX, сообщили о новых поражениях по сравнению с 28% тех, кто получал плацебо [56].Дополнительные доказательства роли пероральных антибиотиков в предотвращении рецидивов ИМТП получены в исследовании 357 детей, колонизированных S.
Хотя использование антибиотиков в дополнение к I&D является спорным и рассмотрено в другом месте [54], два РКИ, посвященных лечению абсцесса с I&D с антибиотиком TMP-SMX или без него, не выявили различий в процентном соотношении неудач лечения или рецидивирующих инфекций, что свидетельствует о не меньшей эффективности.Тем не менее, эти исследования наблюдали пациентов в течение длительного периода времени и предполагают, что антибактериальная терапия после I&D предотвращала повторное формирование абсцесса на новом, отдельном участке. В ходе педиатрического исследования пациенты были обследованы через 10 дней после лечения и обнаружили, что у 12,9% тех, кто получал антибиотики, развился новый абсцесс по сравнению с 26,4% в группе плацебо [55]. В другом исследовании наблюдали взрослых пациентов в течение 30 дней после I&D и обнаружили, что 9% тех, кто получал TMP-SMX, сообщили о новых поражениях по сравнению с 28% тех, кто получал плацебо [56].Дополнительные доказательства роли пероральных антибиотиков в предотвращении рецидивов ИМТП получены в исследовании 357 детей, колонизированных S. aureus , которым потребовались I&D по поводу абсцесса [57]. 331 участник получил адъювантный клиндамицин или TMP-SMX, а 26 не получали антибиотики. Среднее время последующего наблюдения было через 38 дней, когда были взяты мазки, чтобы определить, были ли пациенты по-прежнему колонизированы, и уровень колонизации был выше у тех, кто не лечился антибиотиками. Через 1 год наблюдения 57% из тех, кто был колонизирован S.aureus при «38-дневном» наблюдении сообщили о рецидиве ИМТП по сравнению с 30% тех, у кого колонизация не наблюдалась при последующем наблюдении. Это исследование имеет важное значение, поскольку оно продемонстрировало, что введение системных антибиотиков во время I&D может уменьшить колонизацию и защитить от рецидива инфекции. В нынешнюю эпоху устойчивости к антибиотикам кажется маловероятным, что пероральные антибиотики станут стандартом лечения в протоколах деколонизации. Однако важно отметить, что пероральные антибиотики могут уменьшить количество рецидивов инфекций при рассмотрении рисков и преимуществ дополнительной антибактериальной терапии при ИППП и абсцессах.
aureus , которым потребовались I&D по поводу абсцесса [57]. 331 участник получил адъювантный клиндамицин или TMP-SMX, а 26 не получали антибиотики. Среднее время последующего наблюдения было через 38 дней, когда были взяты мазки, чтобы определить, были ли пациенты по-прежнему колонизированы, и уровень колонизации был выше у тех, кто не лечился антибиотиками. Через 1 год наблюдения 57% из тех, кто был колонизирован S.aureus при «38-дневном» наблюдении сообщили о рецидиве ИМТП по сравнению с 30% тех, у кого колонизация не наблюдалась при последующем наблюдении. Это исследование имеет важное значение, поскольку оно продемонстрировало, что введение системных антибиотиков во время I&D может уменьшить колонизацию и защитить от рецидива инфекции. В нынешнюю эпоху устойчивости к антибиотикам кажется маловероятным, что пероральные антибиотики станут стандартом лечения в протоколах деколонизации. Однако важно отметить, что пероральные антибиотики могут уменьшить количество рецидивов инфекций при рассмотрении рисков и преимуществ дополнительной антибактериальной терапии при ИППП и абсцессах.
2.3. Экзема рук
Экзема рук — это хронический дерматит, характеризующийся сухой, болезненной, потрескавшейся кожей рук с волдырями или без них и слезотечением. Обычно он является вторичным по отношению к раздражителю, например, перчаткам, овощам, дезинфицирующим средствам или другим ингредиентам средств личной гигиены. Это чаще встречается у людей, которые часто моют руки, таких как медицинские работники и повара, но также увеличивается у людей с историей болезни Альцгеймера [58, 59]. Было проведено два исследования, посвященных роли S.Колонизация aureus может сыграть на руку экземе. Первое исследование показало, что пациенты с экземой рук с большей вероятностью имели колонизацию Staphylococcus на руках и что это было связано с тяжестью заболевания [60]. В другом исследовании использовался метод «перчаточного сока», когда пациенты с тяжелым дерматитом рук помещали руки в свободную перчатку, а физиологический раствор использовался для полоскания всей руки с анализом мытья. Этот метод помогает уменьшить систематическую ошибку выборки, поскольку таким образом можно тестировать всю поверхность руки.Неудивительно, что они обнаружили положительную связь с тяжестью экземы рук и плотностью колонизации S. aureus в дополнение к повышенным исходным уровням колонизации у пораженных по сравнению со здоровыми людьми из контрольной группы [61]. Также следует отметить, что ни одно из этих исследований не показало различий в носовой колонизации при сравнении пациентов с экземой рук и пациентов без нее. Исследование 2012 года показало контаминацию грамположительными кокками в 90% лекарств и кремов для местного применения, используемых пациентами с экземой рук, при этом 30% этих организмов составляют S.aureus [62]. Другие исследования показали аналогичные результаты с косметикой и кремами в баночках, что дополнительно подчеркивает необходимость надлежащего просвещения в отношении мер предосторожности [63]. Взятые вместе, эти исследования предполагают роль S.
Этот метод помогает уменьшить систематическую ошибку выборки, поскольку таким образом можно тестировать всю поверхность руки.Неудивительно, что они обнаружили положительную связь с тяжестью экземы рук и плотностью колонизации S. aureus в дополнение к повышенным исходным уровням колонизации у пораженных по сравнению со здоровыми людьми из контрольной группы [61]. Также следует отметить, что ни одно из этих исследований не показало различий в носовой колонизации при сравнении пациентов с экземой рук и пациентов без нее. Исследование 2012 года показало контаминацию грамположительными кокками в 90% лекарств и кремов для местного применения, используемых пациентами с экземой рук, при этом 30% этих организмов составляют S.aureus [62]. Другие исследования показали аналогичные результаты с косметикой и кремами в баночках, что дополнительно подчеркивает необходимость надлежащего просвещения в отношении мер предосторожности [63]. Взятые вместе, эти исследования предполагают роль S. aureus в патогенезе и / или сохранении экземы кистей рук, и что могут существовать клинически значимые экзогенные источники микробов в дополнение к носовой колонизации, которая существенно не увеличивается у пациентов с кистами рук. экзема. Отсутствуют исследования, изучающие потенциал деколонизации при лечении экземы рук.
aureus в патогенезе и / или сохранении экземы кистей рук, и что могут существовать клинически значимые экзогенные источники микробов в дополнение к носовой колонизации, которая существенно не увеличивается у пациентов с кистами рук. экзема. Отсутствуют исследования, изучающие потенциал деколонизации при лечении экземы рук.
2.4. Кожная Т-клеточная лимфома
Кожная Т-клеточная лимфома (CTCL) — это клональная Т-клеточная пролиферация, при которой злокачественные клетки локализуются в коже [64]. Эти клетки можно охарактеризовать по экспрессии их бета-цепи вариабельной области Т-клеточного рецептора (V β ) [65]. Т-клетки, экспрессирующие определенные вариации V β , могут пролиферировать в ответ на экзотоксины Staphylococcus и суперантигены in vitro [66]. Также было обнаружено, что клетки Sezary, выделенные от пациентов с CTCL, пролиферируют в ответ на воздействие суперантигена [67].В двух отчетах о клинических случаях также указывается на роль Staphylococcus в CTCL [68]. Мазки с эритродермической кожи были положительными на Staphylococcus , и была предпринята попытка деколонизации антибиотиками и уксусной кислотой, содержащей вазелин. Один пациент был успешно деколонизирован, и на момент публикации он чувствовал себя хорошо; другой не был успешно деколонизирован и в конечном итоге скончался после развития диссеминированного внутрисосудистого свертывания. В его перитонеальной жидкости был обнаружен MRSA.Более поздние исследования дополнительно коррелировали наличие суперантигенов S. aureus с частотой возникновения эритродермических CTCL [69], а также продемонстрировали и увеличили скорость колонизации у пациентов с CTCL по сравнению со здоровыми людьми [70]. Дальнейшая работа продемонстрировала, что экзотоксины Staphylococcus могут приводить к выработке злокачественными Т-клетками интерлейкина-10, цитокина, который может снижать иммунный ответ, а также связан с прогрессирующим CTCL, устойчивым к лечению [71].В другом исследовании случай-контроль изучалось 310 человек с CTCL с подобранным контролем и было обнаружено повышенный риск (отношение шансов 3,33) CTCL с историей импетиго от 1 до 5 лет до постановки диагноза, что дополнительно указывает на возможную роль бактерий в развитии или сохранении болезни [72].
Мазки с эритродермической кожи были положительными на Staphylococcus , и была предпринята попытка деколонизации антибиотиками и уксусной кислотой, содержащей вазелин. Один пациент был успешно деколонизирован, и на момент публикации он чувствовал себя хорошо; другой не был успешно деколонизирован и в конечном итоге скончался после развития диссеминированного внутрисосудистого свертывания. В его перитонеальной жидкости был обнаружен MRSA.Более поздние исследования дополнительно коррелировали наличие суперантигенов S. aureus с частотой возникновения эритродермических CTCL [69], а также продемонстрировали и увеличили скорость колонизации у пациентов с CTCL по сравнению со здоровыми людьми [70]. Дальнейшая работа продемонстрировала, что экзотоксины Staphylococcus могут приводить к выработке злокачественными Т-клетками интерлейкина-10, цитокина, который может снижать иммунный ответ, а также связан с прогрессирующим CTCL, устойчивым к лечению [71].В другом исследовании случай-контроль изучалось 310 человек с CTCL с подобранным контролем и было обнаружено повышенный риск (отношение шансов 3,33) CTCL с историей импетиго от 1 до 5 лет до постановки диагноза, что дополнительно указывает на возможную роль бактерий в развитии или сохранении болезни [72].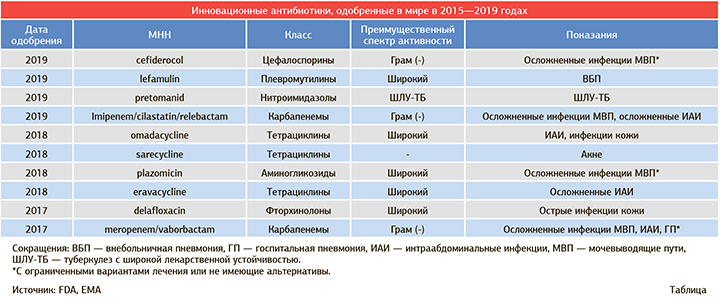
Было проведено одно исследование, посвященное изучению роли деколонизации в CTCL [73]. Из 106 отобранных пациентов 59% и 54% были колонизированы стафилококками на коже и носовых ходах соответственно. В частности, Staphylococcus aureus колонизировал 31% пациентов с положительной реакцией на кожу и нос. Пациенты получали мупироцин интраназально два раза в день в течение 5 дней, затем еженедельно в дополнение к пероральным антибиотикам в течение 4 недель (диклоксациллин или цефалексин для пациентов с аллергией на пенициллин). Более половины пролеченных пациентов продемонстрировали клинический ответ на терапию антибиотиками путем снижения уровня BSA не менее чем на 50%, при этом у некоторых пациентов наблюдался полный ответ или 100% снижение пораженного BSA.Антибиотики ликвидировали колонизацию S. aureus у 91% пациентов, получавших лечение, через 4-8 недель наблюдения. При повторном заселении отмечалось возгорание CTCL. Было бы интересно наблюдать за пациентами в течение более длительного периода, чтобы увидеть, как долго протокол деколонизации может улучшить или поддержать ремиссию их заболевания, а также использовать методы деколонизации без антибиотиков, такие как отбеливающие ванны. Тем не менее, это исследование важно для данной области, поскольку оно коррелировало клиническое улучшение с деколонизацией Staphylococcus у пациентов с CTCL.
Тем не менее, это исследование важно для данной области, поскольку оно коррелировало клиническое улучшение с деколонизацией Staphylococcus у пациентов с CTCL.
2,5. Mohs Surgery
Риск инфицирования при хирургии Mohs считается низким, но зависит от пациента и факторов риска окружающей среды. В некоторых случаях, относящихся к группе высокого риска, будут назначены профилактические антибиотики [74]. Всемирная организация здравоохранения рекомендует предоперационную деколонизацию с помощью интраназального мупироцина два раза в день, с промыванием хлоргексидином или без него, для предотвращения инфекций в области хирургического вмешательства у лиц, у которых был положительный результат мазка из носа на Staphylococcus [75].Колонизация носа является наиболее важным фактором риска инфекций в области хирургического вмешательства у пациентов [76]. В РКИ 738 случаев хирургического вмешательства по Моосу было рандомизировано носителей S. aureus для лечения деколонизацией (состоящее из интраназальной мази мупироцина два раза в день и промывания хлоргексидином ежедневно в течение 5 дней) или без предварительной обработки, с инфекцией области хирургического вмешательства, отмеченной как клинический исход [76] . У 4% колонизированных лиц, прошедших деколонизацию, развилась инфекция в области хирургического вмешательства, по сравнению с 11% носителей, которые не подвергались деколонизации.Частота инфицирования области хирургического вмешательства у деколонизированных пациентов была аналогична 3% у неколонизированных пациентов. Авторы также провели анализ затрат и определили, что было бы дешевле давать всем пациентам профилактические системные антибиотики вместо мазков и деколонизации пациентов, но предупреждают, что существуют риски для отдельного человека и на уровне населения из-за воздействия ненужных системных антибиотиков. Указанные затраты включают перерыв для обследования, материалы мазков, лабораторные расходы и процедуры деколонизации.Примерно в то же время было опубликовано рандомизированное контролируемое исследование, в котором сравнивалась роль профилактических антибиотиков и деколонизации у носителей S. aureus 693, перенесших операцию по Моосу [77]. Профилактический прием антибиотиков состоял из 2 доз цефалексина перорально.
У 4% колонизированных лиц, прошедших деколонизацию, развилась инфекция в области хирургического вмешательства, по сравнению с 11% носителей, которые не подвергались деколонизации.Частота инфицирования области хирургического вмешательства у деколонизированных пациентов была аналогична 3% у неколонизированных пациентов. Авторы также провели анализ затрат и определили, что было бы дешевле давать всем пациентам профилактические системные антибиотики вместо мазков и деколонизации пациентов, но предупреждают, что существуют риски для отдельного человека и на уровне населения из-за воздействия ненужных системных антибиотиков. Указанные затраты включают перерыв для обследования, материалы мазков, лабораторные расходы и процедуры деколонизации.Примерно в то же время было опубликовано рандомизированное контролируемое исследование, в котором сравнивалась роль профилактических антибиотиков и деколонизации у носителей S. aureus 693, перенесших операцию по Моосу [77]. Профилактический прием антибиотиков состоял из 2 доз цефалексина перорально. У 9% пациентов, получавших профилактику, развилась инфекция в области хирургического вмешательства, тогда как ни у одного пациента в группе деколонизации не развилось инфекция. Хотя это исследование не было слепым, оно поддерживает использование процедур деколонизации для идентифицированных носителей, если связанные с этим расходы находятся в разумных пределах.
У 9% пациентов, получавших профилактику, развилась инфекция в области хирургического вмешательства, тогда как ни у одного пациента в группе деколонизации не развилось инфекция. Хотя это исследование не было слепым, оно поддерживает использование процедур деколонизации для идентифицированных носителей, если связанные с этим расходы находятся в разумных пределах.
Несмотря на то, что Staphylococcus преимущественно колонизирует ноздри и носовые ходы, есть опасения, что мазки из носа могут занижать данные об истинных носителях, поскольку микроорганизмы были обнаружены в других местах у пациентов с отрицательными мазками из носа. В недавнем РКИ было набрано 1350 пациентов с отрицательными мазками из носа и рандомизировано для деколонизации с помощью интраназального мупироцина дважды в день и ежедневного промывания хлоргексидином в течение 5 дней по сравнению с отсутствием лечения [78]. Через 1 неделю у 2% пациентов, подвергшихся деколонизации, была инфекция в области хирургического вмешательства по сравнению с 4% в контрольной группе.Точно так же это исследование не могло быть закрытым. Взятые вместе, кажется, что существует роль в деколонизации независимо от результатов мазка из носа с общей тенденцией к снижению инфекции области хирургического вмешательства у пациентов Мооса.
3. Устойчивость к противомикробным препаратам
Неудивительно, что растет устойчивость бактерий к мупироцину. В одной больнице распространенность резистентности к мупироцину в изолятах MRSA увеличилась с 2,7% до 65% после того, как они начали протокол деколонизации мупироцина [79].Важно отметить, что в этом исследовании наблюдалось быстрое повышение устойчивости к мупироцину во время эпидемии MRSA в учебной больнице, когда мазь мупироина применялась интраназально три раза в день каждый день во время госпитализации. Высокие показатели устойчивости были связаны с длительным применением мупироцина [80]. Другие исследования выявили больницы и общественные дома с высоким уровнем резистентности [81], а резистентность связана с неудачей деколонизации [82]. Точно так же распространенность устойчивости к хлоргексидину увеличивается, и, по сообщениям, уровень устойчивости достигает 19.3% в отделении интенсивной терапии [83]. Большинство исследований, изучающих развитие резистентности, сосредоточено на больничных палатах и отделениях интенсивной терапии. Существует призыв к антисептическому контролю, при котором можно ограничить использование антисептиков для приложений, не основанных на доказательствах [84]. В эпоху устойчивости к антибиотикам еще предстоит выяснить, могут ли заболеваемость и финансовые преимущества деколонизации перевесить риски, связанные с устойчивостью к этим агентам. Поскольку не сообщалось о устойчивости к отбеливающим ваннам, возможно, что он может заменить промывки хлоргексидином в будущих протоколах деколонизации.
4. Будущие исследования и выводы
Американское общество инфекционных заболеваний опубликовало рекомендуемые руководства по рецидивирующим инфекциям MRSA, которые включают 5-10 дней интраназального введения мупироцина с деколонизацией организма ежедневным промыванием хлоргексидином в течение 5-14 дней или 15 дней. минутные ванны с разбавленным отбеливателем два раза в неделю в течение 3 месяцев [85]. Эти рекомендации основаны на данных, касающихся SSTI, а также эндокардита и инфекций центральной нервной системы. Этот режим является обычным в обсуждаемых исследованиях и, по-видимому, позволяет успешно деколонизировать пациентов.В контексте устойчивости к противомикробным препаратам растет потребность в успешных стратегиях деколонизации, которые могут обеспечить долгосрочную ликвидацию.
S. aureus представляет собой особо опасный для дерматологии организм. Он участвует в патогенезе и сохранении множества кожных заболеваний. Деколонизация пораженных людей может положительно сказаться на их заболевании, помимо предотвращения повторных инфекций. Индивидуальные протоколы деколонизации могут быть лучшими в зависимости от состояния пациента.
Disclosure
LW является вторым исследователем исследования Novartis / Clarity (CAIN457A2326), 6 / 2017–6 / 2018.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.

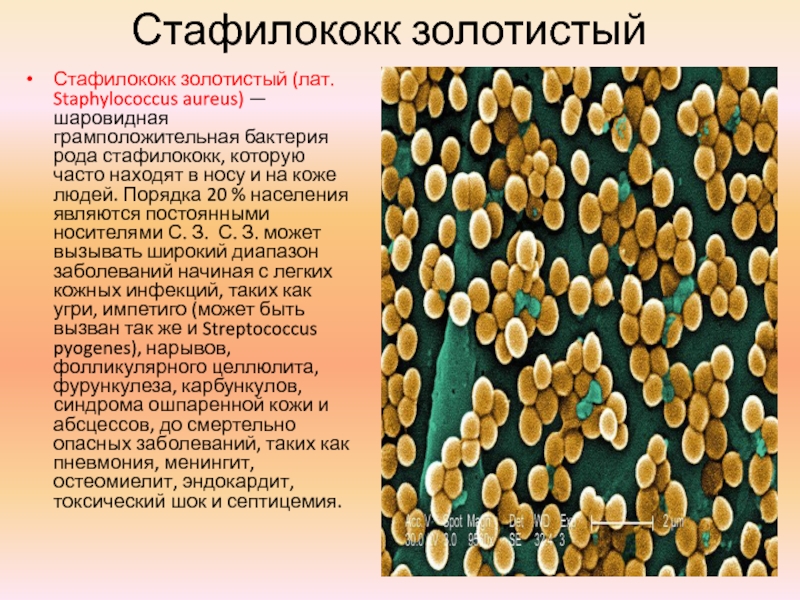
 van Leeuwen и F.R. Mooi. 1994. Различение эпидемических и неэпидемических метициллин-устойчивых штаммов Staphylococcus aureus на основе полиморфизма гена протеина А. J. Clin. Microbiol.32 : 846-847.
van Leeuwen и F.R. Mooi. 1994. Различение эпидемических и неэпидемических метициллин-устойчивых штаммов Staphylococcus aureus на основе полиморфизма гена протеина А. J. Clin. Microbiol.32 : 846-847. 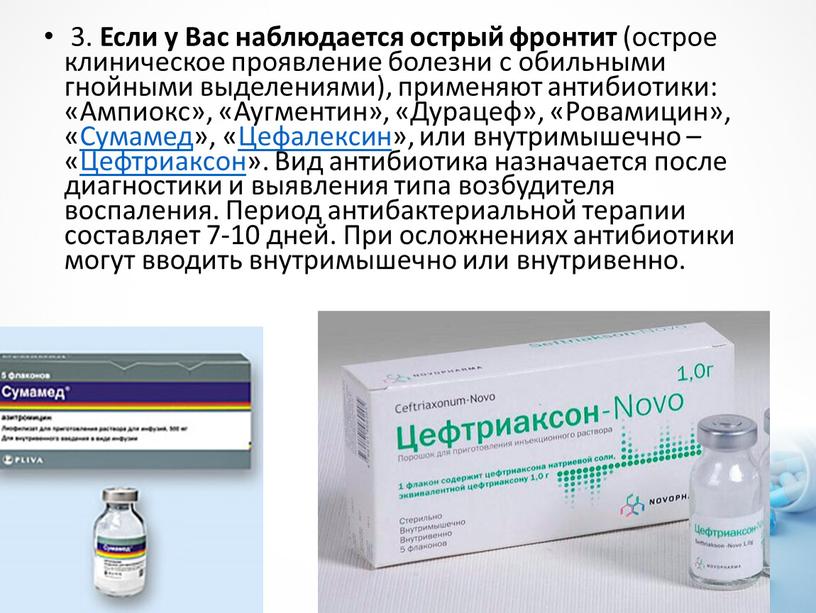 van Belkum и H. Verbrugh. 1997. Носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски.Clin. Microbiol. Версия 10 : 505-520.
van Belkum и H. Verbrugh. 1997. Носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски.Clin. Microbiol. Версия 10 : 505-520.  J. Clin. Microbiol.41 : 1574-1585.
J. Clin. Microbiol.41 : 1574-1585.  , Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать развитию устойчивости к мупироцину у метициллин-резистентного Staphylococcus aureus . J. Clin. Microbiol.39 : 3775-3777.
, Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать развитию устойчивости к мупироцину у метициллин-резистентного Staphylococcus aureus . J. Clin. Microbiol.39 : 3775-3777.  J. Hosp. Заражение 56 : 321-325.
J. Hosp. Заражение 56 : 321-325.