| Бактериофаг клебсиелл пневмонии очищенный | Р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. рег. №: ЛС-001297 от 10.06.11 Дата перерегистрации: 11.05.18 | |||
| Бактериофаг клебсиелл поливалентный очищенный | Р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. рег. №: ЛС-001361 от 07.07.11 Дата перерегистрации: 11.05.18 | |||
| Витабакт® | Капли глазные рег.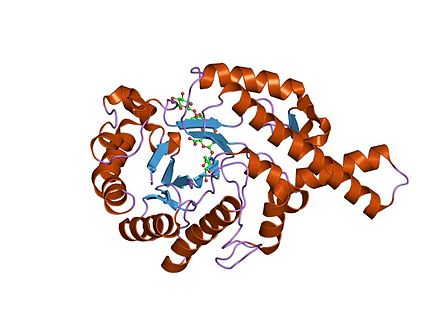 №: П N014701/01
от 22.12.08
Дата перерегистрации: 15.07.09 №: П N014701/01
от 22.12.08
Дата перерегистрации: 15.07.09 | |||
| Вобэнзим | Таблетки кишечнорастворимые, покрытые оболочкой рег. №: П N011530/01 от 19.02.10 Дата перерегистрации: 21.08.17 | |||
| Гидрокортизон | Мазь глазная 0.5%: тубы 3 г или 5 г рег. №: ЛС-002379 от 14.02.11 | |||
| Грамицидин С | Конц. д/пригот. р-ра д/местн. и наружн. прим. спиртовой 2%: фл. 5 мл или 10 мл рег. №: ЛСР-008631/08
от 30.10.08 д/пригот. р-ра д/местн. и наружн. прим. спиртовой 2%: фл. 5 мл или 10 мл рег. №: ЛСР-008631/08
от 30.10.08 | |||
| Грамицидин С | Таб. д/рассасывания 1.5 мг (1500 ЕД): 10 или 20 шт. рег. №: ЛСР-005761/08 от 03.04.12 | |||
| Дексаметазон | Капли глазные 0.1%: тюбик-капельн. 1 мл 2 или 5 шт., 1.5 мл 2 шт., 2 мл 2 или 5 шт., 5 мл или 10 мл 1 шт. рег. №: ЛСР-006566/10 от 09.07.10 Дата перерегистрации: 24.05.18 | |||
| Дексаметазон | Р-р д/инъекц. Р-р д/инъекц. 8 мг/2 мл: амп. 5, 10, 15, 20 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08 | |||
| Дексаметазон-Беталек | Капли глазные и ушные рег. №: ЛСР-002286/07 от 17.08.07 Дата перерегистрации: 28.03.08 | |||
| Дексона | Раствор-капли глазные и ушные рег. №: П N013981/01 от 21.07.08 | |||
| Диклофенак | Капли глазные 0. | |||
| Ивинак®-СОЛОфарм | Капли глазные рег. №: ЛП-006155 от 19.03.20 | |||
| Ирифрин® | Капли глазные 2.5%: фл.-капельн. 5 мл 1 шт. или фл. 5 мл 1 шт. в компл. с капельн. рег. №: П N013268/01
от 04.05.08
Дата перерегистрации: 04.12.13 Капли глазные 10%: фл.-капельн. 5 мл 1 шт. или фл. 5 мл 1 шт. в компл. с капельн. рег. №: П N013268/01 от 04.05.08 Дата перерегистрации: 04.12.13 | |||
| Комбинил® | Капли глазные и ушные рег. | |||
| Корфецин-СОЛОфарм | Капли глазные рег. №: ЛП-004314 от 01.06.17 Дата перерегистрации: 21.12.18 | |||
| Максидекс® | Капли глазные 0.1%: фл.-капельн. 5 мл рег. №: П N013731/01 от 11.12.08 Дата перерегистрации: 12.04.17 | |||
| Макситрол | Капли глазные рег. №: П N014557/01
от 22.05.08 №: П N014557/01
от 22.05.08 | |||
| Медрол® | Таб. 4 мг: 10, 30 или 100 шт. рег. №: П N015350/01 от 15.12.08Таб. 16 мг: 14 или 50 шт. рег. №: П N015350/01 от 15.12.08Таб. 32 мг: 20 или 50 шт. рег. №: П N015350/01 от 15.12.08 | |||
| Метипред | Таб. 4 мг: 30 или 100 шт. рег. №: П N015709/01 от 06.02.09 Дата перерегистрации: 14.09.20Таб. 16 мг: 30 или 100 шт. рег. №: П N015709/01 от 06.02.09 Дата перерегистрации: 14.09.20 | Произведено и расфасовано: ORION CORPORATION (Финляндия) | ||
| Окомистин® | Капли глазные, ушные, назальные 0. | |||
| Офтан® Дексаметазон | Капли глазные рег. №: П N015347/01 от 15.12.08 Дата перерегистрации: 17.02.15 | |||
| Пикторид-СОЛОфарм | Капли глазные рег. №: ЛП-006059 от 24.01.20 | |||
| Пиобактериофаг поливалентный очищенный | Р-р д/приема внутрь, местн. Р-р д/приема внутрь, местн. и наружн. прим.: фл. 20 мл 4 или 10 шт. рег. №: ЛС-002031 от 04.12.12 | |||
| Пирогенал | Р-р д/в/м введ. 10 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 25 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 50 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 100 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13 | |||
| Пирогенал | Супп. | |||
| Пирогенал | Супп. ректальные 150 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Пирогенал | Супп. ректальные 200 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Пирогенал | Супп. ректальные 50 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Полькортолон | Таб. | |||
| Преднизолон | Таб. 5 мг: 100 шт. рег. №: ЛС-001000 от 24.05.11 | |||
| Преднизолон | Таб. 5 мг: 100 шт. рег. №: П N011381/01 от 25.05.09 Дата перерегистрации: 23.10.19 | |||
| Преднизолон | Таб. | |||
| Пренацид | Капли глазные 0.25%: фл. 10 мл 1 шт. в компл. с крышкой-капельницей рег. №: П N015185/02 от 29.08.08 | |||
| Реополиглюкин с глюкозой | Р-р д/инф. 10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт. рег. №: ЛС-001517 от 31.08.11 | |||
| Реополиглюкин-40 | Р-р д/инф. 10%: фл. 200 мл 1, 24 или 28 шт. | |||
| Секстафаг | Раствор для приема внутрь, местного и наружного применения рег. №: ЛС-001049 от 14.02.12 | |||
| Сигницеф® | Капли глазные рег. №: ЛСР-009882/09 от 04.12.09 Дата перерегистрации: 04.12.13 | |||
| Солу-Кортеф | Лиофилизат д/пригот р-ра д/в/в и в/м введен. Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. 1 шт. рег. №: П N008915 от 19.09.11 | |||
| Солу-Медрол® | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1 г: фл. в компл. с растворителем рег. №: П N014983/01 от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. двухъемкостные с растворителем рег. №: П N014983/01 от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 500 мг: фл. в компл. с растворителем рег. №: П N014983/01 от 12.08.09 | |||
| Софрадекс® | Капли глазные и ушные рег. №: П N013871/01
от 29.10.08 №: П N013871/01
от 29.10.08 | |||
| Спарфло® | Таблетки, покрытые оболочкой рег. №: П N011913/01 от 07.08.07 | |||
| Стелфрин супра | Капли глазные рег. №: ЛП-004373 от 11.07.17 Дата перерегистрации: 16.09.19 | |||
| Сульфацил натрия-СОЛОфарм | Капли глазные рег. №: ЛП-003062
от 29.06.15
Дата перерегистрации: 30.06.20 №: ЛП-003062
от 29.06.15
Дата перерегистрации: 30.06.20 | |||
| Трипсин кристаллический | Лиофилизат д/пригот. р-ра д/и и местного применения 10 мг: амп. 10 шт. рег. №: ЛСР-004130/09 от 26.05.09 | |||
| Цикломед® | Капли глазные рег. №: П N012918/01 от 19.12.07 Дата перерегистрации: 05.12.13 | |||
| Ципромед | Капли глазные 0.3%: фл. 5 мл 1 шт. в компл. с капельн., фл.-капельн. 5 мл 1 шт. рег. №: П N012981/01 от 20. 03.08
Дата перерегистрации: 19.10.15 03.08
Дата перерегистрации: 19.10.15 | |||
| Название | Форма выпуска | Владелец рег. уд. | ||
| Виксипин® | Капли глазные рег. №: ЛП-003864 от 28.09.16 Дата перерегистрации: 03.06.20 | ГРОТЕКС
(Россия)
контакты: ГРОТЕКС ООО (Россия) | ||
| Гистохром | Р-р д/инъекц. | Тихоокеанский институт биоорганической химии ДВО РАН (Россия) | ||
| Лидаза | Лиофилизат д/пригот. р-ра д/инъекц. и местн. прим. 64 УЕ: фл. 5 или 10 шт. рег. №: Р N000820/01 от 29.05.09 Дата перерегистрации: 18.03.20 | САМСОН-МЕД
(Россия)
контакты: САМСОН-МЕД ООО (Россия) | ||
| Транексам® | Таб., покр. пленочной оболочкой, 250 мг: 10, 20, 30 или 50 шт. рег. №: ЛС-001070 от 15.02.10 Дата перерегистрации: 07.09.18Таб., покр. пленочной оболочкой, 500 мг: 10, 20, 30 или 50 шт. рег. №: ЛСР-003389/10 от 23.04.10 Дата перерегистрации: 08.10.18 | НИЖФАРМ
(Россия)
Произведено:
Обнинская химико-фармацевтическая компания
(Россия)
контакты: ШТАДА (Россия) | ||
| Трипсин кристаллический | Лиофилизат д/пригот. р-ра д/и и местн. прим. 10 мг: фл. 5 или 10 шт. рег. №: ЛС-000403 от 05.05.10 Дата перерегистрации: 14.12.17 | САМСОН-МЕД
(Россия)
контакты: САМСОН-МЕД ООО (Россия) | ||
| Трипсин кристаллический | Лиофилизат д/пригот. р-ра д/и и местного применения 10 мг: амп. 10 шт. рег. №: ЛСР-004130/09 от 26.05.09 | НПО МИКРОГЕН
(Россия)
контакты: НПО МИКРОГЕН АО (Россия) | ||
| Эмокси-Оптик® | Капли глазные рег. №: Р N002264/01 от 23.07.09 | СИНТЕЗ
(Россия)
контакты: СИНТЕЗ ОАО акционерное курганское общество медицинских препаратов и изделий (Россия) | ||
| Эмоксибел | Капли глазные 1%: фл. 5 мл 1 шт. рег. №: ЛП-000020 от 28.10.10 | ОМЕЛА (Россия) Произведено: БЕЛМЕДПРЕПАРАТЫ (Республика Беларусь) | ||
| Эмоксипин | Капли глазные 1%: фл. 5 мл рег. №: Р N002186/02 от 08.09.08 | Фирма ФЕРМЕНТ (Россия) | ||
| Эмоксипин | Капли глазные 1%: фл. 5 мл с крышкой-капельницей рег. №: ЛС-002151 от 16.11.11 | МОСКОВСКИЙ ЭНДОКРИННЫЙ ЗАВОД (Россия) |
| Бактериофаг клебсиелл пневмонии очищенный | Р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. рег. №: ЛС-001297 от 10.06.11 Дата перерегистрации: 11.05.18 | |||
| Бактериофаг клебсиелл поливалентный очищенный | Р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. рег. №: ЛС-001361 от 07.07.11 Дата перерегистрации: 11.05.18 | |||
| Витабакт® | Капли глазные рег. №: П N014701/01 от 22.12.08 Дата перерегистрации: 15.07.09 | |||
| Вобэнзим | Таблетки кишечнорастворимые, покрытые оболочкой рег. №: П N011530/01 от 19.02.10 Дата перерегистрации: 21.08.17 | |||
| Гидрокортизон | Мазь глазная 0.5%: тубы 3 г или 5 г рег. №: ЛС-002379 от 14.02.11 | |||
| Грамицидин С | Конц. д/пригот. р-ра д/местн. и наружн. прим. спиртовой 2%: фл. 5 мл или 10 мл рег. №: ЛСР-008631/08 от 30.10.08 | |||
| Грамицидин С | Таб. д/рассасывания 1.5 мг (1500 ЕД): 10 или 20 шт. рег. №: ЛСР-005761/08 от 03.04.12 | |||
| Дексаметазон | Капли глазные 0.1%: тюбик-капельн. 1 мл 2 или 5 шт., 1.5 мл 2 шт., 2 мл 2 или 5 шт., 5 мл или 10 мл 1 шт. рег. №: ЛСР-006566/10 от 09.07.10 Дата перерегистрации: 24.05.18 | |||
| Дексаметазон | Р-р д/инъекц. 4 мг/1 мл: амп. 5, 10, 20, 25 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08Р-р д/инъекц. 8 мг/2 мл: амп. 5, 10, 15, 20 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08 | |||
| Дексаметазон-Беталек | Капли глазные и ушные рег. №: ЛСР-002286/07 от 17.08.07 Дата перерегистрации: 28.03.08 | |||
| Дексона | Раствор-капли глазные и ушные рег. №: П N013981/01 от 21.07.08 | |||
| Диклофенак | Капли глазные 0.1%: фл.-капельн. 5 мл или 10 мл. рег. №: ЛС-001146 от 01.11.10 | |||
| Ивинак®-СОЛОфарм | Капли глазные рег. №: ЛП-006155 от 19.03.20 | |||
| Ирифрин® | Капли глазные 2.5%: фл.-капельн. 5 мл 1 шт. или фл. 5 мл 1 шт. в компл. с капельн. рег. №: П N013268/01 от 04.05.08 Дата перерегистрации: 04.12.13Капли глазные 10%: фл.-капельн. 5 мл 1 шт. или фл. 5 мл 1 шт. в компл. с капельн. рег. №: П N013268/01 от 04.05.08 Дата перерегистрации: 04.12.13 | |||
| Комбинил® | Капли глазные и ушные рег. №: ЛСР-006467/09 от 13.08.09 Дата перерегистрации: 28.10.15 | |||
| Корфецин-СОЛОфарм | Капли глазные рег. №: ЛП-004314 от 01.06.17 Дата перерегистрации: 21.12.18 | |||
| Максидекс® | Капли глазные 0.1%: фл.-капельн. 5 мл рег. №: П N013731/01 от 11.12.08 Дата перерегистрации: 12.04.17 | |||
| Макситрол | Капли глазные рег. №: П N014557/01 от 22.05.08 | |||
| Медрол® | Таб. 4 мг: 10, 30 или 100 шт. рег. №: П N015350/01 от 15.12.08Таб. 16 мг: 14 или 50 шт. рег. №: П N015350/01 от 15.12.08Таб. 32 мг: 20 или 50 шт. рег. №: П N015350/01 от 15.12.08 | |||
| Метипред | Таб. 4 мг: 30 или 100 шт. рег. №: П N015709/01 от 06.02.09 Дата перерегистрации: 14.09.20Таб. 16 мг: 30 или 100 шт. рег. №: П N015709/01 от 06.02.09 Дата перерегистрации: 14.09.20 | Произведено и расфасовано: ORION CORPORATION (Финляндия) | ||
| Окомистин® | Капли глазные, ушные, назальные 0.01%: тюбик-капельницы 1 мл, 1.5 мл 5 или 10 шт., фл. полимерные 5 мл, 10 мл 1 или 5 шт., фл. стеклянные 20 мл 1 или 5 шт. рег. №: ЛСР-004896/09 от 19.06.09 Дата перерегистрации: 03.07.19 | |||
| Офтан® Дексаметазон | Капли глазные рег. №: П N015347/01 от 15.12.08 Дата перерегистрации: 17.02.15 | |||
| Пикторид-СОЛОфарм | Капли глазные рег. №: ЛП-006059 от 24.01.20 | |||
| Пиобактериофаг комплексный | Р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 8 шт. рег. №: ЛС-000700 от 21.06.10 Дата перерегистрации: 29.06.20Р-р д/приема внутрь, местн. и наружн. прим. 100 мл: фл. 1 шт. рег. №: ЛС-000700 от 21.06.10 Дата перерегистрации: 29.06.20 | |||
| Пиобактериофаг поливалентный очищенный | Р-р д/приема внутрь, местн. и наружн. прим.: фл. 10 мл 4 или 10 шт. рег. №: ЛС-002031 от 04.12.12Р-р д/приема внутрь, местн. и наружн. прим.: фл. 20 мл 4 или 10 шт. рег. №: ЛС-002031 от 04.12.12 | |||
| Пирогенал | Р-р д/в/м введ. 10 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 25 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 50 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13Р-р д/в/м введ. 100 мкг: 1 мл амп. 10 шт. рег. №: Р N003478/01 от 17.05.13 | |||
| Пирогенал | Супп. ректальные 100 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Пирогенал | Супп. ректальные 150 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Пирогенал | Супп. ректальные 200 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Пирогенал | Супп. ректальные 50 мкг: 10 шт. рег. №: Р N001487/01 от 25.03.08 | |||
| Полькортолон | Таб. 4 мг: 50 шт. рег. №: П N013540/01 от 11.09.12 | |||
| Преднизолон | Таб. 5 мг: 100 шт. рег. №: ЛС-001000 от 24.05.11 | |||
| Преднизолон | Таб. 5 мг: 100 шт. рег. №: П N011381/01 от 25.05.09 Дата перерегистрации: 23.10.19 | |||
| Преднизолон | Таб. 5 мг: 20, 30, 50 или 60 шт. рег. №: ЛП-000773 от 29.09.11 | |||
| Пренацид | Капли глазные 0.25%: фл. 10 мл 1 шт. в компл. с крышкой-капельницей рег. №: П N015185/02 от 29.08.08 | |||
| Секстафаг | Раствор для приема внутрь, местного и наружного применения рег. №: ЛС-001049 от 14.02.12 | |||
| Сигницеф® | Капли глазные рег. №: ЛСР-009882/09 от 04.12.09 Дата перерегистрации: 04.12.13 | |||
| Солу-Кортеф | Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. двухъемкостн. 1 шт. (с растворителем) рег. №: П N008915 от 19.09.11Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. 1 шт. рег. №: П N008915 от 19.09.11 | |||
| Солу-Медрол® | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1 г: фл. в компл. с растворителем рег. №: П N014983/01 от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. двухъемкостные с растворителем рег. №: П N014983/01 от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 500 мг: фл. в компл. с растворителем рег. №: П N014983/01 от 12.08.09 | |||
| Софрадекс® | Капли глазные и ушные рег. №: П N013871/01 от 29.10.08 | |||
| Спарфло® | Таблетки, покрытые оболочкой рег. №: П N011913/01 от 07.08.07 | |||
| Стелфрин супра | Капли глазные рег. №: ЛП-004373 от 11.07.17 Дата перерегистрации: 16.09.19 | |||
| Сульфацил натрия-СОЛОфарм | Капли глазные рег. №: ЛП-003062 от 29.06.15 Дата перерегистрации: 30.06.20 | |||
| Трипсин кристаллический | Лиофилизат д/пригот. р-ра д/и и местн. прим. 10 мг: фл. 5 или 10 шт. рег. №: ЛС-000403 от 05.05.10 Дата перерегистрации: 14.12.17 | |||
| Трипсин кристаллический | Лиофилизат д/пригот. р-ра д/и и местного применения 10 мг: амп. 10 шт. рег. №: ЛСР-004130/09 от 26.05.09 | |||
| Цикломед® | Капли глазные рег. №: П N012918/01 от 19.12.07 Дата перерегистрации: 05.12.13 | |||
| Ципромед | Капли глазные 0.3%: фл. 5 мл 1 шт. в компл. с капельн., фл.-капельн. 5 мл 1 шт. рег. №: П N012981/01 от 20.03.08 Дата перерегистрации: 19.10.15 | |||
Трипсин кристаллический лиоф. д/ин/мест.прим. 10мг флакон №10 (Трипсин)
Бронхоэктатическая болезнь, абсцессы легких, экссудативный плеврит, послеоперационные ателектазы, эмпиема плевры; лечение гнойных ран и ожогов; хронические гнойные отиты, гнойные синуситы, гаймориты; острые тромбофлебиты, острые и хронические одонтогенные остеомиелиты, воспалительно-дистрофические формы пародонтоза, острые ириды и иридоциклиты, кровоизлияния в камере глаза и отеки окологлазничных тканей после травм и операций, непроходимость слезоотводящйх путей.
Гиперчувствительность, сердечная недостаточность, эмфизема легких с дыхательной недостаточностью, декомпенсированная форма туберкулеза легких, дистрофия и цирроз печени, инфекционный гепатит, поражения почек, панкреатит, геморрагический диатез.
Активное вещество: Трипсин кристаллический. Форма выпуска: Лиофилизат для приготовления раствора для инъекций и местного применения 10 мг флакон №10.
Трипсин кристаллический применяется внутримышечно, интраплеврально, в виде аэрозолей и электрофореза. Внутримышечно: трипсин взрослым по 0,005-0,01 г -1-2 раза в сутки, детям по 0,0025 г 1 раз в сутки. Для инъекций разводят, непосредственно перед применением, 0,005 г трипсина кристаллического в 1-2 мл 0,9 % раствора натрия хлорида или 0,5-2 % раствора прокаина. Курс лечения 6-15 инъекций. Применяют также электрофорез с трипсином: на одну процедуру 10 мг трипсина (растворить в 15-20 мл дистиллированной воды), вводят с отрицательного полюса. Ингаляционно: по 0,005-0,01 г в 2-3 мл 0,9 % раствора натрия хлорида через ингалятор или через бронхоскоп. После ингаляции прополоскать рот теплой водой и промыть нос. Глазные капли: 0,2-0,25 % раствор, который готовят непосредственно перед применением, 3-4 раза в сутки в течение 1-3 дней. Интраплеврально: 1 раз в сутки 10-20 мг препарата, растворенного в 20-50 мл 0,9 % раствора натрия хлорида, после введения желательно частое изменение положения тела; на 2 день после инсталляции выпускают, как правило, разжиженный экссудат. Местно: в виде присыпки или раствора , на сухие или некротизированные раны, накладывают компрессы (раствор готовят непосредственно перед применением: 50 мг трипсина растворяют в 5 мл стерильной воды или физиологического раствора, при лечении гнойных ран — в 5 мл фосфатного буферного раствора). Трехслойное тканое полотно из диальдегидцеллюлозы, пропитанное трипсином, накладывают на рану (после ее обработки) и закрепляют повязкой, оставляют на ране не более 24 ч. Перед применением полотно смачивают дистиллированной водой или раствором фурацилина. Время полного очищения раны от некротических тканей и гноя — 24-72 ч. При необходимости — применяют повторно.
Особые указания: Нельзя вводить препарат в очаги воспаления и в кровоточащие полости. Нельзя вводить препарат внутривенно. Нельзя наносить трипсин на изъязвленные поверхности злокачественных опухолей во избежание распространения злокачественного процесса. Хранить в сухом, защищенном от света месте при температуре не выше +10°С. Взаимодействие с другими препаратами: Только при ингаляции можно прибавить к раствору бронхорасширяющие вещества и антибиотики. Побочные эффекты: Аллергические реакции. Повышение температуры тела, тахикардия. Болезненность и гиперемия в месте инъекции при внутримышечном введении. При ингаляции трипсина могут появиться раздражение слизистых оболочек верхних дыхательных путей и охриплость голоса.
Отзывы 💬 Трипсин Кристаллический 10 Мг Лиофилизат Для Приготовления Раствора Для Инъекций И Местного Применения 5 Шт Недостатки и Достоинства
Инструкция на Трипсин кристаллический
10 мг, лиофилизат для приготовления раствора для инъекций и местного применения, 5 шт. Описание Фармакологическое действие Показания к применению Способ применения и дозы Применение при беременности и кормлении грудью Противопоказания Побочное действие Взаимодействие Особые указания Условия хранения Срок годности Условия отпуска КомментарийОписание
Лиофилизат для приготовления раствора для инъекций и местного применения в виде лиофилизированного порошка или пористой массы, уплотненной в таблетку белого или белого со слегка желтоватым оттенком цвета.
1 фл. | |
трипсин кристаллический* | 10 мг |
* получен из поджелудочной железы крупного рогатого скота.
Флаконы стеклянные вместимостью 5 мл (5) — пачки картонные. Флаконы стеклянные вместимостью 5 мл (10) — пачки картонные.
Фармакологическое действие
Трипсин кристаллический — ферментный препарат протеолитического действия, получаемый из поджелудочной железы крупного рогатого скота.
Трипсин обладает выраженными противовоспалительным и противоотечным свойствами, способен расщеплять омертвевшие участки тканей, фибринозные образования, вязкие секреты и экссудаты. По отношению к здоровым тканям фермент неактивен и безопасен в связи с наличием в них ингибиторов трипсина (специфических и неспецифических). Не влияет на систему гемостаза.
Трипсин кристаллический: Показания
— бронхоэктатическая болезнь;
— абсцессы легких;
— экссудативный плеврит;
— послеоперационные ателектазы;
— эмпиема плевры;
— лечение гнойных ран и ожогов;
— хронические гнойные отиты;
— гнойные синуситы, гаймориты;
— острые тромбофлебиты;
— острые и хронические одонтогенные остеомиелиты;
— воспалительно-дистрофические формы пародонтоза;
— острые ириды и иридоциклиты;
— кровоизлияния в камере глаза и отеки окологлазничных тканей после травм и операций;
— непроходимость слезоотводящих путей.
Способ применения и дозы
Трипсин кристаллический применяется в/м, интраплеврально, в виде аэрозолей и электрофореза.
В/м: взрослым по 0.005-0.01 г 1-2 раза/сут, детям — по 0.0025 г 1 раз/сут. Для инъекций разводят, непосредственно перед применением, 0.005 г трипсина кристаллического в 1-2 мл 0.9% раствора натрия хлорида или 0.5-2% раствора прокаина. Курс лечения — 6-15 инъекций. Применяют также электрофорез с трипсином: на одну процедуру 10 мг трипсина (растворить в 15-20 мл дистиллированной воды), вводят с отрицательного полюса.
Ингаляционно: по 0.005-0.01 г в 2-3 мл 0.9% раствора натрия хлорида через ингалятор или через бронхоскоп. После ингаляции прополоскать рот теплой водой и промыть нос.
Глазные капли: 0.2-0.25% раствор, который готовят непосредственно перед применением, 3-4 раза/сут в течение 1-3 дней.
Интраплеврально: 1 раз/сут 10-20 мг препарата, растворенного в 20-50 мл 0.9% раствора натрия хлорида, после введения желательно частое изменение положения тела; на 2 день после инсталляции выпускают, как правило, разжиженный экссудат.
Местно: в виде присыпки или раствора, на сухие или некротизированные раны накладывают компрессы (раствор готовят непосредственно перед применением: 50 мг трипсина растворяют в 5 мл стерильной воды или физиологического раствора, при лечении гнойных ран — в 5 мл фосфатного буферного раствора). Трехслойное тканое полотно из диальдегидцеллюлозы, пропитанное трипсином, накладывают на рану (после ее обработки) и закрепляют повязкой, оставляют на ране не более 24 ч. Перед применением полотно смачивают дистиллированной водой или раствором фурацилина. Время полного очищения раны от некротических тканей и гноя — 24-72 ч. При необходимости — применяют повторно.
Применение при беременности и кормлении грудью
Возможно только при условии, что ожидаемая польза для женщины превышает возможный риск, как для женщины, так и для ребенка.
Трипсин кристаллический: Противопоказания
— сердечная недостаточность;
— эмфизема легких с дыхательной недостаточностью;
— декомпенсированная форма туберкулеза легких;
— дистрофия и цирроз печени;
— инфекционный гепатит;
— поражения почек;
— панкреатит;
— геморрагический диатез;
— гиперчувствительность.
Трипсин кристаллический: Побочные действия
Аллергические реакции, повышение температуры тела, тахикардия.
Местные реакции: Болезненность и гиперемия в месте инъекции при в/м введении. При ингаляции трипсина могут появиться раздражение слизистых оболочек верхних дыхательных путей и охриплость голоса.
Взаимодействие
Только при ингаляции можно прибавить к раствору бронхорасширяющие вещества и антибиотики.
Особые указания
Нельзя вводить препарат в очаги воспаления и в кровоточащие полости.
Нельзя вводить препарат в/в.
Нельзя наносить трипсин на изъязвленные поверхности злокачественных опухолей во избежание распространения злокачественного процесса.
Условия хранения
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре не выше 10°С.
Срок годности
Срок годности — 3 года.
Условия отпуска
Препарат отпускается по рецепту.
Комментарий
НОМЕР И ДАТА РЕГИСТРАЦИИ ЛС-000403 от 05.05.2010
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
ул. Викулова, д. 38Б (круглосуточно) +7 (343) 232-35-00 | 676.00 ₽ 19-03-2021 (ЦФИ) | |
| ПН — ВС 09:00 — 19:00 | Вильгельма де Геннина 33 361-31-81 | 735.10 ₽ 19-03-2021 (086) |
| ПН — ВС 08:00 — 22:00 | Белинского 141А 361-31-81 | 749.10 ₽ 19-03-2021 (086) |
| 07:30-23:00 | ул. 8 Марта, д. 150 +7 (343) 377-72-22 | 768.60 ₽ 19-03-2021 (ЦФИ) |
8 800 700-88-88 (звонки по России беспл. | 779.00 ₽ 19-03-2021 (ЦФИ) | |
| 08:00-22:00 | ул. Луначарского, д. 210Б +7 (343) 385-65-39 | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | ул.Белореченская, д.17/1 +7 (343) 234-18-02 | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | Белинского, 198 8 (343) 210-41-10 | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 08:00-21:00 | Бардина, 19 8 (343) 232-02-62 | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 9:00-23:00 | Ильича, 71 320-39-57, 335-85-34, | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | ул. Посадская, д. 31 +7 (343) 385-77-47 | 787.90 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | проспект Космонавтов, д. 49 +7 (343) 385-67-12 | 790.00 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | Арамиль , ул. 1 Мая, д. 27 +7 (34374) 2-86-00 | 790.00 ₽ 19-03-2021 (ЦФИ) |
| ПН — ПТ 08:00 — 22:00 СБ — ВС 08:00 — 21:00 | Баумана 1 331-22-77 | 790.20 ₽ 19-03-2021 (086) |
| 08:00-22:00 | ул. Тверитина, д. 19 +7 (343) 385-69-32 | 795.80 ₽ 19-03-2021 (ЦФИ) |
Луначарского 74 361-31-81 | 802.90 ₽ 19-03-2021 (086) | |
| 08:00-21:00 | Черноморский, 2 331-81-31 | 805.90 ₽ 19-03-2021 (ЦФИ) |
| 8:00-21:00 | Военная, 6 210-88-67, | 808.30 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | бульвар Денисова-Уральского, д. 16 +7 (343) 300-12-14 | 811.60 ₽ 19-03-2021 (ЦФИ) |
| 8:00-21:00 | Бардина, 48 267-23-02, | 811.60 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | Белореченская, 7 234-74-20 | 815.60 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | Березовский, Шиловская, 19 (34369) 4-20-18, 4-54-06, | 827.70 ₽ 19-03-2021 (ЦФИ) |
| 08:00-22:00 | ул. Комсомольская, д. 6 +7 (343) 375-31-85 | 836.80 ₽ 19-03-2021 (ЦФИ) |
| 08:00-21:00 | ул. Комсомольская, д. 1 +7 (343) 286-18-13 | 836.80 ₽ 19-03-2021 (ЦФИ) |
| 08:00-21:00 | Гагарина, 6 (343) 375-84-74 | 877.70 ₽ 19-03-2021 (ЦФИ) |
| 8:00-21:00 | Варшавская, 38 261-81-44 | 896.00 ₽ 19-03-2021 (ЦФИ) |
| 8:00-21:00 | проспект Ленина, д. 69/3 ( вход с ул. Луначарского) 358-93-98 | 901.80 ₽ 19-03-2021 (ЦФИ) |
| 8:00-21:00 | Заводская, 17 231-50-06, | 934.70 ₽ 19-03-2021 (ЦФИ) |
| 08:00-21:00 | Дружининская, 48 322-07-26 | 942.00 ₽ 19-03-2021 (ЦФИ) |
| 07:00-23:00 | Родонитовая, 3/1 381-27-56 | 956.00 ₽ 19-03-2021 (ЦФИ) |
| 08:00-21:00 | Шаумяна, 105 234-55-33, 234-56-56 | 992.00 ₽ 18-03-2021 (ЦФИ) |
| 08:00-22:00 | ул. Щорса, д. 96 +7 (343) 286-58-29 | 1,005.40 ₽ 19-03-2021 (ЦФИ) |
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействия, дозировка и обзоры уменьшение острых побочных эффектов. Cancer Chemother.Pharmacol 2001; 47 Suppl: S29-S34. Просмотреть аннотацию.
Ито К., Ямагути К., Шибутани Ю., Судзуки К., Ямадзаки Ю., Комачи Х., Охниши Х. и Фуджимура Х. [Противовоспалительное действие протеаз. бромелайн, трипсин и их смешанные препараты.Ниппон Якуригаку Засси 4-20-1979; 75 (3): 227-237. Просмотреть аннотацию.
Кляйн, Г., Куллич, В., Шниткер, Дж. И Шванн, Х. Эффективность и переносимость пероральной комбинации ферментов при болезненном остеоартрите бедра. Двойное слепое рандомизированное исследование, сравнивающее пероральные ферменты с нестероидными противовоспалительными препаратами. Clin Exp Rheumatol. 2006; 24 (1): 25-30. Просмотреть аннотацию.
Martin, T., Uhder, K., Kurek, R., Roeddiger, S., Schneider, L., Vogt, HG, Heyd, R., and Zamboglou, N. Снижает ли профилактическое лечение протеолитическими ферментами острую токсичность адъювантного облучения таза? Результаты двойного слепого рандомизированного исследования.Radiother.Oncol. 2002; 65 (1): 17-22. Просмотреть аннотацию.
Миллер П. К., Бейли С. П., Барнс М. Э., Дерр С. Дж. И Холл Э. Э. Влияние протеаз на функцию скелетных мышц и DOMS после бега с горы. J Sports Sci 2004; 22 (4): 365-372. Просмотреть аннотацию.
Ахтар Н.М., Насир Р., Фаруки А.З., Азиз В., Назир М. Комбинация пероральных ферментов по сравнению с диклофенаком в лечении остеоартрита коленного сустава — двойное слепое проспективное рандомизированное исследование. Clin Rheumatol.2004; 23 (5): 410-5. Просмотреть аннотацию.
Baumhackl U, Kappos L, Radue EW, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование пероральных гидролитических ферментов при рецидивирующем рассеянном склерозе. Мульт Склер. 2005; 11 (2): 166-8. Просмотреть аннотацию.
Bolten WW, Glade MJ, Raum S, Ritz BW. Безопасность и эффективность комбинации ферментов в лечении боли при остеоартрите коленного сустава у взрослых: рандомизированное двойное слепое плацебо-контролируемое исследование. Артрит 2015; 2015: 251521. Просмотреть аннотацию.
Burnham TH, ed.Факты о лекарствах и сравнения, обновляется ежемесячно. Факты и сравнения, Сент-Луис, Миссури.
Cediel G, Olivares M, Gaitán D, Flores S, Brito A, Pizarro F. Влияние трипсина и муцина на биодоступность гемового железа у людей. Biol Trace Elem Res. 2012; 150 (1-3): 37-41. Просмотреть аннотацию.
Сравнение продуктов для ухода за хроническими ранами. Письмо фармацевта / Письмо лечащего врача 2008; 12 (3): 1203.
Грабс В., Керстен А., Халлер Б. и др. Рутозид и гидролитические ферменты не ослабляют воспаление, вызванное марафоном.Медико-спортивные упражнения. 2017; 49 (3): 387-395. Просмотреть аннотацию.
Гуджрал М.С., Патнаик П.М., Каул Р. и др. Эффективность гидролитических ферментов в предотвращении побочных эффектов, вызванных лучевой терапией, у пациентов с раком головы и шеи. Cancer Chemother Pharmacol. 2001; 47 Приложение: S23-8. Просмотреть аннотацию.
Хеллгрен Л., Винсент Дж. Эффект разложения и разжижения стрептокиназы-стрептодорназы и стабилизированного трипсина на некрозы тканей, корки фибриноидов, гнойный экссудат и свернувшуюся кровь из язв ног.J Int Med Res 1977; 5: 334-7. Просмотреть аннотацию.
Кемпф К., Манзо Дж., Ханифи-Могхаддам П. и др. Эффект комбинированного перорального приема протеаз и флавоноидов у субъектов с риском диабета 1 типа. Diabet Med. 2009; 26 (12): 1309-10. Просмотреть аннотацию.
Kerkhoffs GM, Struijs PA, de Wit C, Rahlfs VW, Zwipp H, van Dijk CN. Двойное слепое рандомизированное исследование в параллельных группах эффективности и безопасности лечения острого бокового растяжения связок голеностопного сустава пероральными гидролитическими ферментами. Br J Sports Med. 2004; 38 (4): 431-5.Просмотреть аннотацию.
Кляйн Г., Куллич В. Краткосрочное лечение болезненного остеоартроза коленного сустава пероральными ферментами. Clin Drug Invest 2000; 19: 15-23.
Латха Б., Рамакришнан М., Джаяраман В., Бабу М. Ферментативные изменения сыворотки, модулируемые с помощью препарата трипсин: химотрипсин во время ожоговых ран у людей. Бернс 1997; 23: 560-4. Просмотреть аннотацию.
Латха Б., Рамакришнан М., Джаяраман В., Бабу М. Эффективность препарата трипсин: химотрипсин в уменьшении окислительного повреждения во время ожоговой травмы.Бернс 1998; 24: 532-8. Просмотреть аннотацию.
Popiela T, Kulig J, Klek S, Wachol D, Bock PR, Hanisch J. Двойное слепое пилотное исследование эффективности ферментной терапии при распространенном колоректальном раке. Przegl Lek. 2000; 57 Дополнение 5: 142. Просмотреть аннотацию.
РавиКумар Т., Рамакришнан М., Джаяраман В., Бабу М. Влияние препарата трипсин-химотрипсин (Chymoral Forte D.S.) на модуляцию уровней цитокинов у ожоговых пациентов. Бернс. 2001; 27 (7): 709-16. Просмотреть аннотацию.
Шетти В., Мохан А.Проспективное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование, сравнивающее эффективность системной ферментной терапии для контроля отеков в ортогнатической хирургии с использованием ультразвукового сканирования для измерения отека лица. J Oral Maxillofac Surg. 2013; 71 (7): 1261-7. Просмотреть аннотацию.
Spraycar M, изд. Медицинский словарь Стедмана. 26-е изд. Балтимор, Мэриленд: Williams & Wilkins, 1995.
Суомалайнен О. Оценка двух ферментных препаратов — трипура и варидазы при травматических язвах. Энн Чир Гинекол 1983; 72: 62-5.Просмотреть аннотацию.
Tilwe GH, Beria S, Turakhia NH, Daftary GV, Schiess W. Эффективность и переносимость пероральной ферментной терапии по сравнению с диклофенаком при активном остеоартрозе коленного сустава: открытое рандомизированное контролируемое клиническое исследование. J Assoc Physitors Индия. 2001; 49: 617-21. Просмотреть аннотацию.
Министерство юстиции США. США подали жалобу на техасскую компанию Healthpoint Ltd. в соответствии с Законом о ложных исках. https://www.justice.gov/opa/pr/us-files-complaint-against-texas-based-healthpoint-ltd-under-false-claims-act.(Проверено 19 июня 2019 г.).
Сравнительная оценка изменения биоактивности кристаллического трипсина во время сжатия с помощью хемоинформатических и двумерных инфракрасных спектров с преобразованием Фурье …
DOI: 10.1039 / B604299F (Бумага) Аналитик, 2006 г., 131 , 1116-1121Поступила в редакцию (в CAMBS) 23 марта 2006 г. , Принято 8 августа 2006 г.
Впервые опубликовано 30 августа 2006 г.
Целью данного исследования является разработка метода оценки ферментативной активности трипсина в твердом состоянии на основе инфракрасных спектров с преобразованием Фурье (FT-IR) с использованием хемоинформатика и двумерная (2-D) корреляционная спектроскопия.Порошки кристаллического трипсина сжимают при 0–4000 кг / см -2 с помощью прибора для испытания на сжатие / растяжение. Ферментативная активность трипсина оценивается методом кинетического разложения. Спектры 10 наборов калибровочных образцов записывают 3 раза с помощью ИК-Фурье спектрометра. Максимальная интенсивность ИК-Фурье спектров и ферментативная активность трипсина снижаются с увеличением давления сжатия. Спектры FT-IR образцов трипсина подвергаются регрессии главных компонент (PCR).График полученных данных калибровки строится между фактической и прогнозируемой активностью трипсина на основе двухкомпонентной модели с γ 2 = 0,909 (n = 30). Вектор регрессии почти такой же, как вектор загрузки для PC1. С другой стороны, к спектрам FT-IR сжатого трипсина применяется метод обобщенной двумерной (2-D) корреляционной спектроскопии. Результат согласуется с результатами метода химиоинформатики. Метод хемоинформатики FT-IR позволяет проводить количественный анализ биологической активности порошка полипептидного лекарственного средства в твердом состоянии.
Введение
В процессе фармацевтического производства 1 сыпучий порошок обычно подвергается механической обработке, такой как измельчение, гранулирование и прессование, для изготовления лекарственной формы. Однако механическое напряжение и сжатие во время измельчения, процессов грануляции 2 , 3 и таблетирования 4 могут влиять на свойства сыпучего порошка. Это долгое время считалось серьезной проблемой при контроле качества фармацевтических препаратов.Полипептиды и ферментные препараты могут быть инактивированы в твердом состоянии под действием тепла или давления, 5 , поскольку белки имеют вторичные структуры, то есть витки, спирали и листы, и эти трехмерные структуры 6 денатурируются физическими и химическими воздействиями. стимуляция. Следовательно, необходимо разработать твердую лекарственную форму, подходящую для фармацевтического применения. 7 Сарвер и Крюгер 8 сообщили о методе оценки вторичной структуры белков на основе инфракрасной спектроскопии с преобразованием Фурье (FT-IR) и хемоинформатики.Вторичная структура белка, включая β-витки, спирали, β-листы и другие, может быть количественно оценена на основе FT-IR спектров области амино I, 1600–1700 см -1 стандартных белковых растворов. в регрессии главных компонент (PCR). Однако при влажном анализе для приготовления раствора образца требуется время. Следовательно, оценка вторичной структуры лекарственного белка в твердом состоянии с использованием ИК-Фурье спектров имеет преимущество с точки зрения стоимости, времени и точности.Целью этого исследования было разработать метод оценки ферментативной активности трипсина в твердом состоянии на основе спектров FT-IR и хемоинформатики. Кроме того, мы попытались прояснить взаимосвязь между молекулярным взаимодействием на основе вторичной структуры фермента и калибровочной модели хемоинформатической ИК-Фурье спектрометрии для оценки активности трипсина.
Экспериментальный
Материалы
Кристаллический трипсин (свиной панкреатогенный трипсин, лот.№ TPR1666; активность 5000 ± 500 единиц USP мг -1 ) был получен от Wako Chem. Co. Ltd. Япония. Гидрохлорид этилового эфира N-α-бензоил-L-аргинина (партия № 0702AI) был получен от Sigma-Aldrich Japan Co. Ltd. Все другие использованные химические вещества были аналитической чистоты.Аппарат для сжатия и процедура
Тестер сжатия / растяжения (Autograph, модель IS-5000, Shimadzu Co., Киото, Япония) с двумя тензодатчиками (верхний и нижний штампы) и датчик смещения использовался для измерения верхнего и нижнего давления и расстояния между штампами 25 ± 1 ° С.Пуансон 8 мм и матрица с плоскими поверхностями использовались для сжатия 20 мг образца при 0, 100, 200, 300, 500, 750, 1000, 2000, 3000 или 4000 кг / см −2 со скоростью 25 мм мин. −1 .Анализ ферментативной активности трипсина
Ферментативную активность трипсина анализировали в соответствии с рекомендациями Фармакопеи США (USP) 23. 9 Раствор образца, использованный для растворения измельченного порошка таблетки, точно взвешивали и затем разбавляли 10 мН соляной кислотой.После удаления 200 мкл раствора образца с помощью пипетки в кварцевую кювету диаметром 1 см добавляли 3,0 мл раствора субстрата, содержащего гидрохлорид этилового эфира N-бензоил-L-аргинина. Поглощение при 252 нм измеряли с интервалами 30 с в течение 5 мин. Концентрация единиц трипсина рассчитывалась по наклону профилей поглощения в соответствии с уравнением (1). 9 Остаточную активность трипсина рассчитывали на основе гранул, имеющих 100% активность.| (1) |
| (2) |
Все указанные значения воспроизводимы и представляют собой среднее значение трех прогонов.
Измерение FT-IR
Образец порошка получали диспергированием 5 мас.% Порошка образца в порошке KBr.ИК-Фурье-спектры получали методом диффузного отражения порошка на ИК-Фурье спектрофотометре (Type Spectra One, Perkin Elmer Co., Йокогама, Япония) при следующих условиях: количество сканирований на образец — 64; разрешение, 8 см −1 и дальность; 450–4000 см −1 . ИК-Фурье спектры корректировали с использованием уравнения Кубелки-Мунка.Программное обеспечение для хемоинформатики и 2-D анализа
Спектры 10 наборов калибровочных образцов регистрировали 3 раза с помощью ИК-Фурье спектрометра.Всего 30 наборов спектральных данных были преобразованы, чтобы устранить влияние размера частиц 10 с функцией нормализации площади, и хемоинформатический анализ был выполнен с использованием программы ПЦР, содержащейся в Pirouette ver. 2.6 (GL Sciences. Co.) Сгенерированные двумерные корреляционные спектры просматривали с помощью 2-D-Pocha для Windows 95 (г-н Д. Адачи, Kuwansei Gakuin University).Результаты и обсуждение
Влияние компрессионного стресса на ферментативную активность трипсина
Инжир.1 показано влияние компрессионного стресса на ферментативную активность трипсина. Активность снижалась по мере увеличения давления сжатия, то есть примерно на 6,5% при 100 кг см −2 , примерно на 11,5% при 1000 кг см −2 и примерно на 16% при 4000 кг см — 2 . В предыдущем исследовании потеря активности под высоким давлением зависела от pH и температуры, и трипсин в растворе полностью дезактивировался при 3000–5000 кг см –2 .Однако результат, полученный с порошком, значительно отличался от результата в растворе, поскольку инактивация была более чувствительной в более низком диапазоне сжатия. 5 Активность порошкообразной формы не снижалась в такой степени, как в растворе, даже при высоком давлении, более 5000 кг · см −2 . Результат, сообщенный Kasai et al. 11 согласуется с настоящим открытием инактивации трипсина при сжатии.| Рис.1 Влияние давления сжатия на остаточную ферментативную активность трипсина. Каждая полоса представляет собой среднее значение ± стандартное отклонение (n = 5). | ||
Влияние давления сжатия на ИК-Фурье спектры трипсина
На рис. 2 показано влияние давления сжатия на ИК-Фурье спектры трипсина. Спектры обрабатывались нормализацией по площади для коррекции спектральных флуктуаций из-за размера частиц. Основные полосы трипсина распределены следующим образом: полосы на 1634, 1650, 1653 и 1660 см -1 связаны с ν CO из-за β-листа, другого, спирали и β-поворота. , соответственно. 8 Пиковая интенсивность при 1634 и 1653 см −1 , обусловленная β-слоем и α-спиралью, уменьшалась с увеличением давления сжатия, но интенсивности при 1600 и 1710–1750 см −1 повысился.| Рис. 2 Влияние давления сжатия на ИК-Фурье спектры трипсина. | ||
Otsuka et al. 12 исследовали механизм аморфизации цефалексина (трипептида) во время измельчения и сжатия с использованием инфракрасной спектроскопии и порошковой рентгеновской дифрактометрии.Была предложена следующая модель. Поскольку карбоксильная группа связывается с аминогруппой через кристаллизационную воду, между карбоксильной или аминогруппой и кристаллической водой образуются межмолекулярные водородные связи. После того, как водородные связи были разрушены механохимической энергией во время измельчения, количество аморфного цефалексина увеличивалось вместе с количеством свободных аминогрупп. Таким образом, весьма вероятно, что полосы при 1540 и 1746 см -1 в спектре цефалексина, которые были обусловлены водородными связями карбоксилата ν CO и карбонила ν CO β- лактамное кольцо усиливается при ослаблении полосы при 2100 см -1 , которая была отнесена к аминогруппам.Изменения молекулярного взаимодействия кристаллического цефалексина вызвали твердую химическую нестабильность во время хранения.
Спектральные изменения кристаллического трипсина, вызванные сжатием, могут быть приписаны изменениям в сети меж- и внутримолекулярных водородных связей кристаллического трипсина. Активность трипсина наверняка не снизится, если спектральное изменение вызвано сеткой межмолекулярных водородных связей, как и в случае цефалексина, поскольку активность тестируется после растворения.Однако спектральные изменения трипсина сопровождались изменениями ферментативной активности. Таким образом, результат показал, что вторичные структурные изменения кристаллического трипсина были вызваны разрушением трехмерных взаимодействий в белке во время сжатия, а затем были затронуты ферментативная активность и спектр.
Хемоинформатическая оценка активности трипсина
Поскольку эти спектральные изменения FT-IR отражают преобразование вторичной структуры трипсина, хемоинформатика может использоваться для оценки степени конформационного изменения на основе спектрального изменения, обусловленного вторичной структурой трипсина, что объясняется выше.ПЦР представлен как регрессия Y на выбранных главных компонентах X. Свойства ПЦР приведены вместе с обсуждением выбора собственных векторов. Поскольку ПЦР полезна для понимания взаимосвязи между целевыми параметрами и главным компонентом в спектрах, она была применена к настоящему набору данных FT-IR. Спектр, включающий n спектральных данных, можно рассматривать как точку в n-мерном пространстве. В многомерном анализе основным инструментом является ПЦР матрицы спектральных данных.PCR разлагает X в матрицу оценок, умноженную на матрицу загрузки P и остаточную матрицу E (уравнение (3)) 13
| X = t 1 p ′ 1 + t 2 p ′ 2 + ⋯ + E = TP ′ + E | (3) |
Это разложение особенно полезно для преобразования X в небольшое количество информационных графиков (графики оценок и загрузка графики) и для моделирования систематической структуры X.
Методы предварительной обработки, основанные на преобразовании оптической плотности и нормализованной оптической плотности, были выполнены для ИК-Фурье спектров, чтобы минимизировать экспериментальную ошибку. Были определены лучшие условия для минимизации стандартной ошибки перекрестной проверки (SEV) методом исключения по одному. Наборы данных спектров FT-IR для известной активности образцов трипсина при различных давлениях сжатия подвергали хемоинформатическому анализу с помощью ПЦР.
В таблице 1 показаны профили SEV, рассчитанные на основе спектральных данных, скорректированных с помощью предварительного преобразования.Минимальное значение SEV, основанное на исходных спектрах, указывает на калибровку, основанную на модели с двумя основными компонентами.
Таблица 1 Влияние количества ПК на дисперсию и стандартную ошибку валидации для оценки активности трипсина методом хемоинформатики FT-IR
| Разница (%) | SEV | |
|---|---|---|
| Фактор 1 | 97.90 | 2,19 |
| Фактор 2 | 0,99 | 1,93 |
| Фактор 3 | 0,70 | 2,01 |
| Фактор4 | 0,20 | 1,98 |
| Фактор 5 | 0.09 | 2,04 |
На рис. 3 показан график данных калибровки, полученных методом FT-IR, между фактической и прогнозируемой активностью трипсина на основе двухкомпонентной модели. График показывает прямую линию (Y = 0,825X + 15,82), предсказанные значения воспроизводимы, а стандартные отклонения предсказанных значений намного меньше, чем у фактических значений. Коэффициент корреляции был рассчитан равным 0.909 (n = 30). Этот результат показал, что ферментативную активность трипсина можно оценить на основе калибровочной модели с помощью ИК-Фурье спектроскопии.
| Рис. 3 Взаимосвязь между фактической и прогнозируемой остаточной ферментативной активностью трипсина с помощью метода хемоинформатики FT-IR. Каждая полоса представляет собой среднее значение ± стандартное отклонение (n = 3). Сплошная линия, пунктирная линия и длинная пунктирная линия представляют линию регрессии, 95% доверительный интервал и 95% прогнозируемый интервал соответственно. | ||
Научное обоснование калибровочной модели ферментативной активности трипсина с использованием хемоинформатики FT-IR
Калибровочная модель активности трипсина предполагает, что векторы нагрузки отражают спектральные вариации в области 1600 и 1700 см -1 из-за группы CO, вызванные вторичными структурными изменениями.На рис. 4 показаны векторы нагрузки, соответствующие 1-му главному компоненту (PC1) и второму главному компоненту (PC2).Дисперсия PC1 и PC2 составила 97,9 и 0,99% соответственно. На векторе нагрузки PC1 самый высокий пик был на 1634 см -1 , плечо было на 1653 см -1 , а самое низкое значение было на 1700 см -1 . Пики при 1625 и 1680 см -1 были положительными и отрицательными на векторе загрузки PC2. Согласно отчету Сарвера и Крюгера, 8 полосы на 1634, 1650, 1653 и 1660 см −1 связаны с ν CO из-за β-листа, другой спирали. , и β-поворот соответственно.Таким образом, результат показал, что β-лист, α-спираль и β-виток трансформировались в случайные витки под давлением сжатия. Результат загрузки PC2 не предполагал четкого механизма, но оценка была небольшой, так как дисперсия составляла всего 1,0%. Обратите внимание, что максимальный и минимальный пики вектора загрузки PC1 хорошо согласуются с пиками снижения и увеличения активности трипсина на рис. 2. Поскольку дисперсия PC1 и PC2 составляла 97,9 и 1,0% соответственно, биоактивность трипсина было более тесно связано с загрузкой PC1.
| Рис. 4 Загрузочный вектор калибровочной модели для остаточной ферментативной активности трипсина с использованием метода хемоинформатики FT-IR. | ||
На фиг.5 показан график зависимости между оценками PC1 и PC2 и ферментативной активностью трипсина, определенной биологическим кинетическим методом. График для PC1 дает прямую линию (Y = 1,842X + 167.05) с коэффициентом множественной корреляции (γ 2 ), 0,8076 (n = 30). Однако сюжет для ПК2 не имел существенной связи. Этот результат показал, что показатель PC1 имел более тесную связь с ферментативной активностью трипсина, чем показатель PC2.
| Рис. 5 Связь между фактической ферментативной активностью трипсина и баллами PC1 и PC2. Каждая полоса представляет собой среднее значение ± стандартное отклонение (n = 3).Открытые и закрытые символы представляют собой оценки для ПК1 и ПК2 соответственно. | ||
Поскольку калибровочная модель состояла из векторов оценки и загрузки каждого компонента в соответствии с уравнением (4), оценки всех основных компонентов и целевой функции должны иметь некоторую взаимосвязь.
В общем, целевая функция ŷ u может быть вычислена из исходных спектральных данных и вектора регрессии β. 14 Таким образом, вектор регрессии указывает факторы, важные для дезактивации фермента в спектрах FT-IR сжатого трипсина.
, где β — вектор регрессии, а x u и y u — вектор данных тестовой выборки и его предсказанное свойство, соответственно.На рис. 6 показаны векторы регрессии калибровочных моделей ферментативной активности трипсина. Векторы регрессии могут рассматриваться как комбинации физической информации о базовых сдвигах, связанных с геометрическими изменениями частиц образца, вызванными сжатием, и химической информацией, относящейся к вторичной структуре белка, как упомянуто выше.Однако исходные спектры были предварительно обработаны с использованием нормализации по площади, чтобы исправить колебания физической информации из-за размера частиц, а образцы содержат ошибки. Следовательно, химическая информация, связанная с отдельными функциональными группами, связанными с вторичной структурой белка, более четко проявляется в векторах регрессии следующим образом: наивысший пик был на 1635 см -1 , плечо было на 1655 см −1 , а надир находился на высоте 1700 см −1 , а профиль был почти таким же, как и для вектора нагрузки для ПК1.Следовательно, график вектора регрессии против вектора нагрузки для PC1 показывает прямую линию (Y = -2,8253 × 10 -3 X — 3,460 × 10 −4 ) с γ 2 = 0,9999. Однако график по сравнению с графиком PC2 представлял собой рассеянную линию с низким значением γ 2 = 1,36 × 10 −6 . Этот результат также свидетельствует о том, что вектор регрессии был почти таким же, как вектор загрузки для PC1.
| Рис. 6 Вектор регрессии калибровочной модели для остаточной ферментативной активности трипсина с использованием метода хемоинформатики FT-IR. | ||
Дезактивация трипсина с помощью обобщенного двухмерного корреляционного спектроскопического анализа
Обобщенная двумерная (2-D) корреляционная спектроскопия, предложенная Noda, 15,16 была применена к сложным вариациям спектральной интенсивности ИК, 17 Рамана, 18 и других оптических сигналов, имеющих различные формы волны.Преимущества двухмерного анализа заключаются в том, что он позволяет: (i) исследовать, какие спектральные характеристики находятся в фазе друг с другом, а какие — в противофазе; (ii) идентификация различных меж- и внутримолекулярных взаимодействий посредством селективной корреляции полос; и (iii) назначения полос на основе корреляций между различными положениями полос, в которых участвует информация о форме полосы.Учитывая изменение интенсивности ИК-спектров A (ν, T), наблюдаемое в диапазоне давлений сжатия T мин и T мин , синхронная и асинхронная двумерная корреляционная интенсивность ИК-излучения, ϕ (ν 1 , ν 2 ), становится
| (5) |
В данном случае фактическая последовательность сбора данных больше не важна, но спектральные данные должны быть расположены в порядке увеличения или уменьшения давления сжатия. Хотя спектры собирались как функции давления сжатия, была сохранена терминология двумерной корреляции, первоначально разработанная для анализа временных рядов данных динамических спектров, таких как синхронные и асинхронные спектры. Синхронный двумерный корреляционный спектр представляет связанные или связанные изменения спектральной интенсивности, тогда как асинхронный корреляционный спектр представляет независимые или отдельные вариации.В асинхронном спектре заштрихованный отрицательный перекрестный пик указывает на то, что изменения интенсивности, наблюдаемые в двух спектральных координатах, представленных положением перекрестного пика, движутся в противоположном направлении; т.е. одна интенсивность увеличивается, а другая уменьшается. С другой стороны, положительный кросс-пик без затенения указывает на то, что изменения происходят в том же направлении. В асинхронном спектре отрицательный пик затеняется, если соответствующая синхронная интенсивность положительна в той же координате.
На рис. 7 показаны контурные карты, представляющие двумерный FT-IR синхронный (а) и асинхронный (b) спектры сжатого трипсина. В синхронном спектре на рис. 7 (a) основные автопики, соответствующие ν CO из-за β-листа, другого, спирали и β-витка 8 , наблюдались примерно в 1634, 1650, 1653 , и 1660 см −1 соответственно. Ряд перекрестных пиков, связанных с автопиками, наблюдался на всех синхронных двухмерных картах корреляции.Доминирующие кросс-пики на более чем 1625 и менее чем 1675 см -1 были положительными, что указывает на то, что все изменения спектральной интенсивности, вызванные давлением сжатия, движутся в одном и том же направлении. Однако кросс-пики при 1625–1675 см −1 были отрицательными, что указывает на то, что все изменения происходят в противоположном направлении. Эти результаты согласуются с наблюдениями уменьшения интенсивности ИК-спектральных пиков, вызванных компрессионным прижимом (рис.2) и вектор регрессии (рис. 6).
| Рис. 7 Контурные карты, представляющие 2-D FT-IR синхронный (a) и асинхронный (b) спектры сжатого трипсина. | ||
Тонкое изменение вторичной структуры трипсина в процессе сжатия представлено в асинхронном спектре на рис. 7 (b). Доминирующие кросс-пики при 1610/1700 см −1 , 1625/1630 см −1 , 1650/1685 см −1 и 1685/1710 см −1 были все положительные, но кросс-пики при 1605/1630 см −1 , 1610/1720 см −1 , 1645/1685 см −1 и 1680/1710 см −1 все были отрицательными, что указывает на вызванные давлением сжатия изменения в молекулярном взаимодействии трипсина, основанные на вторичных структурных изменениях после сжатия.
Выводы
Ферментативная активность трипсина может быть оценена на основе четких научных данных из-за вторичной структуры белка в калибровочной модели с помощью хемоинформатического анализа. Результаты по ферментативной активности показали, что хемоинформатическая ИК-Фурье спектроскопия может использоваться для оценки биоактивности почти с той же точностью, что и традиционный метод химической кинетики. Вектор регрессии для калибровочной модели, используемой для оценки активности трипсина с помощью метода химиоинформатики, соответствовал синхронному двухмерному корреляционному спектру.Ссылки
- Инициатива по технологическим аналитическим технологиям (PAT), Домашняя страница Центра оценки и исследований лекарственных средств Управления по контролю за продуктами и лекарствами США (http://www.fda.gov/cder/OPS/PAT.htm).
- M. Otsuka и N. Kaneniwa, Влияние измельчения на степень кристалличности порошка цефалексина, Chem. Pharm. Бюлл., 1983, 31 (12), 4489–4495 CAS.
- М. Оцука, Х. Хасегава и Ю. Мацуда, Влияние полиморфной трансформации в процессе экструзии-грануляции на фармацевтические свойства гранул карбамазепина, Chem.Pharm. Бюлл., 1997, 45 (5), 894–898 CAS.
- Н. Каненива, К. Имагава и М. Оцука, Влияние таблетирования на степень кристалличности и точки дегидратации и разложения кристаллического порошка цефалексина, Chem. Pharm. Бюлл., 1985, 33 (2), 802–809 CAS.
- M. Morii, A. Sano, N. Takeguci и I. Horokoshi, Исследования по инактивации щелочной протеазы путем таблетирования, Yakugaku Zasshi, 1973, 93, 300–303 CAS.
- R. Kishore, Бета-Ala-содержащие пептиды: возможности в разработке и конструировании биоактивных пептидов и имитаторов вторичной структуры белка, Curr.Protein Pept. Наук, 2004, 5 (6), 435–55 Поиск в PubMed.
- I. Horikoshi, N. Takeguchi и M. Morii, Оценка распределения стресса в таблетках выпуклого типа с использованием удельной активности ферментов в качестве параметра, Chem. Pharm. Бюл., 1973, 21, 2136–2140 CAS.
- Б. В. Сарвер и В. К. Крюгер, Вторичная структура белка по данным инфракрасной спектроскопии с преобразованием Фурье: анализ базы данных, Anal. Биохимия, 1991, 194, 89–100 КАС.
- Фармакопея США, Кристаллизованный трипсин, 1995, 23, стр.1611–1612.
- Х. В. Сислер, Ю. Одзаки, С. Кавано и Х. М. Хейсе, Спектроскопия в ближнем инфракрасном диапазоне: принципы, инструменты, приложения, Wiley-VCH, Weinheim, 2001 Search PubMed.
- K. Kasai и T. Uchida, Yakuzaigaku, 1965, 25, 279–282 Search PubMed.
- Н. Каненива и М. Оцука, Взаимодействие между водой и цефалексином в кристаллическом и некристаллическом состояниях, Chem. Pharm. Бюл., 1984, 32 (11), 4551–4993 CAS.
- ЧАС.Мартенс и Т. Наес, Многомерная калибровка, John Weley & Sons, Нью-Йорк, 1989 г. Search PubMed.
- Prouette manual, Multivariate Data Analysis for Windows 95/98 and NT, Version 2.6, Infometrix, Inc., Woodinville, WA, USA, (http://www.infometrix.com).
- I. Noda, A. E. Dowrey, C. Marcott, G.M Story и Y. Ozaki, Генерированная двумерная корреляционная спектроскопия, Appl. Spectrosc., 2000, 54, 236A CAS.
- И. Нода, Определение двухмерных корреляционных спектров с использованием преобразования Хиберта, Прил.Spectrosc., 2000, 54, 994 CrossRef CAS.
- M. Muler, R. Buchet, U. P. Fringeli, J. Phys. Chem., 1996, 100, 10810 CrossRef.
- I. Noda, Y. Liu и Y. Ozaki, Исследование двумерной корреляционной спектроскопии, J. Phys. Chem., 1996, 100, 8674 CrossRef CAS.
| Этот журнал принадлежит Королевскому химическому обществу, 2006 |
VWR Life Science Трипсин, кристаллический, протеомный класс
Положения и условия
Цены:
Указанные цены действительны на момент публикации.Если произошли изменения, будут применяться цены, действующие на момент отгрузки. Цены могут быть изменены без предварительного уведомления.
Расценки:
Наши отделы продаж и обслуживания клиентов приветствуют расценки на лабораторное оборудование и заказы на несколько единиц. Ваши запросы приветствуются и приветствуются.
Условия оплаты:
Условия оплаты: 30 дней нетто по утвержденному кредиту, F.O.B. склад или место производства. Стоимость доставки оплачивается заранее и добавляется к счету.C.O.D. За заказы взимается плата за обработку в размере 10 долларов США плюс стоимость доставки. Принимаются карты AMEX, MasterCard и Visa.
Минимальный заказ:
В BioExpress нет минимального заказа. К товарам, не имеющимся на складе или специальным товарам, может применяться полное или минимальное количество ящиков.
ДОСТАВКА И ДОСТАВКА
Все заказы отправляются на условиях F.O.B. склад или место производства. Стоимость доставки оплачивается заранее и добавляется к счету. Заказы обычно отправляются в течение 24 часов с момента получения.Мы отправляем самые эффективные и экономичные из имеющихся средств. За отправку HAZMAT и сухого льда взимается дополнительная плата.
ПОЛИТИКА ВОЗВРАТА ТОВАРОВ
Если вы хотите вернуть товар, позвоните в службу поддержки клиентов BioExpress или свяжитесь с вашим местным представителем для получения номера RGA. Все возвраты должны включать номер RGA, включать оригинальную упаковку и отправляться с предоплатой. Предметы старше 30 дней, стерильные или специальные заказы подлежат рассмотрению. Взимается комиссия за возврат в размере 15%.
ГАРАНТИИ И ОТВЕТСТВЕННОСТЬ
BioExpress не несет ответственности и не несет ответственности за убытки, ущерб, расходы, косвенный или случайный ущерб. Это включает в себя повреждение собственности, людей или помещений в результате использования этих продуктов. BioExpress НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ, БЕЗ ОГРАНИЧЕНИЙ, ГАРАНТИИ КОММЕРЧЕСКОЙ ЦЕННОСТИ ИЛИ ПРИГОДНОСТИ ДЛЯ ОПРЕДЕЛЕННОЙ ПОКУПКИ. BioExpress прямо отказывается от всех других гарантий, явных, подразумеваемых или установленных законом, включая гарантию КОММЕРЧЕСКОЙ ЦЕННОСТИ И ПРИГОДНОСТИ ДЛЯ ИСПОЛЬЗОВАНИЯ.Ни при каких обстоятельствах BioExpress не несет ответственности за косвенный ущерб, возникший в результате использования продуктов, описанных в этом каталоге.
VWR Трипсин для биологических наук, кристаллический, протеомический класс
Положения и условия
Спасибо, что посетили наш сайт. Эти условия использования применимы к веб-сайтам США, Канады и Пуэрто-Рико (далее «Веб-сайт»), которыми управляет VWR («Компания»). Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, посетите соответствующий международный веб-сайт по адресу www.vwr.com, чтобы ознакомиться с применимыми положениями и условиями. Все пользователи веб-сайта подчиняются следующим условиям использования веб-сайта (эти «Условия использования»). Пожалуйста, внимательно прочтите эти Условия использования перед доступом или использованием любой части веб-сайта. Заходя на веб-сайт или используя его, вы соглашаетесь с тем, что вы прочитали, понимаете и соглашаетесь соблюдать настоящие Условия использования с поправками, которые время от времени вносятся, а также Политику конфиденциальности компании, которая настоящим включена в настоящие Условия. использования. Если вы не желаете соглашаться с настоящими Условиями использования, не открывайте и не используйте какие-либо части веб-сайта.
Компания может пересматривать и обновлять настоящие Условия использования в любое время без предварительного уведомления, разместив измененные условия на веб-сайте. Продолжение использования вами веб-сайта означает, что вы принимаете и соглашаетесь с пересмотренными Условиями использования. Если вы не согласны с Условиями использования (с внесенными в них время от времени поправками) или недовольны Веб-сайтом, ваше единственное и исключительное средство правовой защиты — прекратить использование Веб-сайта.
Использование сайта
Информация, содержащаяся на этом веб-сайте, предназначена только для информационных целей. Хотя считается, что информация верна на момент публикации, вам следует самостоятельно определить ее пригодность для вашего использования. Не все продукты или услуги, описанные на этом веб-сайте, доступны во всех юрисдикциях или для всех потенциальных клиентов, и ничто в настоящем документе не предназначено как предложение или ходатайство в какой-либо юрисдикции или какому-либо потенциальному покупателю, где такое предложение или продажа не соответствует требованиям.
Приобретение товаров и услуг
Настоящие Условия и положения распространяются только на использование веб-сайта. Обратите внимание, что условия, касающиеся обслуживания, продаж продуктов, рекламных акций и других связанных мероприятий, можно найти по адресу https://us.vwr.com/store/content/externalContentPage.jsp?path=/en_US/about_vwr_terms_and_conditions.jsp , и эти условия регулируют любые покупки продуктов или услуг у Компании.
Интерактивные функции
Веб-сайт может содержать службы досок объявлений, области чата, группы новостей, форумы, сообщества, личные веб-страницы, календари и / или другие средства сообщения или связи, предназначенные для того, чтобы вы могли общаться с общественностью в целом или с группой ( вместе «Функция сообщества»).Вы соглашаетесь использовать функцию сообщества только для публикации, отправки и получения сообщений и материалов, которые являются надлежащими и относятся к конкретной функции сообщества. Вы соглашаетесь использовать веб-сайт только в законных целях.
A. В частности, вы соглашаетесь не делать ничего из следующего при использовании функции сообщества:
1. Опорочить, оскорбить, преследовать, преследовать, угрожать или иным образом нарушать законные права (например, право на неприкосновенность частной жизни и гласность) других.
2. Публиковать, размещать, загружать, распространять или распространять любую неприемлемую, непристойную, дискредитирующую, нарушающую авторские права, непристойную, непристойную или незаконную тему, название, материал или информацию.
3. Загружайте файлы, содержащие программное обеспечение или другие материалы, защищенные законами об интеллектуальной собственности (или правами на неприкосновенность частной жизни), если вы не владеете или не контролируете права на них или не получили всех необходимых разрешений.
4. Загрузите файлы, содержащие вирусы, поврежденные файлы или любое другое подобное программное обеспечение или программы, которые могут повредить работу чужого компьютера.
5. Перехватить или попытаться перехватить электронную почту, не предназначенную для вас.
6. Рекламировать или предлагать продавать или покупать какие-либо товары или услуги для любых деловых целей, если такая функция сообщества специально не разрешает такие сообщения.
7. Проводите или рассылайте опросы, конкурсы, финансовые пирамиды или письма счастья.
8. Загрузите любой файл, опубликованный другим пользователем функции сообщества, который, как вы знаете или разумно должен знать, не может распространяться на законных основаниях таким образом или что у вас есть договорное обязательство сохранять конфиденциальность (несмотря на его доступность на веб-сайте).
9. Подделывать или удалять любые ссылки на автора, юридические или другие надлежащие уведомления, обозначения собственности или ярлыки происхождения или источника программного обеспечения или других материалов, содержащихся в загружаемом файле.
10. Предоставление ложной информации о принадлежности к какому-либо лицу или организации.
11. Участвовать в любых других действиях, которые ограничивают или препятствуют использованию веб-сайта кем-либо или которые, по мнению Компании, могут нанести вред Компании или пользователям веб-сайта или подвергнуть их ответственности.
12. Нарушать любые применимые законы или постановления или нарушать любой кодекс поведения или другие правила, которые могут быть применимы к какой-либо конкретной функции Сообщества.
13. Собирать или иным образом собирать информацию о других, включая адреса электронной почты, без их согласия.
B. Вы понимаете и признаете, что несете ответственность за любой контент, который вы отправляете, вы, а не Компания, несете полную ответственность за такой контент, включая его законность, надежность и уместность. Если вы публикуете сообщения от имени или от имени вашего работодателя или другого юридического лица, вы заявляете и гарантируете, что у вас есть на это право. Загружая или иным образом передавая материалы в любую часть веб-сайта, вы гарантируете, что эти материалы являются вашими собственными или находятся в общественном достоянии или иным образом свободны от проприетарных или иных ограничений, и что вы имеете право размещать их на веб-сайте.Кроме того, загружая или иным образом передавая материалы в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное право во всем мире на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
C. Компания оставляет за собой право, но не принимает на себя никакой ответственности (1) удалить любые материалы, размещенные на веб-сайте, которые Компания по своему собственному усмотрению сочтет несовместимыми с вышеуказанными обязательствами или иным образом неприемлемыми по любой причине. ; и (2) прекратить доступ любого пользователя ко всему веб-сайту или к его части. Однако Компания не может ни просмотреть все материалы до их размещения на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые она сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности перед кем-либо за выполнение или невыполнение действий, описанных в этом параграфе.
D. Несоблюдение вами положений пунктов (A) или (B) выше может привести к прекращению вашего доступа к веб-сайту и может повлечь за собой гражданскую и / или уголовную ответственность.
Особое примечание о содержании функций сообщества
Любой контент и / или мнения, загруженные, выраженные или отправленные с помощью любой функции сообщества или любого другого общедоступного раздела веб-сайта (включая области, защищенные паролем), а также все статьи и ответы на вопросы, кроме контента, явно разрешенного Компания, являются исключительно мнениями и ответственностью лица, представляющего их, и не обязательно отражают мнение Компании.Например, любое рекомендованное или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через функцию сообщества, не является признаком одобрения или рекомендации со стороны Компании. Если вы решите следовать какой-либо такой рекомендации, вы делаете это на свой страх и риск.
Ссылки на сторонние сайты
Веб-сайт может содержать ссылки на другие веб-сайты в Интернете. Компания не несет ответственности за контент, продукты, услуги или методы любых сторонних веб-сайтов, включая, помимо прочего, сайты, связанные с Веб-сайтом или с него, сайты, созданные на Веб-сайте, или стороннюю рекламу, и не делает заявлений относительно их качество, содержание или точность.Наличие ссылок с веб-сайта на любой сторонний веб-сайт не означает, что мы одобряем, поддерживаем или рекомендуем этот веб-сайт. Мы отказываемся от всех гарантий, явных или подразумеваемых, в отношении точности, законности, надежности или действительности любого контента на любых сторонних веб-сайтах. Вы используете сторонние веб-сайты на свой страх и риск и в соответствии с условиями использования таких веб-сайтов.
Права собственности на контент
Вы признаете и соглашаетесь с тем, что все содержимое веб-сайта (включая всю информацию, данные, программное обеспечение, графику, текст, изображения, логотипы и / или другие материалы) и его дизайн, выбор, сбор, расположение и сборка являются являются собственностью Компании и защищены законами США и международными законами об интеллектуальной собственности.Вы имеете право использовать содержимое веб-сайта только в личных или законных деловых целях. Вы не можете копировать, изменять, создавать производные работы, публично демонстрировать или исполнять, переиздавать, хранить, передавать, распространять, удалять, удалять, дополнять, добавлять, участвовать в передаче, лицензировать или продавать какие-либо материалы в Интернете. Сайт без предварительного письменного согласия Компании, за исключением: (а) временного хранения копий таких материалов в ОЗУ, (б) хранения файлов, которые автоматически кэшируются вашим веб-браузером в целях улучшения отображения, и (в) печати разумного количество страниц веб-сайта; в каждом случае при условии, что вы не изменяете и не удаляете какие-либо уведомления об авторских правах или других правах собственности, включенные в такие материалы.Ни название, ни какие-либо права интеллектуальной собственности на любую информацию или материалы на веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Товарные знаки
Название и логотип компании, а также все связанные названия, логотипы, названия продуктов и услуг, появляющиеся на веб-сайте, являются товарными знаками компании и / или соответствующих сторонних поставщиков. Их нельзя использовать или повторно отображать без предварительного письменного согласия Компании.
Отказ от ответственности
Компания не несет никакой ответственности за материалы, информацию и мнения, предоставленные или доступные через Веб-сайт («Контент сайта»). Вы полагаетесь на Контент сайта исключительно на свой страх и риск. Компания не несет никакой ответственности за травмы или убытки, возникшие в результате использования любого Контента Сайта.
ВЕБ-САЙТ, СОДЕРЖАНИЕ САЙТА, ПРОДУКТЫ И УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ ИЛИ ДОСТУПНЫЕ ЧЕРЕЗ САЙТ, ПРЕДОСТАВЛЯЮТСЯ НА УСЛОВИЯХ «КАК ЕСТЬ» И «ПО ДОСТУПНОСТИ», СО ВСЕМИ ОШИБКАМИ.КОМПАНИЯ И НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ ИЛИ ЗАЯВЛЕНИЙ В ОТНОШЕНИИ КАЧЕСТВА, ТОЧНОСТИ ИЛИ ДОСТУПНОСТИ ВЕБ-САЙТА. В частности, НО БЕЗ ОГРАНИЧЕНИЯ ВЫШЕИЗЛОЖЕННОГО, НИ КОМПАНИЯ И НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ГАРАНТИРУЕТ ИЛИ ЗАЯВЛЯЕТ, ЧТО ВЕБ-САЙТ, СОДЕРЖАНИЕ САЙТА ИЛИ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА САЙТЕ ИЛИ С ПОМОЩЬЮ САЙТА, БУДУТ ТОЧНЫМИ, НАДЕЖНЫМИ ИЛИ БЕСПЛАТНЫМИ ИЛИ БЕСПЛАТНЫМИ ЧТО ДЕФЕКТЫ БУДУТ ИСПРАВЛЕНЫ; ЧТО ВЕБ-САЙТ ИЛИ СЕРВЕР, ДЕЛАЮЩИЙ ЕГО ДОСТУПНЫМ, СВОБОДНЫ ОТ ВИРУСОВ ИЛИ ДРУГИХ ВРЕДНЫХ КОМПОНЕНТОВ; ИЛИ ЧТО ВЕБ-САЙТ ИНАЧЕ ОТВЕЧАЕТ ВАШИМ ПОТРЕБНОСТЯМ ИЛИ ОЖИДАНИЯМ.КОМПАНИЯ ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙ, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ ЛЮБЫЕ ГАРАНТИИ КОММЕРЧЕСКОЙ ЦЕННОСТИ, ПРИГОДНОСТИ ДЛЯ ОПРЕДЕЛЕННОЙ ЦЕЛИ И НЕ НАРУШЕНИЯ.
НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ КОМПАНИЯ ИЛИ ЕЕ ЛИЦЕНЗИАРЫ ИЛИ ПОДРЯДЧИКИ НЕ НЕСЕТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБЫЕ УБЫТКИ ЛЮБОГО РОДА, ПРИ КАКИХ-ЛИБО ЮРИДИЧЕСКИХ ТЕОРИЯХ, ВЫЗВАННЫЕ ИЛИ В СВЯЗИ С ИСПОЛЬЗОВАНИЕМ ВАМИ ИЛИ НЕВОЗМОЖНОСТЬЮ ИСПОЛЬЗОВАТЬ ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА, ЛЮБЫЕ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ВЕБ-САЙТЕ ИЛИ ЧЕРЕЗ ВЕБ-САЙТ ИЛИ ЛЮБОЙ САЙТ, ВКЛЮЧАЮЩИЙ ПРЯМЫЕ, КОСВЕННЫЕ, СЛУЧАЙНЫЕ, СПЕЦИАЛЬНЫЕ, КОСВЕННЫЕ ИЛИ КАРАТНЫЕ УБЫТКИ, ВКЛЮЧАЯ, НО НЕ ОГРАНИЧИВАЯСЯ, ЛИЧНЫЕ ТРАВМЫ, ПОТЕРЯ ПРИБЫЛИ ИЛИ УБЫТКОВ , ВИРУСЫ, УДАЛЕНИЕ ФАЙЛОВ ИЛИ ЭЛЕКТРОННЫХ СООБЩЕНИЙ, ИЛИ ОШИБКИ, УПУЩЕНИЯ ИЛИ ДРУГИЕ НЕТОЧНОСТИ НА ВЕБ-САЙТЕ ИЛИ СОДЕРЖАНИИ САЙТА ИЛИ УСЛУГ, ИЛИ ИЛИ НЕ ИСПОЛЬЗУЕТСЯ КОМПАНИЯ, И ПРЕДОСТАВЛЯЛА ЛИ КОМПАНИЯ ВОЗМОЖНОСТЬ ЛЮБЫЕ ТАКИЕ УБЫТКИ, ЕСЛИ НЕ ЗАПРЕЩЕНЫ ПРИМЕНИМЫМ ЗАКОНОДАТЕЛЬСТВОМ.
Компенсация
Вы соглашаетесь возместить и обезопасить Компанию и ее должностных лиц, директоров, агентов, сотрудников и других лиц, участвующих в веб-сайте, от любых обязательств, расходов, убытков и издержек, включая разумные гонорары адвокатам, возникающих в результате любое нарушение вами настоящих Условий использования, использование вами Веб-сайта или любых продуктов, услуг или информации, полученных с Веб-сайта или через него, ваше подключение к Веб-сайту, любой контент, который вы отправляете на Веб-сайт через любые Функция сообщества или нарушение вами каких-либо прав другого лица.
Применимое право; Международное использование
Настоящие условия регулируются и толкуются в соответствии с законами штата Пенсильвания без учета каких-либо принципов коллизионного права. Вы соглашаетесь с тем, что любые судебные иски, вытекающие из настоящих Условий использования или связанные с ними, будут подаваться исключительно в суды штата или федеральные суды, расположенные в Пенсильвании, и вы настоящим соглашаетесь и подчиняетесь личной юрисдикции таких судов в цели судебного разбирательства по любому подобному действию.
Настоящие Условия использования применимы к пользователям в США, Канаде и Пуэрто-Рико. Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, пожалуйста, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями. Если вы решите получить доступ к этому веб-сайту из-за пределов указанных юрисдикций, а не использовать доступные международные сайты, вы соглашаетесь с настоящими Условиями использования и тем, что такие условия будут регулироваться и толковаться в соответствии с законами США и штата. Пенсильвании и что мы не делаем никаких заявлений о том, что материалы или услуги на этом веб-сайте подходят или доступны для использования в этих других юрисдикциях.В любом случае все пользователи несут ответственность за соблюдение местных законов.
Общие условия
Настоящие Условия использования, в которые время от времени могут вноситься поправки, представляют собой полное соглашение и понимание между вами и нами, регулирующее использование вами Веб-сайта. Наша неспособность реализовать или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы, тем не менее, соглашаетесь с тем, что суд должен попытаться реализовать намерения сторон, отраженные в этом положении и других положениях Условия использования остаются в силе.Ни ваши деловые отношения или поведение между вами и Компанией, ни какая-либо торговая практика не может считаться изменением настоящих Условий использования. Вы соглашаетесь с тем, что независимо от какого-либо закона или закона об обратном, любые претензии или основания для иска, вытекающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такой претензии или причины. иска возникла или будет навсегда запрещена. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией.Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением любого применимого законодательства или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы, касающиеся настоящих Условий использования, следует направлять по адресу [email protected].
Жалобы на нарушение авторских прав
Мы уважаем интеллектуальную собственность других и просим наших пользователей поступать так же.Если вы считаете, что ваша работа была скопирована и доступна на Сайте способом, который представляет собой нарушение авторских прав, вы можете уведомить нас, предоставив нашему агенту по авторским правам следующую информацию:
электронная или физическая подпись лица, уполномоченного действовать от имени правообладателя;
описание работы, защищенной авторским правом, в отношении которой были нарушены ваши претензии;
идентификация URL-адреса или другого конкретного места на Сайте, где находится материал, который, по вашему мнению, нарушает авторские права;
ваш адрес, номер телефона и адрес электронной почты;
заявление, что у вас есть добросовестное предположение, что спорное использование не разрешено владельцем авторского права, его агентом или законом; и
ваше заявление, сделанное под страхом наказания за лжесвидетельство, о том, что приведенная выше информация в вашем уведомлении является точной и что вы являетесь владельцем авторских прав или уполномочены действовать от имени владельца авторских прав.
С нашим агентом для уведомления о жалобах на нарушение авторских прав на Сайте можно связаться по адресу: [email protected].
Монографии Фармакопеи США: Кристаллизованный трипсин
Упаковка и хранение— Хранить в плотно закрытых контейнерах и избегать чрезмерного нагрева.
Тест на растворимость— Количество, эквивалентное 500 000 единиц трипсина USP, растворимо в 10 мл воды и в 10 мл физиологического раствора ИР.
Предел химотрипсина—0.067 М фосфатный буфер , pH 7,0. Растворите 4,54 г одноосновного фосфата калия в воде, чтобы получить 500 мл раствора. Растворите 4,73 г безводного двухосновного фосфата натрия в воде, чтобы получить 500 мл раствора. Смешайте 38,9 мл раствора одноосновного фосфата калия с 61,1 мл раствора двухосновного фосфата натрия. При необходимости отрегулируйте по каплям раствором двухосновного фосфата натрия до pH 7,0.
Раствор субстрата— Растворите 23,7 мг этилового эфира N-ацетил-L-тирозина, пригодного для использования при определении химотрипсина, примерно в 50 мл 0.067 М фосфатный буфер, pH 7,0 при нагревании. Когда остынет, разбавьте дополнительным буфером с pH 7,0 до 100 мл. (Раствор субстрата можно хранить в замороженном состоянии и использовать после размораживания; однако важно заморозить сразу после приготовления.)
Раствор кристаллизованного трипсина— Растворите достаточное количество кристаллизованного трипсина, точно взвешенного, в 0,0010 н. Соляной кислоте, чтобы получить раствор, содержащий 650 единиц трипсина USP на мл.
Порядок действий— Проведите испытание в подходящем спектрофотометре, оборудованном для поддержания температуры 25 ± 0.1 в кюветном отсеке. Определите температуру в реакционной ячейке до и после измерения оптической плотности, чтобы температура не изменилась более чем на 0,5. Внесите пипеткой 200 мкл 0,0010 н. Соляной кислоты и 3,0 мл раствора субстрата в 1-сантиметровую ячейку. Поместите эту ячейку в спектрофотометр и отрегулируйте прибор так, чтобы оптическая плотность составляла 0,200 при 237 нм. Перенесите пипеткой 200 мкл раствора кристаллизованного трипсина в другую кювету размером 1 см, добавьте 3,0 мл раствора субстрата и поместите кювету в спектрофотометр.[ПРИМЕЧАНИЕ. Необходимо соблюдать этот порядок добавления.] Во время добавления раствора субстрата запустите секундомер и измерьте оптическую плотность с 30-секундными интервалами не менее 5 минут. Повторите процедуру с тем же разведением хотя бы один раз. Значения абсолютной абсорбции менее важны, чем постоянство скорости изменения абсорбции. Если скорость изменения не остается постоянной в течение как минимум 3 минут, повторите цикл и, при необходимости, используйте более низкую концентрацию. Повторный цикл с тем же разведением должен соответствовать скорости изменения абсорбции в первом цикле.Определите среднее изменение поглощения в минуту, используя только значения в пределах 3-минутного участка кривой, где скорость поглощения постоянна. Постройте график зависимости поглощения от времени. Одна единица химотрипсина USP — это активность, вызывающая изменение поглощения на 0,0075 в минуту в условиях, указанных в этом тесте. Рассчитайте количество единиц химотрипсина USP на мг кристаллизованного трипсина, взятого по формуле: (A2 A1) / (0,0075 ТВт), где A2 — это начальное значение абсорбции, прямолинейное, A1 — окончательное значение абсорбции, прямолинейное, T — время, прошедшее в минутах, между начальным и окончательным показаниями, а W — масса кристаллизованного трипсина в мг. в объеме раствора, используемого при определении оптической плотности.Обнаружено не более 50 единиц химотрипсина USP на 2500 единиц трипсина USP, что указывает на присутствие не более чем приблизительно 5% химотрипсина. Анализ —0,067 М фосфатный буфер , pH 7,6. Растворите 4,54 г одноосновного фосфата калия в воде, чтобы получить 500 мл раствора. Растворите 4,73 г безводного двухосновного фосфата натрия в воде, чтобы получить 500 мл раствора. Смешайте 13 мл раствора одноосновного фосфата калия с 87 мл безводного раствора двухосновного фосфата натрия.
Раствор субстрата— Растворите 85,7 мг гидрохлорида этилового эфира N-бензоил-L-аргинина, пригодного для использования в анализе кристаллизованного трипсина (см. ПРИМЕЧАНИЕ), в воде, чтобы получить 100 мл. Разбавьте 10 мл этого раствора 0,067 М фосфатным буфером, pH 7,6–100 мл. Определяют оптическую плотность этого раствора в кювете размером 1 см при 253 нм в подходящем спектрофотометре, оборудованном термосейсмиками для поддержания температуры 25 ± 0,1, используя воду в качестве холостого опыта. Добавляя 0,067 М фосфатный буфер, pH 7.6, или раствора субстрата перед разбавлением, отрегулируйте оптическую плотность так, чтобы она составляла не менее 0,575 и не более 0,585. Используйте этот раствор субстрата в течение 2 часов.Раствор кристаллизованного трипсина— Растворите достаточное количество кристаллизованного трипсина, точно взвешенного, в 0,0010 н. Соляной кислоте, чтобы получить раствор, содержащий от 50 до 60 единиц трипсина USP на мл.
Порядок действий— Внесите пипеткой 200 мкл 0,0010 N соляной кислоты и 3.0 мл раствора субстрата в ячейку размером 1 см. Поместите эту кювету в спектрофотометр и отрегулируйте прибор так, чтобы оптическая плотность составляла 0,050 при 253 нм. Внесите пипеткой 200 мкл раствора кристаллизованного трипсина, содержащего от 10 до 12 единиц трипсина USP, в другую 1-см ячейку, добавьте 3,0 мл раствора субстрата и поместите ячейку в спектрофотометр. При добавлении раствора субстрата включите секундомер и измеряйте оптическую плотность с 30-секундными интервалами в течение 5 минут. Повторите процедуру с тем же разведением хотя бы один раз.Постройте график зависимости поглощения от времени и используйте только те значения, которые образуют прямую линию, для определения активности кристаллизованного трипсина. Если скорость изменения не остается постоянной в течение как минимум 3 минут, повторите цикл и, при необходимости, используйте более низкую концентрацию. Одна единица трипсина USP — это активность, вызывающая изменение абсорбции на 0,003 в минуту в условиях, указанных в данном анализе. Рассчитайте количество единиц трипсина USP на мг по формуле: (A1 A2) / (0,003 ТВт), где A1 — это окончательное значение абсорбции, прямолинейное, A2 — это начальное значение абсорбции, прямолинейное, T — время, прошедшее в минутах, между начальным и окончательным измерениями, а W — масса кристаллизованного трипсина в мг. в объеме раствора, используемого при определении оптической плотности.Трипсин — Руководство по ферментам Worthington
IUB: 3.4.21.4
CAS: 9002-07-7
Ферментативная реакция (изображение откроется в новом окне)
Трипсин — сериновая протеаза поджелудочной железы со специфичностью к субстрату основан на положительно заряженных боковых цепях лизина и аргинина (Brown and Wold 1973). Фермент выводится из организма поджелудочной железой и принимает участие в переваривании пищевых белков и других биологических процессах.Трипсин представляет собой глобулярный белок среднего размера и вырабатывается в виде неактивного профермента, трипсиногена (Chen et al. 2009).
История:
В 1876 году трипсин был впервые назван Куном, который описал протеолитическую активность этого фермента поджелудочной железы. Он сравнил трипсин и пепсин, обнаружив, что дифференцирующим фактором является оптимальный pH. В 1931 году Northrop и Kunitz очистили трипсин путем кристаллизации вскоре после первой очистки пепсина в 1930 году.
В 1974 году была определена трехмерная структура, которая послужила прототипом для семейства сериновых эндопептидаз S1, к которому принадлежит трипсин.
В конце 1980-х и начале 1990-х сайт-направленный мутагенез с рекомбинантным трипсином определил роль определенных аминокислотных остатков (Sprang et al. 1987, McGrath et al. 1989, Corey and Craik 1992 и Corey и др., , 1992).
В конце 1990-х годов была исследована роль трипсина в наследственном панкреатите, и было определено, что мутация в Arg117His отвечает за предотвращение автолиза, вызывая панкреатит.
Сегодня трипсин продолжает использоваться при разработке протоколов культур клеток и тканей (Soleimani et al. 2009, Banumathi et al. 2009, и Ян и др. 2009), а также идентификацию белков с помощью методов секвенирования пептидов (Manz et al. 2004 и Schuchert et al. 2009). В области медицины роль трипсина в заболеваниях поджелудочной железы, включая кистозный фиброз (Tzetis et al. 2007 и Li et al. 2009) и хронический панкреатит (Chen et al. 2009), была определяющей. предмет текущих исследований, а трипсин использовался для моделирования разложения суставного хряща при остеоартрите (Wang et al. 2008 г.).
Специфичность:
Трипсин расщепляет пептиды на С-конце аминокислотных остатков лизина и аргинина. Если остаток пролина находится на карбоксильной стороне сайта расщепления, расщепления не произойдет. Если кислотный остаток находится по обе стороны от сайта расщепления, скорость гидролиза, как было показано, ниже.
Состав:
Трипсиноген можно активировать удалением концевого гексапептида с образованием одноцепочечного β-трипсина.Последующий ограниченный автолиз дает другие активные формы, содержащие две или более пептидных цепей, связанных дисульфидными связями. Преобладающими формами являются α-трипсин, имеющий две пептидные цепи, и β-, одноцепочечный. Различную активность и термическую стабильность проявляют α- и β-трипсин.
Другие структурные особенности включают петли на поверхности аминокислот 185–193, которые влияют на специфичность, несмотря на отсутствие прямого контакта с субстратом. Для стабильности требуется сайт связывания Ca2 + с высоким сродством, и когда он отсутствует, происходит автолиз.Петля автолиза (расположенная в аминокислотах 143–151) очень гибкая как для трипсина, так и для трипсиногена. Расщепление лизина дает альфа-форму, которая сохраняет некоторую каталитическую активность. Белок имеет шесть полностью законсервированных дисульфидных связей (Halfon and Craik 1998).
Молекулярные характеристики:
Поджелудочная железа крупного рогатого скота экспрессирует две формы трипсина: доминирующую катионную и второстепенную анионную формы. Эти белковые последовательности имеют 72% идентичности, в то время как их кодирующие области имеют 78% идентичности.
Каждый из этих белков далее перерабатывается в альтернативные формы. Каталитический трипсин содержит гибкую «петлю автолиза» (остатки G145-V157) (Schroeder and Shaw 1968, и Bartunik et al. 1989) и автолиз доминантной одноцепочечной формы B-трипсина по K148-S149 внутри этого петля приводит к образованию А-трипсина. Дальнейший автолиз по K193-D194 приводит к образованию Psi-трипсина (Fehlhammer and Bode 1975).
Катионные и анионные белки трипсина экспрессируются как проферменты трипсиногена с сигнальным пептидом из 15 остатков (M1-A15) и пропептидом из 8 остатков (F16-K23).Трехмерная складка всех известных трипсинов очень консервативна. Кроме того, каталитическая триада и области, фланкирующие каталитическую триаду, очень консервативны (Hartley 1970).
Номер доступа белка: P00760
Классификация CATH (версия 3.2.0):
- Класс: в основном бета
- Архитектура: бета-цилиндр
- Топология: тромбин, субъединица H
Вес : 23,3 кДа (теоретическая)
Оптимальный pH: 7.5-8,5 (Кутсопулос и др. 2007)
Изоэлектрическая точка:
- Трипсиноген: pH 9,3 (Walsh and Neurath 1964)
- Трипсин: pH 10,5 (Cunningham 1954).
Коэффициент экстинкции: Трипсиноген: 45,250 см -1 M -1 >
Остатки активного центра:
- Гистидин (H63)
- Аспарагиновая кислота (D107)
- Серин
Активаторы: Скорость превращения трипсиногена повышается при использовании лантанида вместо ионов кальция (Gomez et al. 1974).
Ингибиторы:
- Ингибиторы трипсина поджелудочной железы, сои, фасоли и яичного белка (см. Раздел, посвященный ингибиторам трипсина)
- DFP
- Апротинин
- Ag + ED
(White and White 1997)
Приложения:
- Диссоциация тканей, особенно в сочетании с другими ферментами, такими как коллагеназа и эластаза
- Сбор клеток путем «трипсинизации»
- Выделение митохондрий
9
9 Исследования белков in vitro
- Удаление монослоев клеток из пластика и стекла
- Различные процедуры гемагглютинации
- Подготовка образцов для проточного цитометрического анализа ДНК
- Триптическое картирование
- Работа по снятию отпечатков пальцев и секвенированию
- Мониторинг окружающей среды
- Мониторинг окружающей среды
- плотность клеток в т выпуск культуры
- Субкультивирование клеток
- Расщепление слитых белков
- Генерация гликопептидов из очищенных гликопротеинов
(White and White 1997)
Глобальный обзор сегмента рынка раствора кристаллического трипсина, оценка рынка, сценарий конкуренции, тенденции и прогноз 2019-2028
Отчет о рынке растворов кристаллического трипсина предлагает углубленный анализ рыночных тенденций, движущих сил, ограничений, возможностей и т. Д.Помимо качественной информации, этот отчет включает количественный анализ различных сегментов с точки зрения доли рынка, роста, анализа возможностей, рыночной стоимости и т. Д. На прогнозируемые годы. Глобальный рынок раствора кристаллического трипсина сегментирован по типу, применению и географии.
Мировой рынок раствора кристаллического трипсина оценивается в XX.X млн долларов США в 2019 году и, по прогнозам, значительно вырастет со среднегодовым темпом роста x.x% с 2020 по 2028 год.
Объем рынка раствора кристаллического трипсина:
По типу рынок делится на Тип I и Тип II.По применению рынок делится на научные исследования и промышленное производство.
На основании географического положения рынок анализируется в Северной Америке, Европе, Азиатско-Тихоокеанском регионе, Латинской Америке, Ближнем Востоке и Африке. Основные игроки, представленные в отчете, включают Biological Industries и Sigma-Aldrich (Merck).
Ключевые сегменты рынка
Тип
Заявка
- Научные исследования
- Промышленное производство
В отчет включены ключевые игроки рынка:
- Биологическая промышленность
- Sigma-Aldrich (Merck)
Причины получить этот отчет:
Этот отчет посвящен аналитическим отраслевым исследованиям (глобальные отраслевые тенденции) и анализу доли рынка кристаллического трипсина для крупных игроков, а также профилям компаний, которые в совокупности включают фундаментальные мнения относительно рынка. пейзаж; новые и быстрорастущие разделы рынка растворов кристаллического трипсина; регионы с высокими темпами роста; и рыночные драйверы, ограничения, а также рыночные шансы.
Анализ охватывает рынок раствора кристаллического трипсина и его достижения в различных отраслях промышленности и регионах. Он нацелен на оценку текущего размера рынка и потенциала роста глобального рынка растворов кристаллического трипсина по таким разделам, как приложения и представители.
Кроме того, анализ также включает всесторонний обзор ключевых игроков на рынке растворов кристаллического трипсина вместе с профилями их компаний, анализом SWOT, последними достижениями и бизнес-планами.
Цели анализа отчета:
- Для справедливого обмена подробной информацией о важнейших элементах, влияющих на рост отрасли (возможности роста, шансы, драйверы, а также отраслевые проблемы и риски).
- Чтобы узнать рынок растворов кристаллического трипсина, определив его многочисленные подсегменты.
- Для описания важных игроков и анализа их планов роста.
- Для оценки количества и стоимости субрынков раствора кристаллического трипсина в зависимости от ключевых регионов (различных жизненно важных состояний).
- Для анализа рынка растворов кристаллического трипсина с точки зрения тенденций роста, перспектив, а также их участия во всем секторе.
- Для изучения и изучения размера рынка раствора кристаллического трипсина (объем и стоимость) от компании, основных регионов / стран, продуктов и приложений, исходной информации с 2014 по 2019 год, а также прогноза до 2028 года.
- Компании-производители первичного мирового рынка раствора кристаллического трипсина для определения, уточнения и анализа объема продаж продукта, его стоимости и доли на рынке, ландшафта конкуренции на рынке, анализа SWOT и планов развития на ближайшие годы.
- Для изучения конкурентного прогресса, такого как расширения, договоренности, запуск новых продуктов и приобретения на рынке.
Для исследования рынка раствора кристаллического трипсина для оценки размера рынка были приняты во внимание следующие годы:
| Особые | Объем |
|---|---|
| Регион |
|
| Исторический год | с 2015 по 2020 год |
| Расчетный год | 2021 |
| Год прогноза | с 2022 по 2031 год |

 4 мг/1 мл: амп. 5, 10, 20, 25 или 25 шт.
4 мг/1 мл: амп. 5, 10, 20, 25 или 25 шт. 1%: фл.-капельн. 5 мл или 10 мл.
1%: фл.-капельн. 5 мл или 10 мл. 01%: тюбик-капельницы 1 мл, 1.5 мл 5 или 10 шт., фл. полимерные 5 мл, 10 мл 1 или 5 шт., фл. стеклянные 20 мл 1 или 5 шт.
01%: тюбик-капельницы 1 мл, 1.5 мл 5 или 10 шт., фл. полимерные 5 мл, 10 мл 1 или 5 шт., фл. стеклянные 20 мл 1 или 5 шт. и наружн. прим.: фл. 10 мл 4 или 10 шт.
и наружн. прим.: фл. 10 мл 4 или 10 шт. ректальные 100 мкг: 10 шт.
ректальные 100 мкг: 10 шт. 4 мг: 50 шт.
4 мг: 50 шт. 5 мг: 20, 30, 50 или 60 шт.
5 мг: 20, 30, 50 или 60 шт. , фл. 400 мл 1, 12 или 15 шт.
, фл. 400 мл 1, 12 или 15 шт. 100 мг: фл. двухъемкостн. 1 шт. (с растворителем)
100 мг: фл. двухъемкостн. 1 шт. (с растворителем) 0.02%: 1 мл амп. 5 или 10 шт.
0.02%: 1 мл амп. 5 или 10 шт.