Ингаляции с эуфиллином взрослым и детям: инструкция по применению
Эуфиллин в лечении бронхолегочных патологий применяют для облегчения дыхания. Препарат снимает спазмы, расширяет просвет бронхиальных трубок, перенаправляет легочный кровоток, стимулирует сердечную деятельность. Эуфиллин для ингаляций применяют у детей и взрослых. Использование лекарства подобным образом вызывает много сомнений и споров среди практикующих врачей. Однако больные отмечают эффективность ингаляции с эуфиллином.
Эуфиллин для проведения ингаляций
Эуфиллин – это комбинированный препарат, состоящий из теофиллина и этилендиамина. Фармакологическая промышленность выпускает лекарство в трех формах:
- Таблетки, дозировка 150 мг
- Раствор для внутривенного введения в ампулах (концентрация 2,4%)
- Раствор для внутримышечного введения (концентрация 24%)
Обратите внимание! Специальной формы выпуска эуфиллина, как раствора для ингаляций, не существует.
Противники проведения ингаляций с эуфиллином мотивируют свою позицию тем, что проведение подобных процедур бессмысленно и может спровоцировать бронхоспазм. Негативное отношение их объясняется особенностью действия препарата.
Эуфиллин, как препарат системного влияния на организм, лечебный эффект оказывает только если его применяют «централизовано», через кровь. Местного действия на слизистую при использовании ингаляторов он не оказывает. Облегчение дыхания объясняется действием на слизистую физиологического раствора.
Действие препарата
Эуфиллин обладает неизбирательным спазмолитическим действием. Это означает, что при приеме лекарства и достижения в крови больного терапевтической дозы эуфиллина в его организме происходит следующее:
- уменьшается тонус гладкой мускулатуры всех органов и систем
- расширяется просвет бронхиальных трубок
- увеличивается интенсивность сердечных сокращений
- снимается тонус с кровеносных сосудов
- улучшается периферическое кровоснабжение, кровоснабжение головного мозга
- заметно снижается давление
- увеличивается диурез за счет улучшения кровоснабжения почек
- расслабляются желчевыводящие пути
- повышается содержание кислоты в желудочном соке
- у беременных снимается тонус матки
- снижается интенсивность сократительных спазмов мускулатуры кишечника
youtube.com/embed/VgJaRr_7A9E?feature=oembed» frameborder=»0″ gesture=»media» allow=»encrypted-media» allowfullscreen=»»/>
Обратите внимание! Терапевтическая доза препарата незначительно отличается от его токсической дозы. Применение эуфиллина должно проводиться под контролем врача.
Процедуры с эуфилином, при правильном разбавлении раствора и отсутствии на него индивидуальной реакции, не приводят к передозировке средства в крови.
Показания к применению при бронхолегочных патологиях
Касательно заболеваний органов дыхания эуфиллин назначают:
- при астме для купирования и предотвращения бронхоспазма
- при обструктивном бронхите по тем же показаниям
- при аллергических реакциях организма, сопровождающимися бронхоспазмом
Эуфиллин в уколах назначают в период обострения болезни или для оказания срочной медицинской помощи в купировании приступа удушья. В поддерживающей и профилактической терапии эуфиллин принимают в таблетированной форме несколько раз в день, дозировка в зависимости от назначения терапевта.
Предупреждения и противопоказания
Эуфиллин детям и взрослым запрещено применять без консультации врача, особенно если с препаратом столкнулись впервые. Возможна индивидуальная реакция, сходная с реакцией на передозировку.
Это:
- судорожный синдром
- падение артериального давления
- тошнота, рвота, изжога
- головокружение, потеря ориентации
- сердцебиение, нарушение ритма
При лечении не стоит пить много кофе, поскольку препарат в процессе усвоения преобразуется в кофеин.
Факт! Крепкий кофе способен облегчить дыхание. Об этой его особенности хорошо знают люди с хроническими приступами удушья.
Препарат несовместим с теофиллином и эфедрином (которые часто содержаться в сиропах от кашля, в том числе и детских). При совместном применении возникает эффект передозировки.
Препарат не применяют:
- при патологиях сердца, связанных с нарушением ритма
- при гастропатологиях, язвенной болезни кишечника
- при тяжелой почечной/печеночной недостаточности
- при гипотериозе
С осторожностью если у пациента сниженное давление. Эуфиллин в любой форме запрещен к применению детям в домашних условиях без врачебного контроля.
Эуфиллин в любой форме запрещен к применению детям в домашних условиях без врачебного контроля.
Инструкция
Как правильно применять эуфиллин при ингаляции для вдыхания в ампулах? Для процедур с эуфиллином используют распыление через небулайзер – специальный аппарат, который распыляет лечебный раствор до мельчайших частиц, не нагревая его. Паровые ингаляторы для лечения в данном случае не используются. Полученный в небулайзере аэрозоль при вдыхании попадает непосредственно в трахею и бронхи, где оседает.
Как проводить ингаляцию:
- правильно вдыхать при процедуре с эуфиллином следует через рот, а выдыхать носом
- время проведения процедуры 5-8 мин
- раствор не должен быть холодным
Обратите внимание! Официальная инструкция по применению препарата не дает указаний относительно ингаляций. Производитель не предусматривает подобного применения препарата.
Дозировки для детей и взрослых
Приготовление раствора для ингаляций небулайзером у детей и взрослых не отличается, если только врач не назначит иначе. Ампулу эуфиллина разводят в 150 мл гипотонического раствора хлорида натрия (NaCl) + добавляют 3 ампулы димедрола. Раствор следует применять сразу, хранить недопустимо. Для проведения ингаляций (строго по назначению врача!) используют раствор, который предназначен для внутривенного введения, где концентрация действующего вещества 2,4%.
В небулайзер для одной процедуры наливают 3 мл полученного раствора. Как разводить лекарство для одной процедуры? Потребуется соответственно уменьшить объем составляющих, сохраняя пропорции. Так на 50 мл физраствора следует взять 1 ампулу димедрола и треть ампулы эуфиллина.
При лечении детей обязательна к соблюдению допустимая дозировка на 1 кг веса ребенка за один прием через каждые 6 часов. Здесь пропорция зависит от возраста:
- дети 1-9 лет 5 мг
- 9-12 лет 4 мг
- 12-16 лет 3 мг
В заключении стоит отметить, что эуфиллин обладает непереносимо горьким вкусом, что может затруднить его вдыхание.
ПРАВИЛА ПРОВЕДЕНИЯ ИНГАЛЯЦИЙ. Статьи компании «Медтехника для дома»
Выбрать ингалятор > > > >
1. Ингаляции следует принимать не ранее чем через 1-1,5 часа после еды, при этом не следует отвлекаться разговором. После ингаляций в течение 1 часа не рекомендуется разговаривать, принимать пищу, выходить на улицу (в прохладную погоду).
2. При заболеваниях верхних дыхательных путей (носа, околоносовых пазух и носоглотки) вдох и выдох необходимо делать через нос, используя маску. Дышать спокойно, без напряжения.
3. При заболеваниях средних дыхательных путей (горло, гортань) вдох и выдох следует делать через рот, используя маску. Дышать следует спокойно в обычном режиме
4. При заболеваниях трахеи, бронхов, легких рекомендуется вдыхать аэрозоль через рот, используя мундштук. Дышать глубоко и ровно.
5. Большинство растворов для ингаляций приготовляются на основе физиологического раствора 0,9% хлорида натрия (NaCl) в качестве растворителя и увлажнителя.
6. Хранить приготовленный раствор нужно в холодильнике не более суток. Перед употреблением обязательно подогреть до комнатной температуры
7. При одновременном назначении нескольких препаратов следует соблюдать очередность. Первым ингалируется бронхорасширяющее средство, спустя 15-20 минут – средство разжижающее и выводящее мокроту, затем, после отхождения мокроты, – антибиотик или противовоспалительное средство
8. Курс лечения зависит от сложности заболевания и применяемого препарата (от 5 до 10 дней)
9. Хотя небулайзерная терапия не относится к тепловым физиотерапевтическим процедурам, тем не менее, не рекомендуется проводить ингаляции при повышенной температуре тела
10. В небулайзерах запрещено использовать масляные препараты. Различные масла используются для лечения заболеваний только верхних дыхательных путей, для которых достаточно воздействие крупнодисперсных частиц, поэтому для ингаляций маслами используются паровые ингаляторы.
11. В большинстве небулайзеров не разрешено использование самостоятельно приготовленных отваров и настоев трав, поскольку они имеют взвесь, которая значительно крупнее частиц аэрозоли и небулайзер не может их пропустить, что в свою очередь может привести к поломке прибора. По той же причине в небулайзерах не используют суспензии и сиропы (за исключением специальных суспензий для ингаляций). Хотя существуют небулайзеры, которые способны работать с отварами трав.
12. Такие лекарственные препараты как Эуфиллин, Папаверин, Димедрол и им подобные средства, так же не могут быть использованы в небулайзерах, поскольку они не имеют «точек приложения» на слизистой оболочке.
13. НЕ ЗАБУДЬТЕ ПРОКОНСУЛЬТИРОВАТЬСЯ С ВРАЧОМ!
1.Препараты, расширяющие бронхи (Бронхолитики)
- Беродуал, действующее вещество: фенотерол и бромид ипратропиума (раствор для ингаляций) – Предупреждение и лечение удушья при хронических обструктивных заболеваниях дыхательных путей. Наиболее эффективный из бронхорасширяющих препаратов, обладает наименьшими побочными действиями.
- Взрослым и детям старше 12 лет – 2 мл (40 капель) препарата на 1 ингаляцию, до 4 раз в день
- Детям от 6 до 12 лет – 1 мл (20 капель) препарата на 1 ингаляцию, до 4 раз в день
- Детям до 6 лет – 0,5 мл (10 капель) препарата на 1 ингаляцию, до 3 раз в день
- Для приготовления ингаляционного раствора следует к рекомендуемой дозе препарата добавить 3 мл физраствора
- Беротек, действующее вещество: фенотерол (0,1%-ный раствор для ингаляций) –для купирования приступа бронхиальной астмы:
- Взрослым и детям старше 12 лет – 0,5 мл (0,5 мг – 10 капель), в тяжелых случаях – 1 мл (1 мг – 20 капель)
- Детям 6–12 лет (масса тела 22–36 кг) – 0,25-0,5 мл (0,25-0,5 мг – 5-10 капель), в тяжелых случаях – 1 мл (1 мг – 20 капель)
Профилактика и симптоматическое лечение бронхиальной астмы и хронической обструктивной болезни легких:
- Взрослым и детям старше 6 лет – 0,5 мл (0,5 мг – 10 капель) на 1 ингаляцию, до 4 раз в день
- Детям до 6 лет (масса тела менее 22 кг) – 0,25-1 мл (0,25-1 мг – 5-20 капель), до 3 раз в день
- Рекомендованную дозу непосредственно перед применением разводят физраствором до объема 3–4 мл.

- Сальгим, Вентолин Небулы, действующее вещество: сальбутамол (0,1%-ный раствор для ингаляций) – Купирование приступов удушья, профилактика и симптоматическое лечение бронхиальной астмы и хронической обструктивной болезни легких. По эффекту значительно уступает Беротеку
- Взрослым и детям – 2,5 мл (2,5 мг) на 1 ингаляцию, до 4 раз в день с интервалом между ингаляциями не менее 6 часов
- Предназначен для использования в неразведенном виде
- Атровент, действующее вещество: бромид ипратропиума (0,025%-ный раствор для ингаляций) – Купирование приступов удушья, профилактика и симптоматическое лечение бронхиальной астмы и хронической обструктивной болезни легких. По эффекту несколько уступает Беротеку и препаратам сальбутамола, но основным достоинством является безопасность применения
- Взрослым и детям старше 12 лет – 0,5 мг (40 капель) на 1 ингаляцию, 3–4 раза в день
- Детям 6–12 лет – 0,25 мг (20 капель) на 1 ингаляцию, 3–4 раза в день
- Детям до 6 лет – по 0,1–0,25 мг (8-20 капель) на 1 ингаляцию, 3–4 раза в день (под наблюдением врача).

- Рекомендованную дозу непосредственно перед применением разводят физраствором до объема 3–4 мл. Интервал между ингаляциями не менее 2 часов
2. Препараты, разжижающие мокроту (Муколитики) и выводящие мокроту (Секретолитики, отхаркивающие)
- Флуимуцил, АЦЦ Инъект, действующее вещество: ацетилцистеин (10%-ный раствор для инъекций) – Нарушение отхождения мокроты из нижних дыхательных путей, облегчение отхождения слизистого секрета в верхних дыхательных путях
- Взрослым и детям старше 12 лет – 3 мл препарата на 1 ингаляцию, 1-2 раза в день
- Детям от 6 до 12 лет – 2 мл препарата на 1 ингаляцию, 1-2 раза в день
- Детям от 2 до 6 лет – 1-2 мл препарата на 1 ингаляцию, 1-2 раза в день
- Рекомендуемую дозу препарата следует развести с физраствором в соотношении 1:1
- Курс лечения – не более 10 дней
- Препараты ацетилцистеина не следует применять одновременно с приемом антибиотиков, т.к. они снижают всасываемость антибиотиков.
 В случаях, когда требуется одновременное введение ацетилцистеина и антибиотика, используют либо другую форму препарата: «Флуимуцил-антибиотик», либо применяют иные муколитические препараты, совместимые с антибиотиками (к примеру, на основе амброксола). Следует отметить, что применение препаратов ацетилцистеина снижает токсическое действие парацетамола на печень.
В случаях, когда требуется одновременное введение ацетилцистеина и антибиотика, используют либо другую форму препарата: «Флуимуцил-антибиотик», либо применяют иные муколитические препараты, совместимые с антибиотиками (к примеру, на основе амброксола). Следует отметить, что применение препаратов ацетилцистеина снижает токсическое действие парацетамола на печень. - Лазолван, Абмробене, действующее вещество: амброксол (раствор для ингаляций и приема внутрь) – Острые и хронические заболевания дыхательных путей с выделением вязкой мокроты
- Взрослым и детям старше 6 лет – 2-3 мл раствора на 1 ингаляцию, 1-2 раза в день
- Детям от 2 до 6 лет – 2 мл раствора на 1 ингаляцию 1-2 раза в день
- Детям до 2 лет – 1 мл раствора на 1 ингаляцию, 1-2 раза в день
- Для приготовления ингаляционного раствора следует рекомендуемую дозу препарата развести с физраствором в соотношении 1:1
- Курс лечения – не более 5 дней
- Препараты на основе амбоксола не следует применять одновременно с противокашлевыми препаратами (например: кодеин, либексин, фалиминт, бронхолитин, пектуссин, синекод и др.
 ). Применение препаратов амброксола способствует хорошему всасыванию антибиотиков.
). Применение препаратов амброксола способствует хорошему всасыванию антибиотиков. - Нарзан, Боржоми (слабощелочные минеральные воды)
- На 1 ингаляцию используют 3-4 мл минеральной воды, 2-4 раза в день.
- Перед ингаляцией минеральную воду следует отстоять до дегазации.
- Синупрет, гомеопатический фитопрепарат (капли на основе экстрактов растений: корень генциана (горечавки), щавель, первоцвет, бузина, вербена) – Восстанавливает защитные свойства и уменьшает отек слизистой оболочки дыхательных путей при острых и хронических синуситах. Способствует оттоку экссудата из придаточных пазух носа
- Для приготовления ингаляционного раствора препарат необходимо предварительно развести в физрастворе:
- Для взрослых и детей старше 16 лет – в соотношении 1:1 (на 1 мл препарата 1 мл физраствора)
- Для детей от 6 до 16 лет – в соотношении 1:2 (на 1 мл препарата 2 мл физраствора)
- Для детей от 2 до 6 лет – в соотношении 1:3 (на 1 мл препарата 3 мл физраствора)
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.

- Геделикс, фитопрепарат (капли на основе экстракта плюща) – Заболевания верхних дыхательных путей и бронхов с трудноотделяемой мокротой, кашель (в т.ч. сухой)
- Для приготовления ингаляционного раствора препарат необходимо предварительно развести в физрастворе:
- Для взрослых и детей старше 10 лет – в соотношении 1:1 (на 1 мл препарата 1 мл физраствора)
- Для детей до 10 лет – в соотношении 1:2 (на 1 мл препарата 2 мл физраствора)
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.
- Микстура от кашля, фитопрепарат (порошок (детский и взрослый) для приготовления раствора на основе экстрактов растений: анис, корень солодки, корень алтея, термопсис) – Заболевания дыхательных путей, сопровождающиеся кашлем, особенно при затрудненном отхождении мокроты
- Для приготовления ингаляционного раствора следует содержимое 1 упаковки растворить в 15 мл физраствора до полного рстворения без осадка
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.

- Мукалтин, фитопрепарат (таблетки на основе экстракта корня алтея) – Отхаркивающее средство при заболеваниях дыхательных путей и легких
- Для приготовления ингаляционного раствора следует 1 таблетку растворить в 80 мл физраствора до полного растворения без осадка
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.
- Пертуссин, фитопрепарат (раствор на основе экстракта растений: чабрец, тимьян) – Отхаркивающее средство при трахеите, бронхите, коклюше
- Для приготовления ингаляционного раствора препарат необходимо предварительно развести в физрастворе:
- Для взрослых и детей старше 12 лет – в соотношении 1:1 (на 1 мл препарата 1 мл физраствора)
- Для детей до 12 лет – в соотношении 1:2 (на 1 мл препарата 2 мл физраствора)
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.
3. Противовоспалительные препараты
- Ротокан, фитопрепарат (спиртовой настой экстарактов растений: календула, ромашка, тысячелистник) – Острые воспалительные заболевания верхних и средних дыхательных путей
- Раствор для ингаляции готовят путем разведения препарата в физрастворе в отношении 1:40 (1 мл препарата на 40 мл физраствора)
- На 1 ингаляцию используют 4 мл полученного раствора, 3 раза в день.

- Прополис, фитопрепарат (настойка) – Воспалительные процессы, боль и травмы верхних и средних дыхательных путей
- Раствор для ингаляции готовят путем разведения препарата в физрастворе в отношении 1:20 (1 мл препарата на 20 мл физраствора)
- На 1 ингаляцию используют 3 мл полученного раствора, 3 раза в день.
- Противопоказания – аллергия к продуктам пчеловодства
- Эвкалипт, фитопрепарат (спиртовая настойка) – Воспалительные заболевания верхних и средних дыхательных путей
- Раствор для ингаляции готовят путем разведения 10-15 капель препарата в 200 мл физраствора
- На 1 ингаляцию используют 3 мл полученного раствора, 3-4 раза в день
- Противопоказания – бронхиальная астма, бронхоспазм (удушье)
- Малавит, биологически активная добавка (спиртовая настойка на основе минеральных веществ и экстрактов растений) – Острые воспалительные заболевания и боль верхних и средних дыхательных путей
- Раствор для ингаляции готовят путем разведения препарата в физрастворе в отношении 1:30 (1 мл препарата на 30 мл физраствора)
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.

- Тонзилгон Н, гомеопатический фитопрепарат (капли на основе экстрактов растений: корень алтея, листья грецкого ореха, хвощ, ромашка, тысячелистник, кора дуба, одуванчик) – Острые и хронические заболевания верхних отделов дыхательных путей (тонзиллит, фарингит, ларингит)
- Для приготовления ингаляционного раствора препарат необходимо предварительно развести в физрастворе:
- Для взрослых и детей старше 7 лет – в соотношении 1:1 (на 1 мл препарата 1 мл физраствора)
- Для детей от 1 до 7 лет – в соотношении 1:2 (на 1 мл препарата 2 мл физраствора)
- Для детей до 1 года – в соотношении 1:3 (на 1 мл препарата 3 мл физраствора)
- На 1 ингаляцию используют 3-4 мл полученного раствора, 3 раза в день.
- Календула, фитопрепарат (спиртовой настой экстаракта календулы) – Острые воспалительные заболевания верхних отделов дыхательных путей
- Раствор для ингаляции готовят путем разведения препарата в физрастворе в отношении 1:40 (1 мл препарата на 40 мл физраствора)
- На 1 ингаляцию используют 4 мл полученного раствора, 3 раза в день
4. Противовоспалительные гормональные препараты (Глюкокортикостероиды) и противоаллергические препараты (Антигистамины)
Противовоспалительные гормональные препараты (Глюкокортикостероиды) и противоаллергические препараты (Антигистамины)
- Пульмикорт, действующее вещество: будесонид (суспензия для ингаляций, выпускается в «детской» (0,25 мг/мл) и «взрослой» (0,5 мг/мл) дозировках) – Острые воспалительные заболевания нижних дыхательных путей (бронхиальная астма, хроническая болезнь легких), требующие лечения гормональными препаратами. Обладает противовоспалительным и противоаллергическим действием.
- Взрослые/пожилые и дети старше 12 лет – 1 мг на 1 ингаляцию, 1-3 раза в день
- Дети от 6 мес. и до 12 лет – 0,25 мг на 1 ингаляцию, 1-3 раза в день
- Данный препарат не применяют в ультразвуковых небулайзерах. Если разовая доза препарата менее 2 мл, то следует добавить физраствор для увеличения объема ингалируемого раствора до 2 мл. В остальных случаях препарат ингалируют в чистом виде (без разведения в физрастворе).
- Суточная доза препарата:
0,25 мг/мл – 1 мл по 0,25 мг/мл
0,5 мг/мл – 2 мл по 0,25 мг/мл
0,75 мг/мл – 3 мл по 0,25 мг/мл
1 мг/мл – 4 мл по 0,25 мл/мг или 2 мл по 0,5 мг/мл
1,5 мг/мл – 3 мл по 0,5 мг/мл
2 мг/мл – 4 мл по 0,5 мг/мл
- Дексаметазон, (0,4%-ный раствор для инъекций, 4 мг/мл) – Острые воспалительные заболевания дыхательных путей, требующие лечения гормональными препаратами
- На 1 ингаляцию используют 0,5 мл (2 мг) препарата, до 4 раз в день.

- Курс лечения не более 7 дней
- Для приготовления ингаляционного раствора к рекомендуемой дозе препарата следует добавить 3 мл физраствора.
- Также можно ампулы с препаратом предварительно развести в физрастворе в соотношении 1:6 (на 1 мл препарата 6 мл физраствора) и ингалировать по 3-4 мл полученного раствора на 1 ингаляцию.
- Кромогексал, действующее вещество: кромоглициевая кислота (раствор для ингаляций, 20 мг / 2 мл) – Обладает антиаллергическим, противовоспалительным, антиастматическим действием.
- Взрослым и детям старше 2 лет ингалировать по содержимому 1 флакона (без разведения с физраствором) 4 раза в день, по возможности, в равные временные интервалы.
- При необходимости рекомендованная доза может быть увеличена в 2 раза, а частота применения может быть увеличена до 6 раз.
5. Противомикробные и антибактериальные препараты (Антибиотики и Антисептики)
- Флуимуцил-антибиотик, действующее вещество: ацетилцистеин и тиамфеникол (порошок для инъекций и ингаляций в комплекте с растворителем) – Необходимость одновременного введения антибиотика и препарата разжижающего и выводящего мокроту и слизь из нижних и верхних дыхательных путей.

Выбрать ингалятор > > > >
Купить ингалятор компрессорный (небулайзер) в нашем магазине просто ― закажите его оформив заявку на сайте самостоятельно или позвоните менеджеру. Подробнее > > > >
Цены актуальны при самовывозе из офиса в Омске. Также продажа медтехники осуществляется с помощью курьерской доставки, а в другие регионы Почтой России или транспортными компаниями. Подробнее > > > >
Оставьте свой отзыв о стоимости медтехники, применении прибора и работе магазина «Медицинская техника для дома». Подробнее > > > >
НЕБУЛАЙЗЕРНАЯ ТЕРАПИЯ ПРИСТУПА БРОНХИАЛЬНОЙ АСТМЫ
26 Nov 2012
УДК: 616.248.085.053.2/.5
Н.З. Зарубекова, В.П. Воднев, А.Н. Шаметова, З.С. Еременко, М.М.Рыспанова
Каз НМУ им. С.Д. Асфендиярова.
ГККП «СНМП г. Алматы»
Проведен анализ эффективности купирования приступа удушья внутривенным введением эуфиллина и ингаляции беродуала у 173 больных бронхиальной астмой. Обоснована эффективность, безопасность, простота и доступность небулайзера в сравнении с традиционным методом лечения.
Обоснована эффективность, безопасность, простота и доступность небулайзера в сравнении с традиционным методом лечения.
Актуальность. Бронхиальная астма является одной из актуальнейших проблем современной пульмонологии. За последние десять лет отмечается тенденция к увеличению распространенности этой патологии. Соответственно отмечается рост числа больных обращающихся за неотложной помощью и занимает одно из ведущих мест в обращаемости населения крупных городов за скорой медицинской помощью взрослого населения. В Казахстане в последние годы наблюдается тенденция к увеличению распространенности легочных заболеваний.
Целью нашего исследования была оценка эффективности применения β2 – агонистов для купирования приступов удушья у больных бронхиальной астмой, вводимых с помощью небулайзера.
Небулайзер (от латинского слова nebula –туман) – устройство для распыления лекарственных препаратов и их доставки в дыхательные пути. Мы использовали компрессорные небулайзеры («Бореал» Италия), которые генерируют аэрозоль с размером частиц 0,8 – 1,0 мкм, оптимальные для проникновения в мелкие бронхи и альвеолы.
Материал и методы. Для купирования приступа удушья использовался препарат Беродуал — в состав которого входят фенотерол (β2–агонист) и ипратропиум бромид (блокатор М –холинорецепторов), что вызывает быструю дилятацию бронхов с потенцированием бронхолитического эффекта и увеличение его продолжительности.
Для проведения ингаляции через небулайзер общий объём распыляемого вещества должен составлять не более 4 мл., продолжительность ингаляции составляла 5 – 10 минут.
Диагноз обострения заболевания ставился на основании симптомов указанных Глобальной стратегии лечения и профилактики бронхиальной астмы: одышка экспираторного характера, удушье, свистящие хрипы, ощущение сдавления в грудной клетке и кашель усиливающийся в ночные и утренние часы.
Нами проанализировано применение эуфиллина и небулайзера у 173 больных бронхиальной астмой, обратившихся на скорую помощь по поводу острого приступа удушья.
Таблица 1 — Распределение больных по полу и возрасту
| Возраст | До 15 лет | 20-59 | 51 –60 | 60 и старше | всего |
| Мужчины | 2 – 1,1% | 16- 25,6% | 29 – 16,8% | 18 – 10,4% | 65 – 39% |
| Женщины | — | 24– 13,8% | 36–20,8% | 48 – 45,1% | 108 – 61% |
| Итого | 2 – 1,1% | 40 – 23,1% | 65 – 37,6% | 66 – 39,3% | 173 |
Среди больных преобладали женщины, особенно в возрасте старше 50 лет (48,5%). Длительность заболевания у большинства больных составила от 10 до15 лет. Легкое течение приступа было у 16%, средней тяжести -76% , тяжелое – 8% больных. Большинство больных средней тяжести и с тяжелым течением БА постоянно применяли гормональные препараты, ингаляционные β2 – агонисты, α — адреномиметики, муколитики и другие препараты.
Длительность заболевания у большинства больных составила от 10 до15 лет. Легкое течение приступа было у 16%, средней тяжести -76% , тяжелое – 8% больных. Большинство больных средней тяжести и с тяжелым течением БА постоянно применяли гормональные препараты, ингаляционные β2 – агонисты, α — адреномиметики, муколитики и другие препараты.
Полученные результаты. Больные были разделены на 2 группы сопоставимые по возрасту, полу, тяжести течения и длительности заболевания. Первой группе — 84 больных для купирования приступа удушья бригадами СМП применялись в/в инъекции эуфиллина, преднизолона, проводилась ингаляция кислорода, проводилась симптоматическая терапия. Приступы купировались через 15 – 45 минут после инъекции медикаментов, однако у 13 больных приступ купировать не удалось, и они были госпитализированы.
Второй группе состоящей из 89 больных применялась ингаляция беродуала через небулайзер. Продолжительность ингаляции составила 5-20 минут. Применение небулайзера позволяет купировать приступ удушья у больных с легким течением заболевания и у половины больных со средней степенью тяжести в течение 5-7 минут от начала лечения. У 81% больных со средней степенью тяжести и у 84% с тяжелым течением заболевания приступ купировался через 10-20 минут от начала лечения. Не было эффекта от применения небулайзера у 9% со средней степенью тяжести и у 16% с тяжелым течением бронхиальной астмы. Этим больным потребовалось дополнительное внутривенное введение бронхолитиков и глюкокортикостероидов. В группе больных которым применялась небулайзерная терапия, только 1 потребовалась госпитализация. Побочных эффектов от применения небулайзерной терапии не наблюдалось.
У 81% больных со средней степенью тяжести и у 84% с тяжелым течением заболевания приступ купировался через 10-20 минут от начала лечения. Не было эффекта от применения небулайзера у 9% со средней степенью тяжести и у 16% с тяжелым течением бронхиальной астмы. Этим больным потребовалось дополнительное внутривенное введение бронхолитиков и глюкокортикостероидов. В группе больных которым применялась небулайзерная терапия, только 1 потребовалась госпитализация. Побочных эффектов от применения небулайзерной терапии не наблюдалось.
Выводы: Полученные нами результаты подтверждают высокую эффективность небулайзерной терапии, на только у больных с легким и среднетяжелым течением, но при тяжелых приступах бронхиальной астмы. . Быстрая доставка препарата в легкие, меньшая его доза по сравнению с дозированными ингаляторами позволяет отказаться от внутривенных инъекций у большинства больных. Простота и удобство использования аппарата позволяют эффективно проводить лечение в любом возрасте, особенно у детей младшего возраста.
Список литературы
1 Чучалин А.Г., глав. ред. Пульмонология Национальное руководство 2009
2 А.Г. Чучалин редак. Клинические рекомендации. Пульмонология «ГЭОТАР-Медиа»2006 – с. 238.
3 Авдеев С.Н. Тяжелое обострение бронхиальной астмы. — // Скорая медицинская помощь. – 2001. – с. 59 – 67.
Н.З. Зарубекова, В.П. Воднев, А.Н. Шаметова, З.С. Еременко, М.М.Рыспанова
Бронх демікпесі ұстамасының небулайзерлік емі
Түйін: бронх демікпесі ұстамасын басу үшін бронх демікпесі бар 173 науқасқа эуфиллин ерітіндісін көктамырға енгізу және беродуалмен ингаляция жасаудың тиімділігіне талдау жасалған. Небулайзермен емдеудің дәстүрлі емдеу әдістерімен салыстырғанда тиімділігі, қауіпсізідігі, қарапайымдылығы және қолжетімділігі анықталған.
N.Z. Zarubekova, V.I. Vodnev, A. N. Shametova, Z.S. Eremenko, M.M. Ryspanova
N. Shametova, Z.S. Eremenko, M.M. Ryspanova
Nebulizer therapy of attact bronchial asthma
Resume: it has conducted analysis of effectiveness of cutting of attact asthma intravenous injection Eufillin and inhalation Beredual of 173 patients with bronchial asthma. It was grounded an effectiveness, safety, simplycity, accessibility of Nebulizer in comparison with traditional methods of treatment.
Ингаляции лекарственных средств при ЛОР-заболеваниях
АНТИБИОТИКИ И АНТИСЕПТИКИ
В Республике Беларусь отсутствуют лекарственные формы антибиотиков и антисептиков для небулайзерной терапии, однако в ЛОР-практике используются различные формы растворимых инъекционных препаратов.
ДИОКСИДИН (0,5-1% раствор, ампулы по 5 и 10 мл)
Показания: инфекции, вызванные протеем, синегнойной палочкой, клебсиеллой, стафилококками, стрептококками, сальмонеллами, дизентерийной палочкой, патогенными анаэробами.
Противопоказания: гиперчувствительность к препарату, надпочечниковая недостаточность, беременность, кормление грудью.
Побочные эффекты: головная боль, озноб, гиперемия, диспепсия, судорожные сокращения мышц, аллергия.
Способ применения: по 3-4 мл 0,5-1% на 1 ингаляцию 2 раза в сутки.
ГЕНТАМИЦИНА СУЛЬФАТ (4% раствор, ампулы по 2 мл)
Показания: грамположительные и отрицательные инфекции, в т.ч. синегнойная палочка, протей, кишечная палочка и др.
Противопоказания: сенсоневральная тугоухость, гиперчувствительность к препарату, тяжелая почечная недостаточность, беременность, дети до 8 лет.
Побочные эффекты: нарушение слуха и равновесия, поражение почек, головная боль, тошнота, рвота, судороги, мышечная слабость, нарушения клеточного состава крови, гипербилирубинемия, аллергические реакции.
Взаимодействие: несовместим с ото-, нефротоксическими препаратами; усиливает эффект пенициллинов и цефалоспоринов, петлевые диуретики увеличивают ототоксичность, миорелаксанты повышают вероятность паралича дыхания.
Способ применения: по 2 мл 2 раза в день.
РИФАМПИЦИН (порошок лиофилизированный, 150 мг в ампуле)
Показания: бактериальные инфекции при наличии чувствительности возбудителя к рифампицину.
Противопоказания: заболевания печени, почек, беременность, кормление грудью, аллергия на препарат.
Взаимодействие: уменьшает активность непрямых коагулянтов, пероральных сахароснижающих препаратов и содержащих наперстянку.
Способ применения: 0,15 мг лиофилизированного порошка рифампицина развести в 3-5 мл физраствора (оставить до полного растворения на 1 час).
СЛОЖНАЯ ИНГАЛЯЦИЯ С ФУРАЦИЛИНОМ
- раствор аскорбиновой кислоты 3% — 5 мл;
- раствор димедрола 1% — З мл;
- раствор адреналина гидрохлорида 0,1 % — 1 мл;
- раствор фурацилина 1:5000 — до 100 мл.

По 5-10 мл на 1 ингаляцию.
Показания: хронические риниты, острые и хронические синуситы, назофарингиты, ларинготрахеиты.
Противопоказания: нарушения сердечного ритма и сердечная недостаточность, артериальная гипертензия, аллергия к компонентам смеси.
ФЛУИМУЦИЛ АНТИБИОТИК ИТ (муколитическое и антибактериальное действие)
Показания: острые и хронические заболевания верхних дыхательных путей при обильной секреции трудноотделяемой мокроты, ОРВИ, для профилактики послеоперационных гнойных осложнений.
Противопоказания: язвенная болезнь желудка и 12-перстной кишки, кровохарканье, кровотечения, беременность, повышенная чувствительность к препарату.
Побочные эффекты: редко — тошнота, рвота, носовые кровотечения, крапивница, шум в ушах.
Способ применения: 5 мл растворителя добавляют во флакон с сухим порошком препарата. На 1 ингаляцию для взрослых берут ½ полученного раствора, для детей – ¼ %. В лечебных целях проводят ингаляции 2 раза в день, в профилактических — 1 раз в день.
На 1 ингаляцию для взрослых берут ½ полученного раствора, для детей – ¼ %. В лечебных целях проводят ингаляции 2 раза в день, в профилактических — 1 раз в день.
БРОНХОСАН (флаконы по 25 мл)
Механизм действия: отхаркивающее, обезболивающее, противовоспалительное, тонизирующее, спазмолитическое действия.
Состав: бромгексина гидрохлорид, ментол, масла: фенхеля, анисовое, душицы, мяты перечной, эвкалипта.
Показания: инфекционно-воспалительные заболевания верхних и нижних дыхательных путей.
Противопоказания: язвенная болезнь желудка и 12-перстной кишки в стадии обострения, желудочное кровотечение, беременность (1 триместр), кормление грудью, непереносимость компонентов препарата, дети до 5 лет.
Способ применения:
- взрослым — по 4 мл на 1 ингаляцию 2 раза в сутки;
- детям старше 10 лет — по 2 мл;
- детям от 6 до 10 лет — по 1 мл.

МАЛАВИТ (флаконы по 50 мл)
Механизм действия: антисептическое, антибактериальное, противовирусное, противогрибковое, обезболивающее действия.
Показания: острые и хронические инфекции ЛОР-органов (бактериальные, вирусные, грибковые).
Противопоказания: индивидуальная непереносимость (редко).
Способ применения: 1 мл малавита + 30 мл дистиллированной воды, на 1 ингаляцию от 5 до 10 мл раствора 2 раза в сутки.
МИРАМИСТИН (флаконы по 100, 400 мл 0,01% раствор)
Механизм действия: антибактериальное, противогрибковое, антивирусное действия; иммуномодулятор.
Показания: гнойные раны, хронические инфекции ЛОР-органов различной этиологии (бактериальной, вирусной, грибковой).
Противопоказания: индивидуальная непереносимость.
Побочное действие: кратковременное жжение.
Способ применения: по 5-10 мл на 1 ингаляцию 2 раза в сутки.
ГЛЮКОКОРТИКОИДЫ
БУДЕСОНИД (суспензия для ингаляций (0,125, 0,250, 0,500 мг/мл) — по 2 мл)
Механизм действия: многогранное противовоспалительное, противоаллергическое, противозудное, антиэкссудативное действия.
Показания: тяжёлое течение острых и хронических заболеваний верхних дыхательных путей.
Противопоказания: микозы, беременность, кормление грудью, нелеченный туберкулез, астматический приступ или статус.
Побочные эффекты: охриплость, сухость во рту, кандидоз, гиперкортицизм, гиперчувствительность.
Способ применения:
- взрослым — по 0,25-0,5 мг 2-3 раза в сутки;
- детям дошкольного возраста стартовая доза — 0,2-0,5 мг в сутки (1-2 ингаляции).

ГИДРОКОРТИЗОН ГЕМИСУКЦИНАТ (флаконы по 5 мл, в 1 мл 25 мг)
Способ применения: 25-50 мг на 1 ингаляцию.
ПРЕДНИ30Л0Н (ампулы по 1 мл (25, 30 мг))
Способ применения: 15-25 мг на 1 ингаляцию.
ДЕКСАМЕТАЗОН (ампулы по 1 и 2 мл (1 мл 4 мг))
Способ применения: 2-4 мг на 1 ингаляцию.
Указанные дозы препаратов растворяются в 3-10 мл физиологического раствора; ингаляции проводятся до 4-х раз в сутки.
МУКОЛИТИКИ
АМБРОКСОЛ (ЛАЗОЛВАН, АМБРОБЕНЕ, АМБРОГЕКСАЛ, АМБРОЛАН) флаконы по 40, 50 и 100 мл
Показания: острые и хронические заболевания верхних дыхательных путей, сопровождающиеся вязкой и слизисто-гнойной мокротой.
Противопоказания: 1-й триместр беременности, язвенная болезнь желудка и 12-перстной кишки в стадии обострения, желудочное кровотечение, кормление грудью, непереносимость препарата, судорожный синдром.
Побочные эффекты: аллергические реакции, при длительном применении — боль в эпигастрии, тошнота, рвота.
Способ применения: взрослым и детям старше 5 лет — по 2-3 мл 1-3 раза в сутки (развести физраствором в соотношении 1:1).
БРОМГЕКСИН (БИЗОЛЬВОН, ПАСИРАЗОЛ) флаконы по 2 мг в 1 мл
Показания: острые и хронические заболевания верхних дыхательных путей, сопровождающиеся вязкой и слизисто-гнойной мокротой.
Противопоказания: беременность (1-й триместр), кормление грудью, непереносимость компонентов препарата.
Побочные эффекты: аллергические реакции, редко — тошнота, рвота, диспепсия, повышение уровня трансаминаз.
Способ применения:
- взрослым — по 2 мл (8 мг) 4 раза в сутки или по 4-5 мл 2 раза в сутки;
- детям старше 10 лет — по 4 мг;
- детям от 6 до 10 — по 2 мг;
- детям до 6 лет — до 2 мг в сутки (2 ингаляции).

Разведение физраствором в соотношении 1:1
ИММУНОМОДУЛЯТОРЫ
ЦИКЛОФЕРОН
Показания: применяется для лечения и иммунопрофилактики при острых ларингитах, хронических синуситах и тонзиллитах.
Противопоказания: отсутствуют.
Побочные эффекты: повышение температуры тела до субфебрильных цифр через 1-2 часа после ингаляции.
Способ применения: для ингаляций 2 мл 12,5% циклоферона разводят в 5 мл физраствора, ингалируют 1 раз в день в течение 10 дней.
ИНТЕРФЕРОН
Показания: с профилактической целью при гриппе, ОРВИ.
Противопоказания: отсутствуют.
Способ применения: для ингаляции содержимое ампулы растворяют в 3 мл физиологического раствора, 1 ингаляция в день. Всего 4-5 ингаляций.
ЛЕЙКИНФЕРОН (комплекс цитокинов 1-й фазы иммунного ответа)
Показания: иммунодефицитные состояния, острые и хронические вирусные инфекции верхних дыхательных путей, острые и хронические бактериальные инфекции верхних дыхательных путей, аллергические заболевания.
Противопоказания: отсутствуют.
Побочные эффекты: повышение температуры тела до субфебрильных цифр через 1-2 часа после ингаляции.
Способ применения: 1 мл лейкинферона разводят в 5 мл дистиллированной воды, ингаляции проводят 2 раза в неделю 1-2 недели.
ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
АМФОТЕРИЦИН В (АМБИЗОМ, АМФОЦИЛ, ФУНГИЗОН) флаконы по 10, 20, 30 мл с лиофилизированным порошком 50 мг
Показания: системные микозы, микозы полости носа, околоносовых пазух, глотки и гортани.
Противопоказания: гиперчувствительность к препарату, сахарный диабет, заболевания кроветворной системы.
Побочные эффекты: лихорадка, анорексия, нарушения функции печени и почек, головная боль, тошнота, рвота, расстройства зрения и слуха. Снижение уровня гемоглобина, тромбоцитопения.
Способ применения: раствор готовят непосредственно перед ингаляцией, содержимое 1 флакона (50 мг) растворяют в 10 мл дистиллированной воды и используют на 1 ингаляцию (1-2 раза в сутки) 7-10 дней.
Применение ингаляционной терапии при воспалительных заболеваниях гортани
Учреждение разработчик: Государственное учреждение Здравоохранения «Московский научно-практический центр оториноларингологии» Департамента Здравоохранения г. Москвы.
Составители: Директор ГУЗ «МНПЦО» ДЗ Москвы профессор А.И. Крюков, заведующий отделением микрохирургии гортани и фониатрии МНПЦ оториноларингологии ДЗ Москвы к.м.н. С.Г. Романенко, старший научный сотрудник отделения микрохирургии гортани и фониатрии ГУЗ «МНПЦО» ДЗ Москвы к.м.н. О.Г. Павлихин, отделением микрохирургии гортани и фониатрии ГУЗ «МНПЦО» ДЗ Москвы Елисеев О.В.
Рецензент: доктор медицинских наук, профессор В.П. Гамов
Доктор медицинских наук, профессор В.Ф. Антонив
Предназначение: В методических рекомендациях представлены схемы ингаляционной терапии больных воспалительными заболеваниями гортани. Методические рекомендации рассчитаны на врачей – оториноларингологов поликлинического и стационарного звена, врачей – фониатров.
Данный документ является собственностью Департамента здравоохранения Правительства Москвы и не подлежит тиражированию и распространению без соответствующего разрешения.
ВВЕДЕНИЕ
Ингаляционную терапию применяли еще в глубокой древности. Основоположником ингаляционной терапии считают Гиппократа. Тогда же появились и простейшие ингаляционные препараты. Прародители современных ингаляционных аппаратов появились в 19 веке и постепенно совершенствовались вместе с развитием технического прогресса. В 1932г норвежский химик Э. Ротхейм получил патент на первый аэрозольный аппарат. В дальнейшем, до настоящего времени, происходит усовершенствование ингаляционной аппаратуры, и продолжает расширяться круг лекарственных препаратов, применяемых для ингаляционной терапии.
Основным преимуществом аэрозольтерапии является возможность достижения быстрого и эффективного лечебного действия с применением относительно небольшой дозы лекарственного препарата и значительном снижении отрицательного системного эффекта. Во время ингаляции происходит быстрое и интенсивное всасывание лекарственных препаратов, с увеличением активной поверхности и депонированием его в подслизистом слое. Создается высокая концентрация лекарственного средства непосредственно в очаге воспаления.
Во время ингаляции происходит быстрое и интенсивное всасывание лекарственных препаратов, с увеличением активной поверхности и депонированием его в подслизистом слое. Создается высокая концентрация лекарственного средства непосредственно в очаге воспаления.
Эндоларингеальные вливания значительно менее эффективны, чем аэрозольтерапия, т.к. вводимые лекарственные препараты неглубоко проникают в ткани гортани из-за непродолжительного контакта лекарственного вещества со слизистой оболочкой гортани. Применение эндоларингеальных вливаний часто бывает ограничено анатомическими и индивидуальными особенностями пациента. К тому же, вливания в гортань невозможно осуществлять несколько раз в день. Все выше сказанное не означает, что от эндоларингеальных вливаний следует вообще отказаться. Этот вид местной терапии незаменим в фониатрической и ЛОР-практике в тех случаях, когда требуется быстрый лечебный эффект без глубокого проникновения лекарственного вещества. Например, в случае кровоизлияния в голосовую складку, вызванного форсированной фонацией, или острого катарального ларингита, сопровождающегося нарушением микроциркуляции голосовой складки на фоне твердой атаки, более эффективными оказываются вливания в гортань сосудосуживающих средств (адреналин 0,1% – 0,3 в 2 мл физиологического раствора). Лекарственные средства вливают в гортань подогретыми до температуры тела по каплям до достижения клинического эффекта: побледнения слизистой оболочки, сужения сосудов голосовой складки. При этом достигается быстрый терапевтический эффект и не возникают побочные эффекты в виде сухости слизистой оболочки гортани.
Лекарственные средства вливают в гортань подогретыми до температуры тела по каплям до достижения клинического эффекта: побледнения слизистой оболочки, сужения сосудов голосовой складки. При этом достигается быстрый терапевтический эффект и не возникают побочные эффекты в виде сухости слизистой оболочки гортани.
Ингаляторы, исходя из методов получения аэрозольной среды, бывают ультразвуковые, компрессорные, пневматические, паровые и тепловлажные. При выборе того или иного вида ингаляционной терапии следует учитывать не только форму того или иного лекарственного средства, но и все параметры процедуры (форма лекарственного вещества, концентрация аэрозоля, температура аэрозоля, и др.).
Исследованиями доказано, что температура вдыхаемых аэрозолей серьезно влияет на мерцательный эпителий и состояние самого лекарственного вещества. Высокая и низкая температуры ингалируемых растворов отрицательно влияют на течение воспалительного процесса. При температуре вдыхаемого лекарственного препарата выше 39-40 градусов по Цельсию подавляется функция мерцательного эпителия (выше 41 градуса происходит его гибель). Растворы температурой ниже 25 – 28 градусов являются холодовым раздражающим фактором. Оптимальной температурой аэрозоля считается 36-38 градусов. Тепловлажные и паровые ингаляции на фоне острого ларингита могут быть причиной развития отека слизистой оболочки гортани со стенозированием её просвета. Следует так же отметить, что многие препараты резко снижают, или даже теряют свою биологическую активность при нагревании их до высоких температур. В связи с этим, применение тепловлажных и паровых ингаляций для лечения воспалительной патологии гортани мы считаем не целесообразным. Данный вид терапии может с осторожностью применяться при субатрофических и атрофических процессах в гортани.
Растворы температурой ниже 25 – 28 градусов являются холодовым раздражающим фактором. Оптимальной температурой аэрозоля считается 36-38 градусов. Тепловлажные и паровые ингаляции на фоне острого ларингита могут быть причиной развития отека слизистой оболочки гортани со стенозированием её просвета. Следует так же отметить, что многие препараты резко снижают, или даже теряют свою биологическую активность при нагревании их до высоких температур. В связи с этим, применение тепловлажных и паровых ингаляций для лечения воспалительной патологии гортани мы считаем не целесообразным. Данный вид терапии может с осторожностью применяться при субатрофических и атрофических процессах в гортани.
В последние годы расширяется арсенал карманных ингаляторов. Существуют карманные жидкостные ингаляторы и порошковые ингаляторы. Карманные ингаляторы применяются для введения в дыхательные пути дозированного количества препарата. Несмотря на удобство их применения, область использования этого вида ингаляторов при патологии гортани ограничена. Основная масса аэрозоля оседает в полости рта. К недостаткам аэрозольных упаковок следует отнести низкую температуру получаемого аэрозоля. Так же одним из недостатков аэрозольных баллонов является и то, что по мере его использования давление внутри его уменьшается и лекарственный препарат выбрасывается не полностью.
Основная масса аэрозоля оседает в полости рта. К недостаткам аэрозольных упаковок следует отнести низкую температуру получаемого аэрозоля. Так же одним из недостатков аэрозольных баллонов является и то, что по мере его использования давление внутри его уменьшается и лекарственный препарат выбрасывается не полностью.
Ингаляционная аппаратура.
Ингаляционная аппаратура подразделяется на стационарные установки и портативные переносные аппараты. В связи с тем, что терапия воспалительных заболеваний гортани требует многократных ингаляций в течение дня, все большее внимание уделяется переносным ингаляционным аппаратам.
В лечебной практике чаще используются небулайзеры (от лат. nebula – туман, облачко). Различают два основных типа небулайзеров: компрессорные и ультразвуковые. Компрессорные ингаляторы бывают струйными или пневматическими. Компрессорный ингалятор представляет собой устройство для преобразования лекарственного вещества в мелкодисперсный аэрозоль под действием сжатого воздуха от компрессора или под действием сжатого кислорода. В ультразвуковых ингаляторах распыление осуществляется в результате высокочастотной вибрации пьезоэлектрических кристаллов.
В ультразвуковых ингаляторах распыление осуществляется в результате высокочастотной вибрации пьезоэлектрических кристаллов.
Результаты проведенного нами клинико-экспериментального исследования доказывают, что ингаляционные процедуры, проводимые на индивидуальных ультразвуковых ингаляционных аппаратах, более эффективны, по сравнению с ингаляциями, проводимыми на компрессорных аппаратах. Это объясняется тем, что аэрозоль ультразвуковых ингаляционных аппаратов представляет собой электроаэрозоль. Такой аэрозоль помимо лечебных свойств самого лекарственного вещества, практически полностью состоит из отрицательно заряженных частиц, оказывающих дополнительное противовоспалительное действие. Во время же ингаляционных процедур, проводимых на компрессорных ингаляционных аппаратах, помимо отрицательно заряженных частиц образуются так же и положительно заряженные частицы и частицы без заряда. Недостатком использования ультразвукового ингалятора является большой расход лекарственного средства, так как потеря препарата происходит и в фазе выдоха.
По степени дисперсности выделяют аэрозоли высокодисперсные (размер частиц 0,05-0,1 мкм.), среднедисперсные (размер частиц 0,1-1мкм) и крупнодисперсные (размер частиц более 1 мкм). Частицы диаметром 8 – 10 мкм обычно оседают в полости рта, 5 – 8 мкм в глотке и гортани, 3 – 5 мкм – в трахее и бронхах, 1 – 3 мкм в бронхиолах, 0,5 – 2 мкм – в альвеолах. Для лечения заболеваний верхних дыхательных путей преимущественно используются аэрозоли средней и низкой дисперсности.
Ингаляционная терапия для лечения заболеваний гортани может использоваться как монотерапия, так и в комплексе с другими методами лечения. Применение ингаляционной терапии показано пациентам с воспалительной патологией гортани, при отечных ларингитах различной этиологии, узелках голосовых складок, как симптоматическая терапия для достижения муколитического эффекта, увлажнения слизистой оболочки гортани.
Противопоказания к ингаляционной терапии
- Склонность к спазмам коронарных артерий
- Состояние после инфаркта миокарда и кровоизлияния в головной мозг
- Кровотечения различной этиологии и склонность к ним
- Выраженный атеросклероз сосудов мозга и сердца
- Спонтанный пневмоторакс
- Распространенная буллезная форма эмфиземы легких
- Злокачественные новообразования.

Правила проведения ингаляции
- Ингаляции проводят не ранее чем, через 1-1,5 ч после приема пищи, физической нагрузки.
- Перед процедурой пациент не должен принимать отхаркивающие средства и полоскать глотку антисептическими растворами. Рекомендуется прополоскать полость рта кипяченой водой комнатной температуры.
- До и после ингаляций запрещается курение.
- Ингаляции следует принимать сидя в удобной позе, ровно, таким образом, чтобы обеспечивалось спокойное дыхание. Следует учитывать, что сильный наклон туловища вперед во время приема процедуры затрудняет дыхание.
- При заболеваниях носа, околоносовых пазух и носоглотки вдох и выдох необходимо делать через нос. При патологии гортани ингаляцию следует делать через рот. После глубокого вдоха ртом, рекомендуется задержать дыхание на 2 сек., а затем сделать полный выдох через нос.
- Дыхание во время ингаляции должно быть обычным, не форсированным. Частое глубокое дыхание приводит к гипервентиляции и может вызвать головокружение.
 При возникновении головокружения, необходимо прервать ингаляцию на 1-2 минуты.
При возникновении головокружения, необходимо прервать ингаляцию на 1-2 минуты.
Аэрозольтерапия – основные положения.
Аэрозоли лекарственных средств обладают муколитическим, противовоспалительным, противоотечным, антибактериальным действием, способны поддерживать мукоцилиарный клиренс регулировать степень увлажнения.
В аэрозольной форме вводят антибактериальные и противогрибковые средства, ферменты, гормональные препараты, муколитики, минеральные воды, лекарственные средства растительного происхождения, биостимуляторы, биологически активные вещества.
Применение ингаляционной терапии позволяет сократить прием антибактериальных и других лекарственных средств, значительно повысить эффективность лечения, уменьшить проявление системных и побочных эффектов действия других лекарственных средств.
Одним из необходимых условий нормальной фонаторной активности голосовых складок является достаточная влажность слизистой оболочки голосовых складок. Сухость слизистой гортани может быть вызвана не только воспалительным процессом, но и побочными эффектами применения таких лекарственных препаратов, как топические кортикостериоды при бронхиальной астме, десенсибилизирующих препаратов и др. Это особенно важно для пациентов голосовых профессий. Применение ингаляционной терапии с минеральной водой или физиологическим раствором в этих случаях позволит нивелировать побочные эффекты этих лекарственных средств, улучшить качество голоса и ускорить процессы эпителизации после эндоларингеальных вмешательств.
Сухость слизистой гортани может быть вызвана не только воспалительным процессом, но и побочными эффектами применения таких лекарственных препаратов, как топические кортикостериоды при бронхиальной астме, десенсибилизирующих препаратов и др. Это особенно важно для пациентов голосовых профессий. Применение ингаляционной терапии с минеральной водой или физиологическим раствором в этих случаях позволит нивелировать побочные эффекты этих лекарственных средств, улучшить качество голоса и ускорить процессы эпителизации после эндоларингеальных вмешательств.
В последнее время изменилось отношение к применению масляных ингаляций. Цель масляных ингаляций – покрыть слизистую оболочку тонким защитным и смягчающим слоем. Продолжительность масляных ингаляций составляет в среднем 5-8 минут. За 5 минут в аэрозоль превращается 0,25 г масла. По данным многочисленных исследований проведенных за последние годы установлено, что ингалируемое масло попадая в альвеолы способствует развитию альвеолитов и разрушению сурфактанта. Поэтому этот метод лечения, широко распространенный ранее, в настоящее время рекомендовано не использовать.
Поэтому этот метод лечения, широко распространенный ранее, в настоящее время рекомендовано не использовать.
При проведении ингаляционной терапии необходимо соблюдение определенной последовательности применения лекарственных веществ. Наличие большого количества мокроты, корок на поверхности слизистой оболочки препятствует всасыванию ингалируемых веществ. В этих случаях лечение надо начинать с ингалирования муколитических средств и лишь после этого, через 20-30 минут, назначать аэрозоли других лекарственных препаратов. При появлении выраженной сухости слизистой оболочки ротоглотки и гортани после применения ингаляций кортикостероидами показана ингаляция с физиологическим раствором или минеральной водой для увлажнения слизистой оболочки.
При планировании ингаляционной терапии следует придерживаться принципа последовательного применения в течение суток медицинских препаратов с различной фармакологической активностью и направленностью и подбора индивидуальных схем лечения в зависимости от характера, выраженности и стадии воспаления.
Лекарственные препараты для небулайзерной аэрозолетерапии.
Антибактериальные препараты.
Высокая эффективность антибактериальных и противогрибковых препаратов при их местном применении при лечении воспалительной патологии гортани давно известна. Однако перед началом проведения ингаляции следует особенно тщательно собрать аллергологический анамнез. Известны случаи анафилактического шока во время ингаляционной процедуры с антибактериальными средствами. Ранее часто назначались ингаляции со стрептомицином, пенициллином, тетрациклином, левомицетином и олеандомицином. В настоящее время наиболее часто в практике применяются ингаляции 2 мл 0,01% раствора мирамистина или 2 мл 1% раствора диоксидина в смеси с 3 мл физиологического раствора. Высокую терапевтическую эффективность показал Флуимицил-антибиотик, который обладает еще и муколитическим эффектом. Для ингаляции используется ½ флакона препарата на ингаляцию, 2 раза в день. Возможно применение и других антибактериальных средств, которые назначают в соответствии с результатом микробиологического исследования. Длительность курса терапии в среднем составляет 5 дней.
Длительность курса терапии в среднем составляет 5 дней.
Противогрибковые препараты
Для лечения микозов гортани кроме общей противогрибковой и противовоспалительной терапии применяются ингаляции 3000 ЕД/мл нистатина. Раствор готовится перед применением: 75 мг порошка натриевой соли нистатина в 5 мл дистиллированной воды 1 раз в сутки. Применяется так же натриевая соль леворина по 200 000 ЕД на ингаляцию. Курс лечения, как правило, длится 12-15 дней. Так же, как и при любой другой патологии гортани, ингаляции с противогрибковыми препаратами, при необходимости, чередуют с ингаляциями с протеолитическими ферментами, физиологическим раствором или минеральной водой.
Кортикостероиды.
Кортикостероиды в виде ингаляции обладают противоотечным и противовоспалительным действием. Ингаляции кортикостериодов применяются при всех воспалительных заболеваниях гортани, особенно сопровождающихся отеком слизистой оболочки. Используются смеси гидрокортизона гемисукцината 25 мг или преднизолона 15 мг или дексаметазона 2 мг в 3 мл физиологического раствора. Ингаляции назначают 2 раза в сутки. В случае выраженного отека слизистой оболочки гортани – до 4 раз в сутки. Длительность лечения зависит от динамики воспалительных изменений. При хронических воспалительных процессах курс лечения в среднем составляет 10 дней. Побочным эффектом действия этих препаратов является сухость слизистой оболочки гортани. У пациентов с воспалительными заболеваниями гортани, особенно после хирургического вмешательства, это может замедлять процесс эпителизации. В связи с этим после проведения ингаляции кортикостероида возможно проведение через 10-15 минут ингаляции физиологического раствора или минеральной воды.
Ингаляции назначают 2 раза в сутки. В случае выраженного отека слизистой оболочки гортани – до 4 раз в сутки. Длительность лечения зависит от динамики воспалительных изменений. При хронических воспалительных процессах курс лечения в среднем составляет 10 дней. Побочным эффектом действия этих препаратов является сухость слизистой оболочки гортани. У пациентов с воспалительными заболеваниями гортани, особенно после хирургического вмешательства, это может замедлять процесс эпителизации. В связи с этим после проведения ингаляции кортикостероида возможно проведение через 10-15 минут ингаляции физиологического раствора или минеральной воды.
Протеолитические ферменты.
Аэрозоли протеолитических ферментов обладают муколитическим эффектом, улучшают мукоцилиарный клиренс. Ферментные препараты оказывают местное противовоспалительное и противоотечное действие. Применение протеолитических ферментов в виде ингаляций особенно показано для лечения ларингитов, сопровождающихся образованием плотных фибриновых пленок или корок, при подскладковом ларингите на фоне системных заболеваний, при атрофическом ларингите.
Препараты разводят на физиологическом растворе или дистиллированной воде: Химотрипсин –3мг в 1 мл, Трипсин 3 мг в 1 мл, Химопсин 5 мг в 1 мл. Лизоцим используется в виде 0,5% раствора, на 1 ингаляцию расходуют 3-5 мл раствора. Ингаляции назначают 1-3 раза в день в течение 7 дней. Ферментные препараты могут вызывать аллергические реакции, в связи с чем применяться они должны с большой осторожностью.
Муколитики и мукорегуляторы.
Муколитики и мукорегуляторы применяются при воспалительных заболеваниях гортани с целью разжижения секрета, облегчения мукоцилиарного клиренса. Ацетилцистеин применяется в виде 20% р-ра по 2-4 мл 3-4 раза в день. В терапевтической дозировке обладает хорошим муколитическим эффектом. В высоких дозировках подавляет деятельность ресничатых клеток слизистой бронхов и мукоцилиарный клиренс. Нежелательный эффект ацетилцистеина – рефлекторный кашель из-за местного раздражения дыхательных путей. Усиливает склонность к бронхоспазму, поэтому у больных с сочетанной патологией легких рекомендовано не применять.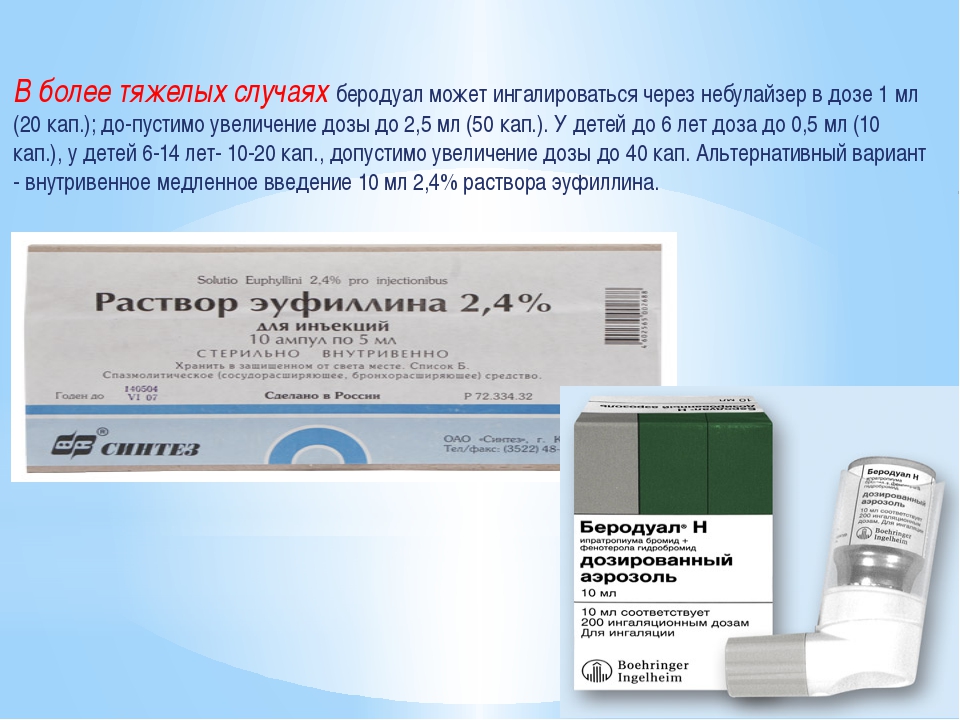 Флуимицил антибиотик – препарат с антибактериальным и муколитическим эффектом. Применяемая дозировка: ½ флакона на 1 ингаляцию 2 раза в день. Лазолван – метаболит бромгексина, обладающий бронхосекретолитическим и отхаркивающим эффектом. Улучшает реологические свойства мокроты, уменьшает её вязкость и адгезивные свойства, нормализует мукоцилиарный клиренс. Лазолван применяется в дозировке 4 мл 2-3 раза в день, затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1. Курс лечения составляет 7 дней.
Флуимицил антибиотик – препарат с антибактериальным и муколитическим эффектом. Применяемая дозировка: ½ флакона на 1 ингаляцию 2 раза в день. Лазолван – метаболит бромгексина, обладающий бронхосекретолитическим и отхаркивающим эффектом. Улучшает реологические свойства мокроты, уменьшает её вязкость и адгезивные свойства, нормализует мукоцилиарный клиренс. Лазолван применяется в дозировке 4 мл 2-3 раза в день, затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1. Курс лечения составляет 7 дней.
Для усиления муколитического эффекта и увлажнения слизистой оболочки гортани в клинике успешно применяется натрия хлорид 0,9% изотонический р-р 2-3 мл на ингаляцию, натрия гидрокарбонат 2% р-р 2-3 мл на ингаляцию. Ингаляции физиологического раствора могут применяться длительно, как симптоматическое средство при сухости слизистой оболочки гортани.
Главными составными компонентами минеральной воды являются натрий, кальций, магний, хлор, железо, радон. Иодистый калий увеличивает количество слизи, разжижает её. Углекислый магний усиливает секрецию слизи, углекислый натрий уменьшает секрецию слизи и разжижает её. Соляно-щелочные воды уменьшают чувство сухости, кашлевое раздражение. Минеральные воды, содержащие сероводород, вызывают расширение сосудов и кратковременное повышение температуры при этом активируется функция мерцательного эпителия. Применяются минеральные воды с концентрацией солей до 150 иг/л. Наилучший лечебный эффект оказывают по нашим данным оказывают среднеминерализованные воды: Ессентуки №17, Славянская.
Иодистый калий увеличивает количество слизи, разжижает её. Углекислый магний усиливает секрецию слизи, углекислый натрий уменьшает секрецию слизи и разжижает её. Соляно-щелочные воды уменьшают чувство сухости, кашлевое раздражение. Минеральные воды, содержащие сероводород, вызывают расширение сосудов и кратковременное повышение температуры при этом активируется функция мерцательного эпителия. Применяются минеральные воды с концентрацией солей до 150 иг/л. Наилучший лечебный эффект оказывают по нашим данным оказывают среднеминерализованные воды: Ессентуки №17, Славянская.
В течение многих лет в терапии воспалительных заболеваний гортани успешно применяются растительные препараты, которые обладают противовоспалительным, бактерицидным, муколитическим действием. Для ингаляции допускаются только смеси лекарственных препаратов, разрешенные в РФ
- Аптечная смесь: Эвкалипт прутьевидный (лист) 15,0, Шалфей лекарственный (листья) 20,0, Ромашка аптечная (цветки) 10,0, Мята перечная (трава) 10,0, Сосна обыкновенная (почки) 15,0, Девясил высокий (корни) 20,0, Тимьян обыкновенный (трава) 10,0,
- Аптечная смесь: Ментол 0,71г, Настойка эвкалипта 35,7 глицерин 35,7, Этиловый спирт 100 мл.

Возможно применение настоя ромашки, смесь экстракта алоэ 5 мл, сока каланхоэ, подорожника, экстракта шиповника, 10% раствора белого натурального меда. Для уменьшения отечности слизистой оболочки и секреции слизи назначают ингаляции с вяжущими веществами отвар коры дуба, шалфея, настой травы зверобоя или цветов бессмертника Хороший терапевтический эффект отмечен при использовании гумизоля 2,0 и пеллоидина. Клинические данные свидетельствуют об увлажняющем и репаративном действии этих препаратов за счет улучшения микроциркуляции. При использовании многокомпонентных растительных препаратов и меда следует с особой тщательностью собирать аллергологический анамнез.
Нами разработаны схемы лечения воспалительных заболеваний гортани с применением ингаляционной терапии. Ингаляционная терапия применяется в комплексном лечении, включающем в себя антибактериальные, противовоспалительные, десенсибилизирующие средства, физиотерапию, энзимотерапию, микрохирургические вмешательства. В виде монотерапии проведение ингаляционного лечения показано при нетяжелых формах воспалительных заболеваний гортани.
В виде монотерапии проведение ингаляционного лечения показано при нетяжелых формах воспалительных заболеваний гортани.
Схема ингаляционной терапии острого катарального ларингита, обострения хронического катарального ларингита:
- Смесь: Мирамистин 0,01% – 2,0 + Физиологический раствор 2,0 мл + раствор Дексаметазона 2 мг. Ингалировать 2 раза в день по 10 минут.
- Физиологический раствор 5,0 или Минеральная вода 5,0 через 20 минут после ингаляции Мирамистина и Дексаметазона. При повышенной сухости слизистой оболочки гортани, а также для лиц голосовых профессий, возможно применение ингаляций минеральной воды или физиологического раствора, как увлажняющего средства до 6 раз в день. Длительность ингаляции 5-10 минут.
Курс лечения 7-10 дней.
Схема ингаляционной терапии острого отечного ларингита, обострения хронического отечно-полипозного ларингита:
- Дексаметазона 2 мг в 3 мл физиологического раствора 2 раза в день по 10 минут.
 При выраженном отеке слизистой оболочки гортани возможно применение ингаляций до 4 раз в день.
При выраженном отеке слизистой оболочки гортани возможно применение ингаляций до 4 раз в день. - Физиологический раствор 5,0 мл или минеральная вода 5,0 мл после ингаляции кортикостероида через 10 – 15 минут, а также в течение дня при сухости слизистой оболочки гортани. Длительность ингаляции 5-10 минут.
Курс лечения при остром воспалительном процессе составляет 3-7 дней, при хроническом – 7-10 дней.
Схема ингаляционной терапии инфильтративного флегмонозного, абсцедирующего ларингита, обострения хронического гиперпластического ларингита:
- При образовании корок, плотного фибринозного налета терапию начинают с ингаляции муколитика или протеолитического фермента. Используют 2-4 мл 20% р-ра Ацетилцистеина 3-4 раза в день или 4 мл Лазолвана в разбавлении физиологическим раствором 1:1. Применяется 3мг Химотрипсина или трипсина 3 мг, химопсина 5 мг в 1 мл физиологического раствора, или 0,5% раствора лизоцима по 5 мл 2 раза в день затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1.

- Через 10 минут – Флуимицил-антибиотик ½ флакона 2 раза в день. При выявлении грибковой природы заболевания проводится ингаляционная терапия с противогрибковыми препаратами. Длительность ингаляции 10 минут.
- Через 15-20 минут – Дексаметазон 2 мг в 3 мл физиологического раствора 2 раза в день. Длительность ингаляции 10 минут.
- 5,0 мл Физиологического раствора или 5,0 мл минеральной воды 4 – 6 раза в день: через 10 – 15 минут после ингаляции кортикостероида и дополнительно 2-4 раза в течение дня в зависимости от количества вязкой мокроты или корок на слизистой оболочке голосовых складок. Длительность ингаляции 10 минут.
Курс лечения составляет 7-10 дней. При хроническом гиперпластическом ларингите на срок до 2-3 недель назначают ингаляции с минеральной водой или физиологическим раствором 2-4 раза в сутки с целью увлажнения слизистой оболочки гортани и уменьшения вязкости секрета.
Схема ингаляционной терапии хронического субатрофического и атрофического ларингита:
- 3мг Химотрипсина или трипсина 3 мг, химопсина 5 мг в 1 мл физиологического раствора, или 0,5% раствора лизоцима по 5 мл 2 раза в день затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1.
 Длительность ингаляции 10 минут.
Длительность ингаляции 10 минут. - 5,0 мл Физиологического раствора или 5,0 мл минеральной воды 4 – 6 раза в день 10 дней или длительно 2 раза в день. Длительность ингаляции 10 минут.
- Ингаляция с 2,0 мл пеллоидина или гумизоля 2 раза в день. Возможно применение ингаляций медом. Длительность ингаляции 10 минут. На курс лечения назначают 10 процедур.
- Ингаляция с готовой аптечной смесью лекарственных трав 2 раза в день по окончании предыдущего курса терапии 10 дней (при очень значительном образовании корок). Длительность ингаляции 10 минут.
Рекомендовано длительное, регулярное использование ингаляций с минеральной водой или физиологическим раствором 2-4 раза в сутки с целью увлажнения слизистой оболочки гортани и уменьшения вязкости секрета до ремиссии заболевания.
Схема ингаляционной терапии острого ларингита после перенесенного эндоларингеального вмешательства:
- В первые дни после операции применяются ингаляции антибактериальных препаратов: 2 мл 0,01% раствора мирамистина или 2 мл 1% раствора диоксидина в смеси с 3 мл физиологического раствора.
 Флуимицил-антибиотик ½ флакона препарата на ингаляцию, 2 раза в день.
Флуимицил-антибиотик ½ флакона препарата на ингаляцию, 2 раза в день. - Ингаляция дексаметазона 2 мг в 3 мл физиологического раствора 2 раза в день 5-7 дней.
- При повышенном образовании фибриновых пленок к лечению добавляют ингаляции 3мг Химотрипсина или трипсина 3 мг, химопсина 5 мг в 1 мл физиологического раствора, или 0,5% раствора лизоцима по 5 мл 2 раза в день затем по 2мл 3-4 раза в день в чистом виде или в разбавлении физиологическим раствором 1:1. Длительность ингаляции 10 минут.
- 5,0 мл Физиологического раствора или 5,0 мл минеральной воды 4 – 6 раза в день 10 дней или длительно 2 раза в день. Длительность ингаляции 10 минут.
- При сохранении сухости слизистой оболочки гортани и замедлении процессов эпителизации назначают ингаляции с пеллоидином или гумизолем 2,0 2 раза в день. На курс лечения назначают 10 процедур.
Курс лечение составляет 7-10 дней. При затяжном течении воспалительного процесса назначают ингаляции с физиологическим раствором или минеральной водой 2-4 раза в сутки на длительный срок.
Лечение воспалительных заболеваний гортани должно быть комплексным. При планировании терапии следует учитывать индивидуальные особенности пациента: возраст, давность заболевания, характер голосовой нагрузки, особенности профессиональной деятельности, наличие сопутствующей патологии. Только лечебная тактика, построенная на принципах индивидуального подхода, этапности, комбинированных методов лечения позволяет реабилитировать пациента с патологией гортани.
Форадил комби капсулы для ингаляций 12/200мкг №60+60 цена от 1150 руб. в аптеках Апрель, инструкция по применению и аналоги
Формотерол
Показано, что при применении формотерола улучшается качество жизни больных ХОБЛ.
Формотерол относится к классу бета2-адреномиметиков длительного действия. На фоне применения другого бета2-адреномиметика длительного действия, салметерола, отмечалось увеличение частоты летальных исходов, связанных с бронхиальной астмой (13 из 13 176 пациентов) по сравнению с плацебо (3 из 13 179 пациентов). Клинических исследований по оценке частоты развития летальных исходов, связанных с бронхиальной астмой, на фоне применения формотерола не проводилось.
Клинических исследований по оценке частоты развития летальных исходов, связанных с бронхиальной астмой, на фоне применения формотерола не проводилось.
Противовоспалительная терапия
У пациентов с бронхиальной астмой формотерол следует применять только в качестве дополнительного лечения при недостаточном контроле симптомов на фоне монотерапии ингаляционными кортикостероидами или при тяжелой форме заболевания, требующей применения ингаляционного кортикостероида и агониста β2-адренорецепторов длительного действия. Формотерол не следует назначать совместно с другими агонистами β2-адренорецепторов длительного действия.
При назначении формотерола, необходимо оценить состояние пациентов в отношении адекватности той противовоспалительной терапии, которую они получают. После начала лечения формотеролом пациентам следует рекомендовать продолжать противовоспалительную терапию без изменений, даже в том случае, если будет отмечено улучшение.
Для купирования острого приступа бронхиальной астмы следует применять агонисты бета2-адренорецепторов короткого действия. При внезапном ухудшении состояния пациенты должны немедленно обращаться за медицинской помощью.
При внезапном ухудшении состояния пациенты должны немедленно обращаться за медицинской помощью.
Тяжелые обострения бронхиальной астмы
В клинических исследованиях при применении формотерола отмечалось небольшое повышение частоты развития тяжелых обострений бронхиальной астмы по сравнению с плацебо, особенно у детей 6-12 лет.
В плацебо-контролируемых клинических исследованиях у пациентов, получавших формотерол в течение 4-х недель, отмечалось повышение частоты развития тяжелых обострений бронхиальной астмы (0.9% при режиме дозирования 10-12 мкг 2 раза/сут, 1.9% — при 24 мкг 2 раза/сут) по сравнению с группой плацебо (0.3%), особенно у детей 6-12 лет.
В двух крупных контролируемых клинических исследованиях, включавших 1095 взрослых пациентов и детей от 12 лет и старше, тяжелые обострения бронхиальной астмы (требовавшие госпитализации) чаще наблюдались у пациентов, получавших формотерол в дозе 24 мкг 2 раза/сут (9/271, 3.3%), по сравнению с группами формотерола в дозе 12 мкг 2 раза/сут (1/275, 0. 4%), плацебо (2/277, 0.7%) и альбутерола (2/272, 0.7%).
4%), плацебо (2/277, 0.7%) и альбутерола (2/272, 0.7%).
При применении формотерола в течение 16 недель в другом крупном клиническом исследовании, включавшем 2085 взрослых пациентов и подростков, не было выявлено повышения частоты тяжелых обострений бронхиальной астмы в зависимости от увеличения дозы формотерола. Однако в данном исследовании частота развития тяжелых обострений была выше в группе формотерола (при режиме дозирования 24 мкг 2 раза/сут — 2/527, 0.4%, при 12 мкг 2 раза/сут — 3/527, 0.6%) по сравнению с плацебо (1/517, 0.2%). В открытой фазе этого исследования при применении формотерола в дозе 12 мкг 2 раза/сут (при необходимости пациенты могли использовать еще до двух дополнительных доз препарата) частота тяжелых обострений бронхиальной астмы составляла 1/517, 0.2%.
В 52-недельном многоцентровом, рандомизированном, двойном-слепом клиническом исследовании, включавшем 518 детей в возрасте от 6 до 12 лет, частота развития тяжелых обострений бронхиальной астмы была выше при применении формотерола в дозах 24 мкг 2 раза/сут (11/171, 6. 4%), 12 мкг 2 раза/сут (8/171, 4.7%) по сравнению с плацебо (0/176, 0.0%).
4%), 12 мкг 2 раза/сут (8/171, 4.7%) по сравнению с плацебо (0/176, 0.0%).
Однако результаты вышеуказанных клинических исследований не позволяют дать количественную оценку частоты развития тяжелых обострений бронхиальной астмы в различных группах.
Гипокалиемия
Следствием терапии бета2-адреномиметиками, включая формотерол, может быть развитие потенциально серьезной гипокалиемии. Гипокалиемия может увеличить предрасположенность к развитию аритмий.
Т.к. данное действие препарата может быть усилено гипоксией и сопутствующим лечением, особую осторожность следует соблюдать у больных бронхиальной астмой тяжелого течения. В этих случаях рекомендуется регулярный контроль концентрации калия в сыворотке крови.
Парадоксальный бронхоспазм
Также как и при проведении другой ингаляционной терапии, следует учитывать возможность развития парадоксального бронхоспазма. Если он возникает, следует немедленно отменить препарат и назначить альтернативное лечение.
Влияние на способность к вождению автотранспорта и управлению механизмами
Пациентам, у которых на фоне применения препарата формотерол возникает головокружение или другие нарушения со стороны ЦНС, следует воздержаться от управления автотранспортом или работы с механизмами в период применения препарата.
Будесонид
Для обеспечения поступления будесонида в легкие важно проинструктировать пациентов правильно поводить ингаляции препарата в соответствии с инструкцией по применению.
Следует проинформировать больных, о том, что препарат предназначен не для купирования приступов, а для регулярного ежедневного профилактического применения даже при отсутствии симптомов бронхиальной астмы.
При развитии парадоксального бронхоспазма следует сразу же прекратить применение будесонида, оценить состояние пациента и при необходимости назначить терапию другими лекарственными препаратами. Парадоксальный бронхоспазм необходимо немедленно купировать с помощью бета2-адреномиметика короткого действия. Пациенты должны всегда иметь в распоряжении ингалятор с бета2-адреномиметиком короткого действия для купирования резких обострений бронхиальной астмы.
Пациенты должны всегда иметь в распоряжении ингалятор с бета2-адреномиметиком короткого действия для купирования резких обострений бронхиальной астмы.
Следует проинформировать больных, о необходимости обращения к врачу при ухудшении состояния (повышении потребности в бронходилататорах короткого действия, усилении приступов одышки). В таких случаях необходимо провести обследование пациента и рассмотреть вопрос о возможности увеличения дозы ингаляционных или пероральных ГКС.
Для снижения риска развития кандидозной инфекции полости рта и глотки пациент должен тщательно полоскать рот водой после каждой ингаляции препарата. При развитии кандидозной инфекции полости рта и глотки возможно проведение местной противогрибковой терапии без прекращения лечения будесонидом.
При обострении бронхиальной астмы следует увеличить дозу будесонида или в случае необходимости провести короткий курс системными ГКС и/или назначить антибиотикотерапию при развитии инфекции.
Необходимо регулярно контролировать динамику роста детей и подростков, получающих длительную терапию ингаляционными ГКС. При задержке роста следует рассмотреть необходимость снижения дозы ингаляционных ГКС (назначение в минимальной эффективной дозе) и направления ребенка на консультацию к аллергологу. Отдаленные последствия задержки роста (влияние на окончательный рост взрослого) у детей, получающих терапию ингаляционными ГКС, не изучены.
При задержке роста следует рассмотреть необходимость снижения дозы ингаляционных ГКС (назначение в минимальной эффективной дозе) и направления ребенка на консультацию к аллергологу. Отдаленные последствия задержки роста (влияние на окончательный рост взрослого) у детей, получающих терапию ингаляционными ГКС, не изучены.
Адекватного исследования возможности компенсировать возникшее отставание в росте у детей после отмены терапии пероральными ГКС не проводилось.
Будесонид обычно не оказывает влияния на функцию надпочечников. Однако у некоторых пациентов при длительном применении в рекомендованных суточных дозах может отмечаться системное действие будесонида.
При назначении ингаляционных ГКС в высоких дозах или в течение длительного периода времени возможно развитие системных нежелательных реакций (однако реже, чем при применении пероральных ГКС), таких как подавление функции коры надпочечников, гиперкортицизм/синдром Кушинга, задержка роста у детей и подростков, снижение минеральной плотности костной ткани, реакции гиперчувствительности, катаракта, глаукома и реже — ряд нарушений поведения, включая психомоторную гиперактивность, нарушения сна, возбуждение, депрессию или агрессивность (особенно у детей).
Пациенты с гормононезависимой бронхиальной астмой
У пациентов с гормононезависимой бронхиальной астмой терапевтический эффект будесонида развивается в среднем в течение 10 дней после начала лечения. В начале терапии будесонидом у больных с повышенной бронхиальной секрецией к ингаляциям препарата можно добавить пероральные ГКС коротким курсом (длительностью около 2 недель).
Пациенты с гормонозависимой бронхиальной астмой
При переходе с перорального приема ГКС к ингаляционному применению будесонида больные должны находиться в относительно стабильном состоянии. В течение первых 10 дней назначают высокие дозы будесонида в комбинации с применявшимися ранее пероральными ГКС в прежней дозе. Затем суточную дозу пероральных ГКС начинают постепенно снижать (по 2.5 мг каждый месяц в пересчете на преднизолон) до минимально возможного уровня. Не следует резко прерывать лечение ГКС, включая будесонид.
В первые месяцы после перехода следует тщательно контролировать состояние пациента, пока его гипоталамо-гипофизарно-надпочечниковая система не восстановится в достаточной степени, чтобы обеспечить адекватную реакцию на стрессовые ситуации (например, травму, хирургическое вмешательство или тяжелую инфекцию). Следует регулярно контролировать показатели функции гипоталамо-гипофизарно-надпочечниковой системы.
Следует регулярно контролировать показатели функции гипоталамо-гипофизарно-надпочечниковой системы.
В ряде случаев пациентам со сниженной функцией коры надпочечников может понадобиться дополнительное назначение ГКС для приема внутрь в период стрессовых ситуаций. Данной категории больных рекомендуется всегда носить с собой предупреждающую карточку, в которой должно быть указано, что они в стрессовых ситуациях нуждаются в дополнительном системном назначении ГКС.
При переводе пациентов с системных ГКС на ингаляционную терапию будесонидом могут проявляться такие реакции, как аллергический ринит, экзема, заторможенность, боль в мышцах и суставах, иногда тошнота и рвота, которые раньше подавлялись приемом системных ГКС. Лечение указанных реакций следует проводить антигистаминными препаратами или местными ГКС.
Влияние на способность к вождению автотранспорта и управлению механизмами
Данных о влиянии будесонида на способность управлять автотранспортом и работать с механизмами нет. Отрицательное влияние препарата на способность управлять автотранспортом и работать с механизмами маловероятно.
Отрицательное влияние препарата на способность управлять автотранспортом и работать с механизмами маловероятно.
Раздел для практикующего врача, назначающего лечение, наглядно демонстрирующий применение новейших научных разработок в области медицины. Статьи носят рекомендательный характер, сочетая в себе практическую информацию и научные обзоры.
Информация только для специалистов в сфере медицины, фармации и здравоохранения!
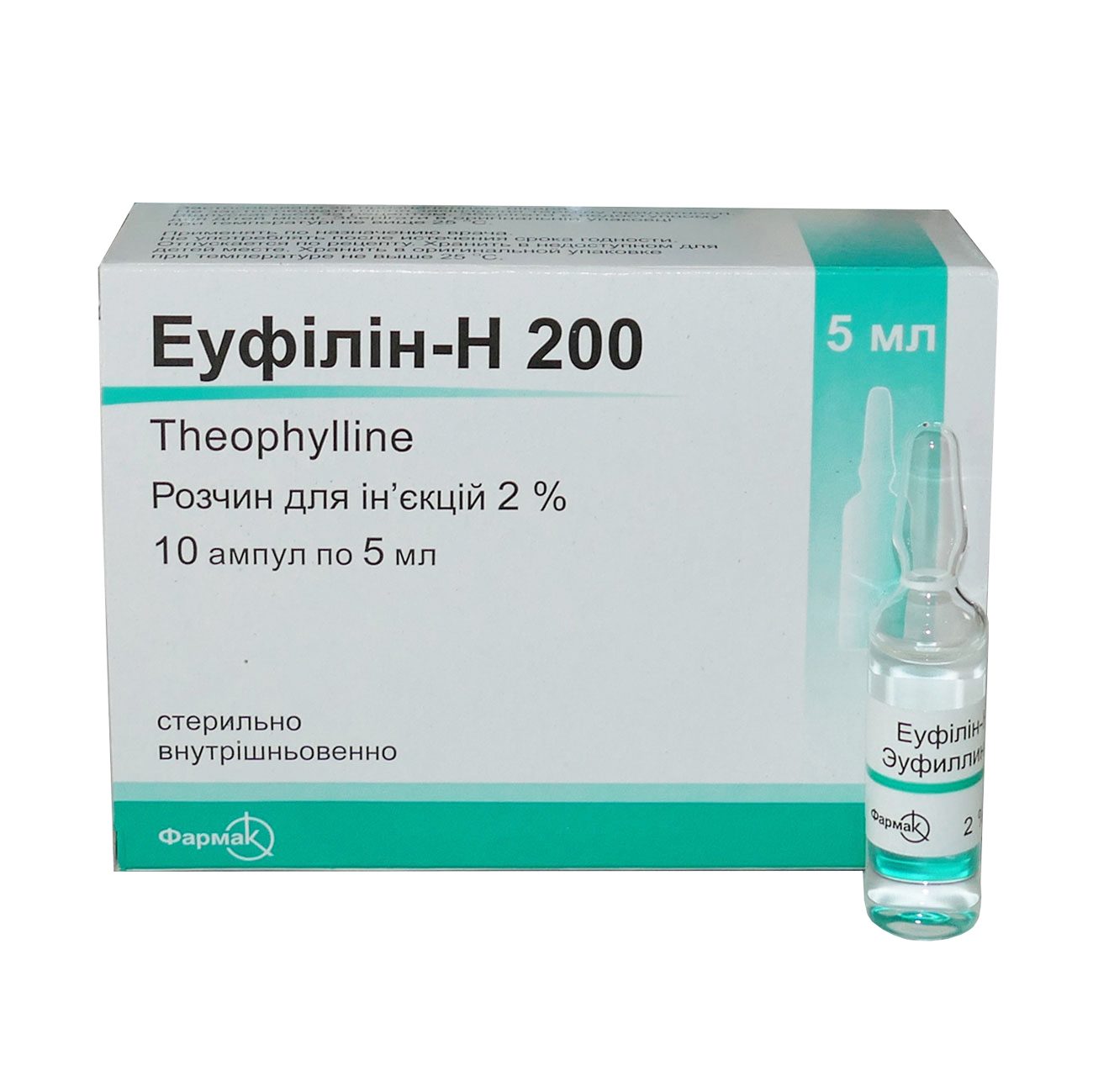 В имеющихся стандартах нередко терапию рекомендуют проводить устаревшими и утратившими свою клиническую значимость малоэффективными лекарственными средствами. Помимо этого, отсутствие единого подхода к ведению больных БА на догоспитальном этапе снижает качество медицинской помощи и создает дополнительные предпосылки для дальнейшего роста этого заболевания.
В имеющихся стандартах нередко терапию рекомендуют проводить устаревшими и утратившими свою клиническую значимость малоэффективными лекарственными средствами. Помимо этого, отсутствие единого подхода к ведению больных БА на догоспитальном этапе снижает качество медицинской помощи и создает дополнительные предпосылки для дальнейшего роста этого заболевания. Так, в 1998 г. по поводу обострений бронхиальной астмы, бригадами ССиНМП города Москвы осуществлено 56154 вызовов, а в 1999 году уже 57626 вызовов. Число госпитализированных больных составило 7639 и 8475 человек соответственно. Эти данные наглядно иллюстрируют важность своевременной и качественной помощи больным на догоспитальном этапе.
В соответствии с Глобальной стратегией по профилактике и лечению БА (ВОЗ, 1996), и накопленным опытом по догоспитальной помощи больным БА, эффективно применение только следующих групп лекарственных средств: селективные бета-2-агонисты адренорецепторов короткого действия, холинолитические средства, метилксантины и глюкокортикоиды (ГКС).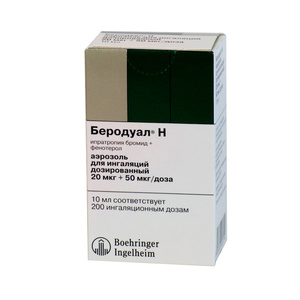 На практике же арсенал препаратов включает еще ряд наименований. Выборочный анализ 120 карт вызовов бригад скорой помощи показал, что при обострении БА в 36,7% используется коргликон, в13,3% — димедрол, супрастин в 9,4%, но-шпа в 15,6%, лазикс в 1,1%, атропин в 3,1%, реланиум в 4,7% и др.
На практике же арсенал препаратов включает еще ряд наименований. Выборочный анализ 120 карт вызовов бригад скорой помощи показал, что при обострении БА в 36,7% используется коргликон, в13,3% — димедрол, супрастин в 9,4%, но-шпа в 15,6%, лазикс в 1,1%, атропин в 3,1%, реланиум в 4,7% и др.
Так, психотропные и наркотические анальгетики могут угнетать дыхательный центр, анальгетики и атропин — усугублять бронхообструкцию. Помимо этого нередко в практике догоспитальной помощи используются нерациональные комбинации лекарственных средств. Так, применение эуфиллина после адекватной ингаляционной терапии бета-2-агонистами является ошибочным, так как при этом повышается риск развития побочных эффектов эуфиллина (тахикардия, аритмия) и уменьшается польза от его введения.
Известны случаи передозировки эуфиллина, когда он используется повторно, у лиц, получающих пролонгированные теофиллины. Часто используемая врачами скорой помощи комбинация эуфиллина и сердечных гликозидов так же не желательна в связи с повышенной в условиях гипоксемии чувствительностью миокарда к гликозидам и увеличением риска в этом случае развития дигиталисных аритмий, в том числе и желудочковых.
Кроме того, известно, что отсутствует связь между дозой сердечных гликозидов и их влиянием на активность синусового узла, поэтому их действие на ЧСС при синусовом ритме непредсказуемо. Из-за преувеличенного страха перед использованием гормональных средств последние нередко назначаются поздно или в неадекватной дозе. Наконец, широкое использование адреналина, показанного для экстренного лечения анафилаксии или ангионевротического отека, при БА сопряжено с риском развития серьезных побочных эффектов.
В последние годы интерес врачей вызывает так называемая небулайзерная терапия, в основе которой лежит введение препаратов, в частности бета-2-агонистов, в аэрозольной форме непосредственно в бронхи с целью получения эффекта через короткий период времени (5-10 минут). В качестве лекарственных форм применяются растворы беродуала во флаконах по 20 мл и вентолина в небулах по 2, 5 мл. Небулайзер — устройство по преобразованию жидкости в аэрозоль под действие сжатого воздуха (струйные) или под воздействием ультразвуковых волн (ультразвуковые).
Небулайзерная терапия применяется при недостаточном эффекте или невозможности использования ингаляторов и при необходимости целенаправленной и быстрой доставки высоких доз лекарственных веществ. Учитывается при этом и желание больного и преимущества ингаляционного введения препаратов перед их внутривенным применением.
Среди достоинств небулайзерной терапии можно выделить также отсутствие необходимости координации дыхания больного с поступлением аэрозоля, возможность безопасного использования высоких доз препарата, отсутствие фреона, портативность и удобство применения, возможность подключения к аппарату ИВЛ при тяжелом течении заболевания.
В то же время применение небулайзерной терапии ограничено наличием источника электроэнергии и стоимостью самого прибора и лекарственных средств. Среди небулайзеров наибольшее распространение получили компрессорные приборы «Pari boy» (фирма «Kraft медицинские системы»), «Omron» (фирма «Комплект-Сервис») и «Бореал» (фирма «ИнтерЭтон») обеспечивающие высокий выход ингалируемого вещества под воздействием сжатого воздуха через компрессор и позволяющие использовать кроме бета-2-агонистов и холинолитиков глюкокортикоиды и отхаркивающие вещества.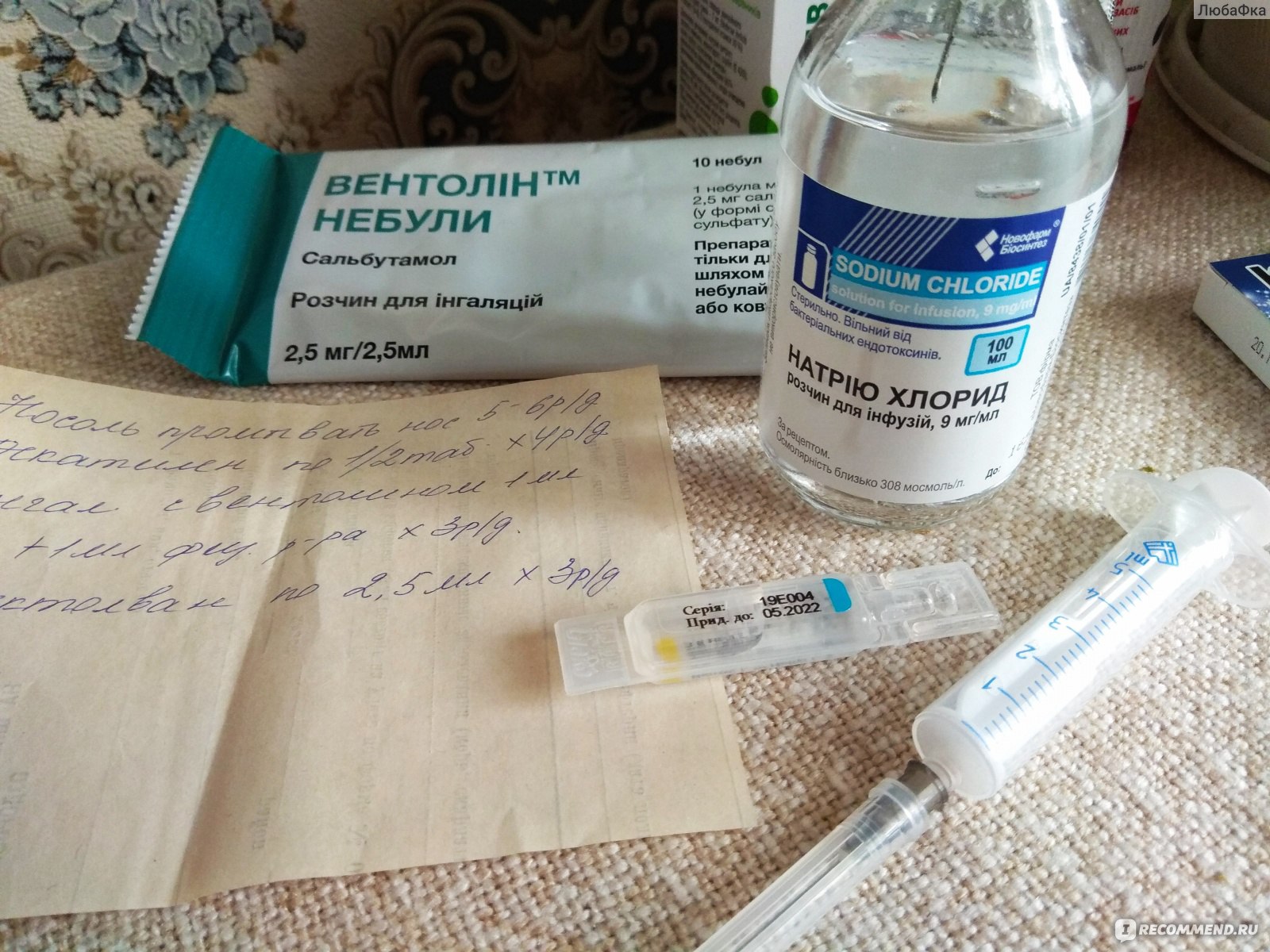
С 2000 года на 5 подстанциях ССиНМП города Москвы был начат проект, задачами которого явились обучение врачей современным принципам ведения больных БА, включая небулайзерную терапию, целенаправленная госпитализация в стационары имеющие образовательные центры для больных БА, информирование больных о работе образовательных центров через бригады ССиНМП г. Москвы.
Подстанции были оснащены 14-ю небулайзерами «Pari boy», 10-ю небулайзерами Бореал, 15-ю небулайзерами «Omron» и 39-мя пикфлоуметрами для оценки эффективности лечения.
За период с 15.03. по 17.04. 2000 г. среди 277 больных, обратившихся на ССиНМП по поводу обострения БА, 149 человек получили небулайзерную терапию (1 группа). Среди них 60 мужчин и 89 женщин (средний возраст 59,7 лет). Из них у 10 — сахарный диабет, у 19 — ИБС, 28 человек не имели сопутствующей патологии, у 78 — артериальная гипертезия, у 98 выявлен хронический бронхит. Обострение легкой степени диагностировано у 72, средней степени — у 45, тяжелой — у 31 и угроза остановки дыхания — у 1 больного соответственно.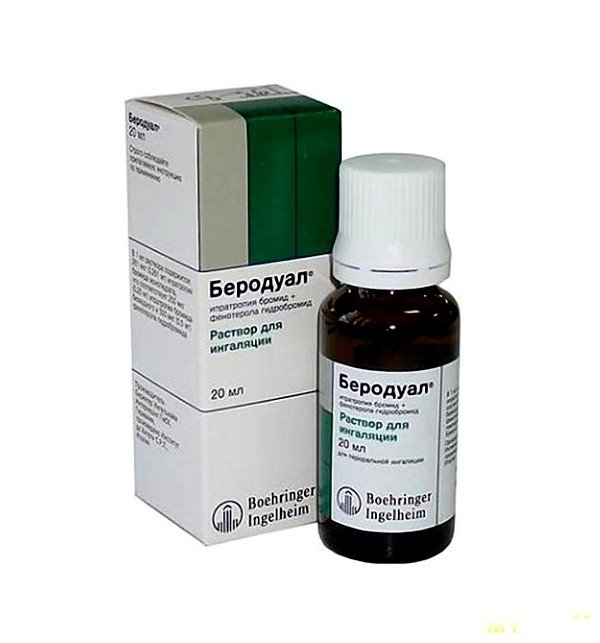
Вторую группу (контрольную) составили 128 человек (49 мужчин, 79 женщин, средний возраст 59,4 года). Сопутствующая патология была представлена хроническим бронхитом у 80, артериальной гипертензией у 67, ИБС у 15 и сахарным диабетом у 4. Сопутствующую патологию не имели 49 человек. Легкая степень обострения диагностирована у 51, средняя — у 36, тяжелая — у 38 и угроза остановки дыхания отмечена у 3 больных соответственно.
В первой группе из предшествующей терапии ГКС получали 57 человек (ингаляционные -31, пероральные — 26), пролонгированные теофиллины -57, бета2-агонисты 83 (вентолин — 37, беротек -46), холинолитики — 19, беродуал — 18. Вообще не лечились 45 человек. В контрольной группе ранее получали ГКС 40 человек (ингаляционные — 23, пероральные — 17), пролонгированные теофиллины — 35, бета2-агонисты — 67 (вентолин -29, беротек -38), холинолитики -12, беродуал -26 больных и не лечились вообще — 32 человека.
В 1 группе при обострении БА легкой степени вводился сальбутамол (вентолин фирмы «Глаксо Вэллком») 2,5 мг (1 небула) через небулайзер в течение 5-10 минут или фенотерол плюс ипратропиум бромид (беродуал фирмы «Берингер Ингельхайм») в количестве 0,5 мл (10 капель) также через небулайзер в течение 5-10 минут.
При обострении среднетяжелой степени применялся вентолин 2,5-5 г (1-2 небулы) через небулайзер или беродуал 0,5-1,5 мл (10-30 капель) и/или эуфиллин 2,4% 10,0 мл в/в медленно и преднизолон 60 мг (или метилпреднизолон 40 мг). При обострении тяжелой степени использовался вентолин 5 мг через небулайзер или беродуал 1-3 мл и/или в/в введение эуфиллина 2,4% 10,0-20,0 и преднизолон в/в 90-150 мг (или метипреднизолон 80-120 мг.). При угрозе остановки дыхания вводился вентолин 5 мг или 1-3 мл беродуала и/или 10-20 мл 2,4% эуфиллина и преднизолон 90-150 мг или метилпреднизолон 80-120 мг. Эффект терапии оценивался через 20 минут. При неудовлетворительном результате повторялась аналогичная ингаляция бронхолитиков. Критериями эффективности лечения служили клинические симптомы (речь: словами, фразами, свободно), одышка, возбуждение, наличие хрипов, ЧДД, ЧСС, АД и инструментальные — пикфлоуметрия (рост ПСВ > 15%).
При купировании приступа больные оставлялись дома, при сохранении бронхоспазма — госпитализировались в стационар.
В результате проводимой небулайзерной терапии приступ удушья был купирован у 142 человек, в том числе (127 (85,5%) в первые 10 минут при введении однократной дозы, и 15 (10%) при повторной ингаляции в последующие 10 минут. У 7 (4.5%) человек приступ купирован не был. Госпитализировано 20 человек (13,7%), из них из-за неэффективности небулайзерной терапии 6 (4,2%) и в связи с сопутствующей патологией, тяжелой степенью обострения БА, угрозой остановки дыхания -14 (9,4%). 7 пациентов отказались от применения небулайзера. Побочных эффектов отмечено не было. В 4 случаях (2,7%) пациенты повторно вызывали бригаду скорой помощи.
В клинической картине была отмечена следующая динамика: количество хрипов над легкими уменьшилось примерно в три раза за тридцать минут; ПСВ, измеряемая до и после ингаляции достоверно увеличилась (более 15%). Причиной неэффективности небулайзерной терапии у 7 человек послужило, вероятно, отсутствие предшествующей адекватной противовоспалительной терапии или вообще какого-либо лечения.
Во II группе приступ удушья купирован в 88 случаях (68,7%). У 40 человек (31,3%) — не было достигнуто положительного эффекта. Госпитализировано 61 (40,7%) человек, из них 47 (31,5%) с неэффективностью догоспитального лечения и 14 (9,2%), входящих в группу риска смерти БА. Было осуществлено 4 (3%) повторных вызова и в 1 случае (3.0%) наблюдались побочные эффекты (тахикардия и желудочковая экстрасистолия).
Таким образом можно констатировать, что небулайзерная терапия на догоспитальном этапе оказалась эффективнее, чем традиционная терапия у больных бронхиальной астмой.
Аминофиллин — обзор | ScienceDirect Topics
Лекарственные взаимодействия
См. Также Атракуриум дибесилат, теофиллин и родственные соединения
Аминофиллин
Аминофиллин способствует нервно-мышечной передаче, возможно, за счет увеличения высвобождения нейромышечных клеток через ингибирование нейротрансмиттеров за счет повышения концентрации циклического АМФ через соединение клеточного АМФ. 39]. Этим можно объяснить антагонизм блокады, вызванной панкуронием, о которой сообщалось в присутствии очень высоких концентраций теофиллина в сыворотке [40].
39]. Этим можно объяснить антагонизм блокады, вызванной панкуронием, о которой сообщалось в присутствии очень высоких концентраций теофиллина в сыворотке [40].
Анестетики общего назначения
Анестезия галотаном увеличивает риск тахидисритмий при применении панкурония [41]. Панкуроний снижает ПДК для галотана на 25% [42], хотя это оспаривается [43].
Противоэпилептические препараты
Долгосрочное использование фенитоина было связано с повышением потребности в панкуронии во время нейрохирургических операций [44], хотя обратного эффекта можно было ожидать от хининоподобной мембраностабилизирующей активности фенитоина.
Азатиоприн
Азатиоприн снижает чувствительность к панкуронию у экспериментальных животных, возможно, в результате ингибирования фосфодиэстеразы, увеличивая высвобождение медиатора [45].
Карбамазепин
Устойчивость к панкуронию со значительным сокращением времени восстановления наблюдалась у пациентов, длительно принимавших карбамазепин [46]; наблюдалась обратная корреляция между суточной дозой и временем восстановления.
Циклоспорин
Циклоспорин может вызывать значительное продление нервно-мышечного паралича, вызванного панкуронием [47], у одного пациента (а также у другого, получавшего векуроний).Для реверсии потребовались и неостигмин, и эдрофоний. Впоследствии произошла рекураризация. Содействующими факторами могли быть растворитель Cremophor EL в составе циклоспорина (Sandimmun) и незначительная почечная дисфункция.
Кортикостероиды — глюкокортикоиды
Сообщалось о том, что кортикостероиды противодействуют нервно-мышечной блокаде, вызванной панкуронием [48,49]. Исследования in vitro на крысах показали прямое облегчающее действие преднизолона на нервно-мышечную передачу [50], так что можно было бы ожидать некоторого антагонизма недеполяризующих релаксантов в целом.
Фуросемид
Фуросемид (1 мг / кг) сокращал время восстановления после блокады панкурония у нейрохирургических пациентов с нормальной функцией почек [51]. В качестве возможных объяснений были предложены ингибирование фосфодиэстеразы и повышенная экскреция панкурония.
Литий
Сообщалось о длительной нервно-мышечной блокаде у пациентов, длительно принимавших литий на фоне панкурония [52]. В экспериментах на животных литий продлевал нервно-мышечный блок из-за панкурония, суксаметония и декаметония, но не из-за d-тубокурарина и галламина [53]; с другой стороны, сообщалось, что литий не оказывает или минимально влияет на блокаду, производимую панкуронием или d-тубокурарином [54].Механизм этого взаимодействия неизвестен, хотя возможные механизмы обсуждались [53]. Рекомендуются осторожность и контроль.
Нитраты, органические
Эксперименты на кошках продемонстрировали значительное продление и усиление нервно-мышечной блокады, вызванной панкуронием во время инфузии тринитрата глицерина (1 мг / кг / мин), начатой до введения миорелаксанта. При использовании суксаметония, d-тубокурарина или галламина вместо панкурония пролонгирования не наблюдалось.Реверсия панкурониевого блока неостигмином не изменилась, и плазменный клиренс панкурония не изменился в течение 2 часов после инъекции [55,56]. Причина этого явления и его применимость к людям еще предстоит выяснить. Однако более поздние эксперименты (также на кошках) с использованием только умеренных доз панкурония (и векурония) не смогли вызвать какого-либо потенцирования тринитратом глицерина [57].
Причина этого явления и его применимость к людям еще предстоит выяснить. Однако более поздние эксперименты (также на кошках) с использованием только умеренных доз панкурония (и векурония) не смогли вызвать какого-либо потенцирования тринитратом глицерина [57].
Трициклические антидепрессанты
Сообщалось о применении галотана и панкурония у пациентов, принимающих трициклические антидепрессанты, как приводящих к тяжелым тахидисритмиям.Эксперименты на собаках показали, что эта комбинация может вызывать фибрилляцию желудочков и остановку сердца [58]. Энфлуран также приводил к тахикардии у собак, получавших как имипрамин, так и панкуроний остро, но не тогда, когда имипрамин давался хронически в течение 15 дней до этого. Панкуроний не следует применять пациентам, принимающим трициклические антидепрессанты.
Аминофиллин: показания, побочные эффекты, предупреждения
- Лекарства от A до Z
- Аминофиллин
- Информация о лекарствах для потребителей
Общее название: Аминофиллин (я в OFF i lin)
Медицинское заключение компании Drugs. com. Последнее обновление: 23 января 2021 г.
com. Последнее обновление: 23 января 2021 г.
Использование аминофиллина:
- Применяется для лечения проблем с дыханием.
Что мне нужно сказать своему врачу, прежде чем я приму аминофиллин?
- Если у вас аллергия на аминофиллин или любой другой компонент аминофиллина.
- Если у вас аллергия на аминофиллин; любая часть аминофиллина; или любые другие лекарства, продукты питания или вещества. Расскажите своему врачу об аллергии и какие у вас были признаки.
Это лекарство может взаимодействовать с другими лекарствами или проблемами со здоровьем.
Расскажите своему врачу и фармацевту обо всех своих лекарствах (рецептурных или безрецептурных, натуральных продуктах, витаминах) и проблемах со здоровьем. Вы должны проверить
чтобы убедиться, что вы можете безопасно принимать аминофиллин со всеми лекарствами и при проблемах со здоровьем. Не начинать, не останавливать и не изменять дозу
любой препарат без консультации с врачом.
Не начинать, не останавливать и не изменять дозу
любой препарат без консультации с врачом.
Что мне нужно знать или делать, пока я принимаю аминофиллин?
- Сообщите всем своим поставщикам медицинских услуг, что вы принимаете аминофиллин.Сюда входят ваши врачи, медсестры, фармацевты и стоматологи.
- Это лекарство может повлиять на некоторые лабораторные тесты. Сообщите всем своим врачам и сотрудникам лабораторий, что вы принимаете аминофиллин.
- Сдайте анализ крови в соответствии с указаниями врача. Поговорите с доктором.
- Если у вас повышенный уровень сахара в крови (диабет), вам необходимо внимательно следить за уровнем сахара в крови.
- Ограничьте употребление кофеина (например, чая, кофе, колы) и шоколада.Использование с аминофиллином может вызвать нервозность, дрожь и голодание. стук сердца.
- Проконсультируйтесь с врачом, прежде чем употреблять алкоголь.

- Если вы начали или бросили курить табак или марихуану, поговорите со своим врачом. Может потребоваться изменить дозировку лекарства.
- Если вы заболели, у вас поднялась температура или у вас хроническое заболевание, которое ухудшается, поговорите со своим врачом.
- Сообщите своему врачу, если другой врач даст вам новое лекарство или скажет вам прекратить прием лекарства, которое вы использовали.
- Если вам 60 лет и старше, используйте аминофиллин с осторожностью. У вас может быть больше побочных эффектов.
- С осторожностью применять у детей. Поговорите с доктором.
- Сообщите своему врачу, если вы беременны, планируете беременность или кормите грудью. Вам нужно будет рассказать о преимуществах и рисках тебе и ребенку.
Как лучше всего принимать это лекарство (аминофиллин)?
Используйте аминофиллин по назначению врача. Прочтите всю предоставленную вам информацию. Внимательно следуйте всем инструкциям.
Прочтите всю предоставленную вам информацию. Внимательно следуйте всем инструкциям.
- Его вводят в вену в течение определенного периода времени.
Что мне делать, если я пропустил дозу?
- Позвоните своему врачу, чтобы узнать, что делать.
По поводу каких побочных эффектов мне нужно немедленно позвонить своему врачу?
ПРЕДУПРЕЖДЕНИЕ / ВНИМАНИЕ: хотя это может быть редким явлением, у некоторых людей могут возникать очень тяжелые, а иногда и смертельные побочные эффекты при приеме лекарства.Сказать твоему Если у вас есть какие-либо из следующих признаков или симптомов, которые могут быть связаны с очень серьезным побочным эффектом, немедленно обратитесь за медицинской помощью:
- Признаки аллергической реакции в виде сыпи; крапивница; зуд; красная, опухшая, покрытая волдырями или шелушащаяся кожа с лихорадкой или без нее; хрипы;
стеснение в груди или горле; затрудненное дыхание, глотание или разговор; необычная охриплость; или отек рта, лица, губ, языка,
или горло.

- Признаки низкого уровня калия, такие как мышечная боль или слабость, мышечные спазмы или ненормальное сердцебиение.
- Признаки высокого уровня сахара в крови, такие как спутанность сознания, чувство сонливости, усиление жажды, усиление голода, более частое мочеиспускание, приливы крови, учащенное дыхание или дыхание, пахнущее фруктами.
- Мышечная боль или слабость.
- Учащенное сердцебиение.
- Ненормальное сердцебиение.
- Учащенное дыхание.
- Очень сильное головокружение или обморок.
- Расстройство желудка или рвота.
- Чувство раздражительности.
- Чувствую себя сбитым с толку.
- Изъятия.
- Шаткость.
Какие еще побочные эффекты у аминофиллина?
Все препараты могут вызывать побочные эффекты. Однако у многих людей побочные эффекты отсутствуют или наблюдаются лишь незначительные побочные эффекты. Позвоните своему врачу или обратитесь за медицинской помощью
помочь, если какие-либо из этих побочных эффектов или любые другие побочные эффекты беспокоят вас или не проходят:
Однако у многих людей побочные эффекты отсутствуют или наблюдаются лишь незначительные побочные эффекты. Позвоните своему врачу или обратитесь за медицинской помощью
помочь, если какие-либо из этих побочных эффектов или любые другие побочные эффекты беспокоят вас или не проходят:
- Чувство нервозности и возбудимости.
- Беспокойство.
- Головная боль.
- Проблемы со сном.
- Боль в желудке или диарея.
- Более частое мочеиспускание.
Это не все возможные побочные эффекты. Если у вас есть вопросы о побочных эффектах, позвоните своему врачу. Позвоните своему врачу за медицинской помощью совет о побочных эффектах.
Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-332-1088.Вы также можете сообщить о побочных эффектах на https://www.fda.gov/medwatch.
Если есть подозрение на ПЕРЕДОЗИРОВКУ:
Если вы подозреваете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью. Будьте готовы рассказать или показать, что было
взяли, сколько и когда это произошло.
Будьте готовы рассказать или показать, что было
взяли, сколько и когда это произошло.
Как хранить и / или выбрасывать аминофиллин?
- Если вам необходимо хранить аминофиллин дома, поговорите со своим врачом, медсестрой или фармацевтом о том, как его хранить.
Использование информации для потребителей
- Если ваши симптомы или проблемы со здоровьем не улучшаются или ухудшаются, позвоните своему врачу.
- Не делитесь своими лекарствами с другими и не принимайте чужие лекарства.
- Храните все лекарства в надежном месте. Храните все лекарства в недоступном для детей и домашних животных месте.
- Выбросьте неиспользованные или просроченные лекарства. Не сливайте воду в унитазе или в канализацию, если вам не сказали об этом.Свяжитесь со своим
фармацевт, если у вас есть вопросы о том, как лучше всего выбросить лекарства. В вашем районе могут быть программы возврата наркотиков.

- Для некоторых препаратов может быть еще одна информационная брошюра для пациента. Проконсультируйтесь с фармацевтом. Если у вас есть вопросы по аминофиллину, обращайтесь с вашим врачом, медсестрой, фармацевтом или другим поставщиком медицинских услуг.
- Если вы считаете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью.Будьте готовы рассказать или показать, что было взяли, сколько и когда это произошло.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Подробнее об аминофиллине
Потребительские ресурсы
Другие бренды: Phyllocontin
Профессиональные ресурсы
Сопутствующие лечебные руководства
Лечение острых тяжелых приступов астмы у детей: с помощью аминофиллина
Введение
Ребенок с острым приступом астмы — хорошо известная клиническая картина среди врачей неотложной помощи. У тех детей, которые не реагируют должным образом на лечение первой линии ингаляционными бронходилататорами и пероральными стероидами, обычно начинают внутривенную бронхолитическую терапию второй линии. В клиническом опыте авторов есть крайние взгляды на один из i.v. препаратов выбора: аминофиллин. Доказательная база слабая, и решение о том, какое лекарство использовать, часто просто основывается на личном выборе клинициста, а также на местной принятой практике и рекомендациях. Когда предлагается аминофиллин, выражаются полярные взгляды: «это опасно и небезопасно»; «Это дьявольский яд»; и «его следует убрать с полок отделения неотложной помощи».Другие врачи считают, что это единственное полезное средство i.v. лечение тяжелых острых приступов. Этот обзор направлен на рассмотрение использования аминофиллина при лечении тяжелых приступов астмы у детей.
У тех детей, которые не реагируют должным образом на лечение первой линии ингаляционными бронходилататорами и пероральными стероидами, обычно начинают внутривенную бронхолитическую терапию второй линии. В клиническом опыте авторов есть крайние взгляды на один из i.v. препаратов выбора: аминофиллин. Доказательная база слабая, и решение о том, какое лекарство использовать, часто просто основывается на личном выборе клинициста, а также на местной принятой практике и рекомендациях. Когда предлагается аминофиллин, выражаются полярные взгляды: «это опасно и небезопасно»; «Это дьявольский яд»; и «его следует убрать с полок отделения неотложной помощи».Другие врачи считают, что это единственное полезное средство i.v. лечение тяжелых острых приступов. Этот обзор направлен на рассмотрение использования аминофиллина при лечении тяжелых приступов астмы у детей.
Лечение острых приступов астмы у детей
Астма — одна из наиболее часто встречающихся проблем в клинической практике [1, 2]. Терапия первой линии при приступах астмы у детей во всем мире одинакова с использованием ингаляционных β 2 -агонистов, высокопоточного кислорода и пероральных стероидов.Политика управления вторым уровнем различается в зависимости от географического положения [1–6]. В исследовании, посвященном лечению острых приступов в Великобритании и Ирландии, аминофиллин использовался в 47,3% случаев, сульфат магния — в 60,9% и сальбутамол — в 55,5% [7, 8].
Терапия первой линии при приступах астмы у детей во всем мире одинакова с использованием ингаляционных β 2 -агонистов, высокопоточного кислорода и пероральных стероидов.Политика управления вторым уровнем различается в зависимости от географического положения [1–6]. В исследовании, посвященном лечению острых приступов в Великобритании и Ирландии, аминофиллин использовался в 47,3% случаев, сульфат магния — в 60,9% и сальбутамол — в 55,5% [7, 8].
Британское торакальное общество (BTS) рекомендует нагрузочную дозу аминофиллина 5 мг · кг -1 с последующей инфузией [2]. Глобальная инициатива по астме (GINA) и Национальный институт здоровья США (NIH) вообще не рекомендуют его использование, заявляя, что его не следует использовать из-за низкой эффективности и профиля безопасности с потенциально смертельными побочными эффектами [3, 4].Ранее исследование, проведенное в Австралии, показало, что аминофиллин с нагрузочной дозой 10 мг · кг -1 по сравнению с плацебо и стандартным лечением, показал значительное улучшение физиологического восстановления и снижение частоты интубации, несмотря на побочные эффекты, такие как тошнота и рвота [9 , 10]. Впоследствии аминофиллин рекомендован в нагрузочной дозе 10 мг · кг -1 в некоторых детских больницах Австралии и Новой Зеландии [11, 12]. Несомненно, следует учитывать побочные эффекты аминофиллина, но означает ли это, что его использование следует полностью прекратить?
Впоследствии аминофиллин рекомендован в нагрузочной дозе 10 мг · кг -1 в некоторых детских больницах Австралии и Новой Зеландии [11, 12]. Несомненно, следует учитывать побочные эффекты аминофиллина, но означает ли это, что его использование следует полностью прекратить?
Фармакологическое действие теофиллинов
Аминофиллин — это метилксантиновый бронходилататор, состоящий из теофиллина и этилендиамина.Теофиллин расслабляет гладкую мускулатуру бронхиальных дыхательных путей и легочных кровеносных сосудов, а также снижает чувствительность дыхательных путей к гистамину, метахолину, аденозину и другим химическим медиаторам. Они также конкурентно разлагают фосфодиэстеразу типа III и IV. Это ферменты, ответственные за деградацию цАМФ в гладкомышечных клетках, что приводит к бронходилатации. Они также могут блокировать аденозиновые рецепторы, вызывая тем самым бронходилататорное адренергическое действие, и есть предположение о противовоспалительном действии за счет уменьшения количества эозинофилов и нейтрофилов [13]. Аминофиллин имеет узкий терапевтический диапазон, поэтому необходимо учитывать токсичность и побочные эффекты [10].
Аминофиллин имеет узкий терапевтический диапазон, поэтому необходимо учитывать токсичность и побочные эффекты [10].
Что говорит нам история?
Конечно, как и все другие лекарства, теофиллины токсичны при введении в определенных дозах как детям, так и взрослым. Одно из первых сообщений об опасности теофиллинов было опубликовано в 1957 г. [14]. 3-летний ребенок с острой астмой умер после ректального введения дозы 32 мг · кг -1 эуфиллина три раза в сутки.Затем они продолжили обследование 35 детей в своем учреждении, у которых была токсичность, и сообщили о семи (20%) случаях смерти, 14 (40%) случаях судорог и 33 (95%) случаях рвоты. Дозы, использованные у 35 детей, варьировались от 9 до 62 мг · кг -1 , повторяемые каждые 3–12 часов. Это были огромные дозы по сравнению с текущими рекомендованными руководствами. Интересно, что они пришли к выводу, что терапевтическая доза для детей не была определена. Тем не менее, исходя из клинического опыта автора, безопасные, но эффективные индивидуальные дозы варьируются от 3 мг · кг -1 внутривенно до 7 мг · кг -1 ректально, с интервалом от 6 до 12 часов. Наконец, они пришли к выводу, что «цель статьи не в том, чтобы осудить использование аминофиллина у детей, а в том, чтобы посоветовать осторожность при выборе дозы, привлечь внимание к ранним симптомам токсичности и призвать исключить из употребления такие лекарства. доступность для детей раннего возраста ”. Это по-прежнему так и должно быть основным выводом данной статьи [15, 16].
Наконец, они пришли к выводу, что «цель статьи не в том, чтобы осудить использование аминофиллина у детей, а в том, чтобы посоветовать осторожность при выборе дозы, привлечь внимание к ранним симптомам токсичности и призвать исключить из употребления такие лекарства. доступность для детей раннего возраста ”. Это по-прежнему так и должно быть основным выводом данной статьи [15, 16].
Работает ли аминофиллин у детей?
Эффективность аминофиллина зависит от дозировки и токсичности.В литературе для взрослых в Кокрановском обзоре 2012 г. рекомендуется не рассматривать аминофиллин для лечения острой астмы из-за серьезных побочных эффектов и ограниченной эффективности [17]. Итак, что говорит нам литература о рекомендуемых дозировках, эффективности и безопасности аминофиллина при острой детской астме?
Методология
Мы провели поиск литературы в основных базах данных, таких как MEDLINE, EMBASE, CINAHL, Web of Science и Кокрановский центральный регистр контролируемых исследований (CENTRAL), с момента создания баз данных до сентября 2020 года. Основными используемыми поисковыми понятиями были «астма», «обострение», «ребенок» и «аминофиллин». Это повествовательный обзор, основанный на 13 недавних статьях (таблица 1) [5, 7, 8, 10, 13, 18–25].
Основными используемыми поисковыми понятиями были «астма», «обострение», «ребенок» и «аминофиллин». Это повествовательный обзор, основанный на 13 недавних статьях (таблица 1) [5, 7, 8, 10, 13, 18–25].
Исследования за последние 5 лет, посвященные использованию аминофиллина у детей с острой тяжелой астмой
Результаты
Безопасен ли аминопиллин?
Самый последний систематический обзор Махемути и др. . [18] изучили комбинированные данные взрослых и детей из 52 групп исследования в 42 отдельных исследованиях.Во всех этих группах исследований 29 сравнивали эуфиллин с активным контролем (таким как адреналин, агонисты β2 и антагонисты лейкотриена), в то время как 23 исследования сравнивали его с плацебо. Хотя они не сделали конкретных комментариев по поводу качества доказательств, очень немногие из этих исследований имели высокий риск систематической ошибки, и не было доказательств систематической ошибки публикации. Они пришли к выводу, что аминофиллин имел аналогичную эффективность и частоту побочных эффектов по сравнению с другими препаратами при применении с бронходилататорами; действительно, ни в одном из этих исследований не было зарегистрировано ни одного случая смерти [18]. Конечно, дьявол кроется в деталях. Тошнота и рвота были выше в группе аминофиллина по сравнению с плацебо (отношение шансов для тошноты 6,05 (95% ДИ 3,65–10,38) и для рвоты 5,35 (95% ДИ 3,14–9,12)). Другие отмеченные побочные эффекты включали сердцебиение, тахикардию и аритмию в группе аминофиллина (отношение шансов 3,52 (95% ДИ 1,66–7,49)), но об этом сообщалось только в исследованиях взрослых.
Конечно, дьявол кроется в деталях. Тошнота и рвота были выше в группе аминофиллина по сравнению с плацебо (отношение шансов для тошноты 6,05 (95% ДИ 3,65–10,38) и для рвоты 5,35 (95% ДИ 3,14–9,12)). Другие отмеченные побочные эффекты включали сердцебиение, тахикардию и аритмию в группе аминофиллина (отношение шансов 3,52 (95% ДИ 1,66–7,49)), но об этом сообщалось только в исследованиях взрослых.
В группах исследования, сравнивающих эуфиллин с другими активными препаратами, тошнота и рвота были более вероятными в группе аминофиллина.Однако не сообщалось о различиях в отношении психологических проблем, головных болей, болей в животе, сердечно-сосудистых заболеваний, судорог, повышения креатинфосфокиназы / креатинкиназы, гипергликемии и тремора. В целом, аминофиллин показал значительное снижение частоты сердечных сокращений (p = 0,01) и продолжительности пребывания в больнице (p = 0,002) по сравнению с активным контролем. В исследованиях взрослых в / в. β 2 -агонистов показали улучшенную функцию легких по сравнению с аминофиллином. Не было разницы в оценке симптомов, сатурации кислорода, использовании спасательных препаратов или частоте госпитализаций.Таким образом, общие данные свидетельствуют о том, что аминофиллин обладает такой же эффективностью, что и другие методы лечения. Они попытались провести анализ подгрупп на основе возраста, но единственным фактором, который они могли напрямую сравнить, было улучшение симптомов. Не было различий между взрослыми и педиатрическими исследованиями, в которых в обеих группах наблюдались улучшения симптомов по сравнению с активным контролем [18].
Не было разницы в оценке симптомов, сатурации кислорода, использовании спасательных препаратов или частоте госпитализаций.Таким образом, общие данные свидетельствуют о том, что аминофиллин обладает такой же эффективностью, что и другие методы лечения. Они попытались провести анализ подгрупп на основе возраста, но единственным фактором, который они могли напрямую сравнить, было улучшение симптомов. Не было различий между взрослыми и педиатрическими исследованиями, в которых в обеих группах наблюдались улучшения симптомов по сравнению с активным контролем [18].
Дозирование аминофиллина
Куни et al. [10] завершил полезный систематический обзор применения аминофиллина у детей с острой астмой.Этот обзор был посвящен 14 рандомизированным контролируемым исследованиям с участием детей, в которых основное внимание уделялось дозировке аминофиллина. Во-первых, ни в каких исследованиях не было зарегистрировано смертей. Они подчеркнули, что введение ударной дозы 7–10 мг · кг –1 связано с тошнотой и рвотой. При использовании более низких доз (5–6 мг · кг -1 ) это не связано с тошнотой и рвотой. Ни в одном исследовании не сравнивали побочные эффекты между β 2 -агонистами и аминофиллином. Время до исчезновения симптомов, по-видимому, не связано с величиной ударной дозы аминофиллина.Ни в одном из исследований не сообщалось о доказательствах, подтверждающих исследование 1998 года, которое показало, что использование аминофиллина по сравнению с плацебо снижает вероятность интубации и госпитализации в отделение интенсивной терапии [9]. Продолжительность пребывания была короче у детей, получавших аминофиллин (ударная доза 5 мг · кг -1 и инфузия 0,9 мг · кг -1 · ч -1 ) по сравнению с β 2 -агонистами. Тем не менее, когда были изучены другие исследования, не было различий в оценке астмы, времени до выписки и продолжительности пребывания.Их выводы заключались в том, что существует плохая связь между дозировкой и исходами, ориентированными на пациента [10].
При использовании более низких доз (5–6 мг · кг -1 ) это не связано с тошнотой и рвотой. Ни в одном исследовании не сравнивали побочные эффекты между β 2 -агонистами и аминофиллином. Время до исчезновения симптомов, по-видимому, не связано с величиной ударной дозы аминофиллина.Ни в одном из исследований не сообщалось о доказательствах, подтверждающих исследование 1998 года, которое показало, что использование аминофиллина по сравнению с плацебо снижает вероятность интубации и госпитализации в отделение интенсивной терапии [9]. Продолжительность пребывания была короче у детей, получавших аминофиллин (ударная доза 5 мг · кг -1 и инфузия 0,9 мг · кг -1 · ч -1 ) по сравнению с β 2 -агонистами. Тем не менее, когда были изучены другие исследования, не было различий в оценке астмы, времени до выписки и продолжительности пребывания.Их выводы заключались в том, что существует плохая связь между дозировкой и исходами, ориентированными на пациента [10].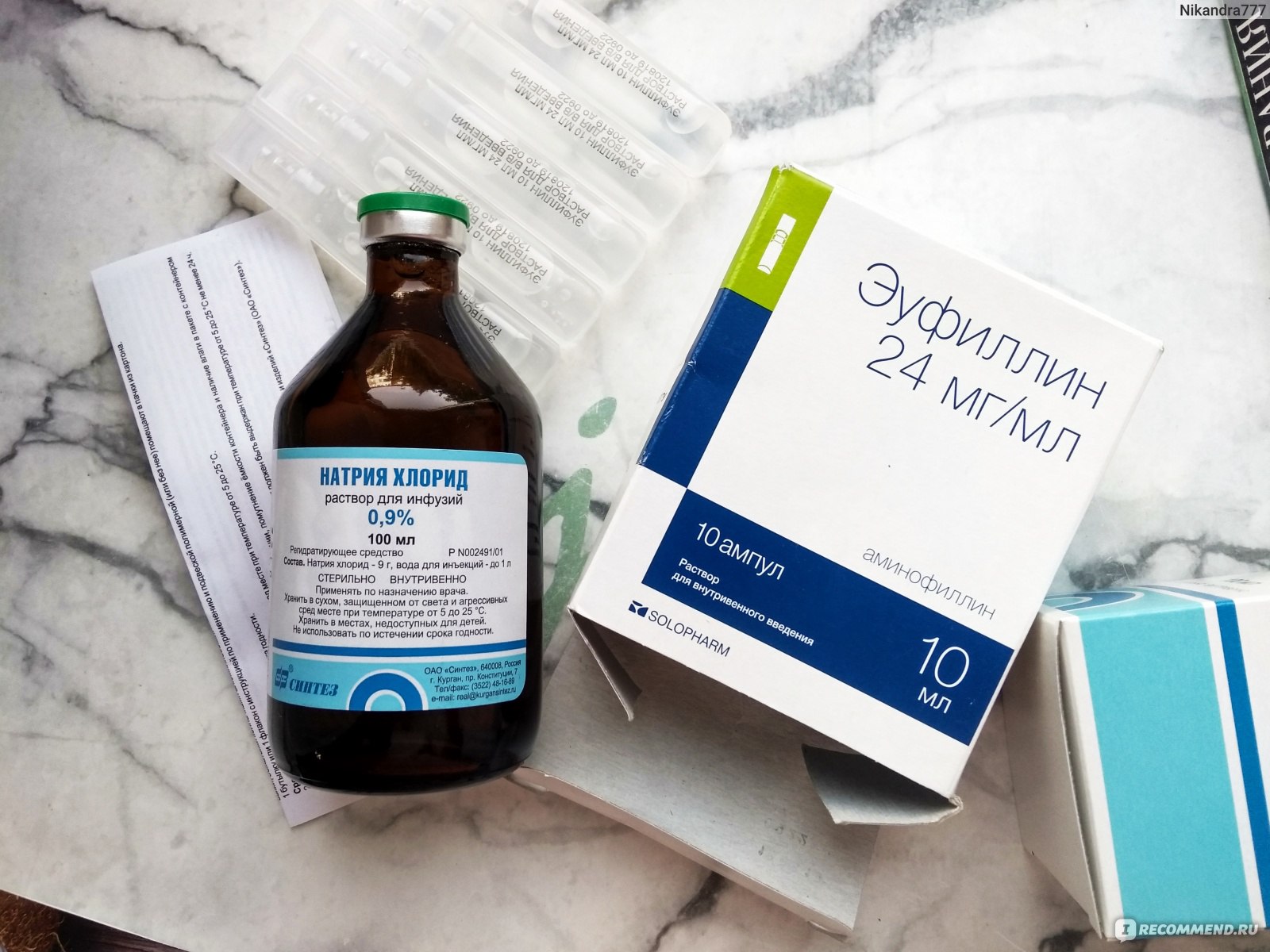 Эта группа продолжила изучение оптимальной детской дозы при острой астме. Они пришли к выводу, что ударная доза 5 мг · кг -1 не позволяет достичь терапевтического диапазона, которого врачи ожидают у большинства пациентов. Клинические доказательства того, что терапевтический диапазон 10–20 мг · л –1 связан с улучшенными клиническими исходами при тяжелых приступах астмы, ограничены [13].Чтобы ответить на эти вопросы, требуются дополнительные фармакокинетические исследования, прежде чем будут завершены более крупные многоцентровые исследования, сравнивающие эффективность четырех используемых в настоящее время в / в. бронходилататоров [19]. Таким образом, данных о наиболее эффективной дозировке аминофиллина для детей нет. Возможно, доза более 7 мг · кг -1 может увеличить частоту тошноты и рвоты, но не было доказательств того, что корректировка дозы с использованием уровней теофиллина увеличивает эффективность или безопасность i.v. аминофиллин [10, 13, 19].
Эта группа продолжила изучение оптимальной детской дозы при острой астме. Они пришли к выводу, что ударная доза 5 мг · кг -1 не позволяет достичь терапевтического диапазона, которого врачи ожидают у большинства пациентов. Клинические доказательства того, что терапевтический диапазон 10–20 мг · л –1 связан с улучшенными клиническими исходами при тяжелых приступах астмы, ограничены [13].Чтобы ответить на эти вопросы, требуются дополнительные фармакокинетические исследования, прежде чем будут завершены более крупные многоцентровые исследования, сравнивающие эффективность четырех используемых в настоящее время в / в. бронходилататоров [19]. Таким образом, данных о наиболее эффективной дозировке аминофиллина для детей нет. Возможно, доза более 7 мг · кг -1 может увеличить частоту тошноты и рвоты, но не было доказательств того, что корректировка дозы с использованием уровней теофиллина увеличивает эффективность или безопасность i.v. аминофиллин [10, 13, 19].
Нет недавних данных, подтверждающих, что использование аминофиллина опасно и небезопасно для детей; не было зарегистрировано случаев смерти в педиатрической популяции, связанной с использованием аминофиллина. В этих недавних исследованиях нет доказательств того, что существует повышенный риск судорог или аритмий в педиатрических исследованиях, в которых эуфиллин используется в допустимых дозах. Основной риск заключается в том, что при более высоких нагрузочных дозах (7–10 мг · кг -1 ) повышается риск тошноты и рвоты.
Интересно, что при более низких концентрациях в сыворотке эуфиллин может действовать как иммуномодулятор, оказывая ингибирующее действие на Т-лимфоциты в дыхательных путях пациентов с астмой, стимулируя апоптоз нейтрофилов и снижая экспрессию воспалительных генов. Также теофиллин может предотвращать подавление β-рецепторов β 2 -агонистами. Одним из основных противовоспалительных свойств аминофиллина является способность восстанавливать активность гистондеацетилазы-2, что приводит к усилению чувствительности к стероидам. Дизайн ретроспективного обсервационного исследования показал, что добавление низких доз теофиллина детям с тяжелыми приступами астмы может положительно повлиять на клинические параметры, сократить время пребывания в больнице и снизить общие расходы на здравоохранение. Это исследование показало, что низкие дозы теофиллина могут оказывать положительное влияние на острый астматический статус [20]. Целевой терапевтический диапазон для аминофиллина у детей обычно составляет 10–20 мг · л –1 . Целевой концентрации аминофиллина в сыворотке трудно достичь, так как это осложняется его высокими индивидуальными вариациями в скорости клиренса.Причины индивидуальных различий неизвестны, хотя было высказано предположение, что играют роль различные факторы, такие как возраст, вес и предыдущий уровень лекарственного средства в сыворотке. Текущая рекомендуемая доза составляет в / в. аминофиллин при обострениях астмы у детей может не служить примером оптимального безопасного и адекватного уровня препарата в сыворотке [10, 13, 15].
Дизайн ретроспективного обсервационного исследования показал, что добавление низких доз теофиллина детям с тяжелыми приступами астмы может положительно повлиять на клинические параметры, сократить время пребывания в больнице и снизить общие расходы на здравоохранение. Это исследование показало, что низкие дозы теофиллина могут оказывать положительное влияние на острый астматический статус [20]. Целевой терапевтический диапазон для аминофиллина у детей обычно составляет 10–20 мг · л –1 . Целевой концентрации аминофиллина в сыворотке трудно достичь, так как это осложняется его высокими индивидуальными вариациями в скорости клиренса.Причины индивидуальных различий неизвестны, хотя было высказано предположение, что играют роль различные факторы, такие как возраст, вес и предыдущий уровень лекарственного средства в сыворотке. Текущая рекомендуемая доза составляет в / в. аминофиллин при обострениях астмы у детей может не служить примером оптимального безопасного и адекватного уровня препарата в сыворотке [10, 13, 15]. Эффекты аминофиллина как бронходилататора сделали его основой терапии астмы в стационаре на протяжении десятилетий в некоторых центрах, и он по-прежнему остается основой для многих сегодня [9, 10].Однако, учитывая потенциальную токсичность и неясную клиническую эффективность, i.v. Состав аминофиллина потерял популярность с появлением селективных β-агонистов, и его использование в настоящее время не одобряется некоторыми рекомендациями по лечению астмы [3, 4].
Эффекты аминофиллина как бронходилататора сделали его основой терапии астмы в стационаре на протяжении десятилетий в некоторых центрах, и он по-прежнему остается основой для многих сегодня [9, 10].Однако, учитывая потенциальную токсичность и неясную клиническую эффективность, i.v. Состав аминофиллина потерял популярность с появлением селективных β-агонистов, и его использование в настоящее время не одобряется некоторыми рекомендациями по лечению астмы [3, 4].
Аминофиллин
по сравнению с плацебо Кокрановский обзор 2005 года показал, что у детей с острой тяжелой астмой, получавших аминофиллин, функция легких улучшилась по сравнению с группой плацебо [26]. Добавление аминофиллина к стероидам и β 2 -агонисту значительно улучшило объем форсированного выдоха за 1 с (FEV 1 )%, прогнозируемый по сравнению с плацебо через 6–8 часов, 12–18 часов и 24 часа; и аминофиллин привели к большему улучшению пикового потока выдоха, прогнозируемого в% по сравнению с плацебо, через 12-18 часов. Однако добавление аминофиллина не было связано со значительным сокращением количества применений небулайзерных бронходилататоров и продолжительности пребывания в больнице. В обзоре также упоминалось, что использование аминофиллина приводит к более высокому риску рвоты. Недостаточно доказательств для подтверждения применения аминофиллина у детей с тяжелыми острыми приступами астмы. Однако авторы призвали к проведению высококачественных испытаний для сравнения клинической эффективности аминофиллина с другими препаратами, учитывая многообещающие результаты более мелких испытаний [26].
Однако добавление аминофиллина не было связано со значительным сокращением количества применений небулайзерных бронходилататоров и продолжительности пребывания в больнице. В обзоре также упоминалось, что использование аминофиллина приводит к более высокому риску рвоты. Недостаточно доказательств для подтверждения применения аминофиллина у детей с тяжелыми острыми приступами астмы. Однако авторы призвали к проведению высококачественных испытаний для сравнения клинической эффективности аминофиллина с другими препаратами, учитывая многообещающие результаты более мелких испытаний [26].
Аминофиллин
по сравнению с β 2 -агонистовДругой Кокрановский обзор 2012 года, основанный на взрослых, не поддержал использование аминофиллина при острой астме [17]. Этот обзор показал, что нет существенного дополнительного расширения бронхов по сравнению со стандартным лечением с использованием ингаляционных β 2 -агонистов.
Побочные эффекты были значительно выше в группе аминофиллина по сравнению с группой β 2 -агонистов, поскольку в группе аминофиллина было больше шансов на рвоту (20/100), сердцебиение (15/100) и аритмию (15/100). 100).В этом обновлении сделан вывод о том, что баланс риска и пользы i.v. аминофиллин неблагоприятен [17].
100).В этом обновлении сделан вывод о том, что баланс риска и пользы i.v. аминофиллин неблагоприятен [17].
Neame et al. [21] подробно исследовали разницу между β 2 -агонистами и аминофиллином на втором уровне лечения у детей. Доказательства эффективности всех опубликованных рандомизированных контролируемых исследований для любого из двух препаратов минимальны и противоречивы. Существует несогласованность в дизайне исследования, определениях, первичных результатах, используемых дозировках и схемах, вмешательствах, сравнениях и сообщениях о побочных эффектах.Наряду с разным качеством доказательств и риском предвзятости невозможно сделать какие-либо однозначные выводы. Однако они пришли к выводу, что аминофиллин может улучшить симптомы, сократить продолжительность пребывания в стационаре и улучшить функцию легких. Точно так же болюс β 2 -агонистов может также уменьшить симптомы и ускорить выздоровление [21]. Нет никаких четких доказательств того, что любой из этих двух препаратов превосходит по эффективности.
Трэверс и др. . [27] не обнаружили значительных различий в сроках пребывания в больнице, максимальной скорости выдоха, ОФВ 1 , частоте сердечных сокращений или клинической недостаточности между i.v. β 2 -агонистов и i.v. К стандартному лечению добавлено аминофиллина. Таким образом, в данном обзоре нельзя отдать предпочтение ни одному из этих двух методов лечения.
Аминофиллин
по сравнению с сульфатом магния Singhi et al. [22] провел рандомизированное контролируемое исследование с участием 100 детей в возрасте от 1 до 12 лет. Цель состояла в том, чтобы изучить эффективность i.v. сульфат магния, аминофиллин и тербуталин. Результаты показали, что у детей более успешный прием сульфата магния по сравнению с группами тербуталина и аминофиллина.Сообщили, что добавление в.в. Сульфат магния был более эффективным и безопасным, чем использование одного аминофиллина при лечении ребенка с острой тяжелой астмой, плохо поддающейся начальному лечению. Они сообщили о более быстром разрешении ретракции, хрипов и одышки в группе сульфата магния. Кроме того, у группы аминофиллина было больше побочных эффектов, таких как тошнота и рвота [22].
Они сообщили о более быстром разрешении ретракции, хрипов и одышки в группе сульфата магния. Кроме того, у группы аминофиллина было больше побочных эффектов, таких как тошнота и рвота [22].
Дальнейший систематический обзор Castro-Rodriguez et al. [23] пришел к выводу, что аминофиллин не превосходит другие препараты, такие как β 2 -агонисты короткого действия, кетамин или сульфат магния.В этом систематическом обзоре i.v. Сульфат магния привел к меньшему количеству госпитализированных в палату при использовании в условиях неотложной помощи. Однако нет убедительных доказательств, позволяющих сделать вывод или руководствоваться выбором препаратов второго ряда [23].
Аминофиллин
по сравнению с кетамином В единственном центре рандомизированное контролируемое исследование, в котором изучается в / в. аминофиллина по сравнению с в / в. кетамин, был сделан вывод, что оба препарата одинаково эффективны. Тем не менее, исследование имело низкую мощность, по 24 случая в каждой группе. Это, вероятно, изменится, так как использование кетамина в качестве терапии второй линии может возрасти в будущем для детей, которые невосприимчивы к традиционному лечению, что даст больше возможностей для более мощных исследований [24].
Тем не менее, исследование имело низкую мощность, по 24 случая в каждой группе. Это, вероятно, изменится, так как использование кетамина в качестве терапии второй линии может возрасти в будущем для детей, которые невосприимчивы к традиционному лечению, что даст больше возможностей для более мощных исследований [24].
Обсуждение
В последнее время нет данных, подтверждающих, что использование аминофиллина опасно и небезопасно для детей. Наиболее важно то, что среди педиатрической популяции не было зарегистрировано ни одного случая смерти из-за использования аминофиллина.Также нет данных о повышенном риске судорог или аритмий в педиатрической популяции при приеме принятых доз эуфиллина. Не следует назначать внутривенный эуфиллин детям с острой астмой легкой и средней степени тяжести, но его следует рассмотреть для использования при тяжелой острой астме у детей, не отвечающих на ингаляционные β 2 -агонисты и пероральные кортикостероиды. Модель i.v. инфузий аминофиллина могут улучшить функцию легких, и некоторые обзоры показали улучшение признаков и симптомов, но доказательства минимальны. Neame et al. хорошо резюмирует этот вопрос [18, 21]. Решения о том, какое лечение использовать, должны включать соображения управления рисками, такие как простота назначения, факторы подготовки и введения, а также наличие коек с высокой степенью зависимости. Какая бы терапия ни использовалась, детей следует обследовать на предмет объективных маркеров улучшения клинического статуса после начальной ударной дозы, чтобы оценить, нужно ли им лечить их с помощью последующей инфузии или нет. Важно подчеркнуть важность строгого и регулярного мониторинга побочных эффектов.Еще один интересный вывод из Mahemuti et al . [18] заключается в том, что с профилем безопасности и низкой стоимостью аминофиллина его следует рассматривать как экономически эффективное лечение обострений астмы, особенно в условиях ограниченной экономики здравоохранения, как в развивающихся странах.
Neame et al. хорошо резюмирует этот вопрос [18, 21]. Решения о том, какое лечение использовать, должны включать соображения управления рисками, такие как простота назначения, факторы подготовки и введения, а также наличие коек с высокой степенью зависимости. Какая бы терапия ни использовалась, детей следует обследовать на предмет объективных маркеров улучшения клинического статуса после начальной ударной дозы, чтобы оценить, нужно ли им лечить их с помощью последующей инфузии или нет. Важно подчеркнуть важность строгого и регулярного мониторинга побочных эффектов.Еще один интересный вывод из Mahemuti et al . [18] заключается в том, что с профилем безопасности и низкой стоимостью аминофиллина его следует рассматривать как экономически эффективное лечение обострений астмы, особенно в условиях ограниченной экономики здравоохранения, как в развивающихся странах.
Нет никаких доказательств того, что можно предложить безопасный и эффективный i.v. дозировка аминофиллина для детей с острой астмой. Рекомендуемый в.в. Доза аминофиллина может не соответствовать оптимальному профилю безопасности и эффективности.Это важная причина ограничить его использование у детей, поскольку недостаточно доказательств того, что корректировка дозировки в зависимости от возраста, веса и предыдущего уровня теофиллина в сыворотке улучшает исходы астмы [10]. Махемути и др. . [18] сообщили, что объединение i.v. аминофиллин (теофиллин) с другими лекарствами, такими как бронходилататоры со стероидами или без них, превосходит другие методы лечения. В обзоре упоминалось, что аминофиллин значительно снижает частоту сердечных сокращений и общую продолжительность пребывания.Однако β 2 -агонисты превосходили теофиллин в улучшении ОФВ 1 . В этом систематическом обзоре авторы считают, что, учитывая низкую стоимость лечения и ограниченные бюджетные ограничения, его можно рассматривать как экономически эффективное лечение острой астмы [18].
Рекомендуемый в.в. Доза аминофиллина может не соответствовать оптимальному профилю безопасности и эффективности.Это важная причина ограничить его использование у детей, поскольку недостаточно доказательств того, что корректировка дозировки в зависимости от возраста, веса и предыдущего уровня теофиллина в сыворотке улучшает исходы астмы [10]. Махемути и др. . [18] сообщили, что объединение i.v. аминофиллин (теофиллин) с другими лекарствами, такими как бронходилататоры со стероидами или без них, превосходит другие методы лечения. В обзоре упоминалось, что аминофиллин значительно снижает частоту сердечных сокращений и общую продолжительность пребывания.Однако β 2 -агонисты превосходили теофиллин в улучшении ОФВ 1 . В этом систематическом обзоре авторы считают, что, учитывая низкую стоимость лечения и ограниченные бюджетные ограничения, его можно рассматривать как экономически эффективное лечение острой астмы [18].
Перефразируя вывод из статьи 1957 года McKee et al.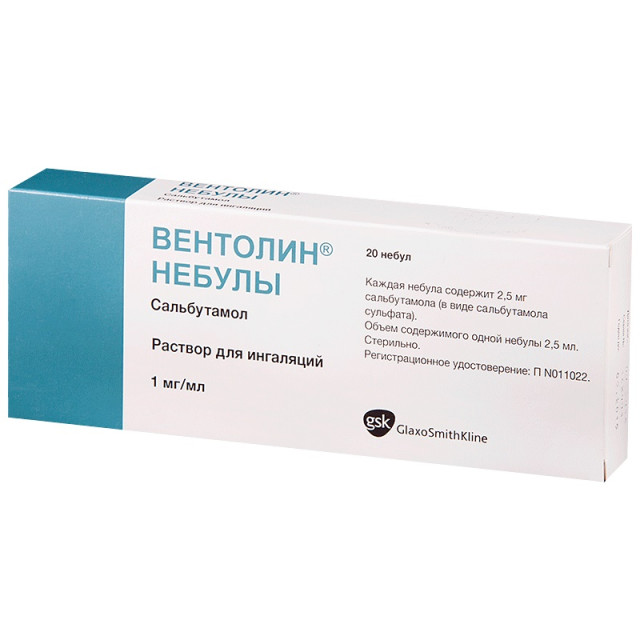 [14], мы считаем, что не следует осуждать использование аминофиллина у детей. Тем не менее, мы советуем с осторожностью выбирать нагрузочную дозу и скорость инфузии.Мы не считаем, что эуфиллин следует убирать с полок, и считаем, что он действительно играет благотворную роль при тяжелых обострениях астмы у детей. Мы обнаружили, что в нынешних дозах, используемых для детей, нет убедительных доказательств того, что использование аминофиллина связано со смертью, сердцебиением, аритмией и судорогами у детей. Тем не менее, клиницисты должны знать о значительных возможностях токсичности, как и в случае любого другого фармакологического лекарства, используемого в клинической практике [25].Основное беспокойство вызывает рвота или тошнота при высоких нагрузочных дозах (7–10 мг · кг –1 за 20 минут), которые можно лечить с помощью противорвотных средств. Однако использование противорвотных средств вместе с аминофиллином следует изучить более подробно. Более низкие нагрузочные дозы (4–6 мг · кг -1 нагрузка за 30 мин) не связаны с неблагоприятными побочными эффектами.
[14], мы считаем, что не следует осуждать использование аминофиллина у детей. Тем не менее, мы советуем с осторожностью выбирать нагрузочную дозу и скорость инфузии.Мы не считаем, что эуфиллин следует убирать с полок, и считаем, что он действительно играет благотворную роль при тяжелых обострениях астмы у детей. Мы обнаружили, что в нынешних дозах, используемых для детей, нет убедительных доказательств того, что использование аминофиллина связано со смертью, сердцебиением, аритмией и судорогами у детей. Тем не менее, клиницисты должны знать о значительных возможностях токсичности, как и в случае любого другого фармакологического лекарства, используемого в клинической практике [25].Основное беспокойство вызывает рвота или тошнота при высоких нагрузочных дозах (7–10 мг · кг –1 за 20 минут), которые можно лечить с помощью противорвотных средств. Однако использование противорвотных средств вместе с аминофиллином следует изучить более подробно. Более низкие нагрузочные дозы (4–6 мг · кг -1 нагрузка за 30 мин) не связаны с неблагоприятными побочными эффектами. Мы полагаем, что существует достаточно доказательств эффективности по сравнению с плацебо или другим препаратом в / в. бронходилататоров, чтобы продолжать использовать его в нашем режиме.Доказательств мало, но мы считаем достаточными для поддержки его использования у детей, поступающих в отделение неотложной помощи с тяжелыми острыми приступами. Тем не менее, нам необходимо способствовать развитию исследований с достаточной мощностью, использующих стандартные определения приступов и тяжести, и иметь всемирно признанный набор основных результатов, измеряемых с учетом результатов, ориентированных на пациента и семью [6]. Нам необходимо больше узнать о фармакокинетике и поведении терапевтических доз эуфиллина и других бронходилататоров.
Мы полагаем, что существует достаточно доказательств эффективности по сравнению с плацебо или другим препаратом в / в. бронходилататоров, чтобы продолжать использовать его в нашем режиме.Доказательств мало, но мы считаем достаточными для поддержки его использования у детей, поступающих в отделение неотложной помощи с тяжелыми острыми приступами. Тем не менее, нам необходимо способствовать развитию исследований с достаточной мощностью, использующих стандартные определения приступов и тяжести, и иметь всемирно признанный набор основных результатов, измеряемых с учетом результатов, ориентированных на пациента и семью [6]. Нам необходимо больше узнать о фармакокинетике и поведении терапевтических доз эуфиллина и других бронходилататоров.
Бронходилататоры — NHS
Бронходилататоры и кортикостероиды
Ингаляционные кортикостероиды — основное средство для уменьшения воспаления и предотвращения обострений астмы.
Но некоторым людям также может быть полезен прием бронходилататоров, чтобы держать дыхательные пути открытыми и усиливать действие кортикостероидов.
Бронходилататоры длительного действия нельзя принимать без кортикостероидов.
При ХОБЛ начальное лечение — бронходилататоры короткого или длительного действия, в некоторых тяжелых случаях добавляются кортикостероиды.
Лечение кортикостероидами и бронходилататорами может потребовать использования отдельных ингаляторов, но все чаще эти лекарства предоставляются вместе в отдельных ингаляторах.
Виды бронходилататоров
3 наиболее широко используемых бронходилататора:
- бета-2 агонистов, таких как сальбутамол, салметерол, формотерол и вилантерол
- холинолитики, такие как ипратропий, тиотропий, аклидиний и гликопирроний
- теофиллин
Бета-2-агонисты и холинолитики доступны в формах как короткого, так и длительного действия, тогда как теофиллин доступен только в форме длительного действия.
Агонисты бета-2
Агонисты бета-2 используются как при астме, так и при ХОБЛ, хотя некоторые типы доступны только при ХОБЛ.
Их обычно вдыхают с помощью небольшого портативного ингалятора, но они также могут быть доступны в виде таблеток или сиропа.
При внезапных тяжелых симптомах их также можно вводить путем инъекции или распыления.
Небулайзер — это компрессор, который превращает жидкое лекарство в тонкий туман, позволяя вдыхать большую дозу лекарства через мундштук или маску для лица.
Агонисты бета-2 действуют, стимулируя рецепторы, называемые рецепторами бета-2, в мышцах, выстилающих дыхательные пути, что заставляет их расслабляться и позволяет дыхательным путям расширяться (расширяться).
Их следует применять с осторожностью людям с:
- сверхактивная щитовидная железа (гипертиреоз) — заболевание, которое возникает, когда в организме слишком много гормона щитовидной железы
- Сердечно-сосудистые заболевания — состояния, поражающие сердце или кровеносные сосуды
- Нерегулярное сердцебиение (аритмия)
- высокое кровяное давление (гипертония)
- диабет — пожизненное заболевание, при котором уровень сахара в крови становится слишком высоким
В редких случаях агонисты бета-2 могут усугубить некоторые симптомы и возможные осложнения этих состояний.
Антихолинергические средства
Антихолинергические средства (также известные как антимускариновые средства) в основном используются для лечения ХОБЛ, но некоторые из них также могут применяться при астме.
Их обычно принимают с помощью ингаляторов, но можно использовать небулайзер для лечения внезапных и серьезных симптомов.
Антихолинергические препараты вызывают расширение дыхательных путей, блокируя холинергические нервы.
Эти нервы выделяют химические вещества, которые вызывают сокращение мышц, выстилающих дыхательные пути.
Их следует применять с осторожностью людям с:
- доброкачественное увеличение простаты — когда предстательная железа увеличивается, что может повлиять на то, как вы мочитесь
- Обструкция оттока из мочевого пузыря — любое состояние, которое влияет на отток мочи из мочевого пузыря, например, камни в мочевом пузыре или рак простаты
- Глаукома — повышение давления в глазу
Если у вас доброкачественное увеличение простаты или нарушение оттока мочевого пузыря, холинолитики могут вызвать проблемы, такие как затруднение мочеиспускания и невозможность полностью опорожнить мочевой пузырь.
Глаукома может ухудшиться, если холинолитики непреднамеренно попадут в глаза.
Теофиллин
Теофиллин обычно принимают в форме таблеток или капсул, но другой вариант, называемый аминофиллином, можно вводить непосредственно в вену (внутривенно), если у вас серьезные симптомы.
Неясно, как именно действует теофиллин, но, похоже, он уменьшает воспаление (отек) в дыхательных путях, а также расслабляет мышцы, выстилающие их.
Теофиллин действует слабее, чем другие бронходилататоры и кортикостероиды.
Кроме того, он с большей вероятностью вызывает побочные эффекты, поэтому часто используется вместе с этими лекарствами, только если они недостаточно эффективны.
Теофиллин следует применять с осторожностью людям с:
- сверхактивная щитовидная железа
- сердечно-сосудистые заболевания
- Проблемы с печенью, например заболевание печени
- высокое кровяное давление
- открытые язвы, развивающиеся на слизистой оболочке желудка (язвы желудка)
- Заболевание, поражающее мозг и вызывающее повторные припадки (эпилепсия)
Теофиллин может ухудшить эти условия. У людей с проблемами печени это иногда может привести к опасному скоплению лекарств в организме.
У людей с проблемами печени это иногда может привести к опасному скоплению лекарств в организме.
Другие лекарства также могут вызывать аномальное накопление теофиллина в организме. Это всегда должен проверять ваш врач.
Пожилым людям также может потребоваться дополнительное наблюдение во время приема теофиллина.
Взаимодействие с другими лекарствами
Бронходилататоры могут взаимодействовать с другими лекарствами, что может повлиять на их действие или увеличить риск побочных эффектов.
Некоторые лекарства, которые могут взаимодействовать с бронходилататорами (особенно теофиллин), включают:
- некоторые мочегонные средства, тип лекарства, который помогает выводить жидкость из организма
- некоторые антидепрессанты, включая ингибиторы моноаминоксидазы (ИМАО) и трициклические антидепрессанты (ТЦА)
- дигоксин, препарат, применяемый для лечения аритмий
- бензодиазепины, тип седативного средства, которое иногда может использоваться в качестве краткосрочного лечения беспокойства или проблем со сном (бессонницы)
- литий, лекарство, используемое для лечения тяжелой депрессии и биполярного расстройства
- хинолоны, один из видов антибиотиков
Это не полный список всех лекарств, которые могут взаимодействовать с бронходилататорами, и не все эти взаимодействия применимы к каждому типу бронходилататоров.
Всегда внимательно читайте информационный буклет для пациента, который прилагается к вашему лекарству.
Вы можете найти конкретную брошюру о лекарствах от А до Я на веб-сайте MHRA.
В случае сомнений обратитесь к фармацевту или терапевту.
оральных бронходилататоров. Лечение астмы бронходилататорами
Что такое оральные бронходилататоры?
Оральные бронходилататоры — это лекарства, которые используются для лечения проблем с дыханием у людей с астмой и другими проблемами легких, такими как хроническая обструктивная болезнь легких (ХОБЛ).Они помогают облегчить такие симптомы, как кашель, хрипы и затрудненное дыхание.
Существует два типа (группы) оральных бронходилататоров, которые можно прописать в Великобритании. Это:
Аминофиллин представляет собой смесь теофиллина и этилендиамина в соотношении 2: 1. Этилендиамин используется для улучшения растворения теофиллина в воде. Оральные бронходилататоры доступны в виде капсул, таблеток и жидкостей для перорального применения. Аминофиллин также доступен в виде инъекций; это обычно делается в больнице.Все они выпускаются под разными торговыми марками.
Аминофиллин также доступен в виде инъекций; это обычно делается в больнице.Все они выпускаются под разными торговыми марками.
Два других бронходилататора: эфедрин и орципреналин, также лицензированы в Великобритании. Однако в настоящее время они очень редко используются для лечения проблем с дыханием, поскольку могут вызывать серьезные побочные эффекты, такие как нерегулярное сердцебиение.
Бронходилататоры также доступны в виде ингаляционных лекарств. Это гораздо более часто используемые бронходилататоры. Однако в остальной части этой брошюры обсуждается только использование пероральных бронходилататоров (то есть бронходилататоров, которые вы принимаете внутрь в виде капсул, таблеток или жидкостей).См. Также отдельные буклеты «Ингаляторы от астмы» и «Ингаляторы от ХОБЛ».
Как действуют оральные бронходилататоры?
Слово бронходилататор означает расширение (расширение) бронхов. Бронходилататоры открывают дыхательные пути (бронхи и бронхиолы) шире, чтобы воздух мог более свободно поступать в легкие. Два разных типа оральных бронходилататоров работают по-разному.
Два разных типа оральных бронходилататоров работают по-разному.
Бета 2 агонисты
Работают за счет стимуляции рецепторов, называемых бета 2 рецепторов в мышцах, выстилающих дыхательные пути.Это расслабляет эти мышцы, что может расширить дыхательные пути, что облегчит дыхание.
Метилксантины
До сих пор точно не известно, как действуют эти лекарства. Однако считается, что они препятствуют действию вещества в организме, называемого фосфодиэстеразой. Затем расслабляются мышцы дыхательных путей, что облегчает дыхание. К сожалению, когда фосфодиэстераза блокируется, это может привести к другим эффектам, таким как низкое кровяное давление, учащенное сердцебиение, головная боль и тошнота.
Когда они обычно назначаются?
Как указано выше, эти лекарства обычно назначают людям, у которых есть проблемы с легкими, которые означают, что у них затрудненное дыхание. Чаще всего их назначают людям, страдающим астмой или ХОБЛ. Большинству людей, страдающих астмой, пероральные бронходилататоры не нужны. Это потому, что ингаляторы обычно работают хорошо.
Большинству людей, страдающих астмой, пероральные бронходилататоры не нужны. Это потому, что ингаляторы обычно работают хорошо.
В некоторых случаях назначают бета-агонист в форме таблеток (жидкая форма для детей) 2 , особенно детям младшего возраста и пожилым людям.Однако ингаляционные бронходилататоры более эффективны и имеют меньше побочных эффектов.
Метилксантины обычно назначают людям со стабильной ХОБЛ, а не в остром обострении. Врачи больниц иногда назначают инъекции аминофиллина, если у вас очень тяжелый приступ астмы.
Как мне принимать оральные бронходилататоры?
Таблетки сальбутамола обычно принимают три или четыре раза в день. Тербуталин обычно принимают три раза в день, тогда как бамбутерол принимают один раз в день перед сном (только для взрослых).
Таблетки и капсулы теофиллина можно принимать один или два раза в день, в зависимости от того, какой препарат прописал врач. Важно всегда придерживаться той же марки теофиллина. Это связано с тем, что количество теофиллина, усваиваемого организмом, сильно различается в зависимости от марки. Если вы начнете принимать препарат другой марки, чем обычно, возможно, у вас слишком много или слишком мало теофиллина. Аминофиллин обычно принимают два раза в день.
Это связано с тем, что количество теофиллина, усваиваемого организмом, сильно различается в зависимости от марки. Если вы начнете принимать препарат другой марки, чем обычно, возможно, у вас слишком много или слишком мало теофиллина. Аминофиллин обычно принимают два раза в день.
Какую дозу мне следует принять?
Назначаемая доза обычно зависит от того, насколько хорошо вы реагируете на лечение и сколько вам лет.Обычно ваш врач начинает с низкой дозы и увеличивает ее (при необходимости) в течение нескольких недель, пока вы не найдете правильную дозу.
Получить правильную дозу теофиллина и аминофиллина может быть непросто. Организм расщепляет (метаболизирует) теофиллин в печени. Этот метаболизм варьируется от человека к человеку. Следовательно, уровень лекарства в крови может сильно различаться. Это особенно характерно для курильщиков, людей с повреждением или нарушением функции печени и с сердечной недостаточностью.В некоторых условиях распад уменьшается, а уровень в крови повышается. В других условиях распад увеличивается, и поэтому уровень теофиллина в крови падает. Это очень важно, поскольку токсичная (опасная) доза теофиллина лишь немногим превышает дозу, необходимую для эффективного действия лекарства. Когда вы впервые начнете лечение одним из этих лекарств, ваш врач сделает несколько анализов крови, чтобы убедиться, что вы принимаете нужное количество лекарства. Этот анализ крови определяет, сколько теофиллина находится в вашей крови.В идеале количество теофиллина в крови составляет от 10 до 20 мг / л. После того, как вы выберете лечение, ваш врач может время от времени проводить дополнительные анализы крови, чтобы проверить, сколько теофиллина в вашей крови.
В других условиях распад увеличивается, и поэтому уровень теофиллина в крови падает. Это очень важно, поскольку токсичная (опасная) доза теофиллина лишь немногим превышает дозу, необходимую для эффективного действия лекарства. Когда вы впервые начнете лечение одним из этих лекарств, ваш врач сделает несколько анализов крови, чтобы убедиться, что вы принимаете нужное количество лекарства. Этот анализ крови определяет, сколько теофиллина находится в вашей крови.В идеале количество теофиллина в крови составляет от 10 до 20 мг / л. После того, как вы выберете лечение, ваш врач может время от времени проводить дополнительные анализы крови, чтобы проверить, сколько теофиллина в вашей крови.
Какова обычная продолжительность лечения?
Если бронходилататоры помогают избавиться от симптомов, их обычно назначают на длительный срок. Ваш врач или практикующая медсестра будут регулярно контролировать ваше дыхание и проверять вашу потребность в этих лекарствах.
Каковы возможные побочные эффекты?
Как и все лекарства, пероральные бронходилататоры имеют ряд побочных эффектов. Ниже перечислены некоторые из наиболее распространенных побочных эффектов:
Ниже перечислены некоторые из наиболее распространенных побочных эффектов:
- Бета 2 агонисты — общие побочные эффекты включают: мелкий тремор (например, дрожание рук), нервное напряжение, головную боль, мышечные судороги и ощущение сильного сердцебиения (учащенное сердцебиение).
- Метилксантины — они обычно вызывают побочные эффекты, такие как сердцебиение, плохое самочувствие (тошнота), головная боль и иногда ненормальное нерегулярное сердцебиение (аритмия) или даже приступы (судороги).
Более подробный список см. В листовке с лекарством.
Могу ли я принимать другие лекарства?
Очень мало лекарств, которые нельзя принимать с сальбутамолом. Однако существует довольно много лекарств, которые могут влиять на теофиллин. Например, циметидин, ципрофлоксацин, эритромицин, флувоксамин и зверобой могут увеличить количество теофиллина в крови. Кроме того, некоторые лекарства, такие как фенитоин, карбамазепин или рифампицин, уменьшают количество теофиллина в крови.
Если вы начнете принимать лекарство, которое может повлиять на количество теофиллина в крови, вашему врачу может потребоваться увеличить или уменьшить дозу теофиллина (или аминофиллина).
Если вы принимаете метилксантин, такой как теофиллин или аминофиллин, всегда спрашивайте у фармацевта, какие лекарства безопасно принимать.
Курение
Если вы курильщик и решили бросить курить, возможно, вам потребуется снизить дозу теофиллина или аминофиллина.Это связано с тем, что люди, которые курят, быстро разрушают это лекарство (по сравнению с людьми, которые не курят) и обычно нуждаются в более высокой дозе по сравнению с людьми, которые не курят. Ваша медсестра или фармацевт посоветует.
Могу ли я купить оральные бронходилататоры?
Нет — оральные бронходилататоры купить нельзя; вам нужен рецепт, чтобы получить эти лекарства.
Кто не может принимать оральные бронходилататоры?
Подавляющее большинство людей могут принимать оральные бронходилататоры.
Как пользоваться схемой желтых карточек
Если вы считаете, что у вас возник побочный эффект одного из ваших лекарств, вы можете сообщить об этом в схеме желтых карточек. Вы можете сделать это онлайн по адресу www.mhra.gov.uk/yellowcard.
Схема желтой карточки используется для информирования фармацевтов, врачей и медсестер о любых новых побочных эффектах, которые могут вызвать лекарства или любые другие медицинские продукты. Если вы хотите сообщить о побочном эффекте, вам необходимо предоставить основную информацию о:
- Побочном эффекте.
- Название лекарства, которое, по вашему мнению, вызвало его.
- Человек, у которого был побочный эффект.
- Ваши контактные данные как докладчика о побочном эффекте.
Будет полезно иметь при себе лекарство и / или прилагаемую к нему листовку, пока вы заполняете отчет.
Теофиллин при ХОБЛ — Новости ХОБЛ сегодня
Теофиллин — это бронходилататор, который используется в лечении ХОБЛ более семи десятилетий. Он используется для лечения свистящего дыхания или одышки, вызванных астмой, бронхитом, эмфиземой и другими нарушениями дыхания.Он работает, расслабляя мышцы легких и груди, облегчая дыхание.
Он используется для лечения свистящего дыхания или одышки, вызванных астмой, бронхитом, эмфиземой и другими нарушениями дыхания.Он работает, расслабляя мышцы легких и груди, облегчая дыхание.
Как действует теофиллин при ХОБЛ?
Теофиллин относится к классу метилксантинов. Он имеет два различных механизма действия у людей с обратимой обструкцией легких: как бронходилататор он вызывает расслабление гладких мышц. Его не бронхолитические эффекты подавляют реакцию дыхательных путей на раздражители.
Его механизм действия полностью не известен, хотя исследования на животных показывают, что бронходилатация включает ингибирование двух ферментов фосфодиэстеразы (ФДЭ III и ФДЭ IV), в то время как подавляющие эффекты, вероятно, связаны с различными механизмами, в которых эти ферменты не задействованы.
Теофиллин также увеличивает силу сокращения диафрагмальных мышц, вероятно, из-за увеличения внутриклеточного кальция через аденозин-опосредованный канал. Он не использовался так часто, как в прошлом, поскольку на рынке появились более переносимые и более эффективные бронходилататоры.
Исследования теофиллина
Исследования людей с ХОБЛ показали, что теофиллин уменьшает одышку, задержку дыхания и затруднения дыхания, а также увеличивает силу сокращения диафрагмальных мышц.
Показания и побочные эффекты
Руководство по лечению ХОБЛ классифицирует теофиллин как бронходилататор третьей линии после ингаляционных холинолитиков (ипратропиум и гликопирролат) и бета2-агонистов (альбутерол, арформотерол, формотерол, индакатерол, левальбутерол, сальметерол, вилантерол) или их комбинации. Однако теофиллин может быть полезен людям с ХОБЛ благодаря своим противовоспалительным свойствам, хотя его использование несколько противоречиво. Благоприятные эффекты теофиллина для пациентов с ХОБЛ имеют узкий терапевтический индекс (небольшие различия в дозах или концентрации в крови могут привести к серьезным терапевтическим неудачам или побочным реакциям на лекарства).Следовательно, токсичность может стать серьезной проблемой при хроническом использовании, и очень важно контролировать этих пациентов.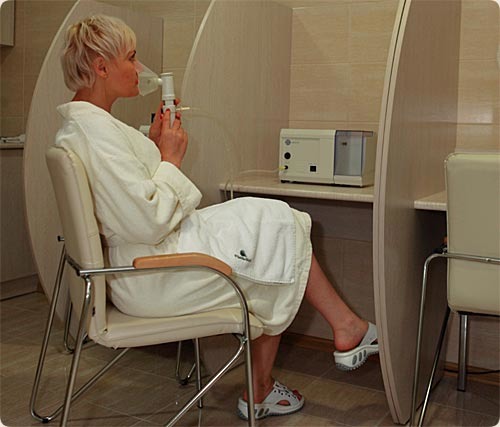
Теофиллин выпускается в виде таблеток, капсул или жидкости для приема внутрь. Это лекарство, которое контролирует симптомы, но не лечит их.
Общие побочные эффекты могут включать боль в желудке, диарею, расстройство желудка, головную боль, потливость, бессонницу или нервозность.
ХОБЛ News Today — это исключительно новостной и информационный сайт об этой болезни.Он не предоставляет медицинских консультаций, диагностики или лечения. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не игнорируйте профессиональные медицинские советы и не откладывайте их поиск из-за того, что вы прочитали на этом сайте.
Дополнительные методы лечения рефрактерного астматического статуса у детей
Abstract
Обострение астмы является частой причиной обращения детей в отделение неотложной помощи. Если первичная терапия не может остановить прогрессирование обострения астмы, астматический статус часто приводит к госпитализации и, возможно, в ОИТ. После первоначального введения ингаляционных β-агонистов и системных кортикостероидов для лечения астматического статуса можно использовать широкий спектр дополнительных медицинских методов лечения. К сожалению, данные, подтверждающие использование этих дополнительных методов лечения, часто неясны, противоречивы или отсутствуют. В этом обзоре будут представлены физиологические основы и обобщены подтверждающие данные для множества дополнительных методов лечения, включая ипратропий, внутривенные β-агонисты, метилксантины, внутривенный и ингаляционный магний, гелиокс (гелий-кислородная смесь), кетамин, антибиотики, неинвазивная вентиляция, ингаляционные анестетики. , и экстракорпоральная мембранная оксигенация.Наконец, мы представляем предлагаемую карту ухода за детьми с рефрактерным астматическим статусом для перехода на эти виды лечения.
Если первичная терапия не может остановить прогрессирование обострения астмы, астматический статус часто приводит к госпитализации и, возможно, в ОИТ. После первоначального введения ингаляционных β-агонистов и системных кортикостероидов для лечения астматического статуса можно использовать широкий спектр дополнительных медицинских методов лечения. К сожалению, данные, подтверждающие использование этих дополнительных методов лечения, часто неясны, противоречивы или отсутствуют. В этом обзоре будут представлены физиологические основы и обобщены подтверждающие данные для множества дополнительных методов лечения, включая ипратропий, внутривенные β-агонисты, метилксантины, внутривенный и ингаляционный магний, гелиокс (гелий-кислородная смесь), кетамин, антибиотики, неинвазивная вентиляция, ингаляционные анестетики. , и экстракорпоральная мембранная оксигенация.Наконец, мы представляем предлагаемую карту ухода за детьми с рефрактерным астматическим статусом для перехода на эти виды лечения.
Введение
Астма — это иммуноопосредованный процесс, при котором экологический или инфекционный агент вызывает аллергическую реакцию, опосредованную иммуноглобулином Е, вызывающую гиперчувствительность, вызывая дегрануляцию тучных клеток, высвобождение гистамина и активацию провоспалительных цитокинов.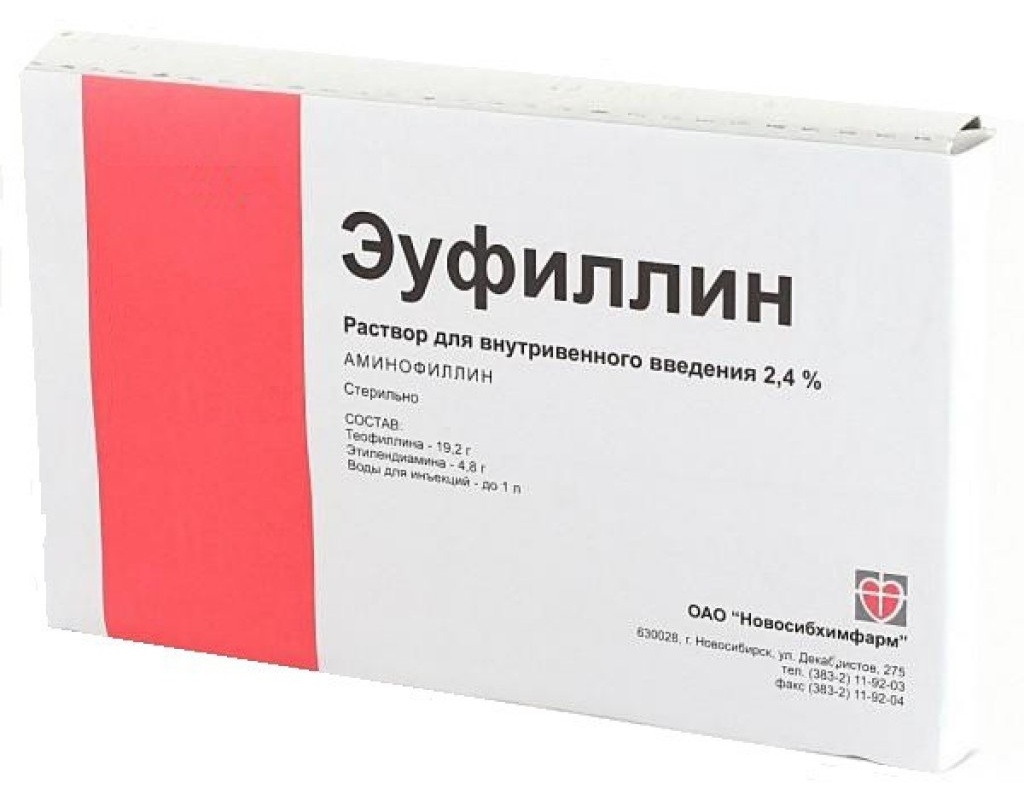 1 Классическая триада астмы является клиническим проявлением этого каскада и включает реактивность дыхательных путей и бронхоспазм, отек слизистой оболочки и образование слизи.Сочетание концентрического отека дыхательных путей и сокращения гладких мышц резко увеличивает сопротивление в нижних дыхательных путях, что приводит к обструктивному процессу (рис. 1). Производство слизи в дыхательных путях усугубляет обструктивный процесс как из-за потенциального сужения дыхательных путей с прилипанием слизи к стенкам дыхательных путей, так и из-за ухудшения захвата воздуха из-за закупорки дыхательных путей в механизме шарового клапана.
1 Классическая триада астмы является клиническим проявлением этого каскада и включает реактивность дыхательных путей и бронхоспазм, отек слизистой оболочки и образование слизи.Сочетание концентрического отека дыхательных путей и сокращения гладких мышц резко увеличивает сопротивление в нижних дыхательных путях, что приводит к обструктивному процессу (рис. 1). Производство слизи в дыхательных путях усугубляет обструктивный процесс как из-за потенциального сужения дыхательных путей с прилипанием слизи к стенкам дыхательных путей, так и из-за ухудшения захвата воздуха из-за закупорки дыхательных путей в механизме шарового клапана.
Схема, демонстрирующая патофизиологию астмы. Обратите внимание на изменение поперечного сечения дыхательных путей от нормальных дыхательных путей (A) к бронхиоле при астме (B) с бронхоспазом гладких мышц, отеком слизистой оболочки и прилипанием слизи к стенкам дыхательных путей.
Основой терапии острой астмы являются ингаляционные β 2 агонисты и системные стероиды, и часто этой комбинации достаточно, чтобы остановить обострение астмы. Агонист β 2 (обычно ингаляционный альбутерол, но он может также включать левальбутерол или сальбутамол) является основным средством лечения острых состояний, вызывающим немедленное снижение сопротивления легких дыхательных путей за счет расслабления гладких мышц бронхов и, как следствие, бронходилатации. Кортикостероиды, чаще всего пероральный преднизон или преднизолон или метилпреднизон внутривенно, имеют 2 различных механизма действия.В первые несколько часов после введения глюкокортикоиды вызывают повышенную регуляцию β-рецепторов на гладкомышечных клетках бронхов, что позволяет повысить эффективность терапии β-агонистами для уменьшения бронхоспазма. 2 Вслед за этим ранним эффектом противовоспалительное действие глюкокортикоидов приводит к снижению воспалительных цитокинов и вызывает уменьшение отека дыхательных путей. Во многих отношениях противовоспалительный эффект стероида обращает вспять основной процесс астмы, тогда как другие методы лечения, включая β-агонисты, просто лечат симптомы и «выигрывают время», чтобы стероиды подействовали.
Агонист β 2 (обычно ингаляционный альбутерол, но он может также включать левальбутерол или сальбутамол) является основным средством лечения острых состояний, вызывающим немедленное снижение сопротивления легких дыхательных путей за счет расслабления гладких мышц бронхов и, как следствие, бронходилатации. Кортикостероиды, чаще всего пероральный преднизон или преднизолон или метилпреднизон внутривенно, имеют 2 различных механизма действия.В первые несколько часов после введения глюкокортикоиды вызывают повышенную регуляцию β-рецепторов на гладкомышечных клетках бронхов, что позволяет повысить эффективность терапии β-агонистами для уменьшения бронхоспазма. 2 Вслед за этим ранним эффектом противовоспалительное действие глюкокортикоидов приводит к снижению воспалительных цитокинов и вызывает уменьшение отека дыхательных путей. Во многих отношениях противовоспалительный эффект стероида обращает вспять основной процесс астмы, тогда как другие методы лечения, включая β-агонисты, просто лечат симптомы и «выигрывают время», чтобы стероиды подействовали.
К сожалению, у некоторых пациентов сохраняется тяжелый бронхоспазм и респираторный дистресс, несмотря на начальное лечение β-агонистами и стероидами. Астматический статус и острая тяжелая астма — это общие термины, используемые для тяжелых или опасных для жизни обострений астмы, при которых бронхоспазм и респираторный дистресс сохраняются, несмотря на лечение стероидами и многократными дозами β-агонистов. Астматический статус встречается примерно в 20% случаев госпитализации с астмой, но количество детей, нуждающихся в педиатрической госпитализации, со временем увеличивается. 3–5
Рекомендации экспертов Национального института здравоохранения (NIH) рекомендуют терапию ингаляционными β-агонистами системными кортикостероидами при всех обострениях астмы, требующих неотложного лечения, с добавлением ингаляционного ипратропия при тяжелых обострениях. 1 Для пациентов, у которых не удалось продемонстрировать улучшение при начальном лечении бета-агонистов и стероидов, можно использовать множество других дополнительных методов лечения. 6 В этой статье будут рассмотрены многие из этих дополнительных методов лечения, включая основные механизмы действия и доказательства, подтверждающие их использование.
6 В этой статье будут рассмотрены многие из этих дополнительных методов лечения, включая основные механизмы действия и доказательства, подтверждающие их использование.
Дозирование стандартной терапии
Если пациенты с астматическим статусом не реагируют на начальное лечение, многие врачи сначала увеличивают дозировку этих препаратов первого ряда выше рекомендованной, предписанной в рекомендациях Национального института здравоохранения по астме. Непрерывная доставка β-агониста стала обычным явлением при лечении тяжелых обострений астмы. У детей такие непрерывные роды более эффективны, чем прерывистые 7,8 , а также обеспечивают более эффективное использование ресурсов респираторного терапевта и медсестер. 9 Руководящие принципы NIH по астме 1 рекомендуют постоянную ингаляционную дозу альбутерола от 0,5 мг / кг / ч до максимальной 15 мг / ч; тем не менее, 20 мг / ч альбутерола непрерывного действия обычно используются поставщиками для детей всех возрастов. В нескольких исследованиях оценивалось использование высоких доз альбутерола непрерывного действия с дозами 75–150 мг / ч, 10–12 без четких доказательств его преимущества по сравнению со стандартными дозами. Фактором, ограничивающим дальнейшее увеличение дозы альбутерола, обычно является дозозависимая тахикардия.Диастолическая гипотензия и легкая гипокалиемия могут наблюдаться при увеличении доз непрерывного ингаляционного альбутерола 12,13 ; однако клиническое значение этих результатов не определено.
В нескольких исследованиях оценивалось использование высоких доз альбутерола непрерывного действия с дозами 75–150 мг / ч, 10–12 без четких доказательств его преимущества по сравнению со стандартными дозами. Фактором, ограничивающим дальнейшее увеличение дозы альбутерола, обычно является дозозависимая тахикардия.Диастолическая гипотензия и легкая гипокалиемия могут наблюдаться при увеличении доз непрерывного ингаляционного альбутерола 12,13 ; однако клиническое значение этих результатов не определено.
Дозировка, эквивалентная 1-2 мг / кг / сут преднизона (максимум 60 мг), является рекомендуемым режимом дозирования стероидов при обострении астмы в рекомендациях NIH по астме 1 ; тем не менее, многие медицинские работники также часто превышают эту дозу во время тяжелого обострения. 14 Хотя некоторые данные у взрослых могут свидетельствовать о пользе раннего применения высоких доз стероидов в отделениях неотложной помощи, 1 данные о системных стероидах остаются неубедительными. В Кокрановском обзоре 2016 года было изучено 18 исследований среди детей и взрослых с использованием различных режимов дозирования системных стероидов и не было обнаружено явных преимуществ какой-либо конкретной схемы. 15 Однако было продемонстрировано, что раннее введение системных стероидов в отделении неотложной помощи связано с уменьшением количества госпитализаций. 16
В Кокрановском обзоре 2016 года было изучено 18 исследований среди детей и взрослых с использованием различных режимов дозирования системных стероидов и не было обнаружено явных преимуществ какой-либо конкретной схемы. 15 Однако было продемонстрировано, что раннее введение системных стероидов в отделении неотложной помощи связано с уменьшением количества госпитализаций. 16
Несмотря на обычную практику увеличения дозирования стандартных методов лечения при астматическом статусе, ограниченные данные поддерживают ингаляционное постоянное дозирование альбутерола> 15-20 мг / ч или дозирование стероидов> 2 мг / кг / день эквивалента преднизона .Поставщики медицинских услуг должны внимательно рассматривать и контролировать побочные эффекты этих лекарств, если они решают превысить стандартные режимы дозирования.
Антихолинергические средства
Ипратропиум — это антихолинергическое средство, вызывающее бронходилатацию за счет своего действия в качестве антагониста рецепторов ацетилхолина. 17 Систематический обзор 32 рандомизированных исследований ипратропия, проведенный в 2005 г. при начальном лечении астматического статуса в отделении неотложной помощи, продемонстрировал явную пользу как у детей, так и у взрослых в плане улучшения параметров легочной функции и предотвращения госпитализации 18 ; это было подтверждено в Кокрановском обзоре 2013 г. 19 Однако, как только ребенок попадает в больницу, потенциальная польза от продолжения терапии ипратропиумом становится менее очевидной. Рандомизированное исследование 210 детей (ипратропиум по сравнению с контролем) выявило преимущество в группе ипратропия в отношении улучшения симптомов и сокращения продолжительности пребывания в больнице; однако это различие было потеряно, когда группы были исправлены на искажающие факторы. 20 Кокрановский обзор 7 рандомизированных исследований, проведенный в 2014 г. с участием детей, госпитализированных в больницу с обострением астмы, также не выявил преимуществ сокращения продолжительности пребывания в стационаре для поддержки продолжения ипратропия после госпитализации; однако ни одно из этих исследований не оценивало пациентов, госпитализированных в ОИТ.
17 Систематический обзор 32 рандомизированных исследований ипратропия, проведенный в 2005 г. при начальном лечении астматического статуса в отделении неотложной помощи, продемонстрировал явную пользу как у детей, так и у взрослых в плане улучшения параметров легочной функции и предотвращения госпитализации 18 ; это было подтверждено в Кокрановском обзоре 2013 г. 19 Однако, как только ребенок попадает в больницу, потенциальная польза от продолжения терапии ипратропиумом становится менее очевидной. Рандомизированное исследование 210 детей (ипратропиум по сравнению с контролем) выявило преимущество в группе ипратропия в отношении улучшения симптомов и сокращения продолжительности пребывания в больнице; однако это различие было потеряно, когда группы были исправлены на искажающие факторы. 20 Кокрановский обзор 7 рандомизированных исследований, проведенный в 2014 г. с участием детей, госпитализированных в больницу с обострением астмы, также не выявил преимуществ сокращения продолжительности пребывания в стационаре для поддержки продолжения ипратропия после госпитализации; однако ни одно из этих исследований не оценивало пациентов, госпитализированных в ОИТ. 21 На этом этапе добавление ипратропия следует рассматривать как стандарт лечения детей, поступающих в отделение неотложной помощи с астматическим статусом; однако нет достаточных данных, подтверждающих их дальнейшее использование после поступления в больницу, и нет данных, оценивающих их использование в отделении интенсивной терапии.
21 На этом этапе добавление ипратропия следует рассматривать как стандарт лечения детей, поступающих в отделение неотложной помощи с астматическим статусом; однако нет достаточных данных, подтверждающих их дальнейшее использование после поступления в больницу, и нет данных, оценивающих их использование в отделении интенсивной терапии.
Внутривенные β-агонисты
Предполагаемая полезность внутривенных β-агонистов в дополнение или вместо ингаляционных β-агонистов проистекает из концепции, что во время тяжелого обострения астмы серьезное сужение бронхов может препятствовать доставке вдыхаемых β-агонистов в дистальные дыхательные пути. 22 Внутривенный β-агонист, чаще всего тербуталин или сальбутамол, может достигать β2-рецепторов в дистальных отделах дыхательных путей через кровоток и вызывать более эффективное расширение бронхов. Поскольку эти β-агонисты доставляются системно, они также с большей вероятностью, чем ингаляционный альбутерол, вызывают побочные эффекты, связанные с взаимодействием с не связанными с дыхательными путями β1 рецепторами, в первую очередь тахикардию и нервозность._rnd25433.jpeg) Это будет еще более преувеличено с другими, менее специфическими агонистами α и β, такими как адреналин.Кроме того, если β-рецепторы дыхательных путей уже насыщены ингаляционным альбутеролом, добавление внутривенного β-агониста может обеспечить минимальную дополнительную пользу.
Это будет еще более преувеличено с другими, менее специфическими агонистами α и β, такими как адреналин.Кроме того, если β-рецепторы дыхательных путей уже насыщены ингаляционным альбутеролом, добавление внутривенного β-агониста может обеспечить минимальную дополнительную пользу.
Рандомизированное исследование 1997 г., проведенное Browne et al. 23 по сравнению с сальбутамолом внутривенно по сравнению с физиологическим раствором, вводимым детям в отделении неотложной помощи, показавшее плохую реакцию на ингаляционный сальбутамол и стероиды, продемонстрировало более раннее время до прекращения терапии небулайзерами и выписки из отделения неотложной помощи в группе внутривенного сальбутамола .Браун повторил испытание в 2002 году с более ранней рандомизацией и аналогичными результатами. 24 Дополнительное рандомизированное исследование 2007 г., в котором тербуталин вводился внутривенно, по сравнению с физиологическим раствором, добавленным к распыляемому альбутеролу для детей, поступающих в отделение неотложной помощи с астматическим статусом, и продемонстрировало статистически незначимое улучшение клинических показателей астмы, времени до прекращения небулайзерной терапии и времени до выписки из интенсивной терапии. 25 Тем не менее, 4 субъекта продемонстрировали некоторую сердечную токсичность тербуталина, при этом у одного наблюдались сердечные нарушения ритма, а в 3 случаях — повышенный уровень тропонина.Несмотря на незначительный успех этих ранних испытаний, Кокрановские обзоры 2001 и 2012 гг., Включающие детей и взрослых, не выявили значительной пользы от добавления внутривенных β-агонистов к ингаляционным β-агонистам. 22
25 Тем не менее, 4 субъекта продемонстрировали некоторую сердечную токсичность тербуталина, при этом у одного наблюдались сердечные нарушения ритма, а в 3 случаях — повышенный уровень тропонина.Несмотря на незначительный успех этих ранних испытаний, Кокрановские обзоры 2001 и 2012 гг., Включающие детей и взрослых, не выявили значительной пользы от добавления внутривенных β-агонистов к ингаляционным β-агонистам. 22
В последнее время более широкое использование β-агонистов длительного действия в амбулаторных условиях в качестве средств контроля астмы может повлиять на реакцию пациентов на краткосрочные спасающие β-агонисты в условиях острого заболевания. Хроническое воздействие β-агонистов, вероятно, подавляет β-рецепторы в гладких мышцах дыхательных путей, делая эти рецепторы менее чувствительными к терапии β-агонистами во время эпизодов астматического статуса.Это одна из теорий, объясняющих повышенный уровень смертности пациентов, получающих ежедневную терапию β-агонистами длительного действия 26 ; тем не менее, остаются некоторые разногласия по поводу причины повышенной засвидетельствованной смертности у этих пациентов. 27,28
β-агонисты являются основой терапии острых приступов астмы, но предпочтительным путем доставки остаются ингаляционные β-агонисты 2 . Если пациент не может получать ингаляционную терапию, целесообразно внутривенное введение β-агонистов.Однако до сих пор нет достаточных данных об эффективности добавления внутривенных β-агонистов к ингаляционным β-агонистам при остром астматическом статусе. Когда внутривенная терапия β-агонистами сочетается с ингаляционными β-агонистами, клиницисты должны внимательно следить за нежелательными эффектами, включая чрезмерную тахикардию и аритмию.
Метилксантины
Метилксантины, класс лекарств, включающий кофеин, теофиллин и аминофиллин, представляют собой неспецифические ингибиторы фосфодиэстеразы, которые вызывают расслабление гладких мышц бронхов за счет увеличения внутриклеточного циклического аденозинмонофосфата. 17 Использование энтерального теофиллина в качестве вспомогательной терапии для амбулаторного лечения астмы росло и уменьшалось, в основном из-за узкого терапевтического диапазона, требующего мониторинга уровней лекарств в сыворотке крови и других лекарственных взаимодействий из-за его метаболизма через путь цитохрома P450. Однако внутривенное введение аминофиллина остается распространенной терапией при астматическом статусе. Общие побочные эффекты включают тахикардию и тошноту, тогда как более значительный побочный эффект включает снижение порога судорожных припадков у пациентов с риском судорог.
Теоретическим преимуществом метилксантина в качестве дополнения к ингаляционным или внутривенным β-агонистам является механизм действия на уникальный рецептор. По идее, нацеливание на сайт, отличный от β-рецептора, может обеспечить дополнительное преимущество для расслабления гладких мышц бронхов. Другие предложенные механизмы включают улучшение сократительной способности диафрагмы и очищения дыхательных путей, ингибирование воспалительной реакции и диуретические свойства, уменьшающие отек легких. 6 К сожалению, профиль побочных эффектов метилксантинов в значительной степени совпадает с профилем β-агонистов, и, в частности, тахикардия часто ограничивает применимость этого класса препаратов.
Внутривенный эуфиллин использовался при астматическом статусе у детей более 70 лет, 29,30 с некоторыми доказательствами того, что добавление аминофиллина улучшало функцию легких у этих пациентов. Однако рандомизированные испытания внутривенного аминофиллина или теофиллина в качестве дополнения к альбутеролу и стероидам при астматическом статусе, завершенные в начале 1990-х годов, неоднократно не демонстрировали преимущества этой терапии как для измерения функции легких, так и для вторичных результатов, таких как продолжительность пребывания в больнице . 31–36 В некоторых из этих исследований также сообщалось об усилении побочных эффектов, чаще всего тошноте и беспокойстве (включая бессонницу и тремор). В рандомизированном исследовании 2001 г. Ream et al 37 продемонстрировали преимущество в группе аминофиллина в улучшении клинических показателей астмы у детей, поступивших в педиатрическое отделение интенсивной терапии, которые также получали кортикостероиды, ингаляционный альбутерол и ипратропий, но не смогли показать различий в показателях. ОИТ остается по сравнению с терапией без аминофиллина; эти результаты были позже подтверждены Кокрановским обзором 2005 года. 38
Wheeler et al. 39 сравнили эффективность аминофиллина, тербуталина и комбинации аминофиллина / тербуталина в качестве дополнений к ингаляционному альбутеролу и обнаружили одинаковую эффективность во всех трех группах. Анализ затрат, включенный в это исследование, показал, что аминофиллин без тербуталина был наиболее экономически эффективным из этих дополнительных методов лечения. В последующем Кокрановском обзоре, в котором сравнивали аминофиллин и тербуталин у детей и взрослых пациентов с астматическим статусом, было обнаружено недостаточно доказательств, подтверждающих одно по сравнению с другим. 40 Наконец, более поздний ретроспективный обзор продемонстрировал увеличение продолжительности пребывания в педиатрической ОИТ для детей, получающих аминофиллин, по сравнению с подобранными контрольными случаями, но остается высокий потенциал для систематической ошибки отбора в этом исследовании. 41
В целом данные, подтверждающие использование метилксантинов в качестве вспомогательного средства для лечения астматического статуса, являются слабыми, и метилксантины являются единственной вспомогательной терапией, обсуждаемой в этом обзоре, которая специально «не рекомендуется» в экспертных рекомендациях NIH. 1 Несмотря на это, метилксантины внутривенно остаются терапевтическим вариантом во многих отделениях интенсивной терапии. Возможность внимательно следить за уровнем теофиллина в отделении интенсивной терапии может помочь смягчить некоторые из потенциальных побочных эффектов метилксантинов, но эти побочные эффекты, особенно тахикардия и тошнота, часто ограничивают их использование. Эноксимон является селективным ингибитором фосфодиэстеразы III, который, как было продемонстрировано, оказывает бронхолитическое действие у взрослых, страдающих астмой, с потенциалом меньшего количества побочных эффектов, чем неселективные метилксантины. 42 Однако клиническое применение этого нового препарата у детей остается неизвестным.
Магний
Магний вызывает расслабление гладких мышц, изменяя поток кальция в саркоплазматический ретикулум мышц и, следовательно, снижая способность мышц сокращаться. 6 Благодаря этому свойству магний также часто используется при преждевременных родах для уменьшения сокращений гладких мышц матки. Таким же образом магний уменьшает сужение бронхов в дыхательных путях.Присутствие магния также ингибирует дегрануляцию тучных клеток, 43 , что может блокировать высвобождение гистамина и смягчать дальнейшее воспаление. Побочные эффекты, как правило, незначительны и могут включать общую слабость, недомогание и гипотензию (хотя о последнем не сообщалось в исследованиях, в которых магний применялся для лечения астмы).
Ciarallo et al. 44 продемонстрировали, что внутривенное болюсное введение 25 мг / кг сульфата магния в течение 20 минут по сравнению с плацебо у детей, поступающих в отделение неотложной помощи с умеренными и тяжелыми обострениями астмы, приводит к значительному улучшению ОФВ 1 через 50 минут. , продолжительностью не менее 110 мин.Последующие рандомизированные исследования с увеличенной дозировкой (40–75 мг / кг) продемонстрировали аналогичные улучшения в пиковом потоке выдоха, а также были связаны с более низкими показателями госпитализации, что было дополнительно подтверждено небольшим (115 субъектов) метаанализом. 45–48 Для детей, впоследствии поступивших в отделение интенсивной терапии, у детей, которым вводили магний внутривенно при обращении в отделение неотложной помощи, может протекать более легкое течение, включая более низкую вероятность потребности в ИВЛ. 49 Singhi et al. 50 также продемонстрировали, что магний более эффективен, чем тербуталин или аминофиллин, в качестве дополнительной терапии к ингаляционным β-агонистам, что измерялось снижением клинических показателей астмы.Было продемонстрировано, что непрерывное внутривенное вливание магния (а не однократное болюсное введение) переносится без осложнений, но клиническая эффективность инфузий> 4 ч не оценивалась. 51–54
В последнее время возрос интерес к использованию ингаляционного распыленного магния при астматическом статусе. Демонстрируя доказательство концепции, Махаджан и др. 55 продемонстрировали 25% -ное увеличение ОФВ 1 , измеренное через 10 и 20 минут после введения дозы распыленного магния в сочетании с альбутеролом, по сравнению с одним альбутеролом у детей, поступающих в отделение неотложной помощи с легкими и легкими формами болезни. умеренная астма.Впоследствии Кокрановский обзор 2005 года, в котором учитывались дети и взрослые, продемонстрировал аналогичное улучшение функции легких при сочетании распыленного магния с альбутеролом, но только у пациентов с более тяжелой астмой. 56 В том же исследовании было обнаружено незначительное снижение количества госпитализаций. Однако, когда тот же самый Кокрановский анализ был повторен в 2012 году, авторы пришли к выводу, что данных недостаточно, чтобы поддерживать рутинное использование ингаляционного магния с ингаляционными β-агонистами. 57 Следует отметить, что вдыхаемый магний, по-видимому, уступает вдыхаемым β-агонистам с точки зрения улучшения функции легких. Исследование магния у детей (исследование MAGNETIC) было опубликовано после Кокрановского обзора 2012 года и рандомизировано для 500 детей, которые получили 3 дозы либо комбинации распыленного альбутерола, ипратропия и магния, либо альбутерола и ипратропия без магния. 57 Как и в предыдущих исследованиях, наблюдалось небольшое улучшение показателей тяжести астмы в группе магния по сравнению с контрольной группой с тенденцией к большей пользе у более больных субъектов.Однако отмеченное улучшение, вероятно, не имело большого клинического значения, без различий в каких-либо вторичных исходах, включая пребывание в больнице или поступление в ОИТ. Наконец, крупное рандомизированное исследование среди взрослых продемонстрировало, что, хотя ни один из них не был особенно эффективным при обострениях астмы, вдыхаемый магний, вероятно, уступает внутривенному магнию. 58
Таким образом, внутривенное введение магния представляет собой недорогую дополнительную терапию с низким уровнем риска, которая, вероятно, дает некоторую пользу детям с астматическим статусом, особенно при раннем обращении в больницу.Хотя распыленный магний кажется безопасным и может оказывать незначительное влияние на функцию легких, остается неясным, дает ли ингаляционный магний какое-либо клиническое преимущество перед внутривенным введением.
Антибиотики
Обострения астмы обычно спровоцированы факторами окружающей среды или вирусными инфекциями, реже — атипичными бактериальными инфекциями и реже — другими бактериальными инфекциями, однако антибиотики часто назначают во время тяжелых обострений астмы у детей. 59 По сравнению со взрослыми, дети обладают несколькими физиологическими характеристиками, которые подвергают их повышенному риску ателектаза, включая меньшие размеры дыхательных путей, меньшее количество анатомических путей коллатеральной вентиляции и повышенную эластичность грудной клетки. Таким образом, рентгенография грудной клетки при обострении детской астмы обычно выявляет области ателектаза, которые можно легко принять за инфильтраты. Однако, поскольку астма — это в первую очередь проблема небольших дыхательных путей, альвеолы обычно сохраняются, а сопутствующая очаговая бактериальная пневмония встречается редко.Кокрановский обзор рандомизированных контрольных исследований 2001 года продемонстрировал отсутствие клинической пользы от добавления антибиотиков во время обострений астмы у детей или взрослых. 60
Совсем недавно макролиды были предложены в качестве вспомогательной терапии астмы из-за их активности против атипичных бактерий, а также их внутренних противовоспалительных эффектов. 61 Исследования макролидов при астме в основном проводятся у взрослых, некачественные и сосредоточены на хроническом лечении астмы, а не на лечении во время обострений.Кокрановский обзор 2015 года показал, что, хотя хроническое употребление макролидов может иметь некоторую пользу для функции легких, макролиды не лучше плацебо в предотвращении госпитализации или улучшении показателей качества жизни. 62 Нет данных, подтверждающих использование макролидов при астматическом статусе.
Имеющиеся данные не поддерживают рутинное использование антибиотиков при астматическом статусе. Использование антибиотиков должно быть ограничено детьми с подозрением на бактериальную инфекцию либо в результате окончательной очаговой пневмонии на рентгенограмме грудной клетки, либо в анамнезе, соответствующем атипичной бактериальной инфекции или подверженности ей.
Кетамин
Кетамин — диссоциативный анестетик, наиболее часто используемый из-за его седативных и обезболивающих свойств. Благодаря своему механизму действия в качестве неконкурентного антагониста рецепторов N-метил-D-аспартата в коре и лимбической системе кетамин вызывает диссоциативное каталептическое состояние и анальгезию. 17 В периферической нервной системе стимуляция рецептора N-метил-D-аспартата вызывает высвобождение норэпинефрина и других катехоламинов. 63 Наиболее частые побочные эффекты кетамина являются результатом этого выброса катехоламинов: тахикардия, гипертония и бронходилатация.Этот последний эффект привел к использованию кетамина в качестве дополнительной терапии при астматическом статусе. Другие заметные побочные эффекты включают тошноту и повышенную секрецию в виде сиалореи и бронхореи. 17 Редкое, но потенциально опасное для жизни осложнение — ларингоспазм.
Впервые о кетамине сообщили в качестве средства для лечения заболеваний легких в 1971 году, когда врачи отметили внезапное исчезновение хрипов после введения кетамина у маленького ребенка с респираторной недостаточностью. 64 В нескольких отчетах о случаях и сериях случаев описывается успешное применение кетамина у детей и взрослых с астматическим статусом без серьезных побочных эффектов. 65–69 Для пациентов на ИВЛ введение кетамина было связано с увеличением динамической податливости и P aO 2 / F IO 2 и сопутствующим снижением пикового давления на вдохе и P aCO 2 . 67,70
Проспективное наблюдательное исследование кетамина (ударная доза 1 мг / кг с последующей инфузией 0.75 мг / кг / ч) для детей, поступающих в отделение неотложной помощи с астматическим статусом, продемонстрировали снижение частоты дыхания и клинической оценки астмы наряду с улучшением сатурации кислорода после введения кетамина. 71 У некоторых из этих детей были легкие галлюцинации, которые исчезли после приема бензодиазепинов. Для сравнения, рандомизированное исследование кетамина (ударная доза 0,2 мг / кг с последующей инфузией 0,5 мг / кг / ч) по сравнению с плацебо у детей, поступающих в отделение неотложной помощи с астматическим статусом, не продемонстрировало различий в клинических показателях астмы. 71
Если у ребенка астма прогрессирует до дыхательной недостаточности, сам процесс интубации может быть чрезвычайно опасным. В то время как отрицательное внутригрудное давление (присутствует во время спонтанной вентиляции) помогает увеличить венозный возврат в правое предсердие, переход на вентиляцию с положительным давлением может сжимать правое предсердие, уменьшая преднагрузку на сердце и понижая сердечный выброс, а также может привести к остановке сердца. Кетамин может быть особенно полезен пациентам с астмой с дыхательной недостаточностью, сочетая бронходилатацию с седативными и обезболивающими, которые могут потребоваться интубированному пациенту.В отличие от других седативных средств, которые могут использоваться для интубации, кетамин может помочь поддерживать предварительную нагрузку на сердце за счет периферической вазоконстрикции из-за высвобождения катехоламинов. Потенциальные недостатки использования кетамина у пациентов с искусственной вентиляцией легких включают повышенный объем секреции и риск делирия при длительном применении кетамина.
Небольшие исследования, упомянутые здесь, показывают, что кетамин, вероятно, имеет некоторое преимущество при бронходилатации и клинических симптомах при введении в дозе, равной или приближающейся к 1 мг / кг.Тем не менее, исследования не предоставляют доказательств относительно кетамина по сравнению с другими вспомогательными методами лечения астмы или влияния кетамина на долгосрочные клинические исходы; также нет никаких рандомизированных контрольных испытаний, поддерживающих использование кетамина в более высоком диапазоне доз.
Heliox
Слышимое свистящее дыхание у астматиков вызывается турбулентным потоком в дыхательных путях меньшего размера, что представляет собой состояние с высоким сопротивлением. Во время турбулентного потока газы с меньшей плотностью имеют меньшее сопротивление потоку. Ламинарный поток — это состояние с более низким сопротивлением, при котором воздушный поток более организован, а сопротивление потоку в первую очередь зависит от диаметра дыхательных путей.Переход от ламинарного к турбулентному потоку определяется числом Рейнольдса и является функцией диаметра, вязкости и плотности дыхательных путей. 72 Газы с более низкой плотностью более склонны к ламинарному потоку, как и газы, проходящие через дыхательные пути большего диаметра или с более высокой вязкостью. 72,73
Гелиокс (гелий-кислородная смесь) — это недорогая газовая смесь, в которой азот, примерно 79% молекул атмосферного воздуха, заменен гелием. Поскольку гелий в 7 раз легче, чем N 2 , образующийся газ менее плотен (с номинальным изменением вязкости) и, следовательно, улучшает поток в турбулентных состояниях и с большей вероятностью приведет к ламинарному потоку с низким сопротивлением через небольшие дыхательные пути.Эффект от гелиоксотерапии должен быть довольно мгновенным, потому что азот должен вымываться из дыхательных путей за несколько вдохов. После достижения ламинарного потока (т. Е. Хрипы утихли) достигается максимальный эффект. Поскольку O 2 по весу аналогичен азоту, польза гелиокса уменьшается по мере увеличения F IO 2 , и остается меньшая доля гелия (рис. 2). Неясно, при каком F IO 2 клиническая польза гелиокса сводится на нет, но многие поставщики ставят под сомнение полезность, когда доля гелия падает ниже 0.5. Heliox представляет собой небольшой риск, но за доставкой следует внимательно следить, поскольку расходомеры на некоторых устройствах не могут быть откалиброваны для различной плотности газа, и поэтому подаваемый поток может быть ненадежным. Кроме того, длительное использование гелиокса может предотвратить турбулентное течение во время кашля и, следовательно, препятствовать очищению дыхательных путей. Наконец, газообразный гелий — ограниченный ресурс, и поэтому его следует использовать разумно.
Рис. 2.Относительная плотность газовой смеси азот-кислород по сравнению с газовой смесью гелий-кислород.
Рандомизированное исследование гелиокса (70% гелия / 30% O 2 ) 1996 г. у пациентов с астмой, госпитализированных в больницу, продемонстрировало небольшое, но значительное улучшение максимальной скорости выдоха, но не было отмечено никаких различий в клинических исходах, включая одышку. оценки. 74 Другое рандомизированное исследование, опубликованное год спустя, продемонстрировало, что гелиокс (80% гелий / 20% O 2 ) улучшил показатели одышки и привел к уменьшению парадоксального пульса, что было обратимым при прекращении лечения гелиоксом. 75 В контрольной группе таких изменений не отмечалось, и, кроме того, эти авторы сообщили, что клинические улучшения, наблюдаемые при добавлении гелиокса, привели к тому, что 3 пациента избежали интубации. В отдельном исследовании интубированных астматиков добавление гелиокса в схему вентилятора привело к значительному снижению как пикового давления на вдохе, так и P aCO 2 . 76 Однако Кокрановский обзор 6 исследований (1 педиатрических, 5 взрослых или смешанных возрастов) 2003 г., в которых подробно описывалось использование гелиокса в отделениях неотложной помощи при астме, не обнаружил значительных различий в функции легких у субъектов, получавших гелиокс. 77 Рандомизированное исследование 2010 г. (гелиокс против воздуха) с участием 42 детей, поступивших в педиатрическое отделение интенсивной терапии, также не продемонстрировало разницы во времени до улучшения клинических показателей астмы или времени до отделения интенсивной терапии или выписки из больницы. 78
Еще одно теоретическое преимущество гелиокса связано с проведением ингаляционной терапии, с предположением, что гелиокс может улучшить транспортировку этих лекарств в малые дыхательные пути. 79 Kim et al. 80 рандомизированных субъектов, получавших непрерывный альбутерол, доставляемый либо 100% кислородом, либо гелиоксом, и были отмечены улучшенные показатели легочного индекса и более высокая вероятность выписки из больницы в течение 12 часов в группе гелиокса.Эти результаты не были воспроизведены в рандомизированном исследовании 2006 года с использованием показателей индекса одышки и частоты госпитализаций в качестве исходов, 81 , но когортное исследование 2010 года засвидетельствовало более короткую продолжительность пребывания в отделении неотложной помощи для тех субъектов, которые получали распыление с помощью гелиокса (а не кислорода). сальбутамол. 82 Наконец, в систематическом обзоре 2014 года терапии распыляемыми β-агонистами, управляемыми гелиоксом, у детей и взрослых сообщалось об увеличении пикового потока выдоха и снижении количества госпитализаций по поводу гелиокса по сравнению с контрольными группами, с тенденцией к большей пользе у пациентов с более тяжелым поражением. . 83
Следует отметить, что применение гелиокса не было согласованным в этих исследованиях с варьированием F IO 2 смеси гелиокса и контрольного газа, а также различными инструментами клинической оценки, используемыми для оценки эффективности лечение гелиоксом. Учитывая противоречивые результаты и неоднородность дизайна исследования, трудно сделать какие-либо твердые выводы относительно использования гелиокса, особенно за пределами отделения неотложной помощи. Учитывая низкую стоимость и незначительный профиль побочных эффектов, целесообразно назначать гелиокс пациентам с астматическим статусом, страдающим респираторным дистресс-синдромом, рефрактерным к более стандартным методам лечения, но прием газа следует прекратить, если после короткого терапевтического испытания не наблюдается улучшения клинического статуса.
Неинвазивная респираторная поддержка
Неинвазивная респираторная поддержка, включая неинвазивную вентиляцию (НИВ) и назальную канюлю с высоким потоком (HFNC), все чаще используется при многих формах дыхательной недостаточности, включая тяжелую острую астму. Положительное давление снижает работу дыхания, помогая респираторным мышцам, улучшает оксигенацию за счет повышения среднего давления в дыхательных путях и, при обструктивном заболевании легких, может способствовать газообмену путем механического стентирования дыхательных путей. 84 Хотя возможность избежать инвазивной вентиляции является реальным преимуществом этого подхода, неинвазивная вентиляция у детей часто бывает сложной из-за необходимости множества интерфейсов надлежащего размера и непереносимости устройства некоторыми детьми.
Использование НИВ у детей и взрослых с астматическим статусом было связано со снижением P aCO 2 и частоты дыхания и сопутствующим повышением pH и P aO 2 . 85–91 Улучшение этих параметров обычно отмечается в течение первых 1-2 часов терапии и сохраняется с возможным постоянным улучшением в течение всего периода терапии (в этих исследованиях колеблется от 2 до 48 часов). НИВЛ обычно назначается пациентам, не отвечающим на начальную терапию астмы, и у меньшинства из этих пациентов требуется интубация и инвазивная механическая вентиляция.Некоторым из них могут потребоваться анксиолитики или легкие седативные средства, чтобы переносить устройство. Редкие осложнения могут включать синдромы утечки воздуха, включая пневмоторакс, пневмомедиастинум или подкожную эмфизему. 90
Beers et al. 89 сообщили о своем опыте использования НИВЛ у 83 детей в отделении неотложной помощи с астматическим статусом, резистентным к другим методам лечения. Принимая во внимание, что 12% субъектов не переносили устройство, 22% субъектов, получавших НИВЛ, продемонстрировали достаточное клиническое улучшение, чтобы изменить свое запланированное расположение в отделениях интенсивной терапии в палаты общего профиля.Небольшое рандомизированное контрольное исследование НИВ по сравнению с традиционной терапией для детей с астматическим статусом в 2012 году отметило значительное улучшение частоты дыхания и потребности в оксигенации в группе НИВ. 92
HFNC обычно определяется как поток нагретого увлажненного газа, доставляемый через назальную канюлю при потоке, превышающем инспираторную потребность пациента. 93 В дополнение к обеспечению переменного низкого уровня положительного давления, еще одним предлагаемым преимуществом HFNC является непрерывное вымывание анатомического мертвого пространства.В моделях на животных было продемонстрировано, что увеличение потока через HFNC способствует удалению CO 2 независимо от давления в трахее. 94 Непонятно, при каком потоке анатомическая промывка завершается и достигается максимальный эффект. Хотя HFNC не обеспечивает такой же устойчивой поддержки положительным давлением, как NIV, он часто намного лучше переносится пациентами с более удобным интерфейсом (назальная канюля против лицевой маски).
Хотя существует немного данных об использовании HFNC у детей с астматическим статусом, было показано, что HFNC снижает работу дыхания у взрослых с ХОБЛ, обструктивным заболеванием, которое имеет некоторые физиологические характеристики с астмой. 95 Несколько ретроспективных обзоров использования HFNC у детей включают пациентов, страдающих астмой, в серии их случаев, демонстрируя универсальность его использования при астматическом статусе и предлагая приемлемый профиль безопасности. 96,97 Данные, оценивающие его эффективность в этой популяции, отсутствуют.
Углубленное обсуждение различных методов доставки небулайзерных аэрозолей во время неинвазивной респираторной поддержки — тема, выходящая за рамки настоящего обзора, но это область, требующая дальнейшего изучения.Для NIV технические аспекты, влияющие на доставку аэрозоля, могут включать дизайн интерфейса и уплотнение, тип небулайзера и расположение небулайзера в контуре. 98–100 Некоторые исследования предполагают улучшение доставки аэрозольных препаратов в сочетании с НИВ; однако трудно отличить преимущества положительного давления от любых изменений в доставке аэрозолей. HFNC может также повлиять на проведение ингаляционной терапии. В модели in vitro Perry et al 101 обнаружили снижение доставки распыленного альбутерола с увеличенным потоком через различные устройства HFNC, что было подтверждено в отдельном исследовании in vitro, проведенном Reminiac. 102 Тем не менее, не существует клинических исследований, подробно описывающих влияние доставки аэрозоля HFNC на исходы лечения пациентов.
Текущие данные свидетельствуют о том, что НИВЛ безопасна для детей с астматическим статусом и улучшает симптомы респираторного дистресса. Нет данных относительно долгосрочных результатов, включая необходимость инвазивной искусственной вентиляции легких, интенсивной терапии или пребывания в больнице. Кроме того, влияние неинвазивной респираторной поддержки на ингаляционную терапию остается неясным, и нет исследований, сравнивающих эффективность неинвазивной респираторной поддержки с другими вспомогательными методами лечения, упомянутыми в этом обзоре.Одно последовательное сообщение в литературе, описывающее использование неинвазивной респираторной поддержки, сосредоточено на сроках эффективности. Подавляющее большинство пациентов продемонстрируют улучшение в течение 1-2 часов, 93,103 , и в отсутствие этого улучшения лечение следует усилить, а не продолжать с неинвазивной респираторной поддержкой без других вмешательств. Точно так же состояние пациента, которое первоначально демонстрирует улучшение при получении неинвазивной респираторной поддержки, может позже ухудшиться, поэтому это пациенты, за которыми необходимо внимательно следить на предмет признаков надвигающегося отказа, включая усиление дыхательной работы, снижение психического статуса или неспособность поддерживать F IO 2 <0.6. Принимая во внимание эти предостережения, у большинства пациентов с астматическим статусом с рефрактерным статусом целесообразно провести тщательный мониторинг исследования HFNC и / или NIV.
Ингаляционные анестетики
Если у пациента астматический статус прогрессирует до дыхательной недостаточности, вдыхание анестезирующих газов может предоставить другой вариант для усиления бронходилатации. Ингаляционные анестетики, такие как изофлуоран, галотан и севофлуран, являются мощными релаксантами гладких мышц и могут помочь облегчить сужение бронхов. 104 Изофлуран и севофлуран чаще всего сообщаются с опасениями, что галотан может вызвать серьезную гепатотоксичность, особенно при длительном применении.Из-за их системных эффектов основными побочными эффектами ингаляционных анестетиков являются снижение системного сосудистого сопротивления и гипотония. Злокачественная гипертермия — редкое и потенциально смертельное осложнение ингаляционных анестетиков.
В нескольких отчетах о случаях показано успешное применение ингаляционных анестетиков у детей и молодых людей с рефрактерным астматическим статусом, 105–112 , но не существует клинических испытаний, сравнивающих эту терапию с другими вспомогательными методами лечения. Ретроспективные обзоры показывают, что появление этих газов неизменно связано с уменьшением P aCO 2 примерно на 20 мм рт.ст. и сопутствующим повышением pH примерно до 0.1 в течение нескольких часов после администрации. 105,108,111,113–115 Крупнейшая на сегодняшний день серия случаев включает 31 ребенка в течение 15-летнего периода, в котором дети получали изофлуран в течение средней продолжительности 55 часов (диапазон 1–181 час) и подвергались инвазивной вентиляции в среднем в течение 252 часов. (диапазон 16–1 444 ч). У большинства (77%) этих детей развилась артериальная гипотензия, требующая вазопрессорной поддержки, но все выжили без долгосрочных последствий. Char et al., , 104, использовали административную базу данных Педиатрических информационных систем для сравнения центров, использующих ингаляционные анестетики для> 10% пациентов с астмой с механической вентиляцией, с теми, которые редко используют ингаляционные анестетики, и не обнаружили различий в смертности, но отметили, что использование ингаляционных анестетиков анестезия была связана с большей продолжительностью вентиляции, продолжительностью пребывания в больнице и затратами.
Из-за высокой стоимости этой терапии и возможности побочных эффектов, ингаляционные анестетики обычно сохраняются в качестве спасательной терапии для пациентов с астматическим статусом, не получающих других дополнительных методов лечения. Для предоставления ингаляционных анестетиков за пределами операционной требуется специальное оборудование для предотвращения выброса активного газа в окружающую среду и воздействия на медицинских работников. 116 Таким образом, многие отделения интенсивной терапии будут ограничены в своей способности проводить такую терапию или должны будут полагаться на оборудование и персонал, взятые в аренду из операционной.
Экстракорпоральная мембранная оксигенация
Инвазивная механическая вентиляция может быть сложной задачей для пациента, страдающего астмой, потому что установка искусственного дыхательного пути не обходит пораженные более мелкие дыхательные пути и фактически может вызвать дальнейший бронхоспазм. Захват газа является обычным явлением, что приводит к ухудшению гиперкарбии, гиперинфляции легких и повышенному риску повреждения легких, вызванного вентилятором. Стратегии вентиляции у пациентов с астмой противоречивы и выходят за рамки данной статьи, но следует сосредоточить внимание на оптимизации времени выдоха, чтобы обеспечить полный выдох.Когда медицинские работники не могут достичь клинических целей с помощью аппарата ИВЛ, экстракорпоральная мембранная оксигенация (ЭКМО) является технологической поддержкой, которую можно использовать для обеспечения или дополнения газообмена.
Действуя по существу как третье легкое, ЭКМО использует большие катетеры для забора деоксигенированной венозной крови от пациента и пропускания этой крови через газообменник с искусственной мембраной, который добавляет кислород и удаляет диоксид углерода из крови. Затем насыщенная кислородом кровь возвращается пациенту в венозную или артериальную систему.Из-за рисков, связанных с ЭКМО, включая кровотечение и неврологический инсульт, ЭКМО обычно используется в качестве спасательной терапии при рефрактерной дыхательной недостаточности. 117,118
Как и механическая вентиляция, ЭКМО обеспечивает поддержку легких и / или сердца, пока пациент восстанавливается после определенного болезненного процесса или инсульта. Также как и механическая вентиляция легких, ЭКМО не делает ничего для лечения или обращения вспять процесса основного заболевания, хотя ЭКМО обычно позволяет медработникам уменьшить настройки вентилятора и «дать отдых» легким.Поскольку рефрактерный астматический статус является кратковременным, самоограничивающимся заболеванием, он концептуально является идеальным заболеванием для поддержки ЭКМО. Если во время обострения астмы пациент может получить адекватную оксигенацию и вентиляцию легких без значительного повреждения легких, вероятность долгосрочного восстановления легких велика.
В нескольких отчетах описывается успешное использование ЭКМО при рефрактерном астматическом статусе 119–122 ; тем не менее, существует ограниченное количество систематических данных, оценивающих эффективность этой терапии.Самый большой набор данных, описывающих исходы ЭКМО при астме, — это реестр Организации экстракорпорального жизнеобеспечения, который собирает добровольно предоставленные данные из> 100 международных центров ЭКМО. 123 Хотя смертность среди пациентов с астмой, нуждающихся в поддержке ЭКМО, значительна, 17% для 72 детей с астматическим статусом, зарегистрированных в реестре Организации экстракорпорального жизнеобеспечения, важно отметить, что эта популяция обычно терпит неудачу при других методах лечения астматического статуса. и поэтому имеет очень высокую ожидаемую смертность.Фактически, среди детей, помещенных на ЭКМО по поводу дыхательной недостаточности, диагноз астматического статуса является независимым предиктором выживаемости с выживаемостью 83% по сравнению с выживаемостью 56% для всех педиатрических пациентов с респираторной ЭКМО. 124
Поскольку астма — это в первую очередь заболевание вентиляции легких, не затрагивающее альвеолы, гиперкарбия обычно представляет собой большую проблему, чем оксигенация. По этой причине, а также по общему профилю безопасности, вено-венозная ЭКМО обычно является предпочтительным подходом для пациентов с астмой, которым требуется ЭКМО. 117 Высокая растворимость диоксида углерода в воде позволяет искусственной мембране быть высокоэффективной при удалении диоксида углерода, а адекватная вентиляция может быть достигнута при более низких кровотоках, чем при веноартериальной ЭКМО. Экстракорпоральное удаление углекислого газа, иногда называемое «респираторным диализом», представляет собой систему, аналогичную венозной ЭКМО, но использующую меньшую венозную канюлю и меньший поток, а также сообщалось в отдельных отчетах о случаях как успешный способ терапии астматического статуса. 125,126 Третий вариант экстракорпоральной поддержки, который следует учитывать пациентам с астмой, — это экстракорпоральная помощь легких без помпы, при которой собственное артериальное давление пациента используется для продвижения крови через газообменную мембрану, возвращая насыщенную кислородом и вентилируемую кровь в венозную систему пациента. Возможные преимущества этой стратегии включают отсутствие механического насоса и снижение потребности в антикоагуляции. Несмотря на то, что существует несколько сообщений о случаях, демонстрирующих успешное применение этого метода у взрослых, страдающих астмой, 127–129 данных у детей отсутствуют.
Наконец, ЭКМО может быть полезной для тех пациентов с астмой, у которых возникают осложнения искусственной вентиляции легких с дополнительным повреждением легких, включая синдромы утечки воздуха. Синдромы утечки воздуха редки как основная причина использования ЭКМО за пределами неонатального периода, но сообщения о случаях демонстрируют успешное использование ЭКМО для синдромов утечки воздуха, что может означать аналогичный успех для пациентов с повреждением легких, вызванным вентилятором, в условиях статуса. астматик. 130–133
Подобно ингаляционным анестетикам, экстракорпоральная поддержка легких представляет собой дорогостоящую и ресурсоемкую терапию, которая клинически показана только пациентам с астмой, не получающим других методов лечения.К сожалению, некоторые из этих пациентов могут потерпеть неудачу из-за осложнений от ИВЛ, которые могут быть вторичными по сравнению с неоптимальным лечением. Однако у этих пациентов и для некоторых других пациентов с астмой имеются благоприятные доказательства того, что ЭКМО может быть терапией, спасающей жизнь, с минимальной долгосрочной заболеваемостью.
Обсуждение
Несмотря на высокую распространенность астматического статуса в качестве показания для посещения отделения неотложной помощи, госпитализации и госпитализации в ОИТ, по-прежнему не хватает четких рекомендаций по соответствующим методам лечения для эскалации помощи, когда пациенты не поддаются начальному лечению ингаляционного альбутерола, системных кортикостероидов и ипратропия.В рекомендациях NIH -1 рекомендуется рассмотреть возможность дополнительной терапии для пациентов, у которых наблюдается неполный или плохой ответ на начальную терапию альбутеролом, кортикостероидами и ипратропием, но не дается никаких дополнительных указаний относительно пути эскалации.
Таблица 1 суммирует механизм действия, потенциальные риски и преимущества, а также класс доказательств для каждого из описанных выше дополнительных методов лечения. Несмотря на то, что существует большое количество рандомизированных исследований относительно использования этих методов лечения астматического статуса, значительная гетерогенность этих исследований ограничивает нашу способность делать окончательные выводы относительно эффективности и полезности большинства дополнительных методов лечения.Несколько исследований предполагают большую пользу этих методов лечения у более тяжелых пациентов, но абсолютное количество этих пациентов с более тяжелой астмой в любом данном исследовании, как правило, слишком мало, чтобы делать окончательные выводы.
Таблица 1.Дополнительные методы лечения астматического статуса
Учитывая потенциальные риски, присущие пациентам с астмой с инвазивной вентиляцией легких, следует по возможности стараться избегать интубации. В целом, 12% пациентов, интубированных по поводу астматического статуса, имели осложнения во время госпитализации, а 4% умерли. 4 Несмотря на скудность данных о дополнительных методах лечения, перечисленных в этой статье, большинство из них имеют низкий риск, и разумно рассмотреть возможность использования большинства этих методов лечения пациентов с астмой при надвигающейся дыхательной недостаточности. На рисунке 3 представлена предлагаемая карта помощи для продвижения дополнительных методов лечения астмы с учетом их потенциальной пользы и связанных рисков. Аналогичные карты ухода были опубликованы Wong et al. 6 и Nievas et al. 135 Тем не менее, следует отметить, что маловероятно, что эти методы лечения будут постоянно предлагать значительные преимущества с точки зрения ОИТ или пребывания в больнице.
Рис. 3.Путь к развитию методов лечения астмы. ЭКМО = экстракорпоральная мембранная оксигенация.
Учитывая остающееся равновесие для многих из этих вспомогательных терапий, даже в условиях тщательного изучения литературы, клинический акцент сначала следует сместить на стандартизацию подхода к лечению астматического статуса. Значительная неоднородность существует в использовании дополнительных методов лечения астмы. 136 Даже когда передовая практика четко определена и основана на фактических данных, например, раннее введение ингаляционных β-агонистов и кортикостероидов, достижение оптимального применения этих методов лечения часто бывает непоследовательным.В ретроспективном обзоре детей, интубированных по поводу астматического статуса в 8 детских больницах, Newth et al 4 отметили, что до интубации только 69% детей получали кортикостероиды, 75% получали ингаляционный альбутерол с перерывами, 45% получали альбутерол непрерывно и 36% получил ипратропий. Из более чем 13 500 детей, поступивших с диагнозом астмы в критическом состоянии, зарегистрированных в базе данных педиатрических информационных систем, только 87% субъектов получали ингаляционный альбутерол и 86% получали стероиды во время госпитализации. 137 В той же базе данных использование дополнительных методов лечения широко варьировало: ипратропий (69%), магний (42%), тербуталин (22%), метилксантины (6%) и гелиокс (9%). В то время как 13% получали инвазивную вентиляцию, только 5% получали неинвазивную вентиляцию.
Стандартизация методов лечения астмы может иметь уникальные преимущества для каждой части посещения больницы. Обеспечение последовательного и раннего введения ингаляционного альбутерола, системных стероидов и ингаляционного ипратропия с последующим внутривенным введением магния у не отвечающих на лечение, вероятно, имеет наибольший потенциал для остановки прогрессирования обострения астмы и потенциально предотвращения госпитализации.Кроме того, если пациенту требуется госпитализация, раннее введение магния может улучшить его траекторию и предотвратить интубацию в некоторых из наиболее тяжелых случаев. Стандартизация эскалации терапии после поступления в ОИТ позволит нам лучше понять, какие из этих дополнительных методов лечения могут принести наибольшую пользу, и поможет определить оптимальные стратегии лечения. Когда пациент находится в фазе выздоровления от болезни, стандартизация процесса отлучения от груди может привести к более последовательному сокращению лечения с потенциальным улучшением сроков интенсивной терапии и пребывания в больнице.Существует несколько клинических оценок астмы, которые могут служить объективным показателем как для эскалации, так и для прекращения лечения. 138–141 Дополнительную терапию обычно прерывают в порядке, обратном порядку, в котором они были добавлены, так что последнее добавление является первым, кого отнимают от груди. Однако следует учитывать соответствующие преимущества и токсичность каждой терапии для этого пациента, причем методы лечения, обеспечивающие низкую пользу или высокую токсичность, имеют приоритет при отлучении от груди.
Наконец, усилия по оптимизации амбулаторной помощи при астме до ее поступления в больницу могут оказать глубокое влияние на заболеваемость и смертность от астмы, а также на общие расходы на здравоохранение, связанные с астмой.В то время как некоторые из этих усилий могут быть сосредоточены на оптимизации стратегий приема лекарств, важность обучения астме невозможно переоценить. 142–144 Просвещение по астме с участием пациентов — лучшая стратегия для обеспечения последовательной доставки тех лекарств, которые могут предотвратить обострения астмы, а также для помощи в раннем выявлении и лечении обострений астмы. 145
Резюме
Раннее вмешательство с использованием ингаляционных β-агонистов и ипратропия и системных стероидов для детей, поступающих в отделение неотложной помощи с умеренным и тяжелым обострением астмы, имеет наилучший потенциал для остановки прогрессирования астматического статуса.Если после начального лечения не отмечается клинического улучшения, следует ввести болюсную дозу магния внутривенно. По-прежнему недостаточно данных, чтобы руководствоваться применением конкретных дополнительных методов лечения, если симптомы сохраняются или требуется госпитализация; тем не менее, могут быть рассмотрены различные методы лечения, которые могут принести незначительную пользу самым тяжелым пациентам.
Обсуждение
Берлински:
Спасибо за презентацию. Прежде всего, я хотел бы полностью согласиться с вашей рекомендацией использовать методы принятия решений на основе протоколов и баллов для перехода из отделения неотложной помощи в педиатрическое отделение интенсивной терапии, а затем в педиатрические отделения для подготовки к выписке.Невозможно переоценить важность совместной работы. Но это настоящая проблема для многих учреждений, где 3 или 4 группы должны договориться о том, что они собираются делать. Второе: есть ли у вас данные о повторных курсах внутривенного введения магния? Я вижу, что его часто используют после того, как его опробовали в отделении неотложной помощи, и просто хотел узнать ваши мысли.
Rehder:
Я определенно согласен с необходимостью протоколирования. Снова и снова в различных условиях, не только при астме, было показано, что протоколы улучшают медицинское обслуживание во многих отношениях.Для магния, к сожалению, нет подтверждающих данных для повторных доз. Это, безусловно, испытали, и это касается использования настоев с теоретической пользой для поддержания высокого уровня магния. Но на самом деле единственные данные о инфузиях магния демонстрируют, что он хорошо переносится, но достоверных данных об исходах нет.
Sweet:
Спасибо, отличный обзор. Когда дело доходит до протоколирования, мне интересно, могут ли усилия по возмещению затрат на основе качества способствовать развитию этого процесса? И говорят ли люди о том, чтобы действительно зафиксировать некоторые из вещей, которые вы указали на слайде, как часть мер по процессу лечения астмы, которая составляет значительный компонент неотложной помощи в большинстве наших детских больниц.
Rehder:
Нам нужно больше исследований, таких как Derek Wheeler, 1 , в которых сравнивалась экономическая эффективность двух разных лекарств. Если два метода лечения имеют одинаковую эффективность, то важным аспектом протоколов должно быть то, какой из них будет дешевле. Надеюсь, мы сможем получить наш собственный опыт [Duke Children’s] с опубликованным протоколом лечения астмы и начать разговор не только о снижении затрат за счет протоколирования, но и о лучшем уходе и результатах.
Panitch:
Спасибо за отличный разговор, Кайл. На вашем пути схема в конечном итоге перешла к ЭКМО, без промежуточных этапов интубации или механической вентиляции на пути?
Rehder:
Хотя я специально не говорил об интубации в презентации, мы говорили об ингаляционных анестетиках, и, очевидно, это было бы невозможно без искусственной вентиляции легких. Фактически, версия карты лечения, которая будет включена в документ, имеет интубацию, указанную в настройке использования ингаляционных анестетиков или ЭКМО.Искусственная вентиляция легких у больного астмой — это большая тема сама по себе, которая может быть довольно сложной и может привести к задержке газов и баротравме. Однако, насколько мне известно, об инициировании ЭКМО перед интубацией пациента с астмой не сообщалось, но это, безусловно, интересная идея. В этой статье я упоминаю экстракорпоральное удаление углекислого газа и некоторые другие менее инвазивные системы поддержки ЭКМО. Поскольку этим пациентам часто в первую очередь требуется удаление CO 2 , вы можете имитировать модель респираторного диализа, которая используется в некоторых европейских странах.Этот метод влечет за собой размещение катетера размером с диализ, в отличие от канюли ЭКМО большего размера, и использование гораздо меньшего потока. С помощью этой модели вы сможете снизить уровни CO 2 настолько, чтобы потенциально предотвратить интубацию и связанные с ней заболевания. Думаю, это очень интересная концепция, но реальных данных нет.
Stokes:
У нас была награда за инновации CMS в 3 миллиона долларов, которая помогла нам разработать программу лечения астмы с высоким риском, и я думаю, что ключевым компонентом этого было предоставление детям, которые неоднократно посещали отделения неотложной помощи, другой системы, чтобы мог позвонить в нерабочее время.Им фактически дали стероиды как часть гранта, прежде чем они отправятся в отделение неотложной помощи, и мы смогли сократить количество госпитализаций, посещений отделений неотложной помощи и сократить расходы за счет наличия системы до прибытия в отделение неотложной помощи. отделение. Одна из вещей, которые мы делаем в рамках клинической оценки высокого риска, — это тесты функции легких (PFT). Мы видим много разных закономерностей, когда проводим PFT пациентов с астмой высокого риска, некоторые из которых ходят с довольно значительными легочными аномалиями, а другие совершенно нормальны в периоды между обострениями.Я никогда не видел связи между функцией легких перед посещением отделения неотложной помощи и изменением нашего терапевтического подхода в отделении неотложной помощи. Мы как бы придерживаемся одного подхода к лечению астмы, когда они попадают в отделение неотложной помощи, но астма — это не одно и то же, и наличие этих схем, доступных врачу отделения неотложной помощи, может изменить терапевтический подход.
Rehder:
Я думаю, что это еще одна интересная концепция; честно говоря, я не так хорошо знаком с амбулаторной литературой, потому что я не там практикую, но, просматривая это, я не видел ничего опубликованного об оценке в отделении неотложной помощи, которая использовалась для руководства терапией.Баланс между индивидуальным уходом и стандартизированным уходом всегда является проблемой. Если бы вы могли ориентироваться на детей с разными генетическими полиморфизмами, которые изменяют их реакцию на лекарства, я думаю, что на это стоит действительно смотреть в будущем. Есть ли определенная популяция, которая — из-за своего полиморфизма или этнического происхождения — могла бы действительно хорошо реагировать на метилксантины, но у вас есть другая группа, которая не реагирует? Можем ли мы использовать PFT для оценки или идентификации этих пациентов до того, как они появятся в отделении неотложной помощи? Я считаю, что это действительно отличные концепции, которые необходимо изучить.
Стокса:
Интересная идея. Мы изучаем обратимость бронходилататоров в этой популяции, но было бы интересно посмотреть на метилксантин или даже посмотреть на обратимость с другими агентами.
Rehder:
Большинство данных, которые я видел, относятся именно к генетическим полиморфизмам. Они часто обращаются к «острой асфиксической астме» или «астме с почти смертельным исходом», описываемым как пациенты, которые быстро переходят от клинического состояния к необходимости интубации, в отличие от тех, у кого приступ астмы начинается постепенно. -UPS.Конечно, я думаю, что интерес к различным фенотипам астмы растет.
Stokes:
Одним из аспектов классической триады астмы, классической диаграммы Неттера острой астмы, который вы не рассматривали, является обструкция слизью. Знаете ли вы какую-либо литературу, в которой рассматриваются возможные методы лечения, направленные против обструкции слизью?
Rehder:
Я не знаю какой-либо литературы, которая действительно посвящена этому. Единственное реальное лекарство из этих дополнительных методов лечения, которое в первую очередь касается чего-то другого, кроме бронхоспазма, — это ипратроприум, который должен уменьшить выработку слизи.Большинство других сосредоточены на бронхоспазме или бронхоспазме.
Федор:
Я бы также включил обучение пациентов в вашу дополнительную терапию, потому что есть много доказательств, касающихся проблемы повторной госпитализации, связанной с астмой, из-за плохой приверженности и плохого понимания процесса болезни.
Rehder:
Я думаю, что это отличная идея; люди могут не рассматривать образование как дополнительную терапию, но его действительно можно рассматривать как таковую.
Berlinksi:
Можете ли вы прокомментировать бесполезность мегадоз стероидов? К сожалению, он до сих пор широко используется, особенно когда пациент плохо себя чувствует.
Rehder:
Мне не известны какие-либо данные, подтверждающие преимущество более высоких доз стероидов, чем типичная доза 2 мг / кг / день преднизона (или его эквивалента). Я согласен с тем, что часто люди говорят: «Немного — хорошо, значит, больше — значит лучше», но все, что мы, вероятно, делаем — это увеличиваем риск побочных эффектов от стероидов.
Walsh:
Многие из этих пациентов, невосприимчивых к нашим стандартным методам лечения, имеют другие проблемы, такие как пневмония или какое-либо вирусное заболевание.Как вы относитесь к антибиотикам и тому подобному к тем парням, которые не поддаются стандартной терапии?
Rehder:
Моя личная позиция — я стараюсь избегать приема антибиотиков. Чаще всего мы осознаем, что это вирусный триггер, а не бактериальная причина. Одна вещь, на которую я потенциально мог бы обратить внимание, — это азитромицин — есть некоторые свидетельства того, что он обладает противовоспалительными свойствами, и он, безусловно, использовался для этого у пациентов с муковисцидозом. Другой аспект — любые бактериальные инфекции, которые с большей вероятностью могут вызвать хрипы, и это было бы нетипично.Возможно, стоит подумать об этом, но если на рентгенограмме грудной клетки нет настоящего очагового инфильтрата — а не ателектаза правой средней доли, который часто ошибочно принимают за инфильтрат. Или, если после открытия дыхательных путей сохраняется гипоксия, это, скорее всего, объясняется истинным альвеолярным отростком. В остальном я бы действительно старался держаться подальше от антибиотиков. [Примечание автора: впоследствии к рукописи был добавлен раздел об антибиотиках от острой астмы.]
Уолш:
Это так сложно понять, особенно когда мы видим их в отделении интенсивной терапии; они изнурены, и у них может быть ателектаз из-за усталости, или может быть, что у них есть основная пневмония, которая спровоцировала весь эпизод.Нам кажется трудным разобраться, когда мы продолжаем идти по пути астмы, астмы, астмы и делать такие вещи, как изофлуоран и даже ЭКМО, не думая о других стратегиях лечения пневмонии.
Rehder:
За свою карьеру я видел двух пациентов, которым вводили ЭКМО по поводу астмы. В качестве сопровождающего я надела его; вторая — позже я принимал участие в ее лечении, и они оба принимали антибиотики во время курса лечения, несмотря на то, что у нас не было никаких доказательств бактериальной инфекции.Но опять же, вы попадаете в категорию «риск / польза», и очевидно, что когда вы достигли этой точки тяжести, вы выйдете за пределы типичного ожидаемого курса для пациента с астмой, поэтому в этом пациенте есть что-то уникальное.
Berlinski:
Полезно использование методов очистки дыхательных путей, таких как положительное давление на выдохе, у очень избранной группы пациентов со значительной бронхореей. Я хочу вернуться к употреблению больших доз стероидов; Вероятно, есть данные за 10 или 15 лет, которые показывают, что увеличение доз просто вызывает больше побочных эффектов, гипертонию, повышение уровня глюкозы, а не каких-либо дополнительных преимуществ.Это связано с отсутствием дополнительных преимуществ внутривенного введения стероидов по сравнению с пероральным путем.




 В случаях, когда требуется одновременное введение ацетилцистеина и антибиотика, используют либо другую форму препарата: «Флуимуцил-антибиотик», либо применяют иные муколитические препараты, совместимые с антибиотиками (к примеру, на основе амброксола). Следует отметить, что применение препаратов ацетилцистеина снижает токсическое действие парацетамола на печень.
В случаях, когда требуется одновременное введение ацетилцистеина и антибиотика, используют либо другую форму препарата: «Флуимуцил-антибиотик», либо применяют иные муколитические препараты, совместимые с антибиотиками (к примеру, на основе амброксола). Следует отметить, что применение препаратов ацетилцистеина снижает токсическое действие парацетамола на печень.







 При возникновении головокружения, необходимо прервать ингаляцию на 1-2 минуты.
При возникновении головокружения, необходимо прервать ингаляцию на 1-2 минуты.
 При выраженном отеке слизистой оболочки гортани возможно применение ингаляций до 4 раз в день.
При выраженном отеке слизистой оболочки гортани возможно применение ингаляций до 4 раз в день.
 Длительность ингаляции 10 минут.
Длительность ингаляции 10 минут. Флуимицил-антибиотик ½ флакона препарата на ингаляцию, 2 раза в день.
Флуимицил-антибиотик ½ флакона препарата на ингаляцию, 2 раза в день.
