Назван самый ранний признак COVID-19
Испанские ученые выяснили, что сухость и неприятные ощущения в носу возникают у заразившихся коронавирусом еще до того, как больной потеряет обоняние и вкус.
По мнению специалистов, эти симптомы можно считать самыми ранними признаками COVID-19.
Изменение или полную потерю запаха и вкуса отмечают примерно 80% больных COVID-19. Ученые это связывают с поражением вирусом эпителия носоглотки, клетки которого несут ACE2 — ангиотензинпревращающий фермент 2, рецептор, с которым соединяется спайковый белок вируса SARS-CoV-2, чтобы проникнуть в здоровые клетки и начать репликацию.
В частности, мишенями для коронавируса служат бокаловидные клетки, разбросанные по эпителию дыхательного и кишечного трактов, поскольку они экспрессируют ACE2. В носоглотке эти клетки продуцируют муцины — главный компонент слизи, которая выделяется, чтобы защитить дыхательные пути от проникновения вирусов.
Исследователи предположили, что потеря обоняния при COVID-19 связана с тем, что пораженные вирусом бокаловидные клетки перестают выделять слизь, которая необходима молекулам одорантов — веществ, отвечающих за запахи, чтобы прилипают к соответствующим рецепторам.
Для подтверждения своей гипотезы, ученые провели исследование в группе из 35 пациентов с легкой формой COVID-19, отмечающих потерю обоняния, а также параллельно — в контрольной группе здоровых людей аналогичного возраста и пола.
Около 70% пациентов из группы с COVID-19 на ранних стадиях заболевания заявили, что у них есть «странное ощущение» и сухость в носу, а половина участников сказали, что у них такое чувство, что им сделали промывание носа. Такие симптомы продолжались в среднем 12 дней и по времени совпадали или предшествовали потере обоняния и вкуса, которую в итоге отметили 80-85% участников группы.
Исследователи объясняют необычные назальные ощущения тем, что попадание вируса в респираторный эпителий носа, особенно в бокаловидные клетки, вызывает высыхание эпителия.
По мнению ученых, их результаты очень важны для раннего выявления инфекции, особенно у тех, у кого она протекает в легкой или бессимптомной форме, и их следует учитывать в протоколах мониторинга распространения COVID-19, передает РИА «Новости».
Ранее заместитель директора по клинико-аналитической работе ЦНИИ эпидемиологии Роспотребнадзора Наталья Пшеничная назвала самые частые симптомы заражения коронавирусной инфекцией.
Она отметила, что у 78% заболевших коронавирусом отмечается повышение температуры тела, у 57% – кашель.
– Они могут характеризовать как легкое, так и тяжелое течение заболевания. Лихорадка более чем у половины пациентов не превышает обычно 38 градусов. Одышка характеризует тяжелое течение болезни, сочетаясь с другими проявлениями заболевания, – сказала она.
Кроме того, у 15-40% пациентов наблюдаются боли в мышцах и суставах, головная боль и слабость. В 20% случаев при коронавирусной инфекции отмечается чаще, чем при других ОРВИ, диарея, тошнота и рвота.
Напомним, за последние сутки на Кубани подтверждено 163 случая заражения коронавирусом.
Оперативный штаб региона сообщает, что среди пациентов 89 женщин и 74 мужчины, в том числе 23 ребенка.
Общее число заболевших на сегодняшний день – 21062 человека, из них 1773 ребенка. Показатель заболеваемости COVID-19 на 100 тысяч населения – 371,1. Выздоровели 14224 пациента. 559 человек спасти не удалось. В тяжелом состоянии на ИВЛ находится 41 пациент, еще четверо – на ЭКМО.
Слизь в носоглотке — как избавиться?
При дыхании воздух попадает, прежде всего, в носовые пазухи и носоглоточную область, где происходит его очищение, нагревание и увлажнение. Для этого организм человека вырабатывает слизь, которая помогает поддерживать нормальную влажность в носоглотке и способствует избавлению от пыли.
Ежедневная выработка таких выделений составляет около двух литров. У здорового человека стекает слизь по задней стенке носоглотки медленно и неосознанно проглатывается, что говорит о физиологической норме.
Читайте также:
Как вывести слизь из организма: http://dometod.ru/zdorovie/kak-vyvesti-sliz-iz-organizma.html
При определенных обстоятельствах количество слизи в носоглотке увеличивается и вызывает дискомфорт у человека. В таком состоянии появляется затруднения в дыхании, заложенность в носу, першение в горле и желание высморкаться. Существует множество факторов, влияющих на скоплении выделений в носоглоточной области.
Причины избытка слизи в носоглотке
Скопление слизи в носоглотке может происходить в таких случаях:
1. При попадании в органы дыхания микробов организм начинает вырабатывать увеличенное количество слизи, что способствует при откашливании выходу микроорганизмов. Однако усиленная выработка выделений провоцирует нарушение этого процесса, и в результате по стенке горла стекает слизь с бактериями в бронхи и легкие, вызывая осложнения.
2. Часто увеличенные выделения в носоглотке появляются при аллергии.
3. Скопление слизи происходят при заболеваниях пищеварительной системы.
4. При неврологических патологиях, когда снижен глоточный рефлекс.
5. Вредные привычки, употребление слишком горячей и холодной еды, загрязненный воздух провоцируют скопление слизи в носоглоточной области.
Также в горле собирается слизь после ночного отдыха, при этом происходит приступ кашля с отхождением выделений. После выхода слизи он проходит. А вот еще народные способы лечения затяжного кашля.
Лечебная терапия
Устранение обильных выделений из носоглотки напрямую зависит от провоцирующего фактора. Определить причину данных проявлений поможет консультация у доктора.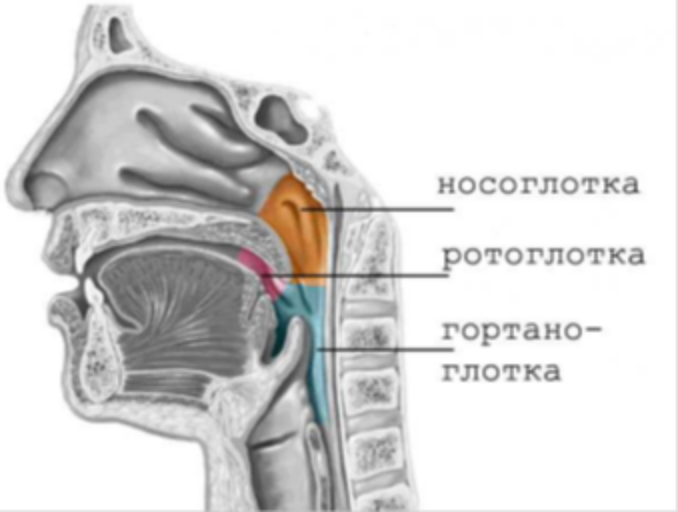 На основании проведенного медицинского обследования специалист может назначить соответствующее лечение.
На основании проведенного медицинского обследования специалист может назначить соответствующее лечение.
При простудных заболеваниях рекомендуются противомикробные лекарственные препараты, которые избавят от вредных бактерий, тем самым устраняя неприятные выделения.
Когда источником слизи является аллергия, следуют соблюдать диетическое питание и результат проявится через несколько дней.
Кроме медикаментозного лечения следует ежедневно употреблять необходимое количество воды, включать в рацион питания продукты с содержанием витамина А, С и Е, выполнять специальные дыхательные упражнения.
Также важным в лечении является проведение таких процедур, как промывание носоглотки и полоскание горла.
Как убрать слизь из носоглотки
Эффективным способом в борьбе со скопившимися выделениями в носоглотке является промывание. Перед проведением этой процедуры рекомендуется сделать ингаляцию, чтобы слизь стала жидкой и легко смогла выйти.
Для ингаляции понадобится горячий картофельный отвар или заваренный травяной сбор, который нужно вдыхать около 20 минут попеременно носом и ртом.
После этого проводится непосредственное промывание:
Потребуется в чайник залить 0,5 л теплой воды и добавить две столовые ложки соли. После на носик чайника одевается резиновая соска с прорезом 5 мм в диаметре, которая предотвратит повреждение носоглотки.
Вот подробное описание процесса:
Как промывать нос?
Сухость в носу и корочки — что делать: http://dometod.ru/zdorovie/kak-lechit-suxost-i-korochki-v-nosu.html
Для проведения процедуры нужно стать над раковиной, при этом носик чайника вставить в ноздрю более свободную от выделений и постепенно вливать раствор. Голова должна быть наклонена в сторону, чтобы жидкость имела возможность выхода из другой ноздри. Во время промывания следует дышать ртом, а если раствор попал в рот нужно наклониться вперед. Когда один канал промыт, следует высморкаться и такую же манипуляцию повторить со второй ноздрей.
Когда один канал промыт, следует высморкаться и такую же манипуляцию повторить со второй ноздрей.
Как избавиться от слизи в горле
Полоскания рта можно делать, используя настойку календулы, эвкалипта, ромашки, а также растворенный в воде фурацилин и солевой раствор.
Полоскать требуется по 15 секунд 20 подходов два раза в сутки. Чаще процедуры проводить не рекомендуется так, как могут из горла и носоглотки вымываться полезные микроорганизмы.
Также избавиться от слизи можно при помощи ароматерапии. Закапывание в нос абрикосового, персикового, вишневого и сливового масел способствует хорошему увлажнению слизистой рта и носоглотки.
← Как покрасить брови в домашних условиях Сыроедческое спагетти из кабачка →
Вазомоторный ринит — симптомы, диагностика, лечение — медцентр Аксис (Зеленоград)
При таком заболевании, как вазомоторный ринит, в носовых раковинах образуется набухание, а тонус сосудов носовой полости нарушается. Данный вид ринита сопровождают обильное выделение слизи из носа и насморк. Впрочем, это заболевание хоть иногда и рассматривается как воспалительный процесс, на деле является больше функциональным нарушением.
Причины возникновения
Очень частой причиной появления вазомоторного ринита является стресс, так как именно в состоянии повышенной возбудимости повышается активность слизистой оболочки носа, выделяется избыточное количество слизи. Гормональные нарушения, влияние инфекций на организм, наличие искривления носовой перегородки и табакокурение также являются одними из причин появления этой болезни.
Симптомы
Главным симптомом вазомоторного ринита является — нарушение дыхания. Если при классическом рините нос у человека закладывает на определенное время, то с вазомоторным ринитом все значительно сложнее, ведь нарушение носового дыхания носит неожиданный и спонтанный характер. У человека начинается чихание и слизь обильно течет из носа утром, когда он находится в положении лежа. При этом из глаз могут начать течь слезы, остановить которые усилием воли достаточно трудно. Как правило, выделяемая слизь является прозрачной, но в некоторых случаях она может приобретать желтый или зеленый оттенок, если будет иметь место бактериальная инфекция. Кроме того, страдающие от вазомоторного ринита жалуются на ухудшение способности воспринимать запахи, ощущение сухости в носу, повышенную утомляемость и бессонницу..
У человека начинается чихание и слизь обильно течет из носа утром, когда он находится в положении лежа. При этом из глаз могут начать течь слезы, остановить которые усилием воли достаточно трудно. Как правило, выделяемая слизь является прозрачной, но в некоторых случаях она может приобретать желтый или зеленый оттенок, если будет иметь место бактериальная инфекция. Кроме того, страдающие от вазомоторного ринита жалуются на ухудшение способности воспринимать запахи, ощущение сухости в носу, повышенную утомляемость и бессонницу..
Диагностика заболевания
“Если у Вас наблюдаются схожие симптомы, советуем записаться на прием к врачу. Также вы можете записаться по телефону: +7 (499) 214-00-00Любая диагностика вазомоторного ринита в обязательном порядке включает в себя осмотр у оториноларинголога. Именно он узнает у пациента важные нюансы и может быстро отличить вазомоторный ринит и хронический насморк, назначив правильное обследование и лечение. Осмотр носовой полости проводится посредством эндоскопа. Также высокую эффективность демонстрирует еще один метод диагностики – рентгеноскопия пазух носа. Анализ крови и кожные аллергопробы позволяют установить, какой именно аллерген привел к появлению заболевания. Это очень важно сделать, так как в дальнейшем именно от этого и будет зависеть назначаемое врачом лечение.
Лечение
Если вазомоторный ринит не перешел в запущенную стадию, применяется консервативный метод его лечения. Этот метод включает в себя использование сосудосуживающих средств, спреев для носа, иммуномодулирующие средства (если был выявлен аллерген). Если же к заболеванию привели новообразования и консервативный метод лечения не дал нужных результатов, врачи назначают хирургическое или лазерное лечение. Исправление носовой перегородки – очень популярная процедура, которая также помогает избавиться от проблемы хирургическим путем, если в этом имеется необходимость.
Когда обратиться к врачу
Обратиться к отоларингологу рекомендуется при обнаружении первых симптомов заболевания, ведь его проще и быстрее лечить на ранней стадии.
Экскурс в анатомию и физиологию носа и околоносовых пазух » Лор-клиника «ЛОР-ПРАКТИКА» в Алматы, услуги врача ухо-горло-носа недорого для детей и взрослых
Нормальное носовое сопротивление человек не замечает. За сутки человек «фильтрует» через нос до 10.000 литров атмосферного воздуха, совершая в среднем 24.000 дыхательных движений. В полости носа воздух очищается и подготавливается для усвоения из его состава кислорода. Турбулентное движение воздуха в полости носа создает лучшие условия его контакта с поверхностью слизистой оболочки. До 90% взвешенных в воздухе веществ оседает в полости носа на слизи и уходит в желудок, где обезвреживается соляной кислотой желудочного сока. В полости носа воздух согревается. При вдыхании воздуха температурой минус 15 градусов в носоглотке воздух имеет температуру плюс 25 градусов. Воздух насыщается водяным паром из слизи, что очень важно для полноценного усвоения кислорода в легких. При нарастании носового сопротивления человек ощущает недостаток кислорода и он переходит на ротовое дыхание. Низкое носовое сопротивление не создает нормального отрицательного давление в грудной клетке, не способствует возникновению рефлексов со стороны слизистой оболочки полости носа, что оценивается человеком также как недостаточность дыхания.
Носовое сопротивление зависит от состояния ряда внутриносовых структур. Самым узким местом, определяющим степень носового сопротивления, является область входа в нос у переднего конца нижней носовой раковины. Эта область называется носовым клапаном. Его форма, размер, величина угла влияют также и на аэродинамику в полости носа. Полость носа имеет сложное анатомическое строение. На ее боковых стенках имеются по три образования, называемые раковинами носа. Наличие раковин существенно увеличивает площадь полости носа, что способствует лучшему согреванию и увлажнению воздуха. В слизистой оболочке носовых раковин имеются специальные полости, наполненные кровью. Они называются пещеристыми телами. Задержка крови в пещеристых венозных сплетениях ведет к набуханию нижних носовых раковин и увеличению сопротивления воздушному потоку вплоть до полного закрытия носовых ходов. Кровенаполнение пещеристых тел зависит от многих факторов, в том числе от температуры окружающего воздуха, запыленности воздуха, наличия воспаления. Регуляция кровенаполнения осуществляется вегетативной нервной системой.
Задержка крови в пещеристых венозных сплетениях ведет к набуханию нижних носовых раковин и увеличению сопротивления воздушному потоку вплоть до полного закрытия носовых ходов. Кровенаполнение пещеристых тел зависит от многих факторов, в том числе от температуры окружающего воздуха, запыленности воздуха, наличия воспаления. Регуляция кровенаполнения осуществляется вегетативной нервной системой.
Воздушный поток, проходящий через обе половины носа асимметричен. У большинства здоровых людей отмечается циклическое изменение сопротивления воздушному потоку, проходящему через левую и правую половины носа, однако суммарное сопротивление остается постоянным. Периодическое изменение степени носового сопротивления называется носовым циклом. Чередующиеся изменения воздушного потока в обеих половинах носа могут быть объяснены необходимостью отдыха для восстановления слизистой оболочки носа от микротравм и функциональных перегрузок при контакте с окружающей средой.
Носовой цикл для каждого человека индивидуален. Кровенаполнение раковин меняется каждые 3-6 часов, но здоровый человек этого не замечает. При вазомоторном рините человек замечает перемену кровенаполнения раковин. В положении лежа на боку нижняя половина носа закрывается. Это связано с нарушением тонуса вегетативной нервной системы.
Физиологический носовой цикл возможен только в том случае, если анатомические структуры, образующие просвет обеих половин носа, симметричны, а перегородка носа не имеет выраженной деформации и расположена по средней линии. В случае аномалий развития внутриносовых структур, ведущих к асимметрии просвета обеих половин носа, на стороне сужения постоянно создается высокая степень сопротивления воздушному потоку, а скорость воздушной струи нарастает. В этом случае основная масса воздуха идет через более широкую половину носа. Циклические изменения сопротивления нарушаются. В связи с постоянной функциональной перегрузкой через несколько лет в более широкой половине носа развивается хронический ринит, приводящий к увеличению нижней носовой раковины и постоянно высокому сопротивлению воздушному потоку уже в двух половинах полости носа, что проявляется стойким затруднением носового дыхания.
Таким образом, перегородка, разделяя полость носа на две половины, создает парность органа. Регулируясь носовым циклом, эти органы (половины носа) функционируют с полной нагрузкой попеременно, периодически отдыхая. Полноценный отдых возможен только при правильном положении перегородки.
Субъективные ощущения, возникающие при прохождении воздушной струи через полость носа, очень важны для комфорта человека. Они возникают в результате раздражения чувствительных окончаний тройничного нерва в слизистой оболочке носа во время дыхания. Анестезия или повреждение нервных рецепторов вызывает ощущение закрытия носа, поэтому больные с атрофическим ринитом часто жалуются на заложенность носа, хотя сопротивление воздушной струе у них очень низкое. Подобное ощущение возникает при синдроме «пустого носа», когда многочисленными операциями в полости носа удалены носовые раковины и создан черезмерно большой просвет полости носа.
Состояние внутриносовых структур влияет на вентиляцию как в полости носа, так и в околоносовых пазухах. При нормальной аэродинамике воздушный поток в полости носа в районе носового клапана делает круговое движение. Затем поднимается вверх по общему носовому ходу на уровне средней носовой раковины и опускается вниз в носоглотку. Возникшее вначале вдоха отрицательное давление в полости носа вызывает отток воздуха из полостей околоносовых пазух в полость носа и эта порция воздуха, очищенная, согретая и увлажненная, идет в наиболее глубокие отделы легких. При выдохе, порция воздуха, которая вошла в полость носа и частично согрелась, увлажнилась и очистилась, поступает в околоносовые пазухи.
Воздухообмен полости носа и околоносовых пазух имеет большое значение и должен происходить постоянно. Прекращение вентиляции, блок околоносовых пазух вызывает воспаление слизистой оболочки пазух.
При искривлении носовой перегородки, шипах и гребнях изменяется направление воздушной струи. От бугра перегородки воздушная струя направляется в средний носовой ход, что вызывает постепенное увеличение переднего конца раковины и блок пазух. Отражаясь от гребня на уровне задних отделов среднего носового хода, воздушная струя вызывает атрофию слизистой оболочки и формирование дополнительного соустья. Дополнительное соустье создает условия рециркуляции слизи и возникновения воспаления в пазухе. Нередко в этом случае формируется в пазухе кисты и хоанальный полип.
Отражаясь от гребня на уровне задних отделов среднего носового хода, воздушная струя вызывает атрофию слизистой оболочки и формирование дополнительного соустья. Дополнительное соустье создает условия рециркуляции слизи и возникновения воспаления в пазухе. Нередко в этом случае формируется в пазухе кисты и хоанальный полип.
Слизистая оболочка полости носа покрыта мерцательным эпителием. Клетки мерцательного эпителия имеют ворсинки, которые постоянно находятся в движении и перемещают слизь по поверхности слизистой оболочки в сторону носоглотки. Постоянное движение ресничек защищает слизистую оболочку от вирусов и бактерий. Остановка работы мерцательного эпителия всегда приводит к воспалению. Поверхность слизистой оболочки всегда влажная. Она покрыта слизью, которая вырабатывается различными железами. Слизь содержит много биологически активных веществ, которые защищают слизистую оболочку. При нормальной работе мерцательного эпителия бактерии и вирусы, оседающие на его поверхности из воздуха, уничтожаются биологически активными веществами и со слизью проглатываются в желудок. Нормальная работа клеток мерцательного эпителия не дает возможности вирусам и бактериям вступить в контакт с клетками организма. Мерцательный эпителий и слизь является первой линией защиты слизистой оболочки. Мерцательные движения находятся в зависимости от факторов внешней среды. Они могут ускорять или полностью тормозить мерцательные движения, но не изменять направление движения.
Большое значение слизистой оболочки и для формирования иммунитета. На воздействие содержащихся в воздухе вирусов и бактерии, различные клетки слизистой оболочки носа и всего организма формируют местный и общий иммунитет.
Таким образом, нос имеет сложное анатомическое строение, ему присущи важные для организма функции и нет ненужных элементов в строении носа.
О заболеваемости гриппом и острыми респираторными вирусными инфекциями,
Путь к странице: Главная Новости О заболеваемости гриппом и острыми респираторными вирусными инфекциямиНа 2 неделе 2020 года (06. 01.2020-12.01.2020) на территории Ханты-Мансийского автономного округа – Югры заболеваемость ОРВИ и гриппом находится на неэпидемическом уровне. За 2-ю неделю 2020 зарегистрировано 36 случаев ОРВИ и гриппа на 10 тысяч населения. По сравнению с 01 неделей заболеваемость возросла на 7,0%. Заболеваемость совокупного населения ниже эпидемического порога на 37,6%. По всем возрастным группам заболеваемость также не превышает пороговых уровней.
01.2020-12.01.2020) на территории Ханты-Мансийского автономного округа – Югры заболеваемость ОРВИ и гриппом находится на неэпидемическом уровне. За 2-ю неделю 2020 зарегистрировано 36 случаев ОРВИ и гриппа на 10 тысяч населения. По сравнению с 01 неделей заболеваемость возросла на 7,0%. Заболеваемость совокупного населения ниже эпидемического порога на 37,6%. По всем возрастным группам заболеваемость также не превышает пороговых уровней.
Заболеваемость ОРВИ обусловлена преимущественно циркуляцией респираторных вирусов не гриппозной этиологии (парагрипп, аденовирус,и др.). Вирусы гриппа выявляются в единичных случаях.
Грипп — сезонный, свиной, пандемический, вообще не грипп — это не важно. Важно лишь то, что это вирус, что он передается воздушно-капельным путем и что он поражает органы дыхания.
Существует более двухсот респираторных вирусов разных типов – риновирусы, энтеровирусы, аденовирусы, коронавирусы, вирусы гриппа и парагриппа и другие. Самые распространенные виновники простуды – это риновирусы, они становятся причиной болезни в 25–50% случаев. Риновирусы любят относительно прохладную среду и поэтому предпочитают жить в носоглотке, а не глубоко внутри тела, – вот почему главные симптомы простуды появляются именно там.
Заражение вирусом, вызывающим ОРВИ, происходит воздушно-капельным путем (вдыхание микроскопических частей слизи от кашляющего или чихающего человека) или из-за самозаражения (касание слизистой глаз, рта или носа) после контакта с заболевшими людьми или предметами, ими использованными.
Вирусы могут жить на поверхностях в течение нескольких дней (причем дольше они выживают на гладких, непористых материалах) и в течение 24 часов сохранять способность вызвать заражение, поэтому можно «подцепить простуду» в общественном транспорте, в самолете или через предметы общего пользования в офисе, магазине или школе. Вирус не может проникнуть в организм через кожу, поэтому ему нужно несколько часов, чтобы добраться, к примеру, с рук до носа – если только мы сами не помогаем ему, доставляя на слизистые оболочки.
Механика заражения такова. Когда вирус попадает в носовой проход с пальцев или с вдыхаемым воздухом, он переносится на заднюю часть носоглотки. Там он прикрепляется к местным рецепторам с помощью белка и проникает через мембрану в клетку, где «распаковывает» свою РНК – так начинается деление вируса и заражение организма. Этот процесс занимает 8–12 часов, а с момента попадания вируса в носоглотку до проявления симптомов простуды может пройти от 12 часов до 1–2 дней.
ПРОФИЛАКТИКА ГРИППА и ОРВИ.
Если произошла встреча с вирусом и нет в крови защитных антител — заболевание неизбежно. Антитела появятся в одном из двух случаев: либо вследствие активного инфекционного процесса, либо на прививку. Привившись, вы защитите себя не от вирусов вообще, а только от вируса сезонного гриппа.
Не обольщайтесь «народными средствами». Никаких лекарств и «народных средств» с доказанной профилактической эффективностью не существует. Т.е. никакой лук, никакой чеснок, никакая горилка и никакие глотаемые или засовываемые в дитя таблетки не способны защитить ни от какого-либо респираторного вируса вообще, ни от вируса гриппа в частности.
Источник вируса — человек и только человек. Чем меньше людей, тем меньше шансов заболеть. Пройтись остановку пешком, не пойти лишний раз в супермаркет — мудро!
Маска защитит здорового. Полезная штука, но не панацея. Желательно видеть ее на больном, но, если рядом здоровые, маска нужна и здоровому и больному.
Мойте руки! Руки больного — источник вируса не менее значимый, чем рот и нос. Больной касается лица, вирус попадает на руки, больной хватает все вокруг, вы касаетесь этого всего рукой, — здравствуй, ОРВИ. Не трогайте свое лицо. Мойте руки, часто, много, постоянно носите с собой влажные дезинфицирующие гигиенические салфетки, мойте, трите, не ленитесь! Учитесь сами и учите детей, если уж нет платка, кашлять-чихать не в ладошку, а в локоть. Пользуйтесь кредитными карточками. Бумажные деньги — источник распространения вирусов.
Пользуйтесь кредитными карточками. Бумажные деньги — источник распространения вирусов.
Чистый и прохладный воздух! Вирусные частицы часами сохраняют свою активность в сухом, теплом и неподвижном воздухе, но почти мгновенно разрушаются в воздухе прохладном, влажном и движущемся. Гулять можно сколько угодно. Подцепить вирус во время прогулки практически нереально. Поэтому, если уж вы вышли погулять, так не надо показушного хождения в маске по улицам. Уж лучше нормально подышите свежим воздухом. Оптимальные параметры воздуха в помещении — температура около 20 °С, влажность 50–70%.
Частое и интенсивное сквозное проветривание помещений. Любая система отопления сушит воздух. Мойте пол. Включайте увлажнители воздуха. Настоятельно требуйте увлажнения воздуха и проветривания помещений в детских коллективах. Лучше теплее оденьтесь, но не включайте дополнительных обогревателей.
Увлажняйте слизистые оболочки! В верхних дыхательных путях постоянно образуется слизь. Слизь обеспечивает функционирование т.н. местного иммунитета — защиты слизистых оболочек. Если слизь и слизистые оболочки пересыхают — работа местного иммунитета нарушается, вирусы, соответственно, с легкостью преодолевают защитный барьер ослабленного местного иммунитета, и человек заболевает при контакте с вирусом с многократно большей степенью вероятности. Главный враг местного иммунитета — сухой воздух, а также лекарства, способные высушивать слизистые оболочки.
Самое эффективное средство борьбы с любым заболеванием – его профилактика, ведь не допустить болезнь легче, чем лечить, этот постулат работает и в отношении гриппа.
Подготовлено по материалам сайта: http://86.rospotrebnadzor.ru
Боли в носу, зуд и раздражение по задней стенки носоглотки.
Вопрос:
Помогите, пожалуйста, с проблемой.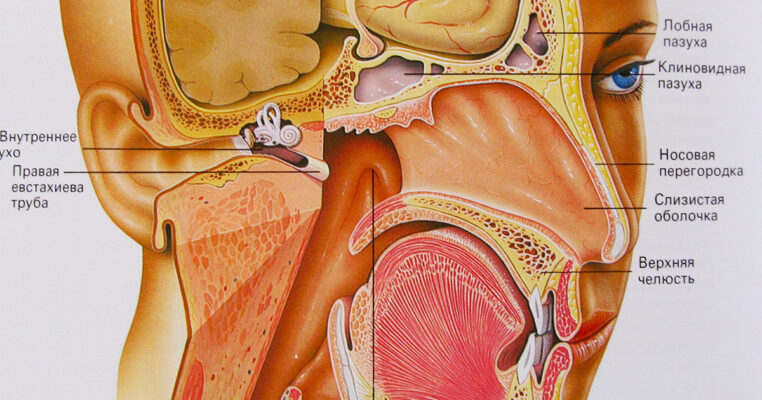
Боли в носу жгучие и режущие, без соплей, зуд и раздражение по задней стенки носоглотки, течет вязкая слизь и из носа и по задней стенке, оседает на горле, иногда отек в носу, то попеременно каждая ноздря, а то обе вместе, головные боли и головокружения, корочки желтые в носу, вдыхать воздух больно, дышу поверхностно, при сильном вдохе жуткая раздражающая боль, и так часто зудящая боль в верхней части носа у переносицы.
Лечили и назофарингит,и атрофический назофарингит, долечили до того, что ни масло облепиховое ни капли не могу капать, все жжет адски в носу, на улицу не выхожу носом больно дышать и сразу слизь начинает течь, бак посев из носоглотки сдавала — нет никаких микробов все чисто.
Подскажите какие обследования и диагностику надо пройти чтоб наконец-то выяснить точный диагноз и начать лечение, очень трудно с этим жить!!
Отвечает: Лор-врач Власова Анна Игоревна.
Здравствуйте. Разумеется, в первую очередь необходим очный осмотр лор-врача, для оценки состояния внутриносовых структур и постановки диагноза. Возможно будет целесообразно провести осмотр с помощью эндоскопического оборудования, для того, чтобы можно было установить источник слизистого отделяемого, а также провести осмотр носоглотки.
Кроме того, показательны будут мазок из носа на микрофлору, а также компьютерная томография придаточных пазух носа для исключения хронического синусита.
Причин для ваших жалоб может быть много, необходимо разбираться.
Кроме того, советуем не использовать масляные капли в нос, т.к. они нарушают мукоцилиарный клиренс и способствуют ухудшению состояния слизистой полости носа!
Рекомендуем вам подойти на прием в клинику «Лор Плюс» для более точной консультации и подбора эффективного лечения.
Записывайтесь по телефону: 258-258-8
С уважением, лор врач Власова Анна Игоревна.
Вы можете задать вопрос или посмотреть уже существующие ответы на вопросы пациентов.
Задать вопрос
Бактериологическое исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы с идентификацией
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»:
355017, г.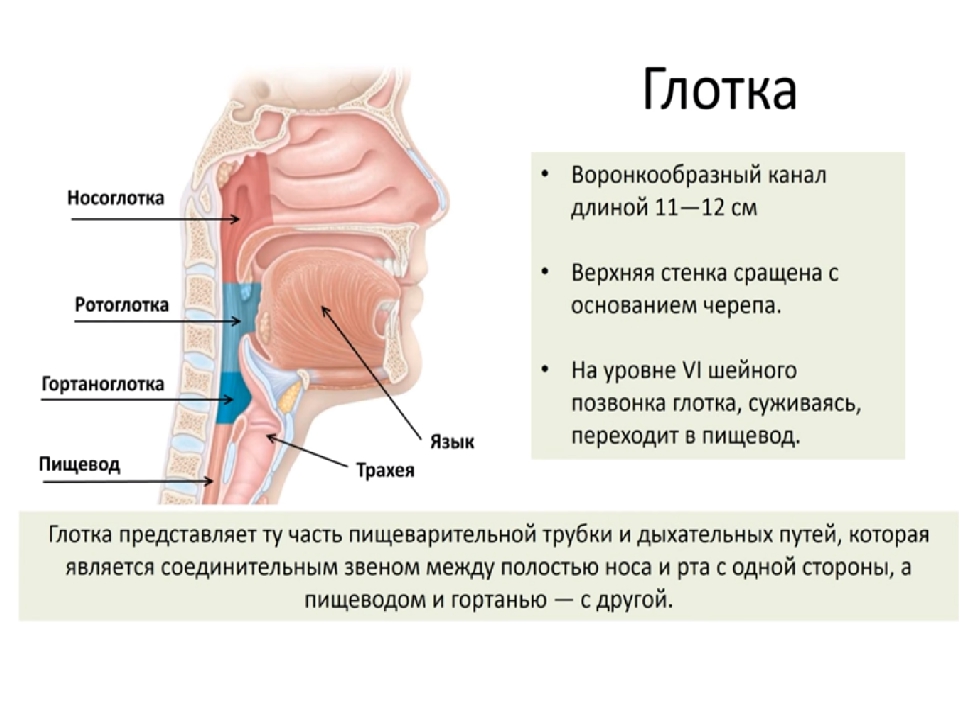 Ставрополь, ул. Ленина 304
Ставрополь, ул. Ленина 304 (8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное подразделение «Диагностический центр на Западном обходе»:
355029 г. Ставрополь, ул. Западный обход, 64(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-68-89 (факс)
Посмотреть подробнееКлиника семейного врача:
355017 г. Ставрополь, пр. К. Маркса, 110 (за ЦУМом)(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-50-60 (регистратура)
Посмотреть подробнееНевинномысский филиал:
357107, г. Невинномысск, ул. Низяева 1(86554) 95-777, 8-962-400-57-10 (регистратура)
Посмотреть подробнееОбособленное структурное подразделение в г. Черкесске :
369000, г. Черкесск, ул. Умара Алиева 318(8782) 26-48-02, +7-988-700-81-06 (контактные телефоны)
Посмотреть подробнееОбособленное структурное подразделение в г. Элисте :
358000, г. Элиста, ул. Республиканская, 478(989) 735-42-07 (контактные телефоны)
Посмотреть подробнееЗАО «Краевой клинический диагностический центр»:
355017 г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное структурное подразделение на ул. Савченко, 38 корп. 9:
Савченко, 38 корп. 9:
8 (8652) 316-847 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение на ул. Чехова, 77 :
355000, г. Ставрополь, ул. Чехова, 778(8652) 951-943 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение в г. Михайловске:
358000, г. Михайловск, ул. Ленина, 201 (в новом жилом районе «Акварель»).8(988) 099-15-55 (контактный телефон)
Посмотреть подробнееСлизь в дыхательных путях ограничивает Neisseria meningitidis от эпителиальных клеток носоглотки и защищает слизистую оболочку от воспаления
РЕЗЮМЕ
Neisseria meningitidis является обитателем носоглотки, откуда она передается от человека к человеку и становится возбудителем. В этой работе мы рассмотрели колонизацию носоглоточной ниши, сосредоточив внимание на взаимодействии между менингококками и слизью дыхательных путей, выстилающей слизистую оболочку хозяина.Используя клетки Calu-3, выращенные в культуре с воздушным интерфейсом (клетки, выращенные с апикальным доменом, обращенным к воздуху), мы изучили менингококковую колонизацию слизи и реакцию хозяина. Наши результаты показали, что N. meningitidis ведет себя как комменсальные бактерии в слизи, не взаимодействуя с клетками человека и не мигрируя активно через клеточный слой. В результате пили типа IV не играют роли в этой модели, и менингококки не вызывают сильного врожденного иммунного ответа со стороны клеток Calu-3. Наконец, мы показали, что эта модель подходит для изучения взаимодействия N.meningitidis с другими бактериями, живущими в носоглотке, и Streptococcus mitis, но не Moraxella catarrhalis, могут способствовать росту менингококков в этой модели.
ВАЖНО N. meningitidis передается от человека к человеку в виде капель аэрозоля, образующихся при дыхании, разговоре, кашле или при прямом контакте с зараженной жидкостью. Естественным резервуаром N. meningitidis является слизистая оболочка носоглотки человека, расположенная в задней части носа и над ротоглоткой.Способы, с помощью которых менингококки проникают через стенку носоглотки, все еще обсуждаются из-за отсутствия удобной и актуальной модели, имитирующей носоглоточную нишу. Здесь мы использовали клетки Calu-3, выращенные в культуре с воздушным интерфейсом, чтобы изучить, как менингококки колонизируют носоглоточную нишу. Мы сообщаем, что слизь в дыхательных путях является одновременно нишей для роста менингококков, а также защитным барьером против инфекции N. meningitidis. Таким образом, N. meningitidis ведет себя как комменсальные бактерии и вряд ли вызовет инфекцию без внешнего триггера.
ВВЕДЕНИЕ
Neisseria meningitidis (менингококк) — грамотрицательная бактерия, которая обычно бессимптомно обитает в носоглотке человека. По неизвестным причинам он может пересекать эпителиальный барьер и размножаться в кровотоке, где становится одним из самых вредных патогенов. N. meningitidis эффективно прикрепляется к эндотелиальным клеткам, выстилающим просвет кровеносных сосудов (1). Отсюда бактерии размножаются и вызывают дисфункцию кровеносных сосудов (2–6), ответственную за быстрое прогрессирование септического шока, что в худшем случае приводит к молниеносной пурпуре, острой системной воспалительной реакции, связанной с внутрисосудистым свертыванием и некрозом тканей.N. meningitidis также может преодолевать гематоэнцефалический барьер и вызывать цереброспинальный менингит (7, 8).
N. meningitidis передается от человека к человеку в виде капель аэрозоля, образующихся при дыхании, разговоре, кашле или при прямом контакте с зараженной жидкостью. Естественным резервуаром N. meningitidis является слизистая оболочка носоглотки человека, расположенная в задней части носа и над ротоглоткой. Там бактерии встречаются с богатой микробиотой (9–11), которая постоянно претерпевает изменения с возрастом и при инфекциях верхних дыхательных путей (12, 13).Носоглотка выстлана двумя основными типами эпителия: плюристратифицированным плоским эпителием, покрывающим 60% носоглотки, и цилиндрическим респираторным эпителием (14, 15). В дыхательных путях клетки защищены двухслойной поверхностной жидкостью толщиной от 10 до 12 мкм, образованной перицилиарной жидкостью низкой вязкости (PCL), контактирующей с клетками, и высоковязкой слизью, обращенной к просвету, которая удерживает бактерии, вдыхаемые частицы и клеточный мусор (внешняя слизь) (16, 17). PCL способствует биению ресничек, что обеспечивает эффективный мукоцилиарный клиренс в 6.9 ± 0,7 мм / мин (18). Благодаря постоянной транспортировке слизи из нижних дыхательных путей в глотку, откуда она проглатывается, этот механизм считается основной защитой от микроорганизмов и частиц. Слизистый слой, в котором ограничены комменсальные бактерии, представляет собой густой гель, образованный муцинами, и содержит множество антимикробных белков и пептидов, таких как IgA, лизоцим, лактоферрин и человеческие дефенсины (19–21). Муцины представляют собой семейство по меньшей мере 22 высокомолекулярных гликопротеинов, разделенных на два класса: связанные с мембраной муцины, которые продуцируются любыми эпителиальными клетками, и гелеобразующие муцины, продуцируемые бокаловидными клетками и подслизистыми железами.В дыхательных путях слизистый слой в основном состоит из MUC5AC и MUC5B. Их экспрессия строго регулируется и реагирует на бактериальные инфекции и различные заболевания дыхательных путей (17).
Там бактерии встречаются с богатой микробиотой (9–11), которая постоянно претерпевает изменения с возрастом и при инфекциях верхних дыхательных путей (12, 13).Носоглотка выстлана двумя основными типами эпителия: плюристратифицированным плоским эпителием, покрывающим 60% носоглотки, и цилиндрическим респираторным эпителием (14, 15). В дыхательных путях клетки защищены двухслойной поверхностной жидкостью толщиной от 10 до 12 мкм, образованной перицилиарной жидкостью низкой вязкости (PCL), контактирующей с клетками, и высоковязкой слизью, обращенной к просвету, которая удерживает бактерии, вдыхаемые частицы и клеточный мусор (внешняя слизь) (16, 17). PCL способствует биению ресничек, что обеспечивает эффективный мукоцилиарный клиренс в 6.9 ± 0,7 мм / мин (18). Благодаря постоянной транспортировке слизи из нижних дыхательных путей в глотку, откуда она проглатывается, этот механизм считается основной защитой от микроорганизмов и частиц. Слизистый слой, в котором ограничены комменсальные бактерии, представляет собой густой гель, образованный муцинами, и содержит множество антимикробных белков и пептидов, таких как IgA, лизоцим, лактоферрин и человеческие дефенсины (19–21). Муцины представляют собой семейство по меньшей мере 22 высокомолекулярных гликопротеинов, разделенных на два класса: связанные с мембраной муцины, которые продуцируются любыми эпителиальными клетками, и гелеобразующие муцины, продуцируемые бокаловидными клетками и подслизистыми железами.В дыхательных путях слизистый слой в основном состоит из MUC5AC и MUC5B. Их экспрессия строго регулируется и реагирует на бактериальные инфекции и различные заболевания дыхательных путей (17).
Взаимодействие N. meningitidis с эпителиальными клетками было предметом многочисленных исследований за последние 4 десятилетия. Однако способы, с помощью которых менингококки проникают через стенку носоглотки, все еще обсуждаются. Это может быть связано с отсутствием удобной и актуальной модели, имитирующей носоглоточную нишу.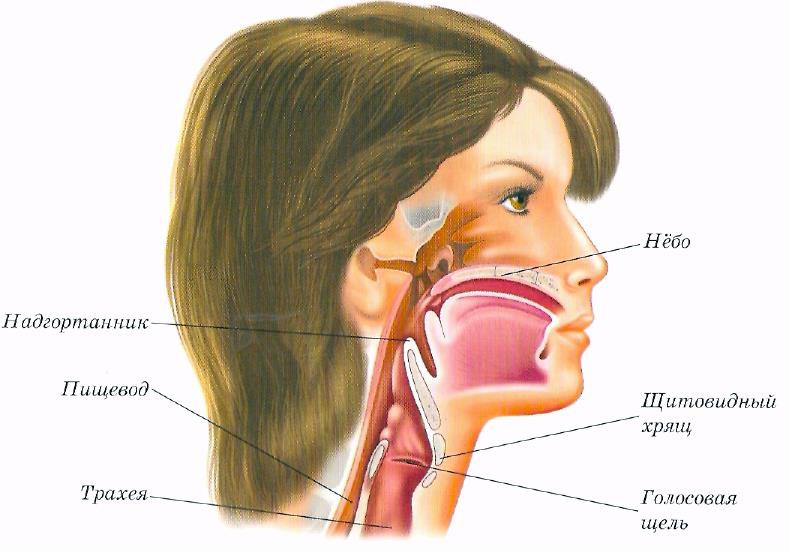 Большинство предыдущих исследований, посвященных зависимому от адгезии взаимодействию N. meningitidis с эпителиальными клетками кишечника и дыхательных путей, проводилось на клетках, культивируемых в жидких средах, таких как RPMI и среда Игла, модифицированная Дульбекко (DMEM). Эти первые исследования привели к появлению концепции колонизации клеток, опосредованной ворсинками IV типа и / или Opa / Opc. В такой модели менингококки взаимодействуют с эпителиальными клетками через свои пили типа IV и образуют высокопролиферативные микроколонии, которые в конечном итоге пересекают эпителиальный барьер (22–28), в то время как белки Opa и Opc участвуют в активном процессе интернализации, который, как предполагается, способствует развитию транслокация бактерий через монослой клеток (29–31).Каждая из этих работ продемонстрировала тесное взаимодействие N. meningitidis с эпителиальными клетками человека. За последнее десятилетие мало исследований было сосредоточено на транслокации N. meningitidis через эпителиальный слой. Работа T. C. Sutherland et al. в 2010 (32) обращается к этому вопросу с помощью Calu-3 клеток бронхиального эпителия человека, клеточной модели дыхательных путей, которая может быть полностью дифференцирована в поляризованный эпителий. Хотя авторы работали с клетками, инфицированными в культуре, покрытой жидкостью (LCC), они предложили использовать клетки Calu-3 в культуре с воздушным интерфейсом (AIC), модель, в которой клетки выращиваются с апикальным доменом, обращенным к воздуху.В конце концов они пришли к выводу, что N. meningitidis может пересекать эпителиальный слой трансцеллюлярным путем с использованием пилей IV типа. Между тем, Barrile et al. показали, используя клетки Calu-3, выращенные в LCC, что менингококки могут интернализоваться и транспортироваться в базальный домен, нарушая внутриклеточный трафик клеток-хозяев (33). Однако они также показали, что транслокация бактерий полностью ингибируется в высокополяризованных клетках, культивируемых в течение 18 дней.
Большинство предыдущих исследований, посвященных зависимому от адгезии взаимодействию N. meningitidis с эпителиальными клетками кишечника и дыхательных путей, проводилось на клетках, культивируемых в жидких средах, таких как RPMI и среда Игла, модифицированная Дульбекко (DMEM). Эти первые исследования привели к появлению концепции колонизации клеток, опосредованной ворсинками IV типа и / или Opa / Opc. В такой модели менингококки взаимодействуют с эпителиальными клетками через свои пили типа IV и образуют высокопролиферативные микроколонии, которые в конечном итоге пересекают эпителиальный барьер (22–28), в то время как белки Opa и Opc участвуют в активном процессе интернализации, который, как предполагается, способствует развитию транслокация бактерий через монослой клеток (29–31).Каждая из этих работ продемонстрировала тесное взаимодействие N. meningitidis с эпителиальными клетками человека. За последнее десятилетие мало исследований было сосредоточено на транслокации N. meningitidis через эпителиальный слой. Работа T. C. Sutherland et al. в 2010 (32) обращается к этому вопросу с помощью Calu-3 клеток бронхиального эпителия человека, клеточной модели дыхательных путей, которая может быть полностью дифференцирована в поляризованный эпителий. Хотя авторы работали с клетками, инфицированными в культуре, покрытой жидкостью (LCC), они предложили использовать клетки Calu-3 в культуре с воздушным интерфейсом (AIC), модель, в которой клетки выращиваются с апикальным доменом, обращенным к воздуху.В конце концов они пришли к выводу, что N. meningitidis может пересекать эпителиальный слой трансцеллюлярным путем с использованием пилей IV типа. Между тем, Barrile et al. показали, используя клетки Calu-3, выращенные в LCC, что менингококки могут интернализоваться и транспортироваться в базальный домен, нарушая внутриклеточный трафик клеток-хозяев (33). Однако они также показали, что транслокация бактерий полностью ингибируется в высокополяризованных клетках, культивируемых в течение 18 дней.
В дополнение к этим работам в период с 1980 по 1995 год была проведена серия экспериментов ex vivo с использованием культур органов вместо иммортализованных клеток (34–37).Авторы наблюдали прямое взаимодействие между менингококками и эпителиальными клетками эксплантата. Это было связано с потерей ресничек и, для некоторых эксплантов, с интернализацией бактерий в эпителиальных клетках. Однако в каждом из этих экспериментов эксплантаты были погружены в жидкую среду, протокол, который мог изменить морфологию клеток и нарушить слизистый барьер.
Изучению менингококковой колонизации верхних дыхательных путей человека препятствовало отсутствие соответствующих моделей.В этой работе мы использовали клетки Calu-3, выращенные в AIC (38), чтобы изучить, как менингококки колонизируют носоглоточную нишу. Заражение клеток Calu-3 показало зависимость N. meningitidis от слизи на этой модели. Наши результаты показывают, что слизь защищает менингококки от смерти, связанной с высыханием, и поддерживает рост бактерий. Мы показали, что слизистый слой изолирует бактерии и что прямое взаимодействие бактерий с эпителиальными клетками наблюдается редко.Бактерии росли, не вызывая сильного врожденного иммунного ответа клеток Calu-3. Включенные в слизь, менингококки были защищены и питались, и экспрессировали более низкие уровни адгезинов, но высокий уровень переносчиков железа, в то время как пили типа IV не были необходимы для колонизации. Наконец, мы оценили влияние колонизации Streptococcus mitis и Moraxella catarrhalis, двух бактерий, классически присутствующих в слизистой оболочке носоглотки, на рост N. meningitidis (39–41) и показали, что совместная колонизация N.meningitidis с S. mitis может способствовать росту менингококков.
РЕЗУЛЬТАТЫ
Менингококки требуют продуцирования слизи для колонизации клеток, культивируемых на границе раздела воздух-жидкость. Для изучения колонизации верхних дыхательных путей человека Neisseria meningitidis мы использовали клетки Calu-3, выращенные на мембране с размером пор 0,4 мкм в условиях AIC.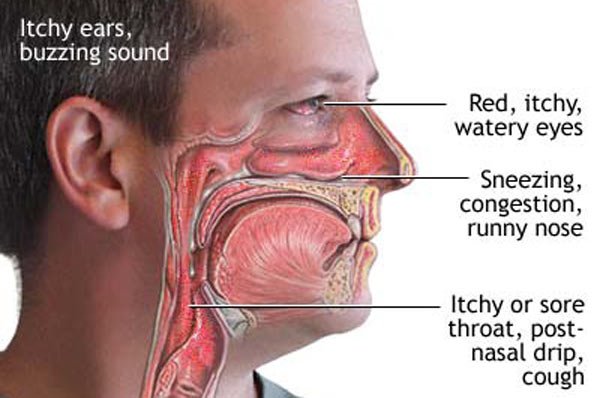 . Клетки, выдерживаемые в течение нескольких дней в AIC (неделя 0), образовывали моностратифицированный эпителий с лишь несколькими пятнами слизи на поверхности клетки (см. Рис. S1A в дополнительном материале).Мы наблюдали псевдостратифицированные клетки Calu-3, покрытые слоем слизи после 2 недель AIC. После 3 недель AIC эпителий выглядел плюристратифицированным с толстым слоем слизи над клетками (рис. S1A). Клетки, выращенные в течение 2 недель в AIC, также выявили наличие плотных контактов, микроворсинок и продуцирующих слизь клеток (рис. S1B). Через две недели после AIC толщина слизи составила 30,6 ± 5,6 мкм (рис. S1C). Сначала мы рассмотрели, может ли слизь влиять на рост менингококков на клетках Calu-3, выращенных в AIC в течение 2 дней или 2 недель (AIC W 0 и AIC W 2 , соответственно).Мы добавили 1 × 10 6 менингококков (штамм 2C4.3) к клеткам и оценили колонизацию эпителия с помощью конфокальной визуализации и количественной культуры (количество КОЕ) через 24 часа после заражения. Эти результаты сравнивали с результатами, полученными после инфицирования клеток Calu-3, культивированных в культуре с жидким покрытием (LCC). Мы наблюдали резкое снижение бактериальной пролиферации через 24 часа после заражения культивированных клеток AIC W 0 по сравнению с культивированными клетками LCC (1,35 × 10 8 ± 0,35 × 10 8 бактерий на лунку в LCC; 0.75 × 10 6 ± 0,25 × 10 6 бактерий на лунку в AIC W 0 ). Это ингибирование менее выражено в культивируемых клетках AIC W 2 , которые продуцировали слизь (2 × 10 7 ± 0,64 × 10 7 бактерий в AIC W 2 ). Кроме того, при LCC бактерии равномерно распределяются на поверхности слизи (рис. 1A и B). Эти результаты предполагают, что LCC более благоприятен для роста бактерий, чем AIC.
. Клетки, выдерживаемые в течение нескольких дней в AIC (неделя 0), образовывали моностратифицированный эпителий с лишь несколькими пятнами слизи на поверхности клетки (см. Рис. S1A в дополнительном материале).Мы наблюдали псевдостратифицированные клетки Calu-3, покрытые слоем слизи после 2 недель AIC. После 3 недель AIC эпителий выглядел плюристратифицированным с толстым слоем слизи над клетками (рис. S1A). Клетки, выращенные в течение 2 недель в AIC, также выявили наличие плотных контактов, микроворсинок и продуцирующих слизь клеток (рис. S1B). Через две недели после AIC толщина слизи составила 30,6 ± 5,6 мкм (рис. S1C). Сначала мы рассмотрели, может ли слизь влиять на рост менингококков на клетках Calu-3, выращенных в AIC в течение 2 дней или 2 недель (AIC W 0 и AIC W 2 , соответственно).Мы добавили 1 × 10 6 менингококков (штамм 2C4.3) к клеткам и оценили колонизацию эпителия с помощью конфокальной визуализации и количественной культуры (количество КОЕ) через 24 часа после заражения. Эти результаты сравнивали с результатами, полученными после инфицирования клеток Calu-3, культивированных в культуре с жидким покрытием (LCC). Мы наблюдали резкое снижение бактериальной пролиферации через 24 часа после заражения культивированных клеток AIC W 0 по сравнению с культивированными клетками LCC (1,35 × 10 8 ± 0,35 × 10 8 бактерий на лунку в LCC; 0.75 × 10 6 ± 0,25 × 10 6 бактерий на лунку в AIC W 0 ). Это ингибирование менее выражено в культивируемых клетках AIC W 2 , которые продуцировали слизь (2 × 10 7 ± 0,64 × 10 7 бактерий в AIC W 2 ). Кроме того, при LCC бактерии равномерно распределяются на поверхности слизи (рис. 1A и B). Эти результаты предполагают, что LCC более благоприятен для роста бактерий, чем AIC.
Размножение N. meningitidis в модели культуры с воздушным интерфейсом.(A) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis через 24 часа после инфицирования клеток Calu-3. Менингококки были помечены антителом против 2С43 (зеленый). Клетки окрашивали фаллоидином, конъюгированным с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Прутки, 20 мкм. (B) Количество КОЕ N. meningitidis на лунку через 24 часа после заражения (10 6 бактерий). Данные были выражены как средние значения КОЕ на фильтр ± стандартные ошибки средних значений (SEM) (планки ошибок). Статистический анализ выполнялся с помощью однофакторного дисперсионного анализа по меньшей мере для пяти фильтров из трех независимых экспериментов.Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: *, P <0,05; **, P <0,01. (C) Анализ осушения. Планшеты покрывали слизью, полученной из клеток Calu-3, или культуральной средой в качестве контроля. Затем бактерии выращивали в течение ночи в этих лунках, содержащих культуральную среду. Затем среду осторожно удалили. Бактерии сушили 0, 30, 60 или 120 мин. Затем оценивали количество КОЕ. Данные были выражены как средние значения КОЕ на миллилитр ± стандартная ошибка среднего.Статистический анализ был выполнен с помощью теста Стьюдента t по крайней мере на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: **, P <0,01.
meningitidis через 24 часа после инфицирования клеток Calu-3. Менингококки были помечены антителом против 2С43 (зеленый). Клетки окрашивали фаллоидином, конъюгированным с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Прутки, 20 мкм. (B) Количество КОЕ N. meningitidis на лунку через 24 часа после заражения (10 6 бактерий). Данные были выражены как средние значения КОЕ на фильтр ± стандартные ошибки средних значений (SEM) (планки ошибок). Статистический анализ выполнялся с помощью однофакторного дисперсионного анализа по меньшей мере для пяти фильтров из трех независимых экспериментов.Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: *, P <0,05; **, P <0,01. (C) Анализ осушения. Планшеты покрывали слизью, полученной из клеток Calu-3, или культуральной средой в качестве контроля. Затем бактерии выращивали в течение ночи в этих лунках, содержащих культуральную среду. Затем среду осторожно удалили. Бактерии сушили 0, 30, 60 или 120 мин. Затем оценивали количество КОЕ. Данные были выражены как средние значения КОЕ на миллилитр ± стандартная ошибка среднего.Статистический анализ был выполнен с помощью теста Стьюдента t по крайней мере на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: **, P <0,01.
FIG. S1
Клетки Calu-3, выращенные с использованием AIC. (A) Конфокальные 3D-реконструкции живых клеток Calu-3, показывающие накопление слизи после 2 недель культивирования в AIC. Слизь была помечена декстраном, конъюгированным с Alexa Fluor (голубой), и клетки были окрашены с помощью Cell Trace Calcein Red Orange, AM (красный).Пруток, 20 мкм. (B) Изображения просвечивающей электронной микроскопии (поперечный разрез). Обозначены плотное соединение (звездочка), муцинсодержащие везикулы (стрелка), микроворсинки (мкВ) и слизь (M). Прутки, 2 мкм.Авторские права © 2019 Audry et al.Этот контент распространяется на условиях международной лицензии Creative Commons Attribution 4.0.
Известно, что слизистый слой является плохой питательной средой, которая ограничивает рост многих комменсальных и патогенных бактерий. Это сильно гидратированный гель, который также защищает клеточную поверхность от высыхания.Поэтому мы стремились определить, может ли слой слизи защитить N. meningitidis от высыхания в модели абиотической поверхностной колонизации (рис. 1C). Мы инфицировали пластиковые лунки, покрытые очищенной и высушенной слизью, в течение 24 часов, чтобы позволить бактериям прилипнуть и образоваться биопленке на дне лунок (см. Материалы и методы). Важно отметить, что слизь не способствовала росту бактерий. Мы подсчитали одинаковое количество КОЕ перед сушкой как в контрольных лунках, так и в лунках, покрытых слизью (1.7 × 10 7 и 1,4 × 10 7 КОЕ соответственно). В день эксперимента мы удалили питательную среду и инкубировали прилипшие бактерии под ламинарным вытяжным шкафом в течение 30, 60 и 120 мин. В этом состоянии менингококки были особенно чувствительны к высыханию. В контрольных лунках количество живых бактерий уменьшилось в 5,6 × 10 3 раз за 30 мин и в 7,9 × 10 5 раз через 120 мин после начала эксперимента. И наоборот, в лунках, покрытых слизью, количество живых бактерий снижалось в 110 раз через 30 минут и 1. 46 × 10 3 -кратно через 120 мин после начала эксперимента. В целом, наши результаты показывают, что слизистый слой клеток Calu-3, культивируемых в AIC, вероятно, защищает бактерии от высыхания.
46 × 10 3 -кратно через 120 мин после начала эксперимента. В целом, наши результаты показывают, что слизистый слой клеток Calu-3, культивируемых в AIC, вероятно, защищает бактерии от высыхания.
Менингококки ограничены слоем слизи и не проникают через эпителий. Во время инфекции LCC бактерии легко прикрепляются к клеткам человека и индуцируют передачу сигналов клетки-хозяина, что приводит к привлечению эзрина и актина и образованию выступов на мембране (42, 43 ). И наоборот, во время инфекции AIC, как в случае колонизации носоглоточной слизи, бактерии откладываются на слое слизи, которое защищает клетки.Поэтому мы изучили, как N. meningitidis взаимодействует с эпителием, выращенным в AIC. Сначала мы сравнили количество КОЕ, выделенных из внешней слизи, с фракцией, содержащей как клетки, так и прикрепленную к клеткам слизь. Клетки были инфицированы 1 × 10 6 менингококков дикого типа или его непилированным производным (мутант pilE ; Δ pilE ), который не может прикрепляться к клеткам человека (24). До 80% менингококков дикого типа или менингококков Δ pilE было извлечено во внешнем слое слизи, что означает, что N.meningitidis лишь незначительно проникает в этот слой (рис. 2А). Интересно, что такое же количество менингококков дикого типа и Δ pilE было собрано во фракции, содержащей клетки и прикрепленную к клеткам слизь. Чтобы лучше охарактеризовать инфекцию клеток Calu-3, выращенных с использованием AIC, и определить, взаимодействовали ли бактерии с клетками, мы визуализировали инфицированные клетки с помощью трансмиссионной и сканирующей электронной микроскопии (TEM и SEM). Мы обнаружили, что большинство бактерий попало в слизь (рис.2B и C) и организованы в небольшие скопления живых и умирающих менингококков в соответствии с морфологией клеток. Было обнаружено несколько бактерий, находящихся в прямом контакте с плазматическими мембранами клеток Calu-3, и мы редко обнаруживали выступы мембран рядом с бактериями, в отличие от того, что наблюдалось ранее, когда клетки были инфицированы в LCC (43). Мы обнаружили несколько интернализованных бактерий, несмотря на анализ четырех различных продольно разрезанных слоев клеток. Эти бактерии находились вблизи апикальной плазматической мембраны (рис.2D) или уже переварены в вакуоли (рис. S2). Затем мы изучили инфицированные клетки Calu-3 с помощью конфокальной микроскопии. Опять же, большинство бактерий было обнаружено в слизи, окрашенной антителом против MUC5AC. Мы также наблюдали как с помощью конфокальной микроскопии, так и с помощью ПЭМ, микроколонии бактерий, заключенные между эпителиальными клетками в полостях в верхней части клеточного слоя (рис. 3A и B). Однако в базальной части эпителия бактерий не наблюдалось, как можно было бы ожидать, если бы бактерии прошли через него.Кроме того, непилированный мутант Δ pilE показал такое же пространственное расположение, что и штамм дикого типа, что позволяет предположить, что пили типа IV не играют роли в локализации бактерий в слизи (фиг. 3A).
Мы обнаружили несколько интернализованных бактерий, несмотря на анализ четырех различных продольно разрезанных слоев клеток. Эти бактерии находились вблизи апикальной плазматической мембраны (рис.2D) или уже переварены в вакуоли (рис. S2). Затем мы изучили инфицированные клетки Calu-3 с помощью конфокальной микроскопии. Опять же, большинство бактерий было обнаружено в слизи, окрашенной антителом против MUC5AC. Мы также наблюдали как с помощью конфокальной микроскопии, так и с помощью ПЭМ, микроколонии бактерий, заключенные между эпителиальными клетками в полостях в верхней части клеточного слоя (рис. 3A и B). Однако в базальной части эпителия бактерий не наблюдалось, как можно было бы ожидать, если бы бактерии прошли через него.Кроме того, непилированный мутант Δ pilE показал такое же пространственное расположение, что и штамм дикого типа, что позволяет предположить, что пили типа IV не играют роли в локализации бактерий в слизи (фиг. 3A).
N. meningitidis колонизирует внешнюю слизь. Клетки Calu-3, выращенные в AIC, инфицировали в течение 24 ч 10 6 бактериями. (A) После того, как клетки Calu-3 были инфицированы диким типом (WT) или мутантом Δ pilE штамма 2C4.3 N. meningitidis, внешний слой слизи (наружная слизь) был отделен от прикрепленной к клетке слизи. с использованием N -ацетилцистеина.Определяли бактериальную нагрузку во фракции N -ацетилцистеина или во фракции, присоединенной к клеткам. Данные были выражены в виде среднего процента КОЕ ± SEM для по крайней мере пяти фильтров из трех независимых экспериментов. (B) Изображения, полученные с помощью сканирующей электронной микроскопии, показывают бактерии, попавшие в слизь. Показаны бактерии, застрявшие в слизи (красная звездочка), и бактерии, которые напрямую взаимодействуют с клетками Calu-3 (красная стрелка). Прутки, 10 мкм. (C) Изображения просвечивающей электронной микроскопии, показывающие бактерии в слизи (слева) или в контакте с клетками (справа). Показаны умирающие бактерии (красная звездочка) и бактерии, прикрепленные к клеткам Calu-3 (красные стрелки). (D) Z-стек из конфокальной трехмерной реконструкции двух различных слоев клеток Calu-3, инфицированных N. meningitidis. Слои клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый) и антителом против MUC5AC (фиолетовый). Клетки окрашивали A546-фаллоидином (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм.
Показаны умирающие бактерии (красная звездочка) и бактерии, прикрепленные к клеткам Calu-3 (красные стрелки). (D) Z-стек из конфокальной трехмерной реконструкции двух различных слоев клеток Calu-3, инфицированных N. meningitidis. Слои клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый) и антителом против MUC5AC (фиолетовый). Клетки окрашивали A546-фаллоидином (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм.
N. meningitidis не пересекает эпителиальный слой. (A) Z-стек из конфокальной трехмерной реконструкции клеточного слоя Calu-3, инфицированного за 24 часа 10 6 бактериями штамма дикого типа (2C4.3 WT) или деформация дефектная для пилей типа IV (2C4.3 Δ pilE ). Слой клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали фаллоидином, конъюгированным с Alexa Fluor (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм. (B) Изображения просвечивающей электронной микроскопии (продольные срезы) клеточного слоя Calu-3, инфицированного в течение 24 часов 10 6 менингококков дикого типа. (C) Графики Каплана-Мейера, показывающие прохождение N. meningitidis дикого типа через слой клеток Calu-3.Данные были выражены в процентах от проникновения в базальную камеру. Для необработанных клеток восемь фильтров заражали бактериями 10 4 или 10 2 и проводили три независимых эксперимента. Для клеток, обработанных IL-4 или IL-13, четыре фильтра были инфицированы 10 4 или 10 2 бактериями, и были выполнены два независимых эксперимента.
FIG S2
Умирающий и живой N. meningitidis. Изображения просвечивающей электронной микроскопии (продольный разрез), показывающие умирающие и живые бактерии внутри слизи (A) и умирающие бактерии внутри клетки (B).Показаны мертвые бактерии (DB) и живые бактерии (LB). Прутки, 1 мкм. Скачать FIG S2, файл TIF, 1,6 МБ.Авторские права © 2019 Audry et al.Этот контент распространяется на условиях международной лицензии Creative Commons Attribution 4.
0.
На основании этого наблюдения мы изучили транслокацию менингококков через слой эпителиальных клеток. Сначала мы выращивали клетки Calu-3 в AIC с использованием мембран с порами 3 мкм вместо мембран с порами 0,4 мкм. Мы решили заразить клетки Calu-3 бактериями 10 2 или 10 4 и сначала подтвердили пролиферацию N.meningitidis в этих условиях (рис. S3A и B). Независимо от инокулята количество колонизирующих бактерий через 24 часа, 10 7 КОЕ, было одинаковым. Затем мы изучили транслокацию N. meningitidis из слизи в базальную камеру, высевая базальную среду на чашки с агаром через 4 и 24 часа после заражения. Мы считали транслокацию положительной, когда хотя бы одна КОЕ была извлечена из базальной камеры. Интересно, что через 24 часа после заражения мы обнаружили всего 2 из 16 колонизированных базальных камер, а бактерии в базальных камерах не были обнаружены через 4 часа после заражения (рис.3С). Затем, используя эту модель, мы оценили влияние интерлейкина-4 (IL-4) или IL-13, двух цитокинов, которые, как известно, участвуют в воспалении глотки (44), на транслокацию N. meningitidis. Клетки обрабатывали 24 часа 5 нг / мл IL-4 или IL-13, как описано ранее (44) (фиг. 3C). Как и ожидалось, обработка клеток Calu-3 IL-4 или IL-13 привела к двукратному снижению трансэпителиального электрического сопротивления (TEER) (165,9 ± 20,02 Ом · см 2 и 155,3 ± 11,58 Ом · см 2 соответственно; рис.S3C). Однако это не было связано с повышенным прохождением через клеточный слой N. meningitidis (Fig. 3C). Наши результаты показывают, что менингококки могут колонизировать внешний слой слизи, из которой бактерии могут достигать прикрепленной к клеткам слизи, но редко контактируют с клетками или пересекают эпителиальный слой, культивируемый в AIC.
ФИГ. S3
Культура клеток Calu-3 в присутствии IL-4 и IL-13 и инфицирование клеток Calu-3. (A) Количество менингококков через 24 часа после инфицирования клеток Calu-3, выращенных в AIC, с 10 2 , 10 4 или 10 6 бактериями. Данные были выражены как среднее значение КОЕ на фильтр ± SEM для шести фильтров из двух независимых экспериментов. (B) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis. Через 24 часа после инфицирования клеток Calu-3 бактериями 10 2 , 10 4 или 10 6 клетки фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали, используя фаллоидин, конъюгированный с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Пруток, 20 мкм. (C) Измерение TEER слоя клеток Calu-3, культивируемых в AIC, с использованием 0.Мембрана с порами 4 мкм или мембрана с порами 3 мкм, с добавлением или без добавления 5 нг / мл IL-4 или IL-13 в течение 24 часов. TEER выражали как среднее значение Ом · см 2 ± SEM. Статистический анализ выполняли с помощью однофакторного дисперсионного анализа (для мембраны с размером пор 0,4 и 3 мкм, три фильтра; для контроля по сравнению с обработанными IL-4 или IL-13, четыре фильтра из двух независимых экспериментов). Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ***, P P FIG S3, файл TIF, 1.1 МБ.
Данные были выражены как среднее значение КОЕ на фильтр ± SEM для шести фильтров из двух независимых экспериментов. (B) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis. Через 24 часа после инфицирования клеток Calu-3 бактериями 10 2 , 10 4 или 10 6 клетки фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали, используя фаллоидин, конъюгированный с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Пруток, 20 мкм. (C) Измерение TEER слоя клеток Calu-3, культивируемых в AIC, с использованием 0.Мембрана с порами 4 мкм или мембрана с порами 3 мкм, с добавлением или без добавления 5 нг / мл IL-4 или IL-13 в течение 24 часов. TEER выражали как среднее значение Ом · см 2 ± SEM. Статистический анализ выполняли с помощью однофакторного дисперсионного анализа (для мембраны с размером пор 0,4 и 3 мкм, три фильтра; для контроля по сравнению с обработанными IL-4 или IL-13, четыре фильтра из двух независимых экспериментов). Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ***, P P FIG S3, файл TIF, 1.1 МБ. Авторские права © 2019 Audry et al.Этот контент распространяется на условиях международной лицензии Creative Commons Attribution 4.0.
Экспрессия факторов вирулентности менингококков во время инфекции AIC. Наши результаты показывают, что на слизистой оболочке менингококки могут жить в ловушке слизи. В этих условиях вполне вероятно, что менингококки регулируют экспрессию своих генов иначе, чем в бульоне. Поэтому мы охарактеризовали относительную экспрессию генов, которые, как известно, участвуют в колонизации слизистой оболочки.Мы сосредоточились на экспрессии генов, кодирующих факторы адгезии: pilE , opaB , opaC и nhbA ; гены, кодирующие белки, участвующие в приобретении железа: tbpA , lbpA , fetA и tonB ; mtrC , кодирующий первый ген оперона mtrCDE , который участвует в оттоке лекарственного средства; ctrA , который кодирует капсульный транспортный белок А; и четыре гена, кодирующие мишени вакцины meningitidis B (MenB), porA , fhbp , nadA и nhbA . Мы сравнили экспрессию этих генов во время инфекции AIC с их экспрессией во время экспоненциальной и стационарной фазы роста в бульоне (рис. 4).
Мы сравнили экспрессию этих генов во время инфекции AIC с их экспрессией во время экспоненциальной и стационарной фазы роста в бульоне (рис. 4).
Экспрессия факторов вирулентности. Была приготовлена общая РНК, полученная из 3-часовой или 24-часовой бульонной культуры или собранная после 24 часов инфицирования клеток Calu-3 с использованием AIC или LCC. Выражение pilE , opaB , opaC , tbpA , lbpA , fetA , tonB , mtrC , porA , nadA , fhbp , 19 nhbp , 19 nhbp и ctrA генов анализировали с помощью количественной ОТ-ПЦР.Экспрессию гена нормализовали до мкг / и выражали как относительную экспрессию ± SEM. Статистический анализ был выполнен с помощью однофакторного дисперсионного анализа двух независимых экспериментов в трех повторностях. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P <0,0001; ***, P <0,001; **, P <0,01; *, P <0,05. Указаны значения, которые существенно не отличаются (нс).
Эти гены следовали разным профилям экспрессии.Экспрессия факторов адгезии ( pilE , opaB , opaC и nhbA ) сопоставима между стационарной фазой роста в бульоне и инфицированием клеток Calu-3 в течение 24 часов. Напротив, экспрессия pilE , opaB , opaC и nhbA в AIC была снижена по отношению к экспоненциальной фазе роста (AIC / экспоненциальная фаза, 0,28, 0,34, 0,33 и 0,47, соответственно) . Три протестированных транспортера железа ( tbpA , lbpA и fetA ) были сильно экспрессированы в AIC по сравнению с экспоненциальной фазой роста (AIC / экспоненциальная фаза, 6.25, 10 и 27 соответственно).
Примечательно, что экспрессия fhbp , tonB и mtrC была слабой во время инфекции AIC. Их экспрессия в слизи клеток Calu-3 была в 6,3, 6,7 и 3,5 раза меньше, чем в стационарной фазе роста./GettyImages-165564610-5a60a646c7822d0037df638b.jpg) Экспрессия porA снижена в AIC по сравнению как с стационарной фазой, так и с экспоненциальной фазой роста (AIC / стационарная фаза, 0,67; AIC / экспоненциальная фаза, 0,51). Никаких серьезных различий в экспрессии nadA и ctrA между тестируемыми условиями не наблюдалось.В целом, 9 из 13 протестированных генов, по-видимому, следовали той же модели экспрессии в AIC, что и в стационарной фазе роста. Затем мы рассмотрели влияние на экспрессию генов взаимодействия слизи и бактерий по сравнению с взаимодействием клеток и бактерий. Клетки, выращенные в LCC, инфицировали в течение 24 часов и экспрессию генов определяли количественно, как описано выше. Интересно, что 9 из 13 генов следовали одному и тому же профилю экспрессии в AIC и LCC. Только экспрессия opaB , opaC , nadA и fhbp была значительно увеличена во время инфекции LCC по сравнению с инфекцией AIC.Эти результаты предполагают, что через 24 часа после заражения менингококк не распознает слизь или клетки в качестве триггера для экспрессии генов.
Экспрессия porA снижена в AIC по сравнению как с стационарной фазой, так и с экспоненциальной фазой роста (AIC / стационарная фаза, 0,67; AIC / экспоненциальная фаза, 0,51). Никаких серьезных различий в экспрессии nadA и ctrA между тестируемыми условиями не наблюдалось.В целом, 9 из 13 протестированных генов, по-видимому, следовали той же модели экспрессии в AIC, что и в стационарной фазе роста. Затем мы рассмотрели влияние на экспрессию генов взаимодействия слизи и бактерий по сравнению с взаимодействием клеток и бактерий. Клетки, выращенные в LCC, инфицировали в течение 24 часов и экспрессию генов определяли количественно, как описано выше. Интересно, что 9 из 13 генов следовали одному и тому же профилю экспрессии в AIC и LCC. Только экспрессия opaB , opaC , nadA и fhbp была значительно увеличена во время инфекции LCC по сравнению с инфекцией AIC.Эти результаты предполагают, что через 24 часа после заражения менингококк не распознает слизь или клетки в качестве триггера для экспрессии генов.
Менингококки вызывают меньшее воспаление при AIC. Затем мы рассмотрели влияние менингококковой колонизации на врожденный иммунный ответ клеток Calu-3, выращенных в AIC или LCC. Поэтому мы измерили высвобождение 10 про- или противовоспалительных цитокинов через 24 часа после заражения по сравнению с базальным высвобождением этих цитокинов клетками Calu-3 через 24 часа культивирования без бактерий (рис.5). Мы наблюдали, что после инфицирования три цитокина продуцировались в больших количествах при LCC-инфекции, чем при AIC-инфекции: IL-1β показал 2,9-кратное увеличение при AIC по сравнению с 15,6-кратным увеличением при LCC; фактор некроза опухоли альфа (TNF-α) показал 66,4-кратное увеличение при AIC по сравнению с 200,4-кратным увеличением при LCC; IL-4 показал 6-кратное увеличение при AIC по сравнению с 31,8-кратным увеличением при LCC. Умеренное высвобождение четырех других цитокинов было обнаружено только при LCC: IL-10, IL-13, IL-2 и IL-6 (1,4-кратное увеличение, 1. 5-кратное увеличение, 1,6-кратное увеличение и 2,33-кратное увеличение соответственно). Наконец, секреция гамма-интерферона (IFN-γ) увеличивалась в 2 раза при AIC по сравнению с 3-кратным при LCC, а секреция IL-12 увеличивалась в 3,1 раза при AIC по сравнению с 5,1 раза при LCC. В целом провоспалительный ответ, оцениваемый по продукции цитокинов, оказался выше в модели LCC по сравнению с моделью AIC. Кроме того, мы не наблюдали секреции IL-2, IL-10, IL-13 и IL-6 во время инфекции AIC.
5-кратное увеличение, 1,6-кратное увеличение и 2,33-кратное увеличение соответственно). Наконец, секреция гамма-интерферона (IFN-γ) увеличивалась в 2 раза при AIC по сравнению с 3-кратным при LCC, а секреция IL-12 увеличивалась в 3,1 раза при AIC по сравнению с 5,1 раза при LCC. В целом провоспалительный ответ, оцениваемый по продукции цитокинов, оказался выше в модели LCC по сравнению с моделью AIC. Кроме того, мы не наблюдали секреции IL-2, IL-10, IL-13 и IL-6 во время инфекции AIC.
Экспрессия цитокинов инфицированными клетками Calu-3, выращенными в AIC и LCC. Секрецию цитокинов исследовали в слизи незараженных и инфицированных клеток Calu-3 в AIC в течение 24 часов или в супернатанте неинфицированных и инфицированных клеток Calu-3 в LCC в течение 24 часов. Данные были выражены как среднее значение ± SEM кратного увеличения между инфицированными и неинфицированными состояниями. Статистический анализ был выполнен с помощью однофакторного дисперсионного анализа, по крайней мере, на двух фильтрах, считанных в двух экземплярах. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P <0.0001; ***, P <0,001; **, P <0,01; *, P <0,05.
Колонизация Streptococcus mitis клетками Calu-3 способствует росту N. meningitidis. Далее мы стремились изучить взаимодействие между N. meningitidis и другими видами бактерий в этой модели. Среди видов, которые, как известно, колонизируют носоглотку человека, мы выбрали Streptococcus mitis и Moraxella catarrhalis, которые классически выделяются из нормальной слизистой оболочки носоглотки у взрослых и детей, соответственно (39–41).Сначала мы инфицировали клетки Calu-3, культивированные в AIC на мембране с размером пор 0,4 мкм, 1 × 10 5 S. mitis или инактивированными нагреванием S. mitis или M. catarrhalis. Обе живые бактерии были способны выжить в слизи клеток Calu-3, но мы не обнаружили пролиферации через 48 часов после заражения (S.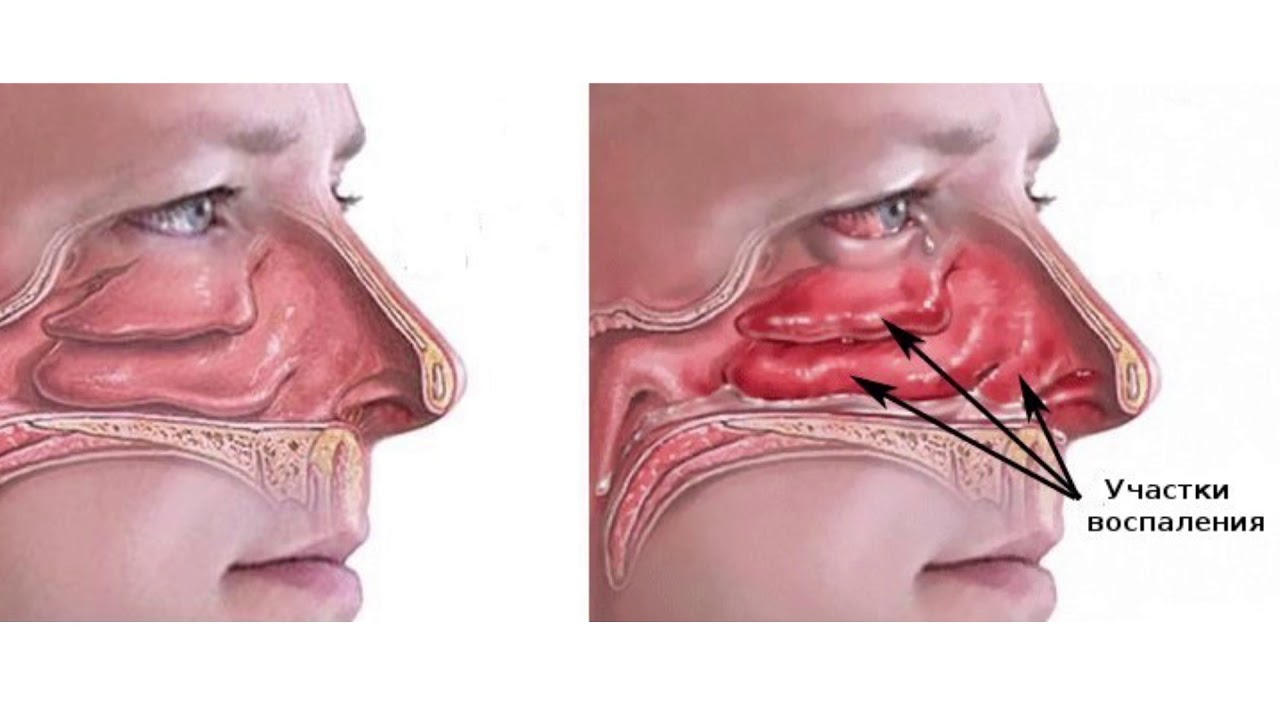 mitis, инокулят, 3,08 × 10 5 ± 0,8 × 10 5 , 48 ч, 2,7 × 10 5 ± 1,01 × 10 5 ; M. catarrhalis, инокулят, 4,12 × 10 5 ± 1,9 × 10 5 , 48 ч, 6.07 × 10 5 ± 2,38 × 10 5 ). Затем мы инфицировали клетки Calu-3, колонизированные инактивированными нагреванием S. mitis или живыми S. mitis и M. catarrhalis, менингококками 1 × 10 6 (штамм 2C4.3 дикого типа) в течение 24 часов (рис. 6). В качестве контроля наивные неинфицированные клетки Calu-3 были инфицированы N. meningitidis. Наши результаты показали, что коинфекция S. mitis значительно улучшила колонизацию менингококков в 6,7 раза, в то время как инактивированные нагреванием S. mitis или живые M. catarrhalis не имели никакого эффекта (рис.6). Интересно, что положительный эффект S. mitis-N. meningitidis при росте менингококков оказалась специфичной для модели AIC. Совместное культивирование в 24-часовом бульоне 1 × 10 5 S. mitis и 1 × 10 6 N. meningitidis выявило небольшое снижение роста менингококков (рис. S4A). В целом, эти результаты подтверждают гипотезу о том, что росту N. meningitidis при AIC могут способствовать другие бактерии носоглоточной ниши.
mitis, инокулят, 3,08 × 10 5 ± 0,8 × 10 5 , 48 ч, 2,7 × 10 5 ± 1,01 × 10 5 ; M. catarrhalis, инокулят, 4,12 × 10 5 ± 1,9 × 10 5 , 48 ч, 6.07 × 10 5 ± 2,38 × 10 5 ). Затем мы инфицировали клетки Calu-3, колонизированные инактивированными нагреванием S. mitis или живыми S. mitis и M. catarrhalis, менингококками 1 × 10 6 (штамм 2C4.3 дикого типа) в течение 24 часов (рис. 6). В качестве контроля наивные неинфицированные клетки Calu-3 были инфицированы N. meningitidis. Наши результаты показали, что коинфекция S. mitis значительно улучшила колонизацию менингококков в 6,7 раза, в то время как инактивированные нагреванием S. mitis или живые M. catarrhalis не имели никакого эффекта (рис.6). Интересно, что положительный эффект S. mitis-N. meningitidis при росте менингококков оказалась специфичной для модели AIC. Совместное культивирование в 24-часовом бульоне 1 × 10 5 S. mitis и 1 × 10 6 N. meningitidis выявило небольшое снижение роста менингококков (рис. S4A). В целом, эти результаты подтверждают гипотезу о том, что росту N. meningitidis при AIC могут способствовать другие бактерии носоглоточной ниши.
Коинфекция S.mitis и M. catarrhalis. (A) Схематическое изображение протокола, применяемого для коинфекции. (B) В день 1 клетки были инфицированы 10 5 S. mitis ( Sm ), инактивированным нагреванием S. mitis (HI Sm ) или M. catarrhalis ( Mc ). На второй день клетки инфицировали 10 6 менингококков (N. meningitidis [ Nm ]). На 3 день собирали бактерии и определяли количество КОЕ. КОЕ менингококков после 24 ч совместного культивирования выражали как средний процент контрольного эксперимента ± SEM (КОЕ менингококков в монокультуре).Статистический анализ был выполнен с помощью теста Стьюдента t по меньшей мере на пяти фильтрах из трех независимых экспериментов. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: **, P <0,01; * P <0,05.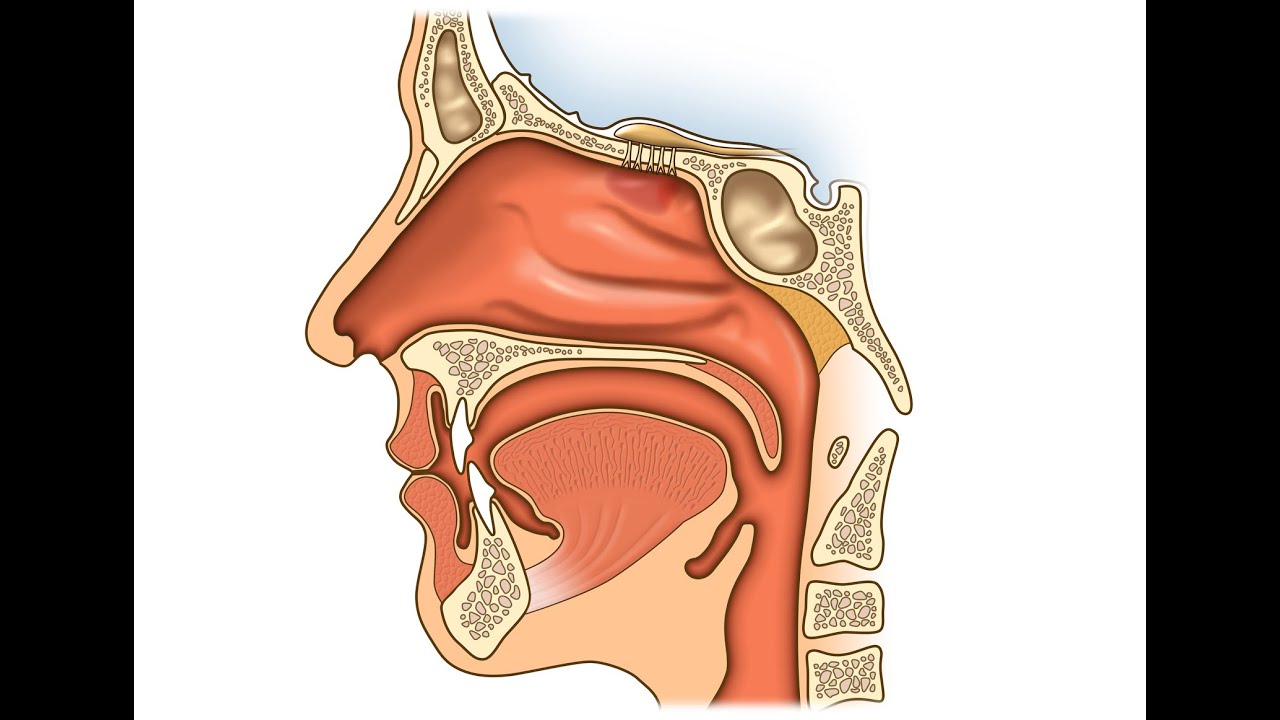
FIG S4
Совместное культивирование N. meningitidis с S. mitis в бульоне. Бульонные культуры BHI с N. meningitidis ( Nm ) и S. mitis ( Sm ) или только N. meningitidis выращивали в течение 24 часов, а N.meningitidis были определены КОЕ. Количество менингококков через 24 часа роста выражали как средний процент от значения для контрольного эксперимента ± SEM. Контролем служили менингококки, выращенные в монокультуре. Статистический анализ был выполнен с помощью теста Стьюдента t на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P P FIG S4, файл TIF, 0,2 МБ.Авторские права © 2019 Audry et al.Этот контент распространяется на условиях международной лицензии Creative Commons Attribution 4.0.
В отличие от M. catarrhalis, S. mitis способен модифицировать слизь, например, путем гидролиза гликанов, которых очень много на белках муцина (45). Таким образом, гидролиз углеводов муцинов может стать дополнительным источником углерода и питательных веществ для менингококков. Для маркера модификации слизи живым S. mitis мы исследовали профили гликозилирования муцинов с помощью масс-спектрометрии после инфицирования или коинфекции клеток Calu-3 с S.mitis, N. meningitidis или M. catarrhalis (Таблица 1; см. также Таблицу S1 в дополнительном материале). Мы наблюдали умеренное сверхсиалилирование муцинов после колонизации N. meningitidis или M. catarrhalis, поскольку 59% или 62,5% обнаруженных олигосахаридов соответственно были сиалированы по сравнению с 36,2% в неинфицированных клетках. Профиль гликозилирования муцинов резко изменился после добавления S. mitis (таблица 1 и таблица S1). Мы заметили глобальное упрощение O-гликанов из-за резкого десиалилирования муцинов, которое, вероятно, приводит к высвобождению сиаловой кислоты.Инфекция стрептококками, инактивированными нагреванием, не изменила профиль гликозилирования муцинов (Таблица S1). Это подтверждает, что S. mitis способен модифицировать слизь Calu-3 и, по крайней мере, гидролизовать O-гликаны муцинов, процесс, который коррелирует с усилением роста N. meningitidis.
Это подтверждает, что S. mitis способен модифицировать слизь Calu-3 и, по крайней мере, гидролизовать O-гликаны муцинов, процесс, который коррелирует с усилением роста N. meningitidis.
Предлагаемые структуры или последовательности олигосахаридов и профили гликозилирования муцинов на сиалилированных олигосахаридах и их несиалилированных формах, идентифицированных на муцинах Calu-3 a
ОБСУЖДЕНИЕ
В этой работе мы адаптировали экспериментальную модель, основанную на Клетки Calu-3, культивируемые в AIC, для изучения поведения N.meningitidis в слизи дыхательных путей. Мы показали, что менингококки задерживаются в слое слизи, где бактерии, вероятно, были защищены от высыхания и, безусловно, получили доступ к питательным веществам. Мы не обнаружили доказательств активного прохождения N. meningitidis через эпителиальный слой, и мы заметили, что пили типа IV не важны для роста или подвижности / подвижности в этой модели. Точно так же мы показали, что факторы вирулентности были плохо выражены в этой модели по сравнению с культурой в бульоне.Поразительно, это предполагает комменсальное поведение N. meningitidis, а это означает, что бактерии извлекают выгоду из клеточного слоя / слоя слизи, не повреждая его. Эта гипотеза подтверждается слабым цитокиновым ответом, наблюдаемым через 24 часа после заражения. Мы воспользовались этой моделью, чтобы исследовать влияние других бактерий на рост N. meningitidis. Мы показали, что S. mitis, который способен гидролизовать гликаны, способствует росту менингококков в протоколе коинфекции.
Большинство исследований, направленных на определение поведения менингококков на эпителиальных клетках, проводилось с клетками, которые были культивированы и инфицированы в LCC.Хотя эти исследования предоставили исчерпывающее описание взаимодействия между N. meningitidis и эпителиальными клетками человека, научное сообщество не смогло прийти к согласию по вопросу о том, как и когда менингококки проникают через эпителий носоглотки. Во время LCC-инфекций бактерии легко размножаются в среде для культивирования клеток, содержащей аминокислоты, источник углерода и белковые экстракты. Это позволяет N. meningitidis расти и в конечном итоге почти полностью покрывать клеточный слой Calu-3.Когда мы инфицировали клетки Calu-3, культивированные в AIC в течение 2 недель, мы наблюдали шестикратное снижение общего количества КОЕ на фильтр через 24 часа после заражения. Бактерии в основном были обнаружены в слизи, где они организовывались в небольшие группы живых и умирающих менингококков. Как следствие, бактерии редко взаимодействуют с клетками человека, и мы почти не обнаружили N. meningitidis в прямом контакте с плазматической мембраной этих клеток. Ввиду этого результата мы спросили, может ли N. meningitidis пересекать эпителиальный слой, выращенный в AIC.После инфицирования клеток, культивированных на мембранах с размером пор 3 мкм, мы обнаружили бактерии в базальной камере только в двух лунках из восьми для самого высокого посевного материала (10 4 КОЕ) и в отсутствии загрязненных камер для самого низкого уровня (10 2 ). КОЕ). Затем мы обрабатывали клетки Calu-3 IL-4 или IL-13, двумя цитокинами, которые вызывают снижение TEER и индуцируют выработку слизи, в течение 24 часов (44). Как и ожидалось, эти два цитокина привели к снижению TEER. Однако это не сопровождалось увеличением транслокации бактерий через эпителиальный слой.Все эти результаты свидетельствуют о том, что наблюдаемый в этом эксперименте обход был только стохастическим и, вероятно, из-за неоднородности слоя слизи на поверхности лунок. Чтобы поддержать эту гипотезу, мы никогда не наблюдали менингококки штамма 2C4.3 внутри или вне клеток и вблизи пористой мембраны. Тем не менее, будет интересно оценить поведение других изолятов N. meningitidis, особенно штаммов других серотипов, таких как MC58 или Z5463.
Во время LCC-инфекций бактерии легко размножаются в среде для культивирования клеток, содержащей аминокислоты, источник углерода и белковые экстракты. Это позволяет N. meningitidis расти и в конечном итоге почти полностью покрывать клеточный слой Calu-3.Когда мы инфицировали клетки Calu-3, культивированные в AIC в течение 2 недель, мы наблюдали шестикратное снижение общего количества КОЕ на фильтр через 24 часа после заражения. Бактерии в основном были обнаружены в слизи, где они организовывались в небольшие группы живых и умирающих менингококков. Как следствие, бактерии редко взаимодействуют с клетками человека, и мы почти не обнаружили N. meningitidis в прямом контакте с плазматической мембраной этих клеток. Ввиду этого результата мы спросили, может ли N. meningitidis пересекать эпителиальный слой, выращенный в AIC.После инфицирования клеток, культивированных на мембранах с размером пор 3 мкм, мы обнаружили бактерии в базальной камере только в двух лунках из восьми для самого высокого посевного материала (10 4 КОЕ) и в отсутствии загрязненных камер для самого низкого уровня (10 2 ). КОЕ). Затем мы обрабатывали клетки Calu-3 IL-4 или IL-13, двумя цитокинами, которые вызывают снижение TEER и индуцируют выработку слизи, в течение 24 часов (44). Как и ожидалось, эти два цитокина привели к снижению TEER. Однако это не сопровождалось увеличением транслокации бактерий через эпителиальный слой.Все эти результаты свидетельствуют о том, что наблюдаемый в этом эксперименте обход был только стохастическим и, вероятно, из-за неоднородности слоя слизи на поверхности лунок. Чтобы поддержать эту гипотезу, мы никогда не наблюдали менингококки штамма 2C4.3 внутри или вне клеток и вблизи пористой мембраны. Тем не менее, будет интересно оценить поведение других изолятов N. meningitidis, особенно штаммов других серотипов, таких как MC58 или Z5463.
Эти результаты позволяют предположить, что N.meningitidis, растущий в слизи эпителиальных клеток, не изменял эпителиальный слой в ходе эксперимента. Поэтому мы изучили продукцию цитокинов эпителиальными клетками, выращенными в AIC или LLC. Примечательно, что мы наблюдали, что три основных воспалительных цитокина (IL-6, TNF-α и IL-1β) продуцируются меньше во время инфекции при AIC, чем при LCC. Два противовоспалительных цитокина, ИЛ-10 и ИЛ-4, также вырабатывались меньше после инфицирования, что свидетельствует об общем снижении цитокинового ответа во время инфекции при АИК.Однако после инфицирования клетки Calu-3 секретировали IL-12 и IFN-γ в одинаковой степени независимо от того, были ли они инфицированы в AIC или LCC. Известно, что IFN-γ и IL-12 связаны с ответами макрофагов и дендритных клеток, хотя есть доказательства того, что эпителиальные клетки продуцируют эти цитокины после заражения микробами (46, 47). IFN-γ оказывает плейотропное действие на эпителиальные клетки дыхательных путей. Было показано, что этот цитокин снижает экспрессию MUC5AC, что может привести к снижению барьерных свойств дыхательной слизи (48).Между тем, IFN-γ индуцирует экспрессию рецепторов CEACAM (49), которые являются рецепторами менингококкового адгезина Opa, который, как известно, участвует в интернализации бактерий. И наоборот, IFN-γ может способствовать барьерной функции эпителиальных клеток легких (44). Наконец, мы не обнаружили секрецию IL-8 после инфицирования клеток Calu-3. В нашем цитокиновом анализе клетки, культивируемые AIC, обычно были менее реактивными, чем клетки, которые были культивированы в LCC, что указывает на то, что слой слизи, вероятно, защищает клетки и сохраняет связанные с патогенами молекулярные структуры, что приводит к снижению врожденного иммунного ответа.Однако наша модель, которая не включала иммунные клетки, дает лишь частичный обзор врожденного иммунного ответа в носоглотке.
Поэтому мы изучили продукцию цитокинов эпителиальными клетками, выращенными в AIC или LLC. Примечательно, что мы наблюдали, что три основных воспалительных цитокина (IL-6, TNF-α и IL-1β) продуцируются меньше во время инфекции при AIC, чем при LCC. Два противовоспалительных цитокина, ИЛ-10 и ИЛ-4, также вырабатывались меньше после инфицирования, что свидетельствует об общем снижении цитокинового ответа во время инфекции при АИК.Однако после инфицирования клетки Calu-3 секретировали IL-12 и IFN-γ в одинаковой степени независимо от того, были ли они инфицированы в AIC или LCC. Известно, что IFN-γ и IL-12 связаны с ответами макрофагов и дендритных клеток, хотя есть доказательства того, что эпителиальные клетки продуцируют эти цитокины после заражения микробами (46, 47). IFN-γ оказывает плейотропное действие на эпителиальные клетки дыхательных путей. Было показано, что этот цитокин снижает экспрессию MUC5AC, что может привести к снижению барьерных свойств дыхательной слизи (48).Между тем, IFN-γ индуцирует экспрессию рецепторов CEACAM (49), которые являются рецепторами менингококкового адгезина Opa, который, как известно, участвует в интернализации бактерий. И наоборот, IFN-γ может способствовать барьерной функции эпителиальных клеток легких (44). Наконец, мы не обнаружили секрецию IL-8 после инфицирования клеток Calu-3. В нашем цитокиновом анализе клетки, культивируемые AIC, обычно были менее реактивными, чем клетки, которые были культивированы в LCC, что указывает на то, что слой слизи, вероятно, защищает клетки и сохраняет связанные с патогенами молекулярные структуры, что приводит к снижению врожденного иммунного ответа.Однако наша модель, которая не включала иммунные клетки, дает лишь частичный обзор врожденного иммунного ответа в носоглотке.
Мы наблюдали, что экспрессия факторов вирулентности N. meningitidis варьировала в зависимости от статуса роста и что три гена вирулентности pilE , mtrC и fhbp значительно подавлялись во время инфекции при AIC.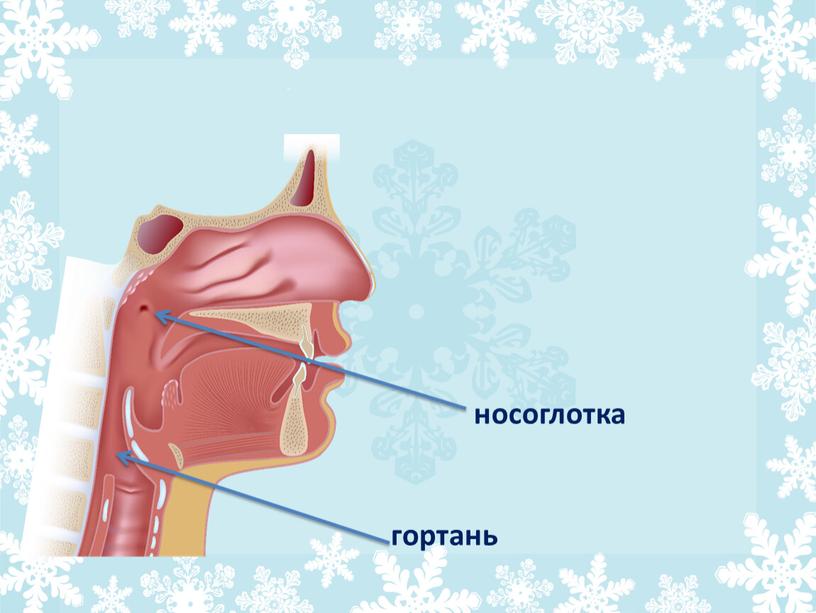 Экспрессия pilE во время инфекции в модели AIC оказалась аналогичной экспрессии, наблюдаемой во время стационарной фазы роста в жидкой культуре.Это коррелировало с отсутствием роли пилей типа IV во время колонизации клеток Calu-3. Хотя большинство штаммов менингококков, обнаруженных in vivo , были пилированными, роль пилей типа IV во время роста в слизи, вероятно, не была связана с подвижностью и / или взаимодействием с эпителиальными клетками. Однако мы не могли исключить взаимодействие между пилями IV типа и муцинами. Напротив, экспрессия fhbp во время инфицирования в AIC была резко снижена по сравнению с экспоненциальной и стационарной фазой роста в бульоне.Интересно, что fHBP (белок, связывающий фактор H) является ключевым фактором вирулентности N. meningitidis (50), необходимым для связывания с человеческим фактором H, и который ингибирует альтернативный путь комплемента хозяина. Роль fHBP в дыхательных путях не ясна. Хотя дыхательная слизь содержит компоненты комплемента (51, 52), бактерицидная активность комплемента четко не определена против N. meningitidis. Например, акапсулированные штаммы регулярно извлекаются мазками, тогда как активная система комплемента должна устранить эти штаммы.Поэтому неудивительно наблюдать отсутствие регуляции экспрессии гена ctrA между различными тестируемыми условиями. Основываясь на наших результатах и в контексте вакцины MenB, может быть важным дальнейшее исследование экспрессии fhbp в контексте респираторной слизи. Наконец, мы показали, что lbpA , tbpA и особенно fetA были высоко экспрессированы в AIC, подтверждая низкую концентрацию свободного железа в этой модели.
Экспрессия pilE во время инфекции в модели AIC оказалась аналогичной экспрессии, наблюдаемой во время стационарной фазы роста в жидкой культуре.Это коррелировало с отсутствием роли пилей типа IV во время колонизации клеток Calu-3. Хотя большинство штаммов менингококков, обнаруженных in vivo , были пилированными, роль пилей типа IV во время роста в слизи, вероятно, не была связана с подвижностью и / или взаимодействием с эпителиальными клетками. Однако мы не могли исключить взаимодействие между пилями IV типа и муцинами. Напротив, экспрессия fhbp во время инфицирования в AIC была резко снижена по сравнению с экспоненциальной и стационарной фазой роста в бульоне.Интересно, что fHBP (белок, связывающий фактор H) является ключевым фактором вирулентности N. meningitidis (50), необходимым для связывания с человеческим фактором H, и который ингибирует альтернативный путь комплемента хозяина. Роль fHBP в дыхательных путях не ясна. Хотя дыхательная слизь содержит компоненты комплемента (51, 52), бактерицидная активность комплемента четко не определена против N. meningitidis. Например, акапсулированные штаммы регулярно извлекаются мазками, тогда как активная система комплемента должна устранить эти штаммы.Поэтому неудивительно наблюдать отсутствие регуляции экспрессии гена ctrA между различными тестируемыми условиями. Основываясь на наших результатах и в контексте вакцины MenB, может быть важным дальнейшее исследование экспрессии fhbp в контексте респираторной слизи. Наконец, мы показали, что lbpA , tbpA и особенно fetA были высоко экспрессированы в AIC, подтверждая низкую концентрацию свободного железа в этой модели.
Носоглотка колонизирована шестью основными родами: Haemophilus , Streptococcus , Moraxella , Staphylococcus , Alloiococcus и Corynebacterium (40, 41). Влияние микробиоты на рост, выживаемость и экспрессию фактора вирулентности N. meningitidis пока не известно. Здесь мы использовали модель AIC для изучения влияния колонизации на рост N. meningitidis двух из этих бактерий, Streptococcus mitis или Moraxella catarrhalis, которые являются типичными колонизаторами носоглотки человека (39–41).Мы коинфицировали клетки Calu-3 с S. mitis или M. catarrhalis и менингококками. Интересно, что мы наблюдали, что S. mitis способствовал росту менингококков через 24 часа после заражения. Такой результат не ожидался, поскольку известно, что пируватоксидаза (SpxB) из Streptococcaceae продуцирует большое количество перекиси водорода и подавляет рост N. meningitidis в бульоне (53). Okahashi et al. показали, что S. mitis также экспрессирует SpxB, который может быть вредным для клеток Calu-3 (54). Поэтому мы изучили рост менингококков, выращенных совместно с S.mitis в бульоне (см. рис. S4 в дополнительном материале). Как описано, высокое соотношение S. mitis убило менингококки, тогда как соотношение 1 S. mitis на 10 N. meningitidis достаточно, чтобы вдвое сократить общее количество менингококков после 1 дня совместного культивирования. Напротив, при AIC S. mitis способствует росту N. meningitidis, что позволяет предположить, что S. mitis менее активен против менингококков в условиях AIC. Кроме того, наш гликомический анализ показал, что S. mitis способен гидролизовать O-гликаны муцина, в то время как N.meningitidis — нет. Этого и следовало ожидать, поскольку известно, что S. mitis экспрессирует многие гликозилгидролазы (45). Поскольку сиаловые кислоты высвобождались из O-гликанов, мы оценили, может ли это обеспечить преимущество роста N. meningitidis. Как и ожидалось, менингококки не могли расти в присутствии сиаловой кислоты в качестве единственного источника углерода в бульоне, и добавления сиаловой кислоты в слизь клеток Calu-3 было недостаточно для усиления роста менингококков (данные не показаны). . Однако можно предположить, что S.mitis может увеличивать концентрацию других питательных веществ, которые могут метаболизироваться N. meningitidis, ингибировать антимикробный пептид или поглощать питательные вещества, которые затем могут метаболизироваться N. meningitidis.
В целом, наши результаты показали, что инфицирование продуцирующих слизь клеток в AIC отличается от таковых в обычных экспериментах, проводимых в LCC. В то время как в последних экспериментах изучали взаимодействие N. meningitidis с эпителиальными клетками, которое, вероятно, происходит после значительного воспаления или механического нарушения в слое слизи, в нашем настоящем исследовании подчеркивается, что N.meningitidis определенно задерживается в слое слизи и редко взаимодействует с клетками человека, в то время как реакция хозяина менее выражена. Потребуется дальнейшая работа, чтобы лучше понять, как N. meningitidis регулирует свои факторы вирулентности и сожительствует с другими видами бактерий в слизи.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы и условия роста. В этом исследовании использовались Neisseria meningitidis NEM 8013 (2C4.3), капсулированный штамм серогруппы C с пилилированной оболочкой и его изогенный неадгезивный мутант с дефектом PilE (Δ pilE ) (27). ).
Streptococcus mitis штамм B26E10 (обозначенный как 0902 230473 в коллекции Necker Hospital) и штамм Moraxella catarrhalis B18F4 (обозначенный как B18F4 в коллекции Necker Hospital) были выделены от пациента в больнице Necker (Париж). За исключением штамма S. mitis, выращенного на чашках поливитекса с шоколадным агаром, все штаммы выращивали на чашках с агаром для инфузии мозга (BHI) с добавлением 5% лошадиной сыворотки при 37 ° C в инкубаторе с 5% CO 2 . Были использованы следующие антибиотики и концентрации: канамицин 100 мкг / мл, ванкомицин 20 мкг / мл и полимиксин 15 мкг / мл.
Клеточная культура. Эпителиальные клетки Calu-3 (ATCC HTB-55) поддерживали в среде optiMEM (Life Technologies) с добавлением 5% фетальной бычьей сыворотки, HEPES, минимального раствора аминокислот и пенициллин-стрептомициновых антибиотиков. Клетки выращивали в инкубаторе с 5% CO 2 при 37 ° C. Клетки выращивали на полиэфирном мембранном фильтре для культивирования клеток с порами 0,4 мкм (Transwell; Corning). Для анализов прохождения использовали мембраны с порами 3 мкм. Перед посевом клеток мембраны фильтра были покрыты коллагеном плаценты человека IV типа (Sigma) в течение 24 часов.Клетки (3 × 10 5 ) высевали на апикальную сторону мембран и поддерживали в 200 мкл культуральной среды в апикальной камере и 1,2 мл в базальной камере. В условиях культивирования с воздушным интерфейсом (AIC) апикальную культуральную среду удаляли через 5 дней, и клеткам позволяли расти на воздушной границе в течение от 3 до 6 дней (неделя 0) или от 14 до 17 дней (неделя 2), когда слизь равномерно распределялся по поверхности слоев клеток. Толщину слизи оценивали на репрезентативных конфокальных изображениях и анализировали с помощью ImageJ.Покрытые жидкостью слои засевали и культивировали от 14 до 17 дней, как описано выше, за исключением того, что апикальная среда сохранялась все время. Трансэпителиальное электрическое сопротивление (TEER) в культуре с воздушным интерфейсом измеряли с помощью вольтметра Millicell (Millipore). Примечательно, что барьерная функция клеточного слоя Calu-3, который был выращен на мембране с размером пор 3 мкм, была снижена, на что указывает измерение трансэпителиального электрического сопротивления (TEER 357 ± 19,83 Ом / см 2 с использованием 0 .Мембрана с размером пор 4 мкм; 258 ± 14,63 Ом / см 2 с использованием мембраны с порами 3 мкм) (см. Рис. S3C в дополнительном материале). Мы оценили, что клетки Calu-3 точно представляют клетки носоглотки, сравнивая профили гликозилирования слизи клеток Calu-3 и носовой слизи от человека-донора. Мы сравнили репертуар гликозилирования муцинов, секретируемых либо клетками Calu-3, либо слизистой оболочкой носа человека ( n = 5 доноров), чтобы продемонстрировать, что основные O-гликаны, переносимые обоими наборами муцинов, аналогичны (см. Таблицу S2 в дополнительном документе). материал).
Инфекция. (i) Инфекция N. meningitidis. За два дня до заражения антибиотики были удалены из питательной среды. В день заражения суспензию бактерий из ночной культуры на чашке с агаром разводили до бактериальной концентрации 5 × 10 7 КОЕ / мл и культивировали в течение 2 ч при 37 ° C в среде optiMEM. Культуральные клетки с воздушным интерфейсом инфицировали на апикальной стороне 10 мкл бактериальной суспензии, содержащей 10 6 КОЕ на 10 мкл, если не указано иное.На следующий день клетки собирали соскабливанием и тщательно встряхивали, а затем подсчитывали КОЕ, нанося серийные разведения на чашки с агаром. Тот же протокол применялся для инфекций раздела жидкостей, за исключением того, что использовался объем 200 мкл бактериальной суспензии (10 6 КОЕ на 200 мкл). Чтобы отделить бактерии, присутствующие во фракции внешней слизи или во фракции прикрепленной к клеткам слизи, раствор optiMEM-0,1% N-ацетилцистеина инкубировали в течение 15 минут над клетками и собирали.Этот процесс повторяли трижды, и подсчитывали КОЕ во фракции внешней слизи путем посева на чашки серийных разведений. Затем для фракции прикрепленной к клеткам слизи клетки соскабливали, собранные клетки встряхивали и оценивали бактериальную нагрузку, высевая КОЕ.
(ii) Анализ трансмиграции. За день до заражения бактериями интерлейкин-4 (IL-4) и интерлейкин-13 (IL-13) человека были добавлены в базальную камеру клеток Calu-3, культивированных в AIC, при концентрации 5 нг / мл каждый.Среду заменяли непосредственно перед заражением и добавляли IL-4 или IL-13. Через 4 и 24 часа после инфицирования среду из базальных камер, содержащую необработанные или обработанные клетки, собирали и центрифугировали. Осадки ресуспендировали в 200 мкл и серийные разведения культивировали на чашках с агаром.
(iii) Коинфекция и сокультура. В день 0 штаммы S. mitis или M. catarrhalis, выращенные на чашках с агаром в течение ночи, ресуспендировали в среде optiMEM и культивировали в среде optiMEM в течение 2–3 часов при 37 ° C.После достижения фазы экспоненциального роста клетки Calu-3, выращенные в течение 2 недель в AIC, инфицировали 10 мкл бактериальной суспензии, содержащей 1 × 10 5 КОЕ. Для контрольных фильтров поверх клеток добавляли 10 мкл стерильной среды. Мы также инфицировали клетки инактивированными нагреванием S. mitis, кипяченными в течение 5 мин при 95 ° C. В день 1 контрольный и инфицированный фильтры инфицировали 1 × 10 6 штамма N. meningitidis 2C4.3, как описано ранее. На 2 день бактерии собирали соскабливанием и культивировали на чашках с селективной средой с агаром.Штамм 2C4.3 был выбран на ванкомицине (20 мкг / мл) при совместном культивировании с S. mitis и на полимиксине (15 мкг / мл) при совместном культивировании с M. catarrhalis. Во время анализа клетки инкубировали при 37 ° C в инкубаторе с 5% CO 2 .
Иммунофлуоресцентный анализ. (i) Фиксированные ячейки. Для иммунофлуоресцентных анализов клетки Calu-3 выращивали в AIC и инфицировали в течение 24 часов. Фильтры фиксировали 4% параформальдегидом в течение 1 ч при комнатной температуре, дважды промывали фосфатно-солевым буфером (PBS) и в течение 10 мин повышали проницаемость с помощью PBS-0.1% Triton X-100 и 10 мин в PBS − 0,1% бычьего сывороточного альбумина (BSA) −0,1% X-100 Triton (окрашивающий буфер). Затем клетки инкубировали с анти-N. meningitidis штамм 2C4.3 (анти-2C4.3) (и моноклональное антитело против MUC5AC (клон 45M1; Life Technologies) в буфере для окрашивания в течение 2 ч. После трех промывок в PBS фильтры инкубировали с вторичным конъюгированным с Alexa Fluor вторичным антитела в течение 2 ч. Ядерную ДНК и актин окрашивали 4 ‘, 6’-диамидино-2-фенилиндолом (DAPI) в концентрации 1 мкг / мл и фаллоидином, конъюгированным с Alexa Fluor (Invitrogen), соответственно.После нескольких промывок мембраны были вырезаны из пластиковой основы, и покровные стекла были закреплены в Mowiol для наблюдения.
(ii) Живые клетки. Поскольку слизь не может быть легко сохранена посредством фиксации, ее образование с течением времени контролировалось путем визуализации живых клеток, меченных декстраном, конъюгированным с Alexa Fluor, в концентрации 1 мг / мл (молекулярная масса [MW] 10000; Life Technologies) и клеточных следов. Кальцеин Red Orange AM в концентрации 2,5 мкМ (Life Technologies) использовали для окрашивания эпителия.Клеточный индикатор добавляли в базальную камеру на 1 ч, а раствор декстрана добавляли поверх клеток. Оба раствора были удалены и промыты перед конфокальной съемкой. Во время сбора клетки поддерживали при 37 ° C и 5% CO 2 .
Анализ изображения. Для трехмерной (3D) реконструкции получение изображения выполнялось на лазерном сканирующем конфокальном микроскопе (Leica TCS SP5). Изображения флуоресцентной микроскопии были собраны и обработаны с использованием программного обеспечения Leica Application Suite AF Lite.Каждый канал был настроен для лучшей визуализации. Трехмерная реконструкция, изображения z-стека и анализ после лечения были выполнены с использованием программного обеспечения Imaris. Анализ толщины слизи проводился с помощью ImageJ.
Электронная микроскопия. (i) Химические вещества. Кристаллический четырехокись осмия (OsO 4 ), какодилат натрия, 25% глутаральдегид и Epon были от Euromedex (Суффельвейерсхайм, Франция). Гексаметилдисилазан (HMDS) был от Sigma-Aldrich (Лион, Франция). Перфторсодержащее соединение FC-72 было от Fisher Scientific (Илкирх, Франция).
(ii) Процедуры. Все инкубации проводили при комнатной температуре. Целые вставки фиксировали в 1% OsO 4 , разведенном в FC-72 в течение 90 минут, промывали в FC-72 в течение 30 минут и фиксировали в 2,5% глутаральдегиде, разведенном в 0,1 М буфере какодилата натрия (pH 7,4) в течение 90 минут. Затем вставки промывали в какодилатном буфере (дважды по 30 мин каждый раз) и погружали в растворы этанола с возрастающей концентрацией (30%, 50%, 70%, 95%, 100%, 100% и 100% на 10 минут). каждый раз) на обезвоживание.Для сканирующей электронной микроскопии (SEM) обезвоживание завершали погружением в HMDS-этанол (1/1, об. / Об.) На 10 мин и в HMDS на 10 мин. После сушки на воздухе в течение ночи каждый фильтр извлекали из вставки с помощью небольшого лезвия скальпеля, помещали на кусок двусторонней липкой ленты на алюминиевом штыре и распыляли с помощью Au / Pd. Изображения были получены с использованием JEOL LV6510 (JEOL, Круасси-сюр-Сен, Франция). Для просвечивающей электронной микроскопии (ПЭМ) вставки погружали в смесь Epon-этанол с возрастающей концентрацией Epon (1/3 в течение 60 минут, 1/1 в течение 60 минут, 3/1 в течение ночи) и, наконец, в чистый Epon (меняли дважды. через 48 ч).Каждый фильтр вынимали из вставки и помещали в капсулу для заливки ячейками вниз. После полимеризации смолы (2 часа при 37 ° C, а затем 72 часа при 60 ° C) блок разделяли на секции, чтобы получить секции клеточного слоя. Ультратонкие срезы (80 нм) окрашивали цитратом свинца и исследовали в JEOL 100S (JEOL, Croissy-sur-Seine, Франция) при ускоряющем напряжении 80 кВ. Живые бактерии были определены как круглые и электронно-плотные клетки.
Анализ осушения. Слизь была извлечена из клеток Calu-3, культивированных в AIC в течение 2 недель с использованием 0.2% β-меркаптоэтанол, разбавленный optiMEM (среда для сбора). Среду для сбора добавляли поверх клеток Calu-3 на 20 мин и собирали в чистую пробирку. Этот шаг повторяли трижды. Затем слизь или свежую среду для сбора (в качестве контроля) наносили в лунки для чистых культур клеток и сушили в течение ночи под вытяжным шкафом с ламинарным потоком. На следующий день высушенную слизь или контрольную среду инфицировали в течение 24 часов 5 × 10 6 бактерий в 100 мкл среды для культивирования клеток. Это способствует осаждению бактерий и образованию биопленки на дне колодца.На следующий день культуральные супернатанты осторожно удаляли, а осевшие бактерии подвергали сушке в течение 0, 30, 60 и 120 минут в вытяжном шкафу с ламинарным потоком. Бактерии собирали и подсчитывали количественным культивированием на чашках с агаром.
Количественная ПЦР с обратной транскрипцией (ОТ-ПЦР). (i) Выделение РНК. Тотальную РНК выделяли из N. meningitidis, культивированного при 37 ° C в среде optiMEM в течение 3 часов (экспоненциальная фаза роста) или в течение ночи (стационарная фаза), или из инфицированных клеток (AIC или LCC [культура, покрытая жидкостью]) через 24 часа.В этих четырех условиях бактерии осаждали центрифугированием на максимальной скорости в микроцентрифуге в течение 2 минут и быстро ресуспендировали в холодном растворе TRIzol.
Образцы замораживали и хранили при –80 ° C. Затем образцы обрабатывали хлороформом, собирали водную фазу и использовали ее в протоколе очистки RNeasy (Qiagen). Образцы РНК инкубировали с турбо-ДНКазой (Invitrogen) в течение 1 ч при 37 ° C перед очисткой на мини-колонке RNeasy. Элюцию РНК проводили в воде, свободной от нуклеаз, и перед хранением добавляли 1 мкл rRNasin (Promega).
(ii) Ретранскрипция. реакций синтеза кДНК проводили с использованием набора Lunascript RT Supermix (NEB), и для каждой реакции использовали 500 нг РНК.
(iii) Метод количественной ОТ-ПЦР. 20-мкл реакционной смеси состоял из 10 мкл Luna Universal qPCR Master Mix, 0,5 мкл 10 мкМ каждого праймера, 1 мкл кДНК и 8 мкл воды, свободной от нуклеаз. Пары праймеров были созданы с помощью программы Primer3Plus. Уровни экспрессии гена были нормализованы по уровню экспрессии гена домашнего хозяйства пгм (NMV_1606).Соответствующие контроли без RT были проведены для обеспечения точности результатов.
Количественный анализ цитокинов. (i) Подготовка образцов. Клетки Calu-3 выращивали на Transwells либо в AIC, либо в LCC в течение 2 недель. Для AIC клетки инкубировали при 37 ° C в течение 20 мин со 100 мкл раствора Рингера и собирали апикальные супернатанты. Этот шаг повторяли один раз, и образцы хранили на льду. Для культуры, покрытой жидкостью, собирали 100 мкл среды в апикальной камере и клетки промывали другим объемом 100 мкл среды optiMEM.Все образцы встряхивали и центрифугировали при 4 ° C в течение 5 минут на максимальной скорости для удаления бактерий и мусора. Супернатанты собирали, мгновенно замораживали в жидком азоте и хранили при –80 ° C перед обработкой.
(ii) Измерение цитокинов. Цитокинов в клеточных супернатантах определяли количественно с помощью наборов для электрохемилюминесцентного мультиплексного анализа от Meso Scale Discovery (Rockville, MD, USA). Вкратце, 25 мкл супернатанта добавляли в каждую лунку 96-луночных многоточечных планшетов, и анализы выполняли в соответствии с инструкциями производителя.Планшеты считывали на мультиплексоре Sector S600 (Meso Scale Discovery). Все образцы были измерены в двух экземплярах.
Анализ гликозилирования муцина. (i) Выделение и очистка муцинов, секретируемых клетками Calu-3. Клетки солюбилизировали в 4 М буфере для восстановления гуанидинхлорида, содержащем 10 мМ дитиотреитола (DTT), 5 мМ ЭДТА, 10 мМ бензамидин, 5 мМ N -этилмалеимид, 0,1 мг / мл ингибитора трипсина сои и 1 мМ фенилметансульфонилфторид. В каждую апикальную камеру добавляли два миллилитра восстанавливающего буфера и инкубировали в течение ночи при комнатной температуре.Затем суспензии клеток осторожно перемешивали пипеткой, и каждую из пяти суспензий фильтра для каждого условия объединяли в одну аликвоту. CsCl добавляли до начальной плотности 1,4 г / мл, и муцины очищали центрифугированием в изопикническом градиенте плотности (ультрацентрифуга Beckman Coulter LE80 K; ротор 70,1 Ti, 417 600 × г, при 15 ° C в течение 72 часов). Фракции объемом 1 мл собирали со дна пробирки и анализировали на реактивность и плотность по периодической кислоте-Шиффу (PAS). Фракции, содержащие муцин, объединяли, диализовали против воды и лиофилизировали.
(ii) Высвобождение олигосахаридов из муцина путем обработки щелочным борогидридом. муцинов подвергали β-элиминированию в восстановительных условиях (0,1 М КОН и 1 М KBH 4 в течение 24 ч при 45 ° C), и смесь олигосахаридных альдитов сушили на роторном испарителе (Buchi) при 45 ° C. Боратные соли удаляли несколькими совместными выпариваниями с метанолом перед очисткой с помощью катионообменной хроматографии (Dowex 50 × 2, 200-400 меш, Н + форма).
(iii) Анализ перметилирования и гликозилирования муцина с помощью MALDI-TOF MS. Перметилирование смеси олигосахаридных альдитов проводили методом гидроксида натрия Чукану и Керека (55). После дериватизации продукты реакции растворяли в 200 мкл метанола и дополнительно очищали на колонке C 18 Sep-Pak (Waters, Milford, MA). Перметилированные олигосахариды анализировали с помощью матричной лазерной десорбции-ионизации-времяпролетной масс-спектрометрии (MALDI-TOF MS) в режиме отражения положительных ионов как [M + Na] + .Количественную оценку через относительный процент каждого олигосахарида рассчитывали на основе интегрирования пиков на спектрах масс-спектрометрии.
Статистика. Статистический анализ проводился с использованием программного обеспечения GraphPad Prism 8. В этом исследовании использовался односторонний дисперсионный анализ (ANOVA), тест Стьюдента t или U-критерий Манна-Уитни. В случаях неравной дисперсии вместо одностороннего дисперсионного анализа применяли дисперсионный анализ Уэлча. P Значение <0,05 считалось показателем статистической значимости.Все изображения, представленные в этой работе, были репрезентативными.
БЛАГОДАРНОСТИ
Мы благодарим Николя Гудена из центра визуализации Института Неккера за его техническую поддержку. Мы благодарим Эммануэль Билле за внимательное прочтение рукописи. Мы благодарим Карин Байли из Центра цитометрии и иммунобиологии Института Кочина (CYBIO) за ее отличную техническую помощь.
Эта работа была поддержана грантами ANR-15-CE15-0002-01. X.N. и M.C. также поддерживаются INSERM, CNRS, Université de Paris и Fondation pour la Recherche Médicale.C.R.-M. был поддержан исследовательской федерацией FRABio (Université de Lille, CNRS, FR 3688, FRABio, Biochimie Structurale et Fonctionnelle des Assemblages Biomoléculaires), CNRS (Unité Mixte de Recherche CNRS / ULille 8576) и Ministère de l’Enseignement de Supérie la Recherche.
- Авторские права © 2019 Audry et al.
Рак носоглотки | UC Irvine Medical Center
Рак носоглотки возникает над задней стенкой глотки и непосредственно за носом в области, называемой носоглоткой.Эта форма рака ежегодно поражает примерно одного человека из 100 000 в Соединенных Штатах, что делает его чрезвычайно редким. Рак носоглотки гораздо чаще встречается в регионах Северной Африки и Юго-Восточной Азии.
Каковы симптомы рака носоглотки?
Симптомы рака носоглотки легко не заметить, поскольку они похожи на симптомы обычных вирусных или бактериальных инфекций, таких как простуда. Фактически, многие пациенты могут не испытывать никаких симптомов до тех пор, пока рак не разовьется.Когда они возникают, симптомы, которые чаще всего связаны с раком носоглотки, включают:
- Боль в горле, заложенность носа и другие симптомы простуды, которые не исчезают
- Частые ушные инфекции
- Головные боли
- Ощущение, что в горле или шее застрял ком
- Изменения слуха
- Слюна или слизь с оттенком крови
- Кто подвержен риску рака носоглотки?
Ряд различных факторов может способствовать повышенному риску развития рака носоглотки, в том числе:
- Возраст: рак носоглотки чаще всего встречается у взрослых в возрасте от 30 до 50 лет
- Пол: у мужчин эта форма рака выше, чем у женщин
- Этническая принадлежность: рак носоглотки чаще всего встречается у лиц происхождения из Юго-Восточной Азии и Северной Африки
- Определенные инфекции: вирус Эпштейна-Барра (EBV), который обычно вызывает только легкие симптомы простуды, был связан с повышенным риском некоторых видов рака, включая рак носоглотки
- Диета: дым и пар от копченостей или овощей могут проникать в носоглотку и вызывать раздражение
Как диагностируется рак носоглотки?
Как и в случае с другими видами рака, диагностика карциномы носоглотки включает сочетание практического физического осмотра и расширенного диагностического тестирования и визуализации:
- Врач получит подробную историю болезни, включая обзор ваших симптомов.
- Врач также проведет целенаправленное обследование головы, шеи и горла для выявления опухших лимфатических узлов и других аномалий.
- Можно выполнить эндоскопию, чтобы врач мог визуально осмотреть весь носоглотку и полость рта. Это включает введение тонкой светящейся трубки в носоглотку через нос или рот. Если замечено что-то ненормальное, во время процедуры можно получить небольшой образец ткани для проведения биопсии.
- Рентгеновские снимки, компьютерная томография, МРТ и ПЭТ-сканирование обеспечивают подробное изображение структур головы и шеи и могут быть полезны для подтверждения или исключения диагноза рака носоглотки.
Лечение рака носоглотки:
Варианты лечения различаются в зависимости от стадии рака, общего состояния здоровья и множества других факторов:
- Лучевая терапия часто является ключевым компонентом лечения, поскольку эта форма рака обычно очень чувствительна к радиации. Радиация может использоваться отдельно или в сочетании с другими методами лечения.
- Циклы химиотерапии могут использоваться в сочетании с лучевой терапией при поздних стадиях рака носоглотки.
- Для удаления опухоли можно использовать хирургическое вмешательство. Оперировать носоглотку очень сложно, поэтому обычно это делается только в тех случаях, когда рак не реагирует на лучевую или химиотерапию.
Носоглотка — обзор | Темы ScienceDirect
Носоглотка
Носоглотка участвует в глотании, а также в дыхании, и она должна иметь возможность сжиматься, чтобы продвигать болюс пищи в пищевод и расширяться во время упражнений, чтобы обеспечить беспрепятственный поток воздуха в легкие и из легких.Эти функции выполняются мышцами, которые уникально расположены так, что как группа они могут как сжимать, так и расширять глотку. 27-29 Точные функции этих мышц у лошади изучены не полностью, но в результате исследований на лошадях и других видах животных вырисовывается общая картина.
Подъязычный аппарат — очень важная структура, поддерживающая глотку, а также корень языка и гортань. Мышцы подъязычного аппарата расширяют глотку, сокращаясь на вдохе следующим образом.Подъязычно-подъязычные и подъязычно-язычные мышцы тянут рострально и вентрально, тогда как грудино-подъязычные и стерно-щитовидные мышцы тянутся в каудально-вентральном направлении. Итоговым эффектом является расширение шилоподъязычно-цератоподъязычного сочленения, вентральное движение подъязычной кости и стабилизация или даже расширение носоглотки (рис. 41-4). Одной из рекомендуемых операций по поводу дорсального смещения мягкого неба является рассечение грудино-подъязычной и щитовидной мышц. 30,31 Целью этой операции является перемещение краниальной области надгортанника, что позволяет лучше задействовать мягкое небо.Из вышеупомянутого обсуждения ясно, что рассечение грудино-подъязычной и щитовидной мышц предотвращает расширение глотки и может способствовать коллапсу глотки. Действительно, измерения у тренирующихся лошадей показали, что разрез грудино-подъязычной и стерно-тироидной мышц немного увеличивает сопротивление верхних дыхательных путей у тренирующихся лошадей. 32
У скаковых лошадей язык часто вытягивают вперед и привязывают к нижней челюсти, чтобы предотвратить дорсальное смещение мягкого неба.Язык прикрепляется к подъязычной кости через подъязычные и подъязычные мышцы. Следовательно, возможно, что язычок расширит глотку. Однако механика потока в верхних дыхательных путях и компьютерные томографические исследования показали, что у нормальных лошадей язычок не вытягивает вперед подъязычный аппарат и не расширяет глотку. 33,34 У лошадей с DDSP использование язычка может предотвратить заболевание у отдельных лошадей, хотя для большинства он неэффективен. 35 Там, где DDSP не предотвращается, наложение язычка не улучшает вентиляцию. 35
Дорзальная стенка глотки поддерживается шилофарингеальными мышцами. Эти мышцы прикрепляются к дорсальной стенке носоглотки перпендикулярно ей, так что сокращение шилофарингеальных мышц поднимает стенку дорсальной части носоглотки, расширяя, поддерживая и предотвращая ее коллапс, поскольку давление в дыхательных путях становится более отрицательным во время вдоха (рис. 41- 5).Блокада черепного нерва (CN) IX, который иннервирует эти мышцы, приводит к коллапсу дорсального глотки и обструкции дыхательных путей во время упражнений. 36
Верхние дыхательные пути богато рецепторами, которые при стимуляции активируют мышцы-расширители верхних дыхательных путей, тем самым укрепляя верхние дыхательные пути. Например, при анестезии слизистой оболочки гортани у тренирующихся лошадей наблюдается коллапс носоглотки и обструкция верхних дыхательных путей. 37 Во время окклюзии носа эти лошади также могут испытывать DDSP.Это демонстрирует, что при тренировке лошадей сенсорные и моторные функции должны быть полностью скоординированы для поддержания проходимости верхних дыхательных путей. Сообщение для хирурга заключается в том, что верхние дыхательные пути — это точно настроенный инструмент, который может быть легко поврежден болезнью или хирургическим вмешательством.
Как удалить слизистую пробку из носовых пазух в домашних условиях — ПОЛНОЕ руководство
Это отвратительно, неудобно и , вероятно, антисанитарно — эта слизь, забивающая нос, сводит вас с ума, и она просто не исчезнет!
Нет ничего хуже заложенного носа.
Дыхание становится такой рутинной работой, и вы продолжаете сморкаться каждые две минуты. Добавьте к этому, у вас могут быть слезящиеся глаза, может быть, кашель, грипп, и вуаля, заложенный нос почти невыносим.
Вам должно быть интересно, как удалить пробку слизи из носовых пазух в домашних условиях?
К счастью для вас, вам не придется терпеть все это, так как у нас есть решения для вашей досадной маленькой проблемы.
Мы даже расскажем вам, что вызывает ваши страдания и как вы можете предотвратить засорение носа всей этой липкой ерундой, которая мешает вам жить спокойно.
Но сначала, что это за жидкость в моем носу?
Подробнее …
Роль слизи
Несмотря на то, что вы думали, что ваша простуда, возможно, возникла ниоткуда, этот материал в вашем носу на самом деле был там все это время — он называется слизь , и это действительно так. вырабатывается слизистых оболочек .
Так было всегда. Фактически, это, по сути, собственная система фильтрации вашего тела.
Как так?
Подобно очистителю воздуха, слизь в носу улавливает такие загрязнители воздуха, как аллергены, пыльцу, фомиты и даже пыль, поэтому она не попадает в легкие или другие части вашего тела.
По сути, слизь действует как защитный механизм от этих посторонних веществ, чтобы вы не заболели.
Если эта слизь была всегда, то почему мне сейчас так неуютно?
Иногда слизистые оболочки перестают работать, вызывая раздражение и воспаление.
Когда в окружающей среде слишком много пыли или пыльцы, слизистые оболочки чрезмерно стимулируются.
Это заставляет их производить на на больше слизи, чем вам действительно нужно, в результате чего слизь капает из носа в так называемом постназальном капле .
Мы также используем этот термин, когда слизь забивает нос, вызывая затруднения с дыханием.
Постназальное выделение жидкости обычно подтверждается:
- болью в горле
- затрудненным дыханием
- частым глотанием или прочисткой горла
- И, конечно же, закупоркой слизи или стекающей по носу
симптомы, возникающие при аллергической реакции, простуде или гриппе.
Они могут быть вызваны даже определенными факторами вашего образа жизни, такими как курение, употребление острой пищи или употребление слишком малого количества воды.
Место вашего проживания также может влиять на то, как часто вы страдаете заложенностью носа. Жить в шумных городах с постоянным потоком транспорта — просто кошмар для ваших слизистых оболочек!
Как выглядит слизистая пробка из носа?
Слизистая пробка из носа обычно выглядит слегка влажной и липкой, но может быть даже сухой и твердой.Его цвет также может варьироваться от желтого до коричневатого.
Чрезмерно сухой климат также может вызвать более легкое пересыхание слизистых оболочек, в результате чего образуется густая слизь, которой вдвойне трудно дышать.
Итак, что вы можете сделать для предотвращения постназального подтекания?
Как удалить пробку слизи из носовых пазух в домашних условиях?
1) Улучшите свой образ жизни
Как упоминалось выше, если вы пьете достаточно воды и держитесь подальше от жидкостей, вызывающих потерю жидкости (например, кофе или алкоголь), и даже бросаете курить, вы можете резко снизить свои шансы от засорения дыхательных путей.
Ваш нос скажет вам спасибо!
2) Используйте увлажнитель воздуха
Поскольку проживание в сухом месте может вызвать раздражение слизистых оболочек, размещение увлажнителя в вашем доме может помочь обеспечить достаточное количество влаги в помещении.
Если вы живете в особенно засушливых местах, ознакомьтесь с этим руководством, чтобы узнать, какой увлажнитель вам подходит.
3) Держитесь подальше от раздражителей
Держитесь подальше от возможных раздражителей.
Если вы не подвергаетесь воздействию аллергенов или мест с высокой концентрацией пыли в воздухе, вы обнаружите, что ваши шансы вызвать раздражение слизистых оболочек уменьшились.
Но мои симптомы уже проявились. Что делать, чтобы избавиться от заложенного носа?
4) Используйте полоскание с соленой водой.
Перед тем, как бежать за аптечками, попробуйте полоскание с соленой водой. Доказано, что он выводит лишнюю воду из тканей и снижает вероятность дальнейшего заражения.
5) Используйте назальный спрей
Вы можете попробовать назальный спрей , который уменьшает воспаление слизистых оболочек. Вы можете использовать их в конце дня, чтобы очистить дыхательные пути.
6) Сходите на массаж
Есть и более необычные способы прочистить нос — если у вас слишком много проблем с дыханием, попробуйте имитировать регулярный поток жидкости в носу с помощью массажа.
Пальцами надавите на впадину в ключицах, чтобы стимулировать нисходящий поток слизи в горле.
Если вы все сделаете правильно, вы почувствуете потребность прочистить горло, тем самым устраняя заложенность носа, хотя бы на время.
7) Используйте лекарства
Если ни один из них не помогает вам, возможно, лекарства — единственный выход, и в этом случае вы можете попробовать следующие безрецептурные лекарства:
- Противоотечные средства Уберите густую слизь в носу, хотя чрезмерное употребление может привести к побочным эффектам, таким как головокружение и высокое кровяное давление.
- Антигистаминные препараты снимают симптомы аллергии.
- Отхаркивающие средства разжижают слизь, что облегчает ее вывод из носа.
8) Другие методы
Другие методы разжижения слизи также включают дыхание через теплое полотенце (используйте мягкое, чтобы не раздражать нос) и кипячение кастрюли с водой , и вдыхая его пар.
Заключение: как удалить пробку слизи из носовых пазух дома
Если вы обнаруживаете, что засорение носа происходит чаще, чем обычно, возможно, подумайте об увлажнитель воздуха как о постоянном приспособлении в вашем доме.
Больше не бойтесь своих аллергических приступов; просто попробуйте то, что мы предложили выше, если вы страдаете от постназальной жидкости.
Но не забывайте, что вы сами можете помочь предотвратить раздражение слизистых оболочек и не засорить собственный нос!
Мы выделили три основных, но довольно простых метода:
- Улучшите свой образ жизни. Прекратите употреблять продукты, вызывающие потерю жидкости, например продукты с кофеином, и пейте много воды. Специалисты советуют выпивать от 8 до 12 стаканов воды в день.
- Избегайте пребывания в слишком сухих местах или используйте увлажнитель воздуха в доме.
- Не подвергайте себя воздействию возможных источников загрязнения.
Забитый нос — одно из самых ужасных ощущений, но жизнь еще не окончена!
Просто попробуйте предлагаемые нами решения и наблюдайте, как улетучивается слизистая пробка из носа.
Типы рака носовых пазух: общие, редкие и другие разновидности
Все пациенты с раком носовых пазух индивидуальны.Специалисты по онкологическим заболеваниям в американских онкологических центрах ® (CTCA) обладают обширным опытом в правильной постановке и диагностике заболевания, а также в разработке плана лечения, адаптированного к вашему типу рака носовых пазух.
Рак носовых пазух классифицируется в зависимости от типа пораженных клеток. Эти типы включают:
Плоскоклеточный рак: Этот тип рака возникает в поверхностных слоях головы или шеи, где клетки являются плоскими и «чешуйчатыми» или покрыты чешуей.Рак, ограниченный этим клеточным слоем, называется карциномой in situ. Инвазивная плоскоклеточная карцинома возникает, когда злокачественные клетки более глубоко проникают в ткань. Плоские эпителиальные клетки — это плоские клетки, выстилающие пазухи и образующие слизистую оболочку, которая представляет собой слой ткани, продуцирующей слизь. Клетки плоского эпителия могут перерасти в плоскоклеточный рак в полости носа и придаточных пазухах носа.
Рак слизистой оболочки: Этот рак возникает на слизистой оболочке.Аномалии внешнего вида клеток затрудняют диагностику карциномы слизистой оболочки. Некоторые карциномы слизистой оболочки относятся к категории «недифференцированных», что означает, что они не похожи на клетки ткани, в которой они развились.
Аденоидно-кистозно-клеточная карцинома: Хотя этот тип рака встречается редко, он может возникать в малых слюнных железах околоносовых пазух.
Ацино-клеточная карцинома: Этот рак развивается в слюнных железах, особенно околоушных желез, расположенных у основания каждого уха.
Недифференцированная карцинома носовых пазух: Это редкое новообразование или новое аномальное образование ткани, развивающееся в эпителии носа или носовых пазух. Это происходит, когда клетки мутируют настолько агрессивно, что трудно определить, к какому типу они относятся.
Рак носовых пазух может возникать в различных частях лица, например:
Полость носа: За носом воздух проходит через это отверстие на пути к горлу. Обе ноздри ведут в полость носа.
Параназальные пазухи: Эти заполненные воздухом области, расположенные вокруг носа или рядом с ним, окружают носовую полость.
Верхнечелюстная пазуха: Наиболее частое место, где возникает рак придаточных пазух носа, верхнечелюстная пазуха расположена в скулах по обе стороны от носа.
Решетчатая пазуха: Расположенная вдоль верхней части носа, между глазами, решетчатая пазуха является частью системы придаточных пазух носа. В этом отрывке могут развиться раковые заболевания, но они встречаются нечасто.
Носоглотка: Составляя верхнюю часть глотки или глотки, носоглотка соединяет носовую полость позади носа и около основания черепа. Лимфомы носоглотки могут возникать в дыхательных путях и окружающей лимфатической ткани. Хотя технически он классифицируется как рак горла, пациенты могут рассматривать его как рак носовых пазух, поскольку он поражает область за носовой полостью.
Следующая тема: Какие стадии рака носовых пазух?
Органы и структуры дыхательной системы — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Перечислите структуры, составляющие дыхательную систему
- Опишите, как дыхательная система обрабатывает кислород и CO 2
- Сравните и сопоставьте функции верхних дыхательных путей и нижних дыхательных путей
Основные органы дыхательной системы функционируют в первую очередь для обеспечения кислородом тканей тела для клеточного дыхания, удаления углекислого газа из отходов и поддержания кислотно-щелочного баланса.Части дыхательной системы также используются для выполнения не жизненно важных функций, таких как распознавание запахов, производство речи и напряжение, например, во время родов или кашля ((Рисунок)).
Функционально дыхательную систему можно разделить на проводящую зону и респираторную зону. В проводящую зону дыхательной системы входят органы и структуры, непосредственно не участвующие в газообмене. Газообмен происходит в респираторной зоне.
Проводящая зона
Основными функциями проводящей зоны являются обеспечение маршрута для входящего и выходящего воздуха, удаление мусора и болезнетворных микроорганизмов из входящего воздуха, а также нагревание и увлажнение входящего воздуха.Некоторые структуры в проводящей зоне выполняют и другие функции. Например, эпителий носовых ходов необходим для восприятия запахов, а эпителий бронхов, выстилающий легкие, может метаболизировать некоторые канцерогены, переносимые по воздуху.
Нос и прилегающие к нему структуры
Основной вход и выход из дыхательной системы — через нос. Обсуждая нос, полезно разделить его на две основные части: внешний нос и полость носа или внутренний нос.
Внешний нос состоит из поверхностных и скелетных структур, которые создают внешний вид носа и вносят свой вклад в его многочисленные функции ((Рисунок)). Корень — это область носа, расположенная между бровями. Переносица — это часть носа, которая соединяет корень с остальной частью носа. Спинка носа — это длина носа. Вершина — кончик носа. По обе стороны от верхушки ноздри образованы крылышками (сингулярное = аля). Ала — это хрящевая структура, которая образует боковую сторону каждой ноздри (множественное число = ноздри) или отверстия ноздри.Желобок — это вогнутая поверхность, которая соединяет верхушку носа с верхней губой.
Нос
На этой иллюстрации показаны особенности внешнего носа (вверху) и скелетные особенности носа (внизу).
Под тонкой кожей носа находятся его скелетные элементы (см. (Рисунок), нижний рисунок). В то время как корень и переносица состоят из кости, выступающая часть носа состоит из хряща. В результате при взгляде на череп отсутствует нос.Носовая кость — одна из пары костей, лежащих под корнем и переносицей. Носовая кость сочленяется сверху с лобной костью и латерально с верхнечелюстными костями. Перегородочный хрящ — это гибкий гиалиновый хрящ, соединенный с носовой костью, образующий спинную часть носа. Хрящ крыльев носа состоит из верхушки носа; он окружает нарис.
Носовые ходы открываются в полость носа, которая разделена на левую и правую части носовой перегородкой ((Рисунок)). Носовая перегородка образована спереди частью перегородочного хряща (гибкая часть, которую можно коснуться пальцами), а сзади — перпендикулярной пластиной решетчатой кости (черепная кость, расположенная сразу после носовых костей) и тонким сошником. кости (название которых связано с формой плуга).Каждая боковая стенка носовой полости имеет три костных выступа, называемых верхней, средней и нижней носовыми раковинами. Нижняя раковина — это отдельные кости, а верхняя и средняя раковины — части решетчатой кости. Раковины служат для увеличения площади поверхности носовой полости и нарушения потока воздуха, когда он попадает в нос, заставляя воздух подпрыгивать вдоль эпителия, где он очищается и нагревается. Раковины и проходы также сохраняют воду и предотвращают обезвоживание носового эпителия, задерживая воду во время выдоха.Дно носовой полости состоит из неба. Твердое небо в передней части носовой полости состоит из кости. Мягкое небо в задней части носовой полости состоит из мышечной ткани. Воздух выходит из носовых полостей через внутренние ноздри и попадает в глотку.
Верхние дыхательные пути
Несколько костей, которые помогают формировать стенки носовой полости, имеют воздухосодержащие пространства, называемые придаточными пазухами носа, которые служат для обогрева и увлажнения поступающего воздуха.Пазухи выстланы слизистой оболочкой. Каждая придаточная пазуха носа названа в честь связанной с ней кости: лобной пазухи, верхнечелюстной пазухи, клиновидной пазухи и решетчатой пазухи. Пазухи выделяют слизь и облегчают вес черепа.
Носовые ходы и передняя часть носовых полостей выстланы слизистыми оболочками, содержащими сальные железы и волосяные фолликулы, которые служат для предотвращения прохождения крупных загрязнений, таких как грязь, через носовую полость. Обонятельный эпителий, используемый для обнаружения запахов, находится глубже в полости носа.
Раковины, проходы и околоносовые пазухи выстланы респираторным эпителием, состоящим из псевдостратифицированного мерцательного столбчатого эпителия ((Рисунок)). Эпителий содержит бокаловидные клетки, одни из специализированных столбчатых эпителиальных клеток, которые производят слизь для улавливания мусора. Реснички респираторного эпителия помогают удалять слизь и мусор из полости носа постоянными толчковыми движениями, перемещая материалы по направлению к глотке, чтобы их проглотить. Интересно, что холодный воздух замедляет движение ресничек, что приводит к накоплению слизи, которая, в свою очередь, может вызвать насморк в холодную погоду.Этот влажный эпителий нагревает и увлажняет поступающий воздух. Капилляры, расположенные непосредственно под эпителием носа, нагревают воздух конвекцией. Серозные и слизистые клетки также секретируют фермент лизоцим и белки, называемые дефенсинами, которые обладают антибактериальными свойствами. Иммунные клетки, патрулирующие соединительную ткань глубоко в респираторном эпителии, обеспечивают дополнительную защиту.
Псевдостратифицированный ресничный столбчатый эпителий
Респираторный эпителий представляет собой псевдостратифицированный мерцательный столбчатый эпителий.Серомукозные железы выделяют смазывающую слизь. LM × 680. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Глотка
Глотка представляет собой трубку, образованную скелетными мышцами и выстланную слизистой оболочкой, которая является продолжением слизистой оболочки носовых полостей (см. (Рисунок)). Глотка делится на три основных области: носоглотку, ротоглотку и гортань ((рисунок)).
Подразделения глотки
Глотка делится на три области: носоглотку, ротоглотку и гортань.
Носоглотка обрамлена раковинами носовой полости и служит только дыхательным путем. В верхней части носоглотки находятся глоточные миндалины. Глоточная миндалина, также называемая аденоидом, представляет собой совокупность лимфоидной ретикулярной ткани, похожую на лимфатический узел, расположенный в верхней части носоглотки. Функция глоточной миндалины до конца не изучена, но она содержит богатый запас лимфоцитов и покрыта мерцательным эпителием, который улавливает и уничтожает вторгшиеся патогены, попадающие при вдыхании.Глоточные миндалины у детей большие, но, что интересно, с возрастом регрессируют и могут даже исчезнуть. Язычок — это небольшая выпуклая каплевидная структура, расположенная на вершине мягкого неба. И язычок, и мягкое небо во время глотания движутся подобно маятнику, качаясь вверх, чтобы закрыть носоглотку, чтобы предотвратить попадание проглоченных веществ в полость носа. Кроме того, слуховые (евстахиевы) трубы, которые соединяются с каждой полостью среднего уха, открываются в носоглотку. В связи с этим простуда часто приводит к ушным инфекциям.
Ротоглотка — это проход как для воздуха, так и для пищи. Ротоглотка окаймлена сверху носоглоткой, а спереди ротовой полостью. Зев — это отверстие на стыке ротовой полости и ротоглотки. Когда носоглотка становится ротоглоткой, эпителий изменяется с псевдостратифицированного мерцательного столбчатого эпителия на многослойный плоский эпителий. Ротоглотка содержит два различных набора миндалин: небные и язычные миндалины. Небная миндалина — одна из пары структур, расположенных латерально в ротоглотке в области зева.Язычная миндалина расположена у основания языка. Подобно глоточной миндалине, небные и язычные миндалины состоят из лимфоидной ткани и улавливают и уничтожают патогены, попадающие в организм через ротовую или носовую полости.
Гортань ниже ротоглотки и позади гортани. Он продолжает путь проглоченного материала и воздуха до его нижнего конца, где пищеварительная и дыхательная системы расходятся. Многослойный плоский эпителий ротоглотки переходит в гортань.Спереди гортань открывается в гортань, а сзади — в пищевод.
Гортань
Гортань — это хрящевая структура, расположенная ниже гортани, которая соединяет глотку с трахеей и помогает регулировать объем воздуха, входящего и выходящего из легких ((Рисунок)). Структура гортани образована несколькими кусочками хряща. Три больших хряща — щитовидный хрящ (передний), надгортанник (верхний) и перстневидный хрящ (нижний) — образуют основную структуру гортани.Щитовидный хрящ — самый большой кусок хряща, из которого состоит гортань. Щитовидный хрящ состоит из выступа гортани, или «адамова яблока», которое обычно более заметно у мужчин. Толстый перстневидный хрящ образует кольцо с широкой задней областью и более тонкой передней областью. Три парных хряща меньшего размера — черпаловидный, роговой и клиновидный — прикрепляются к надгортаннику, голосовым связкам и мышцам, которые помогают двигать голосовые связки для воспроизведения речи.
Гортань
Гортань простирается от гортани и подъязычной кости до трахеи.
Надгортанник, прикрепленный к щитовидному хрящу, представляет собой очень гибкий кусок эластичного хряща, закрывающий отверстие трахеи (см. (Рисунок)). В «закрытом» положении незакрепленный конец надгортанника упирается в голосовую щель. Голосовая щель состоит из вестибулярных складок, настоящих голосовых связок и пространства между этими складками ((Рисунок)). Вестибулярная складка или ложная голосовая связка — это один из пары складчатых участков слизистой оболочки. Настоящая голосовая связка — это одна из белых перепончатых складок, прикрепленных мышцами к щитовидной железе и черпаловидным хрящам гортани на их внешних краях.Внутренние края настоящих голосовых связок свободны, что позволяет производить звук при колебаниях. Размер перепончатых складок настоящих голосовых связок различается у разных людей, что позволяет воспроизводить голоса с разным диапазоном высоты тона. Складки у самцов, как правило, больше, чем у самок, что создает более глубокий голос. Акт глотания заставляет глотку и гортань подниматься вверх, позволяя глотке расширяться, а надгортанник опускается вниз, закрывая отверстие для трахеи. Эти движения увеличивают площадь прохождения пищи, предотвращая попадание пищи и напитков в трахею.
Голосовые связки
Настоящие голосовые связки и вестибулярные складки гортани просматриваются снизу от гортани.
Продолжая гортань, верхняя часть гортани выстлана многослойным плоским эпителием, переходящим в псевдостратифицированный мерцательный столбчатый эпителий, содержащий бокаловидные клетки. Подобно носовой полости и носоглотке, этот специализированный эпителий вырабатывает слизь для улавливания мусора и патогенов, когда они попадают в трахею.Реснички отбивают слизь вверх по направлению к гортани, где ее можно проглотить по пищеводу.
Трахея
Трахея (дыхательное горло) простирается от гортани к легким ((Рисунок) a ). Трахея образована от 16 до 20 уложенных друг на друга С-образных кусочков гиалинового хряща, соединенных плотной соединительной тканью. Мышца трахеи и эластичная соединительная ткань вместе образуют фиброэластическую мембрану, гибкую мембрану, которая закрывает заднюю поверхность трахеи, соединяя С-образные хрящи.Фиброэластичная мембрана позволяет трахее слегка растягиваться и расширяться во время вдоха и выдоха, тогда как хрящевые кольца обеспечивают структурную поддержку и предотвращают схлопывание трахеи. Кроме того, мышца трахеи может сокращаться, чтобы направлять воздух через трахею во время выдоха. Трахея выстлана псевдостратифицированным мерцательным столбчатым эпителием, который переходит в гортань. Пищевод сзади граничит с трахеей.
Трахея
(a) Трахеальная трубка образована сложенными друг на друга С-образными кусочками гиалинового хряща.(b) Слой, видимый на этом поперечном срезе ткани стенки трахеи между гиалиновым хрящом и просветом трахеи, представляет собой слизистую оболочку, которая состоит из псевдостратифицированного мерцательного столбчатого эпителия, содержащего бокаловидные клетки. LM × 1220. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Бронхиальное дерево
Трахея разветвляется на правый и левый главные бронхи у киля. Эти бронхи также выстланы псевдостратифицированным мерцательным столбчатым эпителием, содержащим слизистые бокаловидные клетки ((Рисунок) b ).Киль — это приподнятая структура, содержащая специализированную нервную ткань, которая вызывает сильный кашель, если присутствует инородное тело, такое как пища. Хрящевые кольца, похожие на кольца трахеи, поддерживают структуру бронхов и предотвращают их коллапс. Первичные бронхи входят в легкие в воротах, вогнутой области, где кровеносные сосуды, лимфатические сосуды и нервы также входят в легкие. Бронхи продолжают разветвляться в бронхиальное дерево. Бронхиальное дерево (или респираторное дерево) — собирательный термин, используемый для этих разветвленных бронхов.Основная функция бронхов, как и других структур проводящей зоны, заключается в обеспечении прохода воздуха для входа и выхода из каждого легкого. Кроме того, слизистая оболочка задерживает мусор и болезнетворные микроорганизмы.
Бронхиола отходит от третичных бронхов. Бронхиолы диаметром около 1 мм продолжают ветвиться, пока не становятся крошечными конечными бронхиолами, которые приводят к структурам газообмена. В каждом легком более 1000 терминальных бронхиол. Мышечные стенки бронхиол не содержат хрящей, как в бронхах.Эта мышечная стенка может изменять размер трубки, увеличивая или уменьшая поток воздуха через трубку.
Дыхательная зона
В отличие от проводящей зоны, респираторная зона включает структуры, которые непосредственно участвуют в газообмене. Дыхательная зона начинается там, где терминальные бронхиолы соединяются с респираторной бронхиолой, самым маленьким типом бронхиолы ((Рисунок)), которая затем ведет к альвеолярному протоку, открывающемуся в группу альвеол.
Дыхательная зона
Бронхиолы ведут к альвеолярным мешочкам в респираторной зоне, где происходит газообмен.
Альвеолы
Альвеолярный проток — это трубка, состоящая из гладких мышц и соединительной ткани, которая открывается в группу альвеол. Альвеола — это один из множества маленьких мешочков, похожих на виноград, которые прикрепляются к альвеолярным протокам.
Альвеолярный мешок — это группа из множества отдельных альвеол, которые отвечают за газообмен. Альвеола имеет диаметр примерно 200 мкм с эластичными стенками, которые позволяют альвеолам растягиваться во время всасывания воздуха, что значительно увеличивает площадь поверхности, доступную для газообмена.Альвеолы связаны со своими соседями альвеолярными порами, которые помогают поддерживать одинаковое давление воздуха в альвеолах и легких ((Рисунок)).
Структуры респираторной зоны
(a) Альвеола отвечает за газообмен. (b) Микрофотография показывает альвеолярные структуры в легочной ткани. LM × 178. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Стенка альвеол состоит из трех основных типов клеток: альвеолярных клеток I типа, альвеолярных клеток II типа и альвеолярных макрофагов.Альвеолярная клетка I типа представляет собой плоскоклеточную эпителиальную клетку альвеол, которые составляют до 97 процентов площади поверхности альвеол. Эти ячейки имеют толщину около 25 нм и очень проницаемы для газов. Альвеолярные клетки типа II вкраплены среди клеток типа I и секретируют легочное сурфактант, вещество, состоящее из фосфолипидов и белков, которое снижает поверхностное натяжение альвеол. Вокруг альвеолярной стенки бродит альвеолярный макрофаг, фагоцитарная клетка иммунной системы, которая удаляет мусор и патогены, достигшие альвеол.
Простой плоский эпителий, образованный альвеолярными клетками I типа, прикреплен к тонкой эластичной базальной мембране. Этот эпителий очень тонкий и граничит с эндотелиальной мембраной капилляров. Взятые вместе, альвеолы и капиллярные мембраны образуют дыхательную мембрану толщиной примерно 0,5 мкм (микрометра). Дыхательная мембрана позволяет газам проходить через простую диффузию, позволяя кислороду забираться кровью для транспортировки и высвобождаться CO 2 в воздух альвеол.
Болезни…
Дыхательная система: Астма Астма — распространенное заболевание, поражающее легкие как у взрослых, так и у детей. Приблизительно 8,2 процента взрослых (18,7 миллиона) и 9,4 процента детей (7 миллионов) в Соединенных Штатах страдают астмой. Кроме того, астма — самая частая причина госпитализации детей.
Астма — хроническое заболевание, характеризующееся воспалением и отеком дыхательных путей, а также бронхоспазмами (то есть сужением бронхиол), которые могут препятствовать попаданию воздуха в легкие.Кроме того, может происходить чрезмерная секреция слизи, которая дополнительно способствует закупорке дыхательных путей ((Рисунок)). Клетки иммунной системы, такие как эозинофилы и мононуклеарные клетки, также могут участвовать в инфильтрации стенок бронхов и бронхиол.
Бронхоспазмы возникают периодически и приводят к «приступу астмы». Приступ может быть спровоцирован факторами окружающей среды, такими как пыль, пыльца, шерсть домашних животных или перхоть, перемены погоды, плесень, табачный дым и респираторные инфекции, или физическими упражнениями и стрессом.
Нормальные ткани и ткани при бронхиальной астме
(a) Нормальная легочная ткань не имеет характеристик легочной ткани во время (b) приступа астмы, который включает утолщение слизистой оболочки, повышенное содержание слизистых бокаловидных клеток и инфильтраты эозинофилов.
Симптомы приступа астмы включают кашель, одышку, хрипы и стеснение в груди. Симптомы тяжелого приступа астмы, требующего немедленной медицинской помощи, включают затрудненное дыхание, которое приводит к посинению (синюшности) губ или лица, замешательству, сонливости, учащенному пульсу, потоотделению и сильному беспокойству.Серьезность состояния, частота приступов и выявленные триггеры влияют на тип лекарства, которое может потребоваться человеку. Для людей с более тяжелой астмой используются более длительные методы лечения. Краткосрочные, быстродействующие препараты, которые используются для лечения приступа астмы, обычно вводятся через ингалятор. Маленьким детям или лицам, испытывающим трудности с использованием ингалятора, лекарства от астмы можно вводить через небулайзер.
Во многих случаях основная причина состояния неизвестна.Однако недавние исследования показали, что определенные вирусы, такие как риновирус С человека (HRVC) и бактерии Mycoplasma pneumoniae и Chlamydia pneumoniae , зараженные в младенчестве или раннем детстве, могут способствовать развитию многих случаев астмы. .
Посетите этот сайт, чтобы узнать больше о том, что происходит во время приступа астмы. Какие три изменения происходят в дыхательных путях во время приступа астмы?
Обзор главы
Дыхательная система отвечает за получение кислорода и избавление от углекислого газа, а также за помощь в речи и распознавании запахов.С функциональной точки зрения дыхательную систему можно разделить на две основные области: проводящую зону и респираторную зону. Проводящая зона состоит из всех структур, обеспечивающих проходы воздуха в легкие и из них: носовую полость, глотку, трахею, бронхи и большинство бронхиол. Носовые ходы содержат раковины и проходы, которые увеличивают площадь поверхности полости, что помогает согревать и увлажнять поступающий воздух, удаляя при этом мусор и болезнетворные микроорганизмы.Глотка состоит из трех основных отделов: носоглотки, которая продолжается с носовой полостью; ротоглотка, граничащая с носоглоткой и ротовой полостью; и гортань, которая граничит с ротоглоткой, трахеей и пищеводом. Дыхательная зона включает структуры легкого, которые непосредственно участвуют в газообмене: концевые бронхиолы и альвеолы.
Выстилка проводящей зоны состоит в основном из псевдостратифицированного мерцательного столбчатого эпителия с бокаловидными клетками.Слизь задерживает болезнетворные микроорганизмы и мусор, в то время как биение ресничек перемещает слизь вверх по направлению к глотке, где она проглатывается. По мере того, как бронхиолы становятся все меньше и меньше и ближе к альвеолам, эпителий истончается и представляет собой простой плоский эпителий в альвеолах. Эндотелий окружающих капилляров вместе с альвеолярным эпителием образует дыхательную мембрану. Это гемато-воздушный барьер, через который происходит обмен газов путем простой диффузии.
Центральная роль носовой микросреды в передаче, модуляции и клиническом прогрессировании инфекции SARS-CoV-2
Кийоно, Х. и Фукуяма, S. NALT против иммунитета слизистой оболочки, опосредованного пейеровым пластырем. Nat. Rev. Immunol. 4 , 699–710 (2004).
CAS PubMed PubMed Central Google Scholar
Brandtzaeg, P., Kiyono, H., Pabst, R. & Russell, M. W. Терминология: номенклатура лимфоидной ткани, связанной со слизистой оболочкой. Слизистая. Иммунол. 1 , 31–37 (2008).
CAS PubMed Google Scholar
Tacchi, L. et al. Назальный иммунитет — это древний элемент иммунной системы слизистых оболочек позвоночных. Nat. Commun. 5 , 1–11 (2014).
Google Scholar
Элад Д., Вольф М. и Кек Т. Кондиционирование воздуха в носовой полости человека. Respir. Physiol. Neurobiol. 163 , 121–127 (2008).
PubMed Google Scholar
Newsome, H. et al. Клиническое значение назального кондиционирования воздуха: обзор литературы. Am. J. Rhinol. Аллергия 33 , 763–769 (2019).
PubMed Google Scholar
Takeda, K. et al. Аллергическая конверсия защитного иммунитета слизистой оболочки против носовых бактерий у пациентов с хроническим риносинуситом с полипозом носа. J. Allergy Clin. Иммунол. 143 , 1163–1175 (2019).
CAS PubMed Google Scholar
Бернокки Б., Карпентье Р. и Бетбедер Д. Назальные нановакцины. Int J. Pharm. 530 , 128–138 (2017).
CAS PubMed Google Scholar
Андерсен, К. Г., Рамбаут, А., Липкин, В. И., Холмс, Э. К. и Гарри, Р. Ф. Проксимальное происхождение SARS-CoV-2. Nat. Med. 26 , 450–452 (2020).
CAS PubMed Google Scholar
Zou, L. et al. Вирусная нагрузка SARS-CoV-2 в образцах верхних дыхательных путей инфицированных пациентов. N. Engl. J. Med https://doi.org/10.1056/NEJMc2001737 (2020).
Sungnak, W. et al. Факторы проникновения SARS-CoV-2 высоко экспрессируются в эпителиальных клетках носа вместе с генами врожденного иммунитета. Nat. Med. 26 , 681–687 (2020).
CAS PubMed Google Scholar
Hou, Y. J. et al. Обратная генетика SARS-CoV-2 выявляет переменный градиент инфекции в дыхательных путях. Ячейка (2020).
Ziegler, C.G. et al. Рецептор SARS-CoV-2 ACE2 представляет собой стимулируемый интерфероном ген в эпителиальных клетках дыхательных путей человека и обнаруживается в определенных подмножествах клеток в тканях. Ячейка (2020).
Информационная панель ВОЗ по коронавирусу (COVID-19), данные проверены на 2020/10/24), https://covid19.who.int/.
Lauer, S.A. et al. Инкубационный период коронавирусной болезни 2019 (COVID-19) из официально зарегистрированных подтвержденных случаев: оценка и применение. Ann. Междунар. Мед . https://doi.org/10.7326/M20-0504 (2020).
Чао, К. Ю. Х., Ван, М. П. и Сзе То, Г. Н. Транспортировка и удаление капель выдыхаемого воздуха в условиях больничной палаты. Aerosol Sci. Technol. 42 , 377–394 (2008).
CAS Google Scholar
Sakurai, A. et al. Естественное течение бессимптомной инфекции SARS-CoV-2. N. Engl. J. Med . https://doi.org/10.1056/NEJMc2013020 (2020).
Van Doremalen, N. et al. Аэрозольная и поверхностная стабильность SARS-CoV-2 по сравнению с SARS-CoV-1. N. Engl. J. Med. 382 , 1564–1567 (2020).
PubMed Google Scholar
Асади, С., Бувье, Н., Векслер, А.С. и Ристенпарт, В.D. Пандемия коронавируса и аэрозоли: передается ли COVID-19 через частицы на выдохе? Aerosol Sci. Технол . https://doi.org/10.1080/02786826.2020.1749229 (2020).
Фернстром, А. и Голдблатт, М. Аэробиология и ее роль в передаче инфекционных заболеваний. J. Pathog. 493960 (2013).
Bahl, P. et al. Меры предосторожности при переносе воздушно-капельным путем или воздушно-капельным путем для медицинских работников, лечящих COVID-19? J. Infect. Дис. (2020).
Sommerstein, R. et al. Риск передачи SARS-CoV-2 аэрозолями, рациональное использование масок и защита медицинских работников от COVID-19. Инфекция, устойчивая к противомикробным препаратам. Контроль 9 , 1–8 (2020).
Google Scholar
Научная записка ВОЗ: Передача SARS-CoV-2: значение для мер предосторожности по профилактике инфекций. Женева: Всемирная организация здравоохранения; 2020. https: // www.who.int/news-room/commentaries/detail/transmission-of-sars-cov-2-implications-for-infection-prevention-precautions. Проверено 24 октября 2020 г.
Meselon, M. Droplet и aereosol в передаче SARS-CoV-2. N. Engl. J. Med. 382 , 2063 (2020). https://doi.org/10.1056/NEJMc2009324.
Хан, З. Ю., Венг, В. Г. и Хуанг, К. Ю. Характеристики распределения частиц по размерам капель, выдыхаемых при чихании. Дж.R. Soc. Интерфейс 10 , 20130560 (2013). https://doi.org/10.1098/rsif.2013.0560.
Farzal, Z. et al. Сравнительное исследование моделирования отложений распыленных и распыленных частиц у пациентов с хроническим риносинуситом. Внутр. Форум Allergy Rhinol. 9 , 746–758 (2019).
PubMed PubMed Central Google Scholar
Booth, T. F. et al. Выявление переносимого по воздуху коронавируса тяжелого острого респираторного синдрома (SARS) и загрязнения окружающей среды в очагах вспышки SARS. J. Infect. Дис. 191 , 1472–1477 (2005).
PubMed PubMed Central Google Scholar
Лю Ю. Аэродинамический анализ SARS-CoV-2 в двух больницах Ухани. Природа https://doi.org/10.1038/s41586-020-2271-3 (2020).
Bourouiba, L. Турбулентные газовые облака и выбросы респираторных патогенов: потенциальные последствия для снижения передачи COVID-19. JAMA 323 , 1837–1838 (2020).
PubMed Google Scholar
Голдман, Э. Повышенный риск передачи COVID-19 фомитами. Lancet Infect. Дис. 20 , 892–893 (2020).
CAS PubMed PubMed Central Google Scholar
Очистка и дезинфекция поверхностей окружающей среды в контексте COVID-19. Женева: Всемирная организация здравоохранения; 2020.https://www.who.int/publications/i/item/cleaning-and-disinfection-of-environmental-surfaces-inthe-context-of-covid-19. По состоянию на 24 октября 2020 г.
Herfst, S. et al. Факторы передачи патогенов от человека к человеку воздушно-капельным путем. Curr. Opin. Virol. 22 , 22–29 (2017).
PubMed Google Scholar
Ман, В. Х., де Стинхейсен Питерс, В. А. и Богерт, Д. Микробиота дыхательных путей: привратник для здоровья органов дыхания. Nat. Rev. Microbiol. 15 , 259–270 (2017).
CAS PubMed PubMed Central Google Scholar
Браун Р. Л., Секейра Р. П. и Кларк Т. Б. Микробиота защищает от респираторной инфекции посредством передачи сигналов GM-CSF. Nat. Commun. 8 , 1–11 (2017).
CAS Google Scholar
Сюй Х.и другие. Высокая экспрессия рецептора ACE2 2019-nCoV на эпителиальных клетках слизистой оболочки полости рта. Внутр. J. Oral. Sci. 12 , 1–5 (2020).
Google Scholar
Bunyavanich, S., Do, A. & Vicencio, A. Назальная экспрессия гена ангиотензин-превращающего фермента 2 у детей и взрослых. ЯМА . https://doi.org/10.1001/jama.2020.8707 (2020).
Карли Г., Чекки Л., Стеббинг Дж., Парронки П. и Фарси А. Защищает ли астма от COVID ‐ 19? Аллергия (2020). [Epub перед печатью].
Jackson, D. et al. Ассоциация респираторной аллергии, астмы и экспрессии рецептора SARS-CoV-2, ACE2. J. Allergy Clin. Иммунол . (2020).
Jian, L. et al. Перспектива: COVID-19, значение заболеваний носа и последствия для их лечения. J. Allergy Clin. Иммунол . (2020). [Epub перед печатью]
Patel, T. R., Teitcher, J. E., Tajudeen, B. A. и Revenaugh, P. C. Несопоставимые результаты назофарингеального и трахеального диагностических тестов на COVID-19 у пациента с тотальной ларингэктомией. Отоларингол. — Хирургия шеи и шеи . (2020).
Gallo, O. et al. SARS-CoV-2 в образцах верхних и нижних дыхательных путей пациента, перенесшего ларингэктомию: новые идеи и много уроков. Оральный онкол . 107 , 104841 (2020).
Daly, J. L. et al. Нейропилин-1 является фактором хозяина для инфекции SARS-CoV-2. bioRxiv . (2020).
Roy, S. et al. Многогранная роль нейропилинов в иммунной системе: потенциальные мишени для иммунотерапии. Фронт. Иммунол. 8 , 1228 (2017).
PubMed PubMed Central Google Scholar
Wang, W. et al. Обнаружение SARS-CoV-2 в различных типах клинических образцов. JAMA 323 , 1843–1844 (2020).
CAS PubMed PubMed Central Google Scholar
Tu, Y. P. et al. Мазки, собранные пациентами или медицинскими работниками для тестирования на SARS-CoV-2. N. Engl. J. Med. 383 , 494–496 (2020).
PubMed Google Scholar
Вуккадала, Н., Цянь, З. Дж., Холзингер, Ф. К., Патель, З. М., и Розенталь, Е. COVID-19 и отоларинголог: предварительный обзор, основанный на фактах. Ларингоскоп 130 , 2537–2543 (2020). https://doi.org/10.1002 / lary.28672.
Workman, A. D. et al. Эндоназальное оборудование и риск аэрозолизации в эпоху COVID ‐ 19: моделирование, обзор литературы и предлагаемые стратегии смягчения последствий. Внутр. Форум Allergy Rhinol . 10 , 798–805 (2020).
Zhang, N., Van Crombruggen, K., Gevaert, E. & Bachert, C. Барьерная функция слизистой оболочки носа при здоровых и предвзятых заболеваниях дыхательных путей 2-го типа. Аллергия 71 , 295–307 (2016).
CAS PubMed Google Scholar
Weitnauer, M., Mijošek, V. & Dalpke, A.H. Контроль местного иммунитета с помощью эпителиальных клеток дыхательных путей. Слизистая. Иммунол. 9 , 287–298 (2016).
CAS PubMed Google Scholar
Хеллингс, П. У. и Стилант, Б. Эпителиальные барьеры при аллергии и астме. J. Allergy Clin.Иммунол. 145 , 1499–1509 (2020).
PubMed PubMed Central Google Scholar
Оои, Э. Х., Вормальд, П. Дж. И Тан, Л. В. Врожденный иммунитет в придаточных пазухах носа: обзор защитных механизмов носа хозяина. Am. J. Rhinol. 22 , 13–19 (2008).
PubMed Google Scholar
Линден, С. К., Саттон, П., Карлссон, Н.Г., Королик В. и Макгукин М. А. Муцины в слизистой оболочке барьера для инфекции. Mucosal Immunol. 1 , 183–197 (2008).
CAS PubMed PubMed Central Google Scholar
McAuley, J. L. et al. Муцин клеточной поверхности MUC1 ограничивает тяжесть инфицирования вирусом гриппа А. Mucosal Immunol. 10 , 1581–1593 (2017).
CAS PubMed Google Scholar
Lu, W. et al. Повышенные уровни белка муцина MUC1 и MUC5AC в слизи дыхательных путей критически больных пациентов с COVID-19. J. Med. Virol. (2020). [Epub перед печатью].
Куек, Л. Э. и Ли, Р. Дж. Первый контакт: роль респираторных ресничек во взаимодействиях хозяин-патоген в дыхательных путях. Am. J. Physiol-Lung Cell Mol. Physiol. (2020). [Epub перед печатью].
Sims, A.C. et al. Тяжелый острый респираторный синдром: коронавирусная инфекция реснитчатого эпителия дыхательных путей человека: роль реснитчатых клеток в распространении вируса по проводящим дыхательным путям легких. J. Virol. 79 , 15511–15524 (2005).
CAS PubMed PubMed Central Google Scholar
Fang, Y. et al. Определенные стволовые клетки / клетки-предшественники пролиферируют для регенерации трахеи, внутрилегочных дыхательных путей и альвеол у пациентов с COVID-19. Cell Res. 30 , 705–707 (2020).
CAS PubMed Google Scholar
Jochems, S.P. et al. Новый анализ иммунных клеток от носовой микробиопсии демонстрирует надежные, воспроизводимые данные для иммунных популяций и превосходное обнаружение цитокинов по сравнению с носовой промывкой. PloS One 12 , e0169805 (2017).
PubMed PubMed Central Google Scholar
Панда, С. К. и Колонна, М. Врожденные лимфоидные клетки в иммунитете слизистой оболочки. Фронт. Иммунол. 10 , 861 (2019).
CAS PubMed PubMed Central Google Scholar
Wu, H. Y., Nguyen, H. H. & Russell, M. W. Носовая лимфоидная ткань (NALT) как сайт индукции слизистой оболочки. Сканд. J. Immunol. 46 , 506–513 (1997).
CAS PubMed Google Scholar
Галло, О., Бани, Д., Руччи, Л., Фини Сторчи, О. Играет ли эпителий центральную роль в иммунной функции ринофарингеальных миндалин? Иммуногистохимическое и ультраструктурное исследование. Int J. Ped. Отоларингол. 22 , 219–222 (1991).
CAS Google Scholar
Галло, О., Бани, Д. и Фини Сторчи, О. Внутриэпителиальные субпопуляции лимфоцитов и дендритные дополнительные клетки в нормальных и гипертрофических аденоидах. Ларингоскоп 104 , 869–873 (1994).
PubMed Google Scholar
Heritage, P.Л., Андердаун, Б. Дж., Арсено, А. Л., Синдер, Д. П. и Мак Дермотт, М. Р. Сравнение носовой лимфоидной ткани мышей и бляшек Пейера. Am. J. Respir. Крит. Care Med. 156 , 1256–1262 (1997).
CAS PubMed Google Scholar
Lehtinen, M. J. et al. Кластеры носовой микробиоты связаны с воспалительной реакцией, вирусной нагрузкой и тяжестью симптомов при экспериментальном заражении риновирусом. Sci. Отчет 8 , 11411 (2018).
PubMed PubMed Central Google Scholar
Роуз М.А., Зилен С. и Бауманн У. Иммунитет слизистых оболочек и вакцинация против гриппа через нос. Exp. Rev. Vaccines 11 , 595–607 (2012).
CAS Google Scholar
Tay, M.Z., Poh, C.M., Rénia, L. et al. Триединство COVID-19: иммунитет, воспаление и вмешательство. Nat Rev Immunol. 20 , 363–374 (2020). https://doi.org/10.1038/s41577-020-0311-8.
Боуи, А. Г. и Унтерхольцнер, Л. Уклонение от вирусов и подрыв передачи сигналов рецептора распознавания образов. Nat. Rev. Immunol. 8 , 911–922 (2008).
CAS PubMed PubMed Central Google Scholar
Xu, Z. et al. Патологические данные COVID-19, связанные с острым респираторным дистресс-синдромом. Ланцет Респир. Med. 8 , 420–422 (2020).
CAS PubMed PubMed Central Google Scholar
Матрикарди, П. М., Даль Негро, Р. В. и Нисини, Р. Первая целостная иммунологическая модель COVID-19: значение для профилактики, диагностики и мер общественного здравоохранения. Pediatr. Allergy Immunol. https://doi.org/10.1111/pai.13271 (2020).
Мадсен, Х.O. et al. Взаимодействие между промотором и вариантами структурного гена контролирует базальный сывороточный уровень маннан-связывающего белка. J. Immunol. 155 , 3013–3020 (1995).
CAS PubMed Google Scholar
Эйзен, Д. П. и Минчинтон, Р. М. Влияние маннозо-связывающего лектина на восприимчивость к инфекционным заболеваниям. Clin. Заразить. Дис. 37 , 1496–1505 (2003).
CAS PubMed Google Scholar
Zhang, H. et al. Связь между полиморфизмом гена маннозо-связывающего лектина и восприимчивостью к тяжелой форме острого респираторного синдрома, вызванной коронавирусной инфекцией. J. Infect. Дис. 192 , 1355–1361 (2005).
CAS PubMed PubMed Central Google Scholar
Ip, W. E. et al. Лектин, связывающий маннозу, при тяжелом остром респираторном синдроме, вызванном коронавирусной инфекцией. J. Infect. Дис. 191 , 1697–1704 (2005).
CAS PubMed PubMed Central Google Scholar
Zhou, Y. et al. Один связанный с аспарагином сайт гликозилирования гликопротеина спайк-шипа коронавируса тяжелого острого респираторного синдрома способствует ингибированию маннозосвязывающим лектином посредством множества механизмов. J. Virol. 84 , 8753–8764 (2010).
CAS PubMed PubMed Central Google Scholar
Tomaiuolo, R. et al. Активность связывающего маннозу лектина у долгожителей. Ячейка старения 11 , 394–400 (2012).
CAS PubMed PubMed Central Google Scholar
Холодик, Н. Э., Родригес-Журбенко, Н. и Эрнандес, А. М. Определение естественных антител. Front Immunol. 8 , 872 (2017).
PubMed PubMed Central Google Scholar
Ориол Р., Молликоне Р., Куиллин П., Даликс А. М. и Канделье Дж. Дж. Генетическая регуляция экспрессии антигенов ABH и Льюиса в тканях. APMIS 100 (Supp 27), 28–38 (1992).
Google Scholar
Галили У. Эволюция у приматов посредством взаимодействия «катастрофического отбора» между охваченными вирусными эпидемиями, мутировавшими генами ферментов, синтезирующих углеводные антигены, и естественными антиуглеводными антителами. Am. J. Phys. Антрополь. 168 , 352–363 (2019).
PubMed Google Scholar
Guillon, P. et al. Ингибирование взаимодействия между спайковым белком SARS-CoV и его клеточным рецептором антителами против гистокрови. Гликобиология 18 , 1085–1093 (2008).
CAS PubMed PubMed Central Google Scholar
Cheng, Y., Cheng, G., Chui, C.H. & Lau, F. Y. Группа крови АВО и предрасположенность к тяжелому острому респираторному синдрому. JAMA 293 , 1450–1451 (2005).
CAS PubMed Google Scholar
Жерар, К., Маджипинто, Г. и Минон, Дж. М. Группа крови COVID-19 и ABO: другая точка зрения. Br. J. Haematol. 190 , e93 – e94 (2020).
PubMed Google Scholar
Ellinghaus, D. et al. Общегеномное исследование ассоциации тяжелого Covid-19 с дыхательной недостаточностью. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2020283 (2020).
Нарасимхан П. Б., Марковеккио П., Хамерс А. А. Дж. И Хедрик К. С. Неклассические моноциты в здоровье и болезни. Annu. Rev. Immunol. 37 , 439–56 (2019).
CAS PubMed Google Scholar
Peruzzi, B. et al. Количественные и качественные изменения циркулирующих миелоидных клеток и плазмоцитоидных ДК при инфекции SARS-CoV-2. Иммунология https://doi.org/10.1111/imm.13254 (2020).
Sánchez-Cerrillo, I. et al. Тяжесть COVID-19 связана с легочным перераспределением CD1c + DC и воспалительными переходными и неклассическими моноцитами. J. Clin. Расследование. https://doi.org/10.1172/JCI140335 (2020).
Giamarellos-Bourboulis, E.J. et al. Комплексная иммунная дисрегуляция у пациентов с COVID-19 с тяжелой дыхательной недостаточностью. Клеточный микроб-хозяин 27 , 992–1000.e3 (2020).
CAS PubMed PubMed Central Google Scholar
Kuri-Cervantes, L. et al. Комплексное картирование иммунных нарушений, связанных с тяжелой формой COVID-19. Sci. Иммунол. 5 , eabd7114 (2020).
CAS PubMed PubMed Central Google Scholar
Lee, H. et al. Фенотип и функция дендритных клеток носа. Mucosal Immunol. 8 , 1083–1098 (2015).
CAS PubMed PubMed Central Google Scholar
Blanco-Melo, D. et al. Несбалансированная реакция хозяина на SARS-CoV-2 способствует развитию COVID-19. Ячейка 181 , 1036–1045.e9 (2020).
CAS PubMed PubMed Central Google Scholar
Bastard, P. et al. Аутоантитела к IFN типа I у пациентов с опасным для жизни COVID-19. Наука https://doi.org/10.1126/science.abd4585 (2020).
Zhang, Q. et al. Врожденные аномалии IFN-иммунитета I типа у пациентов с опасным для жизни COVID-19. Наука https://doi.org/10.1126/science.abd4570 (2020).
Mazzoni, A. et al. Нарушение цитотоксичности иммунных клеток при тяжелой форме COVID-19 зависит от IL-6. Дж.Clin. Расследование. 138554. https://doi.org/10.1172/JCI138554 (2020).
Radermecker, C. et al. Внеклеточные ловушки нейтрофилов проникают в дыхательные пути легких, интерстициальные и сосудистые отделы при тяжелой форме COVID-19. J. Exp. Med. 217 , e20201012 (2020).
CAS PubMed PubMed Central Google Scholar
Long, Q. X. et al. Ответы антител на SARS-CoV-2 у пациентов с COVID-19. Nat. Med. 26 , 845–848 (2020).
CAS PubMed Google Scholar
Grifoni, A. et al. Мишени Т-клеточного ответа на коронавирус SARS-CoV-2 у людей с заболеванием COVID-19 и лиц, не подвергшихся воздействию. Ячейка 181 , 1489–1501.e15 (2020).
CAS PubMed PubMed Central Google Scholar
Лонг, Q.X. et al. Клинико-иммунологическая оценка бессимптомных инфекций SARS-CoV-2. Nat. Med. 26 , 1200–1204 (2020).
CAS PubMed PubMed Central Google Scholar
Peng, Y. et al. CD4 + и CD8 + Т-клетки с широкой и сильной памятью, индуцированные SARS-CoV-2 у выздоравливающих людей в Великобритании после COVID-19. Nat Immunol. https://doi.org/10.1038/s41590-020-0782-6 (2020).
Ni, L. et al. Выявление гуморального и клеточного иммунитета, специфичного для SARS-CoV-2, у выздоравливающих людей с COVID-19. Иммунитет 52 , 971–977.e3 (2020).
CAS PubMed PubMed Central Google Scholar
Sekine, T. et al. Устойчивый Т-клеточный иммунитет у выздоравливающих людей с бессимптомным или легкой формой COVID-19. Ячейка 183 , 158–168 (2020). https://doi.org/10.1016/j.ячейка.2020.08.017.
Le Bert, N. et al. SARS-CoV-2-специфический Т-клеточный иммунитет в случаях COVID-19 и SARS, а также неинфицированный контроль. Природа 584 , 457–462 (2020).
PubMed PubMed Central Google Scholar
Braun, J. et al. SARS-CoV-2-реактивные Т-клетки у здоровых доноров и пациентов с COVID-19. Природа https://doi.org/10.1038/s41586-020-2598-9 (2020).
Weiskopf, D. et al. Фенотип и кинетика Т-клеток, специфичных для SARS-CoV-2, у пациентов с COVID-19 с острым респираторным дистресс-синдромом. Sci. Иммунол. 5 , eabd2071 (2020).
CAS PubMed PubMed Central Google Scholar
Mazzoni, A. et al. Клеточно-опосредованный и гуморальный адаптивный иммунный ответ на SARS-CoV-2 у бессимптомных пациентов ниже, чем у пациентов с симптоматическим COVID-19. Eur. J. Immunol. https://doi.org/10.1002/eji.202048915 (2020).
Hua, X. et al. Прайминг носа мышиным коронавирусом обеспечивает защитный иммунитет против летальной гетерологичной вирусной пневмонии. JCI Insight 3 , e99025 (2018).
PubMed Central Google Scholar
Pizzorno, A. et al. Характеристика и лечение SARS-CoV-2 в носовых и бронхиальных эпителиях дыхательных путей человека. Cell Rep. Med. 1 , 100059 (2020).
PubMed PubMed Central Google Scholar
Моренс, Д. М., Дашак, П. и Таубенбергер, Дж. К. Побег из ящика Пандоры — еще один новый коронавирус. N. Engl. J. Med. 382 , 1293–1295 (2020).
CAS PubMed Google Scholar
Де Вит, Э., Ван Дормален, Н., Фальзарано, Д. и Мюнстер, В. Дж. SARS и MERS: последние сведения о новых коронавирусах. Nat. Rev. Microbiol. 14 , 523 (2016).
PubMed PubMed Central Google Scholar
Фер А. Р., Чаннаппанавар Р. и Перлман С. Ближневосточный респираторный синдром: появление патогенного коронавируса человека. Annu. Rev. Med. 68 , 387–399 (2017).
Гу, Дж. И Кортевег, С. Патология и патогенез тяжелого острого респираторного синдрома. Am. J. Pathol. 170 , 1136–1147 (2007).
CAS PubMed PubMed Central Google Scholar
Мемиш, З. А., Перлман, С., Ван Керхов, М. Д., Зумла, А. Ближневосточный респираторный синдром. Ланцет (2020).
Li, W. et al. Ангиотензин-превращающий фермент 2 является функциональным рецептором коронавируса SARS. Природа 426 , 450–454 (2003).
CAS PubMed PubMed Central Google Scholar
Lu, G. et al. Молекулярная основа связывания нового коронавируса человека MERS-CoV и его рецептора CD26. Природа 500 , 227–231 (2013).
CAS PubMed PubMed Central Google Scholar
Ду, Л.и другие. Спайковый белок SARS-CoV — мишень для разработки вакцин и терапевтических средств. Nat. Rev. Microbiol. 7 , 226–236 (2009).
CAS PubMed PubMed Central Google Scholar
Лу, Г., Ван, Q. и Гао, Г. Ф. От летучей мыши к человеку: особенности шипа, определяющие «скачок» коронавирусов SARS-CoV, MERS-CoV и других. Trends Microbiol. 23 , 468–478 (2015).
CAS PubMed PubMed Central Google Scholar
Glowacka, I. et al. Доказательства того, что TMPRSS2 активирует спайковый белок коронавируса тяжелого острого респираторного синдрома для слияния мембран и снижает вирусный контроль за счет гуморального иммунного ответа. J. Virol. 85 , 4122–4134 (2011).
PubMed PubMed Central Google Scholar
Ширато К. Инфекция коронавирусом ближневосточного респираторного синдрома, опосредованная трансмембранной сериновой протеазой TMPRSS2. J. Virol. 87 , 12552–12561 (2013).
CAS PubMed PubMed Central Google Scholar
Walls, A.C. et al. Неожиданная функциональная мимикрия рецептора объясняет активацию слияния коронавируса. Ячейка 176 , 1026–1039.e15 (2019).
CAS PubMed PubMed Central Google Scholar
Mahallawi, W.H. Отчет о клиническом случае: обнаружение коронавируса ближневосточного респираторного синдрома (БВРС-КоВ) в носовых выделениях умершего человека. J. Taibah Univ. Med. Sci. 13 , 302–304 (2018).
PubMed Google Scholar
Li, R. et al. Существенная недокументированная инфекция способствует быстрому распространению нового коронавируса (SARS-CoV-2). Наука 368 , 489–493 (2020).
CAS PubMed PubMed Central Google Scholar
Hoxha, A. et al. Бессимптомная инфекция SARS-CoV-2 в бельгийских учреждениях длительного ухода. Lancet Infect. Дис. https://doi.org/10.1016/S1473-3099(20)30560-0 (2020).
Sattler A. et al. Специфические для SARS-CoV-2 Т-клеточные ответы и корреляция с предрасположенностью пациентов к COVID-19. J. Clin. Расследование. https://doi.org/10.1172/JCI140965 (2020).
Магги, Э., Каноника, Г. В. и Моретта, Л. COVID-19: вопросы без ответа об иммунном ответе и патогенезе. J. Allergy Clin. Иммунол. 146 , 18–22 (2020).
CAS PubMed PubMed Central Google Scholar
Huang, C. et al. Клинические особенности пациентов, инфицированных новым коронавирусом 2019 г., в Ухане, Китай [опубликованное исправление опубликовано в Lancet. 2020 30 января]. Ланцет 395 , 497–506 (2020).
CAS PubMed PubMed Central Google Scholar
Zhou, F. et al. Клиническое течение и факторы риска смертности взрослых пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование. Ланцет 395 , 1038 (2020).
Vultaggio, A. et al. Оперативное прогнозирование раннего клинического ухудшения состояния пациентов с COVID-19 от умеренной до тяжелой: полезность комбинированной оценки с использованием IL-6 в предварительном исследовании. J. Allergy Clin. Иммунол. Практик. S2213-2198 , 30611–30615 (2020).
Google Scholar
Азиз, М., Фатима, Р. и Ассали, Р. Повышенный уровень интерлейкина-6 и тяжелая форма COVID-19: метаанализ. J. Med. Virol. https://doi.org/10.1002/jmv.25948 (2020).
Xu, X. et al. Эффективное лечение тяжелых пациентов с COVID-19 с помощью тоцилизумаба. Proc. Natl Acad. Sci. 117 , 10970–10975 (2020).
CAS PubMed Google Scholar
Vannucchi, A. M. et al. Сострадательное использование ингибитора JAK1 / 2 руксолитиниба при тяжелой форме COVID-19: проспективное обсервационное исследование. Лейкемия 1–13 (2020 г.).
Kaneko, N. et al. Утрата Bcl-6-экспрессирующих Т-фолликулярных вспомогательных клеток и зародышевых центров при COVID-19. Ячейка S0092-S8674: 31067-9. https://doi.org/10.1016/j.cell.2020.08.025 (2020).
Рэй Д. и Юнг Р. Иммунное старение, эпигенетика и аутоиммунитет. Clin.Иммунол. 196 , 59–63 (2018).
CAS PubMed PubMed Central Google Scholar
Мастерс, А. Р., Хейнс, Л., Су, Д. М. и Палмер, Д. Б. Иммунное старение: значение микросреды стромы. Clin. Exp. Иммунол. 187 , 6–15 (2017).
CAS PubMed Google Scholar
Moderbacher, C.R. et al. Антиген-специфический адаптивный иммунитет к SARS-CoV-2 при остром COVID-19 и ассоциации с возрастом и тяжестью заболевания. Ячейка https://doi.org/10.1016/j.cell.2020.09.038 (2020).
Fujihashi, K. & Kiyono, H. Иммуностарение слизистой оболочки: новые разработки и вакцины для борьбы с инфекционными заболеваниями. Trends Immunol. 30 , 334–343 (2009).
CAS PubMed Google Scholar
Koga, T. et al. Доказательства раннего старения иммунной системы слизистых оболочек. J. Immunol. 165 , 5352–5359 (2000).
CAS PubMed Google Scholar
Hagiwara, Y. et al. Защитный иммунитет слизистой оболочки при старении связан с функциональными CD4 + Т-клетками в лимфоретикулярной ткани, ассоциированной с носоглоткой. J. Immunol. 170 , 1754–1762 (2003).
CAS PubMed Google Scholar
Lechien, J. R. et al. Потеря запаха и вкуса у европейских пациентов с COVID-19 от легкой до умеренной степени тяжести в 2013 г. Ann. Междунар. Med. https://doi.org/10.7326/M20-2428 (2020).
Артикул PubMed PubMed Central Google Scholar
Whitcroft, K. L. & Hummel, T. Дисфункция обоняния при COVID-19: диагностика и лечение. JAMA 323 , 2512–2514 (2020).
CAS PubMed Google Scholar
Cooper, K. W. et al. COVID-19 и химические чувства: в центре внимания игроки поддержки. Нейрон 107 , 219–233 (2020).
CAS PubMed PubMed Central Google Scholar
Menni, C. et al. Отслеживание симптомов в реальном времени для прогнозирования потенциального COVID-19. Nat. Med. 26 , 1037–1040 (2020).
CAS PubMed PubMed Central Google Scholar
Spinato, G. et al. Изменения запаха или вкуса у амбулаторных пациентов с легкими симптомами и инфекцией SARS-CoV-2. JAMA 323 , 2089–2090 (2020).
CAS PubMed PubMed Central Google Scholar
Li, Y. C., Bai, W. Z. & Hashikawa, T. Нейроинвазивный потенциал SARS-CoV2 может играть роль в дыхательной недостаточности пациентов с COVID-19. J. Med. Virol. 92 , 552–555 (2020).
CAS PubMed Google Scholar
Solomon, I.H. et al. Невропатологические особенности Covid-19. N. Engl. J. Med. https://doi.org/10.1056/NEJMc2019373 (2020).
Brann, D. H. et al. Ненейрональная экспрессия генов входа SARS-CoV-2 в обонятельной системе предполагает механизмы, лежащие в основе аносмии, связанной с COVID-19. Sci. Adv. eabc5801 (2020).
Boscolo-Rizzo, P. et al. Эволюция измененного обоняния или вкуса у пациентов с COVID-19 с легкими симптомами. ДЖАМА Отоларингол. — Зав. Neck Surg. 146 , 729–732 (2020).
Google Scholar
Локателло, Л. Г., Маджоре, Г., Бруно, К., Тротта, М. и Галло, О. Стратегия комплексной помощи для последующего наблюдения за пациентами с химиосенсорной дисфункцией, связанной с COVID-19. Отоларингол.—Head Neck Surg. 0194599820950716 (2020).
Cantuti-Castelvetri L. et al. Нейропилин-1 способствует проникновению и инфицированию клеток SARS-CoV-2. Наука eabd2985. https://doi.org/10.1126/science.abd2985 (2020).
Martin, J. E. et al. ДНК-вакцина против SARS индуцирует нейтрализующие антитела и клеточный иммунный ответ у здоровых взрослых в ходе клинических испытаний фазы I. Вакцина 26 , 6338–6343 (2008).
CAS PubMed PubMed Central Google Scholar
Folegatti, P. M. et al. Безопасность и иммуногенность вакцины-кандидата от коронавируса ближневосточного респираторного синдрома с вирусным вектором: открытое, нерандомизированное, неконтролируемое испытание фазы 1 с увеличением дозы. Lancet Infect. Дис. 20 , 816–826 (2020).
Краммер, Ф. Вакцины против SARS-CoV-2 в разработке. Природа https://doi.org/10.1038/s41586-020-2798-3 (2020).
Хитон, П. М. Мультивселенная по разработке вакцины против Covid-19. NEJM (2020 г.).
Folegatti, P. M. et al. Безопасность и иммуногенность вакцины ChAdOx1 nCoV-19 против SARS-CoV-2: предварительный отчет фазы 1/2, простого слепого, рандомизированного контролируемого исследования. Ланцет 396 , 467–478 (2020).
CAS PubMed PubMed Central Google Scholar
Hassan, A. O. et al. Модель инфекции SARS-CoV-2 на мышах демонстрирует защиту за счет нейтрализующих антител. Ячейка 182 , 744–753 (2020).
CAS PubMed PubMed Central Google Scholar
Зост, С. Дж., Гильчук, П., Кейс, Дж. Б. и др. Сильно нейтрализующие и защитные человеческие антитела против SARS-CoV-2. Природа 584 , 443–449 (2020). https://doi.org/10.1038/s41586-020-2548-6.
Shin, M. D. et al. Разработка вакцины против COVID-19 и потенциальный путь развития наноматериалов. Nat. Nanotechnol. 15 , 646–655 (2020).
CAS PubMed Google Scholar
Zhang, S., Caldeira-Dantas, S., Smith, C.J. & Snyder, C.M. Устойчивая репликация вируса и развитие Т-клеточных ответов после интраназального инфицирования MCMV. Med. Microbiol. Иммунол. 208 , 457–468 (2019).
CAS PubMed PubMed Central Google Scholar
Ричард М. и др. Вирусы гриппа А передаются по воздуху через носовой респираторный эпителий хорьков. Nat. Commun. 11 , 1–11 (2020).
Google Scholar
Джавина-Бианки, П., Аун, М. В., Такеджима, П., Калил, Дж. И Агонди, Р. К. Объединенные болезни дыхательных путей: современные перспективы. J. Asthma Allergy 9 , 93 (2016).
CAS PubMed PubMed Central Google Scholar
Joo, S. et al. Критическая роль TSLP-чувствительных дендритных клеток слизистой оболочки в индукции назального антиген-специфического ответа IgA. Слизистая. Иммунол. 10 , 901–911 (2017).
CAS PubMed Google Scholar
Zhao, J. et al. CD4 (+) Т-клетки памяти дыхательных путей обеспечивают защитный иммунитет против появляющихся респираторных коронавирусов. Иммунитет 44 , 1379–1391 (2016).
CAS PubMed PubMed Central Google Scholar
Мюллер, С. Н. и Маккей, Л. К. Резидентные в тканях Т-клетки памяти: местные специалисты по иммунной защите. Nat. Rev. Immunol. 16 , 79–89 (2016).
CAS PubMed Google Scholar
Pizzolla, A. et al. Резидентные CD8 + Т-клетки памяти в верхних дыхательных путях предотвращают инфицирование вирусом легочного гриппа.

 0.
0.