Активность протеазы и ее связь с будущим заживлением венозных язв на ногах
Какова цель этого обзора?
Целью этого Кокрейновского обзора был поиск связи между различными уровнями протеазы в венозных язвах ног (открытые кожные раны на голени, вызванные проблемами кровотока по венам) в настоящий момент и заживлением ран в будущем. Протеаза — это фермент, химическое вещество, которое естественным образом вырабатывается организмом и расщепляет белки, и может влиять на заживление ран. Мы хотели знать, означают ли более высокие уровни протеазы, что раны будут заживать с меньшей вероятностью или заживать медленнее. Если это так, это может помочь найти наиболее полезные методы лечения для каждого человека с язвами ног. Авторы этого Кокрейновского обзора собрали и проанализировали все соответствующие исследования, чтобы ответить на этот вопрос, и обнаружили 19 исследований.
Ключевая информация
В настоящее время существует полная неопределенность в отношении какой-либо связи между активностью протеазы и заживлением венозных язв на ногах, но этот обзор действительно дал представление о том, что может стать важным для будущих исследований природных химических веществ, присутствующих в ранах, и их влияния на заживление.
Что было изучено в этом обзоре?
Венозные язвы на ногах могут не заживать неделями, месяцами или годами. Язвы нижних конечностей могут быть болезненными, могут инфицироваться и могут оказывать влияние на подвижность и качество жизни. Обычным лечением венозных язв нижних конечностей является компрессионная терапия (например, компрессионные (эластические) бандажи), но даже это эффективно не у каждого (около трети людей имеют раны, которые не заживают после шести месяцев лечения). Мы хотели выяснить, почему эти раны часто не заживают, и есть ли в ране факторы (называемые биомаркерами), которые могут указывать, какие раны вряд ли заживут. Было высказано предположение, что раны медленно заживают при высоком уровне протеазы. В этом обзоре мы исследовали, есть ли какие-либо доказательства того, что более высокие уровни протеазы в начале исследования были связаны с более медленным заживлением язв на ногах или меньшим заживлением в будущем (например, через шесть месяцев).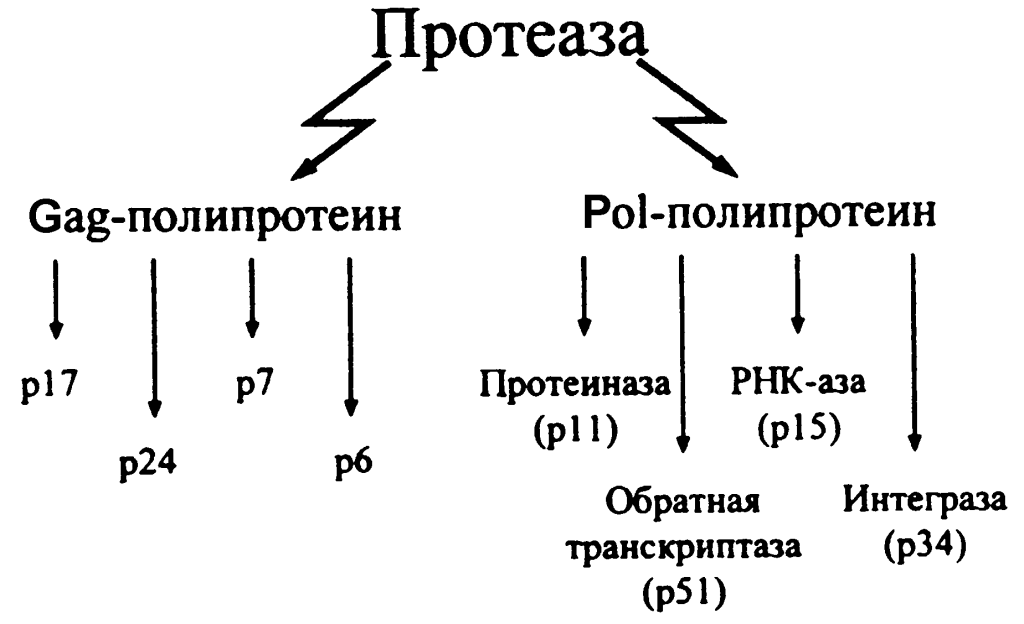
В феврале 2018 года мы провели поиск соответствующих исследований, которые имели надежный дизайн и исследовали связь между уровнями протеазы и будущим заживлением венозных язв на ногах. Мы нашли 19 исследований с участием 646 человек. Не во всех исследованиях указывали возраст и пол участников. В тех, в которых это было указано, средний возраст участников варьировал от 51 до 75 лет. Одиннадцать исследований дали результаты, которые мы могли использовать, с участием 13 групп людей. У большинства людей были раны, которые не заживали по меньшей мере три месяца.
Каковы основные результаты этого обзора?
Было много различий между включенными исследованиями: например, как они определяли заживление, тип протеаз и как они их измеряли, виды лечения и как они сообщали о результатах. Это отсутствие согласованности означало, что мы не могли объединить и сравнить результаты, поэтому мы суммировали результаты в общем виде.
Большая проблема заключалась в том, что ни в одном из исследований не проанализировали данные надлежащим образом, так как они не учитывали влияние возраста или инфекции, или лечения, и поэтому мы не могли быть уверены, что именно уровни протеазы были важны для заживления, скорее чем возраст или другие факторы. Большинство исследований были небольшими и могли быть проведены лучше, поэтому было трудно убедиться, насколько значимы были результаты. В целом, определённость доказательств была очень низкой. Необходимы дальнейшие исследования для изучения важности биомаркеров для заживления ран.
Большинство исследований были небольшими и могли быть проведены лучше, поэтому было трудно убедиться, насколько значимы были результаты. В целом, определённость доказательств была очень низкой. Необходимы дальнейшие исследования для изучения важности биомаркеров для заживления ран.
Насколько актуален этот обзор?
Мы провели поиск исследований, опубликованных к февралю 2018 года.
что это такое. Протеаза, амилаза, липаза
Дата публикации: .
Врач лабораторной диагностики
(заведующий клинико-
диагностической лабораторией)
Лавицкая Т.В.
Анализ на липазу назначают при подозрении на заболевания ЖКТ. Давайте рассмотрим более подробно фермент под названием «липаза» – что это? Какие функции в организме она выполняет, и о каких заболеваниях свидетельствует отклонение ее от нормы в результатах анализов?
Липаза – это фермент, вырабатываемый определенными органами человеческого организма. Она растворяет, разделяет и переваривает различные фракции жиров, а также выполняет ряд других важных задач. Основное значение имеет липаза панкреатическая. Ее активность можно оценить при поступлении в организм жиров.
Она растворяет, разделяет и переваривает различные фракции жиров, а также выполняет ряд других важных задач. Основное значение имеет липаза панкреатическая. Ее активность можно оценить при поступлении в организм жиров.
«Работает» фермент вместе с колипазой (коферментом) и желчными кислотами. Вырабатывается она, помимо поджелудочной железы, легкими, желудком, кишечником и даже лейкоцитами – белыми кровяными тельцами, принадлежащими иммунной системе. Также существует такое понятие, как «лингвальная липаза». Что это такое?
Это фермент, который вырабатывается в ротовой полости у новорожденных детей для первичного расщепления пищи, то есть для расщепления материнского молока. Панкреатическая липаза.
Ее уровень в крови гораздо выше, чем уровень других видов липазы. Однако при панкреатэктомии (удалении поджелудочной железы) небольшой процент липазы все-таки останется благодаря ее выделению другими органами.
Функции липазы в организме
Помимо расщепления жиров, липаза участвует в энергетическом обмене, а также принимает участие в усвоении полиненасыщенных жирных кислот и даже некоторых витаминов – в частности, А, D, E, K. Печеночная липаза отвечает за регулировку содержания в плазме липидов. Она способствует усвоению хиломикронов и липопротеидов низкой плотности.
Анализ на липазу
Анализ на липазу проводят в двух случаях:
-С целью выявления панкреатита (воспаления поджелудочной железы).
— Для оценки эффективности лечения панкреатита.
Исследование крови на липазу считается более информативным для диагностики острого панкреатита, чем определение в крови амилазы. Однако на поздних стадиях острого панкреатита уровень липазы может снижаться.
Однако на поздних стадиях острого панкреатита уровень липазы может снижаться.
Как подготовиться к анализу?
Кровь сдается строго натощак, пить перед сдачей анализа можно только воду. После последнего приема пищи должно пройти не менее 8-12 часов. Лучше делать это до начала приема лекарственных препаратов или через 1-2 недели после их отмены. Если сделать это невозможно, перед сдачей крови следует сообщить о том, какие именно препараты применяются. За день до взятия крови следует сесть на легкую диету – исключить жирную, жареную, острую пищу, алкоголь, а также избегать тяжелых физических нагрузок. Рекомендуется сдавать кровь до проведения других исследований – флюорографии, рентгенографии — или физиотерапевтических процедур.
Норма уровня липазы в крови
Индикатором многих заболеваний является фермент липаза, норма которого у взрослых мужчин и женщин почти не отличается. У взрослых, то есть лиц, достигших 18 лет – от 0 до 190 ед. У детей (до 17 лет) считается приемлемым содержание липазы от 0 до 130 ед.
У детей (до 17 лет) считается приемлемым содержание липазы от 0 до 130 ед.
О чем говорит повышение уровня фермента под названием липаза?
Норма ее содержания свидетельствует о том, что с поджелудочной железой все в порядке, если же показатели повышены, это может свидетельствовать о следующих заболеваниях:
Остром панкреатите или обострении заболевания, протекающего хронически.
Желчных коликах.
Хронических патологиях желчного пузыря.
Травмах поджелудочной железы.
Наличии новообразований в поджелудочной железе.
Закупорке протоков поджелудочной железы (камнем или рубцом).
Внутрипеченочном холестазе (и уменьшении поступления желчи в двенадцатиперстную кишку).
Острой кишечной непроходимости.
Инфаркте кишечника.
Перитоните (воспалении брюшины).
Прободной язве желудка. Перфорации полого органа.
Печеночной патологии, острой либо хронической.
Эпидемическом паротите («свинке»), дающем осложнение на поджелудочную железу. Нарушениях метаболизма, что обычно наблюдается при подагре, сахарном диабете, ожирении.
Нарушениях метаболизма, что обычно наблюдается при подагре, сахарном диабете, ожирении.
Циррозе печени
Причины понижения в крови липазы
Если липаза понижена, это сообщает о таких проблемах, как:
-Развитие любого онкозаболевания за исключением онкологии поджелудочной железы. — -Избыток триглицеридов, что встречается при неправильном питании, в частности чрезмерном употреблении жиров.
-Переход панкреатита в хроническую стадию.
Наш организм вырабатывает пищевые ферменты для переваривания белков, жиров и углеводов (основные из них — это амилаза, липаза и протеаза). Однако в случае снижения выработки ферментов (ферментативной недостаточности), панкреатите и других болезнях поджелудочной врачи назначают препараты, содержащие животные ферменты – они находятся в оболочке, поэтому защищены даже от повышенной кислотности желудочного сока. Достигая двенадцатиперстной кишки, они активизируются в ней. Зачастую ферменты назначают короткими курсами, но бывает случаи, когда пить их приходится достаточно долго. Длительной прием ферментов может сопровождаться некоторым снижением функции поджелудочной железы, однако после отмены препарата работа органа восстанавливается.
Зачастую ферменты назначают короткими курсами, но бывает случаи, когда пить их приходится достаточно долго. Длительной прием ферментов может сопровождаться некоторым снижением функции поджелудочной железы, однако после отмены препарата работа органа восстанавливается.
Из панкреатических ферментов обычно назначают «Креон», «Фестал», «Мезим», «Панкреазим», «Панзинорм» и другие препараты, основным действующим веществом которых является панкреатин.
В нем содержится протеаза, липаза, амилаза. Уровень липазы в одной таблетке выше, чем уровень других ферментов. Это связано с тем, что липаза, по сравнению с остальными ферментами, при болезни вырабатывается организмом в наименьшем количестве. Учитывая то, что липаза понижена в организме, ее содержание в препаратах — не менее
10 000 единиц действия (ЕД).
Ферментные препараты являются в большинстве случаев безопасными для организма. Они часто играют роль сопутствующей терапии при лечении антибиотиками, наряду с пре- и пробиотиками, а также витаминами и другими средствами.
Активация фермента протеазы в мозге привела к перееданию при ожирении
Молекула лептина
Vossman / Wikimedia Commons
Американские исследователи объяснили механизм формирования гормональной
резистентности при ожирении, которая ведет к дальнейшему перееданию и
накоплению жировой ткани. Как предположили авторы статьи в Science Translational Medicine, причиной
потери клетками чувствительности к гормону лептину в конечном счете может быть
локальное воспаление в мозге.
Количество энергетических резервов в организме млекопитающих в норме регулируется по принципу обратной связи. Клетки жировой ткани при наполнении выделяют пептидный гормон лептин, который отправляется в мозг и с участием нескольких посредников подавляет центр голода в гипоталамусе, таким образом снижая аппетит. Для этого на клетках нервной ткани есть специальные рецепторы лептина — белки, с которыми он связывается.
У людей с ожирением часто наблюдается резистентность к
лептину — несмотря на его высокие концентрации в крови, нейроны на гормон не
реагируют. Исследователи из Калифорнийского университета в Сан-Диего на
мышиной модели впервые обнаружили молекулярный механизм, по которому происходит
формирование резистентности. Оказалось, что на высококалорийной диете с высоким
содержанием жира у животных в гипоталамусе активируется протеаза (фермент,
расщепляющий белки) Mmp-2,
которая срезает рецепторы лептина с поверхности нейронов и астроцитов, таким образом
делая клетки нечувствительными к гормону. ГМ-мыши с делецией обоих копий гена,
кодирующего Mmp-2, на
высококалорийной диете набирали вес медленнее, и к концу эксперимента весили
меньше, чем мыши дикого типа.
ГМ-мыши с делецией обоих копий гена,
кодирующего Mmp-2, на
высококалорийной диете набирали вес медленнее, и к концу эксперимента весили
меньше, чем мыши дикого типа.
Динамика набора веса мышами дикого типа (WT) и мутантными по MMP2 (mmp2-/-) на высококалорийной диете (HFD). Справа график, отражающий вес мышей, которым искусственно снизили экспрессию mmp2 в гипоталамусе (черный столбик) по сравнению с мышами дикого типа на высококалорийной диете
Rafi Mazor et al / Science Translational Medicine 2018
Ученые предположили, что активность протеазы можно направленно снизить и таким образом восстановить чувствительность животных к лептину. Чтобы это проверить, в гипоталамус мышей при помощи вирусного вектора доставили короткие молекулы РНК, подавляющие экспрессию гена MMP2. Через 12 недель высококалорийной
диеты оказалось, что мыши с выключенным геном действительно более худые, чем
контрольные животные. При этом концентрация лептина в крови у них снизилась.
Через 12 недель высококалорийной
диеты оказалось, что мыши с выключенным геном действительно более худые, чем
контрольные животные. При этом концентрация лептина в крови у них снизилась.Авторы работы предположили, что повышенная концентрация лептина вследствие первичного накопления жировой ткани становится причиной активации протеазы по механизму, ассоциированному с воспалением. Таким образом, применительно к людям, хорошей стратегией для предотвращения развития резистентности к лептину и сопутствующего переедания стала бы разработка препаратов, снижающих системное воспаление в целом и воспаление в гипоталамусе в частности, резюмируют ученые.
Ранее формирование резистентности к лептину также связали с избыточным потреблением соли. Мыши, которых дополнительно поили солевым раствором, синтезировали больше фруктозы в печени, в результате чего у них развивалась нечувствительность к лептину, инсулину и метаболический синдром.
Дарья Спасская
что есть и от чего отказаться, чтобы их уберечь
От ферментов зависит наша биологическая жизнь, без них не работала бы наша пищевая цепочка, сообщает Sputnik Беларусь.
Почему ферменты так важны для нас?
В нашем организме с рождения заложено определенное количество ферментов. Их у нас более 3 тысяч видов.
Без ферментов невозможно ни пищеварение, ни дыхание, без них ни единого раза не сократится сердце, не будут работать мыслительные процессы в головном мозге. Ферменты участвуют в беременности и родах, уменьшают воспалительные процессы, улучшают иммунную систему, а также участвуют в синтезе ДНК и внутриклеточном пищеварении. Мы состоим из клеток, жизнь кипит в каждой из них 24 часа в сутки благодаря ферментам. Можно уверенно сказать, что управление жизнью — это ферментативная реакция.
Ферменты — это белковые структуры, состоящие из цепочек аминокислот. Они участвуют в расщеплении необходимого и в разрушении ненужного.
Каждый фермент, как ключ, открывает только свой замок. Ферменты бывают растительные, животные и те, которые производит наш организм. Они всегда работают в определенной среде и условиях. Для них важна рН-среда, температура, наличие микроэлементов, витаминов и аминокислот. Поскольку ферменты — это белковая структура, при температуре около 48°С они коагулируются (разрушаются). Ферменты животного происхождения — это, по сути, высушенный фермент железы животного. И неприятность в том, что ферменты животного происхождения наш организм распознает, как свои и со временем функции желез, вырабатывающих собственные ферменты значительно снижаются, а при болезни органа и вовсе могут приблизиться к нулю.
Поскольку ферменты — это белковая структура, при температуре около 48°С они коагулируются (разрушаются). Ферменты животного происхождения — это, по сути, высушенный фермент железы животного. И неприятность в том, что ферменты животного происхождения наш организм распознает, как свои и со временем функции желез, вырабатывающих собственные ферменты значительно снижаются, а при болезни органа и вовсе могут приблизиться к нулю.
Пельмени — шок для ферментов
Кислотно-щелочная среда имеет огромное значение для ферментов. Одни ферменты работают в кислой среде, а другие в щелочной. Именно поэтому медики рекомендуют раздельное питание, а иногда — добавочный прием ферментов.
Приведем пример: многие из вас наверняка замечали, что после хорошей порции пельменей нередко мучает отрыжка. Потому что пельмени — это мясной фарш и тесто. Чтобы расщепить мясо, нужны ферменты, работающие в кислой среде, а чтобы расщепить тесто — ферменты из щелочной среды. Вспоминаем химию. Кислота + щелочь = новый продукт и газ, который и выходит в виде отрыжки! Так что пельмени — скорее повод побаловать вкусовые рецепторы, чем польза для организма. Любое мясо лучше кушать с овощами и зеленью, которые содержат собственные ферменты и помогают организму справиться с белковым продуктом.
Любое мясо лучше кушать с овощами и зеленью, которые содержат собственные ферменты и помогают организму справиться с белковым продуктом.
Как заставить правильно работать ферменты пищеварения?
Съев определенную пищу, мы должны перевести ее в доступную для нашего организма форму. И ферменты выступают здесь катализаторами процессов. На каждом этапе пищеварения работают свои группы ферментов. Давайте рассмотрим основные.
Амилаза
Вырабатывается слюнной железой. Благодаря чему в ротовой полости начинается первичный процесс ферментации, расщепления пищи. Поэтому правильное пищеварение начинается с тщательного пережевывания пищи.
Амилаза преобразует крахмал в глюкозу. Этот фермент не активен в желудочном соке, поэтому сахар лучше есть вприкуску — так в ротовой полости начнется его первичное расщепление.
Например, если пожевать 2-3 минуты кусочек черного хлеба, он приобретает сладковатый вкус, это означает, что фермент амилаза расщепил крахмал до глюкозы. Один этап пищеварения преодолен. Продолжайте жевать.
Один этап пищеварения преодолен. Продолжайте жевать.
Чем дольше вы жуете — тем длиннее будет ваша жизнь.
Если амилаза поработала недостаточно, крахмал или сахара другими ферментами не расщепляются. Когда они попадут в толстый кишечник, то станут пищей для грибов, в частности рода Candida. Так что плохо пережеванный сахар помимо метеоризма может подарить вам еще и кандидоз.
Протеазы
Класс ферментов, которые расщепляют белки. Вырабатываются желудком, поджелудочной железой и кишечным секретом. В желудке начинает свою работу фермент пепсин. Он активен при рН 2, т. е. в кислой среде, расщепляет белки до пептидов. Если у человека гастрит, то идет сбой выработки и других ферментов желудка, участвующих в расщеплении белков. Особое внимание медиков привлекла способность этой группы ферментов расщеплять белки, вызывающие воспаление.
Если образуется недостаток протеаз, это приводит к тому, что белки не смогут расщепиться до конца и часть белков попадает в толстый кишечник.
У нас в кишечнике живет более 500 активных видов микрофлоры. Одни ее представители для нас полезны, другие — нейтральны до тех пор, пока не получают нужного питания. Нерасщепленные белки — как раз та пища, которой им не хватает. Подкрепившись, нейтральная флора начинает активно размножаться и переходит в патогенную, опасную для нас. Происходит резкое изменение микрофлоры и развивается дисбактериоз.
Лактаза
Выделяется тонким кишечником, для расщепления молочного сахара, он переходит в глюкозу.
Липаза
Фермент синтезируется поджелудочной железой для двенадцатиперстной кишки и тонкого кишечника, где идет расщепление жиров на глицерин и высшие жирные кислоты.
Также печенью выделяется желчь, которая позволяет расщепить жир из крупных капель на маленькие и дальше под действием липазы на мельчайшие формы. Переходя в питательные вещества, они впитываются в кишечнике и разносятся кровью к клеткам. Ферменты в клетках печени срабатывают миллион раз за 1 секунду.
При недостатке липазы жиры не до конца расщепляются и в виде крупных капель достигают толстого кишечника, вызывая раздражение его стенок, формируется синдром раздраженного кишечника.
Как понять, что ферментов в организме недостаточно?
Недостаток ферментов мы можем почувствовать на физическом уровне, если в течение 30 минут — часа ощущаем в области живота тяжесть, ноющую боль, распирание в животе или если вас клонит ко сну — проанализируйте содержимое своей тарелки и что было с ней рядом!
Может, это банальное отсутствие ферментов, ведь последствия могут быть разные: от недополучения питательных веществ как строительного материала до серьезных заболеваний.
Чтобы всегда быть в форме, нужно обязательно помнить, что еда — это в том числе и приятное вкусное лекарство. Практически все можно отрегулировать правильным питанием и разумным подходом!
Что уничтожает ферменты?
Температура, сахар, соль, уксус, контакт с металлом, время. Но если замороженные фрукты взбить в шербет, то в течение 15 минут вы получите изумительный коктейль из ферментов. Правда, желательно скушать его побыстрее, иначе в нем пойдут обратные процессы.
Правда, желательно скушать его побыстрее, иначе в нем пойдут обратные процессы.
На земле существует немало продуктов, которые содержат ферменты.
Продукты, содержащие высокоактивные ферменты, способствующие очищению: бананы, манго, папайя, ананас, авокадо, киви, брусника, грейпфрут.
С осторожностью — чеснок, лук, сырая и квашеная капуста, сырые без химикатов морковь и свекла, редьки, пророщенное зерно, кроме пшеницы, мягкие сыры. А вот орехи, напротив, являются ингибиторами (блокаторами) ферментов, поэтому, готовя овощные салаты с орехами и семечками, подумайте, что для вас в прерогативе: наслаждение или польза?
Вещества, разрушающие ферменты: яичный белок, проросшая картошка, горох, бобы, чечевица, семечки, поэтому эти продукты лучше употреблять с вареной пищей, где априори уже не будет ферментов.
При нехватке ферментов, помимо того что в кишечнике бактерии и грибы начинают расти на непереваренных остатках пищи, начинаются запоры, болезни, связанные с нарушением обмена веществ (фосфорно-кальциевый обмен): боли в суставах и подагра, образуются кристаллы мочевой кислоты, которая скапливается в суставах.
Правильное пищеварение — это база как для здоровья, так и для развития болезни. Не забывайте об этом всякий раз, размышляя о том, чем бы подкрепиться.
Untitled-2
%PDF-1.3 % 5 0 obj > stream application/postscript
 adobe.illustrator
adobe.illustrator adobe.illustrator
adobe.illustrator adobe.illustrator
adobe.illustrator adobe.illustrator
adobe.illustrator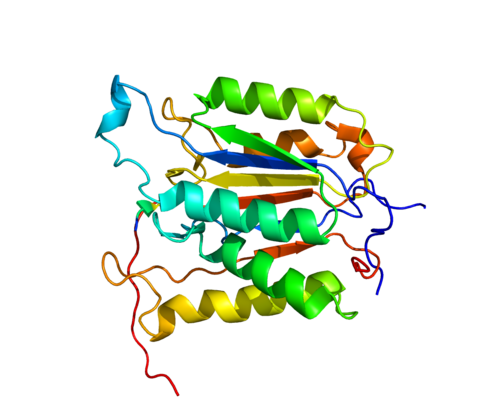 adobe.illustrator
adobe.illustrator adobe.illustrator
adobe.illustrator uٳTv!$5u{4C~5BVYgV3iјk:kiP롭fXw
͢z~On]ȶ:FJ9A.a]MU9 %DdRED
uٳTv!$5u{4C~5BVYgV3iјk:kiP롭fXw
͢z~On]ȶ:FJ9A.a]MU9 %DdREDru:about:media:2015:20151208 [Институт химической биологии и фундаментальной медицины]
Оригинал статьи
ПОИСК от 18.08.2016 г.
МАРКЕРЫ НАЧЕКУ. С ТЯЖЕЛЫМИ ЗАБОЛЕВАНИЯМИ ПОМОГУТ СПРАВИТЬСЯ АНТИТЕЛА-ПРОТЕАЗЫ.
Не один десяток лет свирепствуют ВИЧ-инфекция и СПИД, который она вызывает, а надежного лекарства от них пока нет. Ученые не бездействуют, они упорно ищут способы обуздания коварного заболевания. Каждая научная группа идет своим путем, стремится предложить оригинальное и эффективное решение проблемы. Многие из них не ставят задачу найти “лекарство от СПИДа”, ведь порой не менее важно — суметь правильно поставить диагноз, спрогнозировать течение болезни, подобрать правильную методику лечения. Есть надежда, что приведенные к общему знаменателю результаты поиска в этих и других направлениях принесут долгожданную победу над недугом. Одно из таких направлений разрабатывает младший научный сотрудник лаборатории ферментов репарации Института химической биологии и фундаментальной медицины СО РАН Елена ОДИНЦОВА. Она изучает возможности антител-протеаз — новых диагностических маркеров характера течения и дифференциальной диагностики ВИЧ-инфекции. Социально значимая работа получила поддержку ряда фондов, а также грант Президента России. Наш корреспондент попросил молодого ученого рассказать о его исследовании.
Она изучает возможности антител-протеаз — новых диагностических маркеров характера течения и дифференциальной диагностики ВИЧ-инфекции. Социально значимая работа получила поддержку ряда фондов, а также грант Президента России. Наш корреспондент попросил молодого ученого рассказать о его исследовании.
— Природные антитела разнообразны по строению, — объясняет Елена Сергеевна. — Они циркулируют в крови как часть иммунной системы. Открытие каталитической активности антител изменило традиционные представления об их роли и функции. Каталитическая (ферментативная) активность — это способность антител выступать в роли ферментов, то есть ускорять химические реакции. Принципиальная возможность открытия подобных антител была высказана в 1948 году американским химиком, лауреатом двух Нобелевских премий Лайнусом Полингом. В зависимости от природы вещества, расщепляемого на кусочки, ферменты делятся на протеазы, ДНКазы и амилазы. Первые “едят” белки и их части — пептиды. Вторые — ДНК. Третьи предпочитают сахара. Новые перспективы в этой области появились в 1989 году, после открытия природных каталитически активных антител с протеазной активностью в сыворотке крови больных астмой.
Новые перспективы в этой области появились в 1989 году, после открытия природных каталитически активных антител с протеазной активностью в сыворотке крови больных астмой.
При аутоиммунных заболеваниях в организме наблюдается высокий титр аутоантител — антител к собственным антигенам организма. Их обнаруживают у пациентов с такими недугами, как системная красная волчанка, полиартрит, аутоиммунный тиреоидит, рассеянный склероз. А также при гепатите, лейкемии, клещевом энцефалите, ВИЧ-инфекции — при этих заболеваниях происходит “срыв” “толерантности” к собственным антигенам и наработка аутоантител. Но, согласно нашим исследованиям, антитела из крови здоровых доноров, а также больных гриппом, пневмонией, туберкулезом, тонзиллитом, язвой 12-перстной кишки и некоторыми онкологическими заболеваниями не проявляют заметной каталитической активности.
Впервые антитела-протеазы обнаружили при аутоиммунных заболеваниях. Они различаются по строению активных центров — структур, в которых субстрат расщепляется на части, и по субстратной специфичности — не все протеазы “едят” все белки (субстраты) подряд, у некоторых есть определенные “вкусовые” предпочтения. Антитела из крови больных системной красной волчанкой и рассеянным склерозом эффективно расщепляют основной белок миелина и могут играть важную роль в развитии заболевания, усиливая расщепление миелиновой оболочки длинных отростков нервных клеток — аксонов. Положительную роль в развитии болезни Альцгеймера могут играть природные антитела, расщепляющие бета-амилоид. Известно, что накопление бета-амилоида в головном мозге вызывает разрушение нервной ткани. Защитная роль антител-протеаз важна при сепсисе — заражении крови болезнетворными бактериями. Появление в крови антител с протеазной активностью способствует снижению случаев закупорки мелких сосудов и благоприятному исходу заболевания.
Антитела из крови больных системной красной волчанкой и рассеянным склерозом эффективно расщепляют основной белок миелина и могут играть важную роль в развитии заболевания, усиливая расщепление миелиновой оболочки длинных отростков нервных клеток — аксонов. Положительную роль в развитии болезни Альцгеймера могут играть природные антитела, расщепляющие бета-амилоид. Известно, что накопление бета-амилоида в головном мозге вызывает разрушение нервной ткани. Защитная роль антител-протеаз важна при сепсисе — заражении крови болезнетворными бактериями. Появление в крови антител с протеазной активностью способствует снижению случаев закупорки мелких сосудов и благоприятному исходу заболевания.
В крови больных ВИЧ-инфекцией, заболеванием с выраженной аутоиммунностью, на разных стадиях (пре-СПИД и СПИД) были обнаружены антитела-протеазы, расщепляющие ферменты вируса. Эти ферменты участвуют в процессе обмена генома — обратной транскриптазе (копирует вирусную одноцепочечную РНК в двуцепочечную ДНК) и интегразе (вводит вирусный геном в геном клетки хозяина). Согласно опубликованным данным, антитела против компонентов вируса могут стать причиной замедленного перехода заболевания в последнюю стадию — СПИД. Мы подтвердили защитную роль антител против интегразы ВИЧ из крови ВИЧ-инфицированных больных. Она состоит не только в высоко избирательном расщеплении интегразы ВИЧ, но и в уменьшении скорости катализируемых (ускоряемых) ею реакций, которые обеспечивают развитие вирусной инфекции в организме человека.
Согласно опубликованным данным, антитела против компонентов вируса могут стать причиной замедленного перехода заболевания в последнюю стадию — СПИД. Мы подтвердили защитную роль антител против интегразы ВИЧ из крови ВИЧ-инфицированных больных. Она состоит не только в высоко избирательном расщеплении интегразы ВИЧ, но и в уменьшении скорости катализируемых (ускоряемых) ею реакций, которые обеспечивают развитие вирусной инфекции в организме человека.
— Почему именно эти антитела были выбраны в качестве диагностических маркеров?
— В недавних публикациях мы доказали, что субстраты антител-протеаз — это гистоны, то есть белки, принимающие участие в упаковке ДНК в хромосомы. Согласно нашим предварительным результатам, антитела-протеазы крови больных ВИЧ-инфекцией, расщепляющие основной белок миелина и гистоны, есть основания считать новыми перспективными маркерами протекания ВИЧ-инфекции. Их можно использовать для дифференциальной диагностики.
Строгая субстратная специфичность антител ВИЧ-инфицированных больных и относительная простота методов их детекции позволит разработать дополнительные методы дифференциальной диагностики ВИЧ-инфекции.
— Как проводится эта диагностика?
— Сегодня для дифференциальной диагностики на наличие вируса иммунодефицита в крови, а также контроля состояния больного используют иммуноферментный анализ и вестерн-блот (определяют антитела к белкам вируса в крови), ПЦР с обратной транскрипцией (определяют РНК вируса) и проточную цитометрию (количественно выявляют те или иные типы клеток). Стадию ВИЧ-инфекции также определяют по сопутствующим заболеваниям, развивающимся вследствие иммунодефицита. Перечисленные подходы не позволяют прогнозировать характер течения заболевания (быстрый или медленный вариант развития) и переход заболевания на следующую стадию. Такой прогноз позволил бы заблаговременно изменить терапию пациента и в перспективе улучшить состояние. Согласно опубликованным данным, ВИЧ-инфекция не только сопровождается иммунным ответом на компоненты вируса, но и приводит к сбою иммунной системы, ведущему к развитию аутоиммунных патологий. В последние годы мы детально исследовали антитела крови ВИЧ-инфицированных больных, расщепляющие ДНК и белки, и получили данные, указывающие на связь этих активностей со скоростью перехода заболевания на следующую стадию.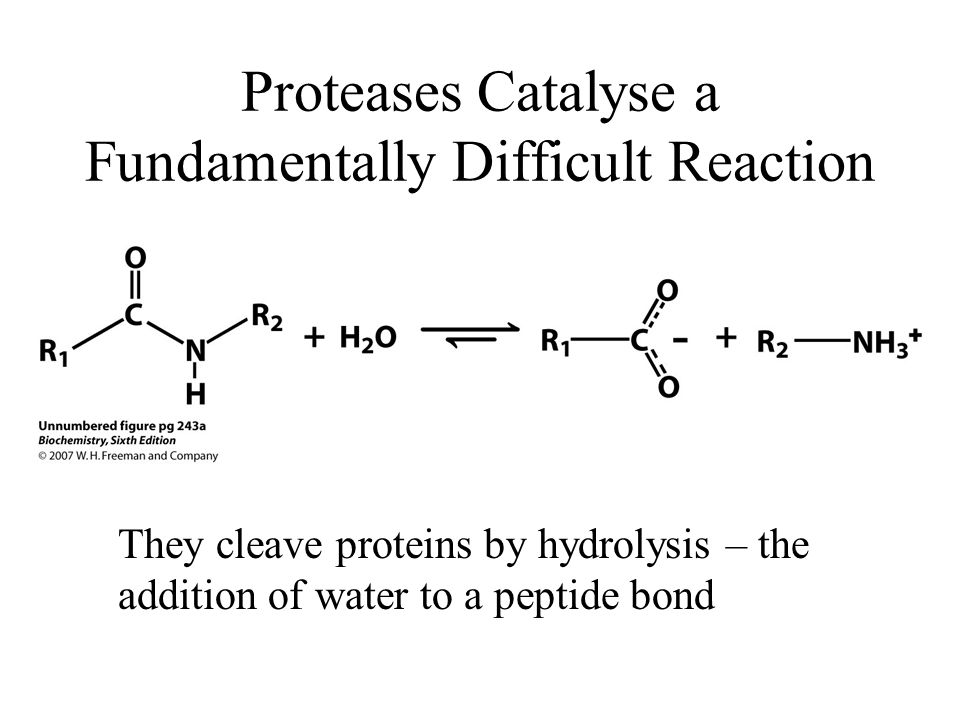
— Какие исследования входят в ваш проект по этой тематике?
— Цель нашего проекта — детальное изучение каталитических свойств антител-протеаз по отношению к гистонам, основному белку миелина и другим белкам при ВИЧ-инфекции, сравнение их со свойствами ферментов. Полученные данные необходимы для установления механизмов наработки и возможной биологической роли таких антител при ВИЧ-инфекции. Кроме того, протеазная активность может служить дополнительным критерием, отражающим состояние ВИЧ-инфицированного пациента. Это позволит сделать прогноз о скорости развития заболевания, а также индивидуально подобрать терапию. Мы будем искать связь между каталитическими свойствами антител-протеаз и характером течения ВИЧ-инфекции.
— С каким материалом вы работаете?
— Для работы мы используем образцы крови больных ВИЧ-инфекцией. Так как детальный анализ антител-протеаз крови больных требует клинической базы для всестороннего анализа больных, наши исследования ведутся совместно с Ростовским государственным медицинским университетом. Всесторонний биохимический, иммунологический и клинический анализы пациентов, страдающих ВИЧ-инфекцией, провели в НИИ клинической иммунологии РостГМУ.
Всесторонний биохимический, иммунологический и клинический анализы пациентов, страдающих ВИЧ-инфекцией, провели в НИИ клинической иммунологии РостГМУ.
В качестве субстратов для определения протеазной активности мы используем рекомбинантные белки, выращенные в бактериях, а также искусственно синтезированные пептиды, соответствующие определенным участкам последовательности аминокислот гистонов и основного белка миелина.
— Какие проблемы поможет решить ваша работа?
— Наш проект направлен на решение фундаментальной проблемы — поиск новых маркеров дифференциальной диагностики и характера течения ВИЧ-инфекции. Это позволит выработать новые стандарты персонализованной терапии заболевания. Разработка новых методов диагностики состояния больного, эффективности терапии, а также прогнозирования характера течения заболевания поможет найти оптимальное лечение, а также улучшить качество жизни больного. В конце беседы хотелось бы отметить, что наша работа, без сомнений, социально значимая. Она поддержана грантами РФФИ, программами фундаментальных исследований РАН, а также грантом мэрии Новосибирской области.
Она поддержана грантами РФФИ, программами фундаментальных исследований РАН, а также грантом мэрии Новосибирской области.
Беседу вел Василий ЯНЧИЛИН
Фото предоставлено Е.Одинцовой
Партнерский материал. Протеаза — ключ к снижению стоимости корма и концентрации аммиака — Агроинвестор
«Фидлэнд Групп»Автор: Александр Комаров, руководитель отдела продаж компании «Фидлэнд Групп»
Из-за постоянного роста цен на корма производители вынуждены искать новые пути удешевления рационов кормления и повышения усвояемости питательных веществ из более недорогих компонентов. Актуальным решением в сложившихся условиях является использование биологически активных добавок для сельскохозяйственных животных. К таким в частности относятся ферментные препараты, расщепляющие высокомолекулярные соединения (крахмал, белки, липиды, компоненты клетчатки) до легкоусвояемых форм питательных веществ.
Добавление кормовых ферментов способствует не только повышению усвояемости отдельных компонентов корма, но и увеличению нормы ввода недорогого сырья, «богатого» антипитательными факторами, без ущерба здоровью и продуктивности животных.
Одним из таких ферментов является протеаза, активно набирающая популярность в мировом кормлении. По мнению ряда экспертов как в России, так и за рубежом, именно рынок протеазы ждет наиболее динамичное развитие в ближайшее время.
Александр Комаров, руководитель отдела продаж компании «Фидлэнд Групп»«Фидлэнд Групп»
По данным исследования «Рынок кормовой протеазы России в 2017—2018 годах», опубликованном агентством «Фидлот», в 2017 году в Россию было ввезено свыше 530 тонн кормовой протеазы. На российском рынке представлены следующие импортные кормовые добавки, имеющие в своем составе протеазу: «Сибенза DP 100» от компании NOVUS, «Ронозим Проакт» производства DSM, «Акстра PRO TPT» DuPont и зарегистрированная в августе 2018 года протеаза компании Weifang KDN Biotech — «КДН Протеаза ТС», производственного подразделения компании VLAND BIOTECH INC. — одного из крупнейших мировых производителей ферментов для сельского хозяйства, пищевой, текстильной и химической промышленности.
— одного из крупнейших мировых производителей ферментов для сельского хозяйства, пищевой, текстильной и химической промышленности.
Протеаза — протеолитический фермент, позволяющий максимально эффективно использовать белковую составляющую кормов, сокращая ввод ряда дорогих кормовых компонентов. При этом помимо снижения стоимости корма протеаза позволяет существенно сократить загрязнение воздуха в животноводческих помещениях аммиаком, благотворно влияя на здоровье и продуктивность животных и на общую экологическую обстановку около свинокомплексов и птицефабрик — проблему, приобретающую особое значение и важность, в том числе в России.
Протеаза позволяет снизить фактическую питательность рациона по протеину и аминокислотам на 4-6%. Как правило, для рецепта корма с добавлением протеазы требуется меньшее количество дорогостоящих источников белка, таких как соевый шрот. Экономия за счет снижения стоимости корма при вводе в него протеазных ферментов зависит от следующих факторов:
— используемых матричных значений при составлении рациона;
— стоимости компонентов корма, при их удорожании экономия от применения энзимов только увеличивается;
— ввода сырья с труднодоступным белком;
— добавления других ферментов в корм (следует правильно учитывать матричные значения).
Энзимы улучшают переваримость и усвояемость питательных веществ кормов, устраняют или снижают отрицательное влияние антипитательных факторов, восполняют дефицит эндогенных ферментов на ранних стадиях развития молодняка животных и птицы, когда выработка собственных ферментов затруднена.
Protease — обзор | Темы ScienceDirect
3.48.3.2 Протеазы
Протеазы (EC 3.4) способны катализировать гидролитические реакции, которые разлагают молекулы белка до пептидов и, в конечном итоге, до свободных аминокислот; Помимо проведения протеолитических реакций, протеазы также регулируют различные ферментативные каскады как часть метаболических циклов (например, расщепление жиров и углеводов) посредством атаки на проферментные зимогены, которые в конечном итоге высвобождают другие активные ферменты из более длинных, но неактивных пептидных последовательностей [9] .Протеазы составляют довольно большую и сложную группу ферментов, которые отличаются друг от друга субстратной специфичностью, природой активного центра и каталитическим механизмом, а также оптимумом pH и температуры и термостабильностью; В частности, специфичность протеаз определяется типом аминокислотных остатков в их каталитических сайтах.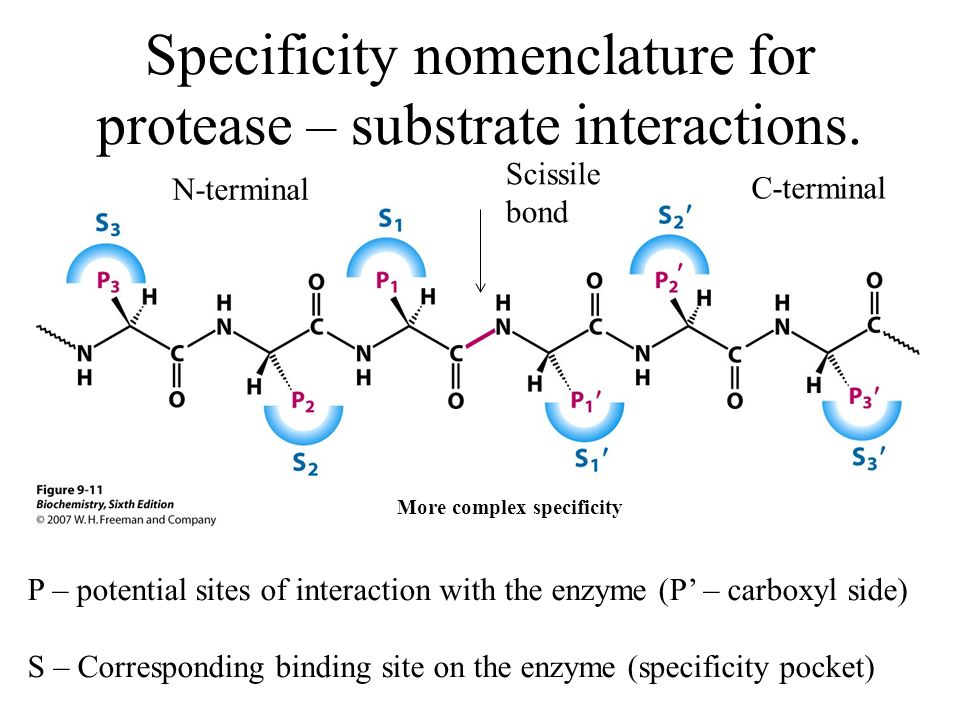 Четыре механистических класса признаны Международным союзом биохимиков, и в них рассматриваются шесть семейств протеаз: сериновые протеазы (EC 3.4.21), серинкарбоксипротеазы (EC 3.4.16), цистеиновые протеазы (EC 3.4.22), аспарагиновые протеазы (EC 3.4.23), металлопротеазы I (EC 3.4.24) и металлокарбоксипротеазы (EC 3.4.17), в зависимости от конкретной каталитической аминокислоты (или металла), участвующей в протеолизе [7]. Вначале протеазы классифицировали в соответствии с их источником (животное, растение или микроорганизм), каталитическим действием (эндо- или экзопептидазы), то есть расщепляют ли они внутренние пептидные связи или N- / C-концевые пептидные связи, молекулярную размер, заряд, оптимум pH (т.е. кислый, нейтральный или щелочной), специфичность к субстрату (например, коллагеназа, кератиназа или эластаза) или гомология с хорошо изученными белками (например, трипсином или пепсином).
Четыре механистических класса признаны Международным союзом биохимиков, и в них рассматриваются шесть семейств протеаз: сериновые протеазы (EC 3.4.21), серинкарбоксипротеазы (EC 3.4.16), цистеиновые протеазы (EC 3.4.22), аспарагиновые протеазы (EC 3.4.23), металлопротеазы I (EC 3.4.24) и металлокарбоксипротеазы (EC 3.4.17), в зависимости от конкретной каталитической аминокислоты (или металла), участвующей в протеолизе [7]. Вначале протеазы классифицировали в соответствии с их источником (животное, растение или микроорганизм), каталитическим действием (эндо- или экзопептидазы), то есть расщепляют ли они внутренние пептидные связи или N- / C-концевые пептидные связи, молекулярную размер, заряд, оптимум pH (т.е. кислый, нейтральный или щелочной), специфичность к субстрату (например, коллагеназа, кератиназа или эластаза) или гомология с хорошо изученными белками (например, трипсином или пепсином).
Поскольку протеазы незаменимы для живых организмов, они встречаются у самых разных растений, животных и микроорганизмов. Папаин, бромелайн, кератиназы и фиксин представляют собой одни из самых известных протеаз растений; однако использование растений в качестве продуцентов протеаз регулируется трудно контролируемыми факторами, такими как наличие земли и погода; к тому же их выведение — длительный процесс.
Папаин, бромелайн, кератиназы и фиксин представляют собой одни из самых известных протеаз растений; однако использование растений в качестве продуцентов протеаз регулируется трудно контролируемыми факторами, такими как наличие земли и погода; к тому же их выведение — длительный процесс.
Панкреатический трипсин, химотрипсин, пепсин и реннин, с другой стороны, являются наиболее важными протеазами животного происхождения; еще раз, их производство зависит от наличия скота для убоя и часто сталкивается с этическими ограничениями.Следовательно, микробные протеазы в конечном итоге предпочтительнее как по качеству, так и по количеству [7]. Большинство бактериальных протеаз с коммерческой экспрессией очень активны при нейтральном и щелочном pH и в меньшей степени продуцируются микроорганизмами рода Bacillus и Clostridium . Как правило, нейтральные протеазы активны в узком диапазоне pH (5,0–8,0) и имеют относительно низкую термотолерантность, но широкую субстратную специфичность и оптимальные температуры ~ 60 ° C; некоторые из них принадлежат к типу металлопротеаз, поэтому для полной каталитической активности им требуются двухвалентные катионы, тогда как на другие (например, сериновые протеазы) хелатирующие агенты не влияют.
Щелочные протеазы из Brevibacterium linens были полностью использованы в молочной промышленности, а протеазы из Bacillus thermoproteolyticus в настоящее время используются для ферментативного синтеза аспартама. Несмотря на длинный список бактериальных протеаз пищевого качества, в основном получаемых при глубокой ферментации, грибковые протеазы пользуются более высоким спросом [7]. Как эукариоты, грибы действительно могут синтезировать более широкий спектр протеаз, чем бактерии — как в случае кислотных, нейтральных и щелочных протеаз, продуцируемых A.oryzae , Rhizopus oligosporum , A. flavus , A. niger , Ophiostoma piceae и Metarhizium anisopliae ; твердофазная ферментация, а не погруженная ферментация, является предпочтительным способом культивирования последней. Грибковые протеазы обычно активны в гораздо более широком диапазоне pH (4,0–11,0), а также обладают более широкой субстратной специфичностью; кислотные протеазы грибов, в частности, имеют оптимальный диапазон pH 4,0–4,5 и стабильны в пределах 2. 5 и 6.0. Нейтральные протеазы грибов обычно являются металлопротеазами и часто используются в конъюгации с другими протеазами растений, животных и бактерий [7].
5 и 6.0. Нейтральные протеазы грибов обычно являются металлопротеазами и часто используются в конъюгации с другими протеазами растений, животных и бактерий [7].
Протеазы, безусловно, являются наиболее важными ферментами в пищевой промышленности и использовались на протяжении многих столетий, первоначально как агенты свертывания молока (сычужный фермент) при производстве сыра [9]. В сыроварении химозин является предпочтительной протеазой из-за его высокой специфичности по отношению к казеину, и особенно к связи Phe105 – Met106 k -казеина, которая является первой стадией свертывания молока при производстве сыра.Тем временем обширные исследования протеаз из Mucor miehei , помимо ферментов из Bacillus subtilis , постепенно привели к замене химозина в сыроделии, поскольку первые менее дороги и термолабильны, чем ренины животного происхождения. Кроме того, химическая обработка окислителями ренина, полученного из M. miehei , дает фермент, аналогичный его животным аналогам, с точки зрения производительности и качества конечного продукта. Наконец, узкие диапазоны pH и температуры действия делают протеазы грибов особенно подходящими для сыроварения, которые также включают кислотные, щелочные и нейтральные протеазы из A.oryzae .
Наконец, узкие диапазоны pH и температуры действия делают протеазы грибов особенно подходящими для сыроварения, которые также включают кислотные, щелочные и нейтральные протеазы из A.oryzae .
В хлебопекарной промышленности эндо- и экзопротеазы из A. oryzae были использованы для модификации глютена пшеницы посредством ограниченного протеолиза; такая ферментативная обработка сокращает время замеса, улучшает текстуру теста и увеличивает объем хлеба. С древних времен протеазы использовались для приготовления соевых продуктов: щелочные и нейтральные грибковые протеазы играют важную роль в производстве соевого соуса, а также в гидролизе соевых белков, направленном на улучшение их функциональных свойств и уменьшение горечи [7] .Протеазы также используются при обезволашивании шкур, смягчении мяса и улучшении вкуса и цвета печенья [9]. Эндопептидазы в промышленности более важны, чем экзопептидазы, поскольку они выделяют пептиды, а не отдельные аминокислоты; Некоторые экзопептидазы находят коммерческое применение, как, например, лейцинаминопептидаза грибного происхождения для уменьшения количества белков гидролизатов [7].
протеолитический фермент | Описание, типы и функции
Протеолитический фермент , также называемый протеазой , протеиназой или пептидазой , любой из группы ферментов, которые расщепляют длинные цепочечные молекулы белков на более короткие фрагменты (пептиды) и в конечном итоге на их компоненты, аминокислоты.Протеолитические ферменты присутствуют в бактериях, архее, некоторых типах водорослей, некоторых вирусах и растениях; Однако больше всего они встречаются у животных.
Существуют различные типы протеолитических ферментов, которые классифицируются по участкам, в которых они катализируют расщепление белков. Две основные группы — это экзопептидазы, которые нацелены на концевые концы белков, и эндопептидазы, которые нацелены на сайты внутри белков. Эндопептидазы используют различные каталитические механизмы; в эту группу входят аспарагиновые эндопептидазы, цистеинэндопептидазы, глутаминовые эндопептидазы, металлоэндопептидазы, сериновые эндопептидазы и треониновые эндопептидазы. Термин олигопептидаза зарезервирован для тех ферментов, которые специфически действуют на пептиды.
Термин олигопептидаза зарезервирован для тех ферментов, которые специфически действуют на пептиды.
Среди наиболее известных протеолитических ферментов находятся те, которые находятся в пищеварительном тракте. В желудке белковые материалы изначально атакуются желудочной эндопептидазой, известной как пепсин. Когда белковый материал попадает в тонкий кишечник, белки, которые лишь частично перевариваются в желудке, подвергаются дальнейшей атаке протеолитическими ферментами, секретируемыми поджелудочной железой. Эти ферменты высвобождаются в тонком кишечнике из неактивных предшественников, продуцируемых ацинарными клетками поджелудочной железы.Предшественники называются трипсиногеном, химотрипсиногеном, проэластазой и прокарбоксипептидазой. Трипсиноген трансформируется в эндопептидазу, называемую трипсином, ферментом (энтерокиназой), секретируемым стенками тонкой кишки. Затем трипсин активирует предшественников химотрипсина, эластазы и карбоксипептидазы. Когда ферменты поджелудочной железы активируются в кишечнике, они превращают белки в свободные аминокислоты, которые легко абсорбируются клетками стенки кишечника. Поджелудочная железа также вырабатывает белок, называемый ингибитором секреторного трипсина поджелудочной железы, который связывается с трипсином и блокирует его активность.Считается, что таким образом поджелудочная железа защищает себя от самопереваривания.
Поджелудочная железа также вырабатывает белок, называемый ингибитором секреторного трипсина поджелудочной железы, который связывается с трипсином и блокирует его активность.Считается, что таким образом поджелудочная железа защищает себя от самопереваривания.
Что такое протеаза? — Наука о ферментах
Важность белка
Белок обычно считается одним из «строительных блоков» человеческого тела, являясь важным компонентом многих структур организма, а также телесных процессов. Однако, как и любой другой тип питательных веществ, мы должны иметь возможность извлекать их из своего рациона или из других источников.Наш организм делает это в основном с помощью ферментов, а в случае с белками основными ферментами, выполняющими свою работу, являются протеазы, также известные как пептидазы или протеиназы. Примечательно, что как растения, так и животные полагаются на протеазы для повседневной деятельности, и этот факт может иметь отношение к вашему здоровью, как мы объясним. 1
1
Роль протеазы
По сравнению с липазой и амилазой, которые расщепляют жиры и углеводы соответственно, семейство протеаз играет более обширную роль.Да, протеаза помогает расщеплять белок в пище на аминокислоты, которые затем организм может использовать для получения энергии, но протеазы отличаются тем, что они также играют ряд других ролей в важных процессах, таких как:- Свертывание крови
- Отделение клеток
- Переработка белков
- Иммунная поддержка
Поддержка пищеварения: Мы упоминали, что протеаза помогает организму усваивать незаменимые аминокислоты, но, помогая процессу пищеварения, ферменты протеазы могут помочь людям, которые испытывают такие симптомы расстройства желудка, как потеря аппетита, вздутие живота и дискомфорт в животе.
Болезненность мышц: Спортсмены считают, что белок является важной частью их режима здоровья, и протеаза также может иметь значение.В одном исследовании смесь ферментов протеаз уменьшала нежность и болезненность мышц после тренировки по сравнению с плацебо.
Заживление ран: Одно небольшое исследование показало, что отек и дискомфортные ощущения уменьшились у пациентов после стоматологической операции после приема фермента протеазы серрапептазы.Выбор подходящей протеазы
Итак, теперь, когда мы знаем все, на что способны протеазы, откуда их взять? Как упоминалось ранее, и растения, и животные имеют протеазы, и в некоторых случаях включение растительных ферментов является отличным вариантом.Две популярные протеазы растительного происхождения — это папаин из папайи и бромелайн из ананасов. Оба они веками использовались из-за их способности расщеплять белки, но в качестве смягчителя мяса, а не по соображениям здоровья. 6 Это два самых популярных источника пищи, но есть и другие, такие как имбирь, спаржа. , киви и кимчи. Другой вариант — получать протеазы из добавок для различных функций поддержки здоровья. Например, использование протеазы в пищеварительной формуле на растительной основе поможет усвоению питательных веществ, поддерживая функцию пищеварения; Однако протеазы также используются для устранения чрезмерного количества слизи из-за аллергии или перепадов температуры.
6 Это два самых популярных источника пищи, но есть и другие, такие как имбирь, спаржа. , киви и кимчи. Другой вариант — получать протеазы из добавок для различных функций поддержки здоровья. Например, использование протеазы в пищеварительной формуле на растительной основе поможет усвоению питательных веществ, поддерживая функцию пищеварения; Однако протеазы также используются для устранения чрезмерного количества слизи из-за аллергии или перепадов температуры.
Следует отметить, что существует много протеаз, поэтому важно выбрать подходящую протеазу для конкретной проблемы. Когда дело доходит до получения большего количества протеаз с помощью дополнительных средств, важно найти то, что подходит вашему клиенту. Есть два варианта на выбор, поскольку протеазы доступны в пищеварительных или системных / терапевтических препаратах. Первые принимают во время еды, а вторые в большинстве случаев забирают из еды. Пожалуйста, свяжитесь с вашим представителем по науке о ферментах для получения дополнительной информации о доступных вариантах.
- Hartl M, Giri AP, Kaur H, Baldwin IT. Многочисленные функции ингибиторов сериновых протеаз растений: защита от травоядных и не только. Сигнальное поведение растений. 2011; 6 (7): 1009-11.
- Mótyán JA, Tóth F, Tőzsér J. Исследовать применение протеолитических ферментов в молекулярной биологии. Биомолекулы. 2013; 3 (4): 923-42.
- К. Чаччи, Ф. Франчески *, Ф. Пурчарони *, П. Капоне **, Ф. Бучеллетти *, П. Якомини *, А. Ранаудо **, П. Андреоцци **, П. Тонди #, Н. Джентилони Сильвери *, А.Гасбаррини °, Дж. Гасбаррини§. Влияние бета-глюкана, инозита и пищеварительных ферментов на симптомы желудочно-кишечного тракта у пациентов с СРК. Eur Rev Med Pharmacol Sci 2011; 15 (6): 637-643
- Udani JK, Singh BB, Singh VJ, Sandoval E. Капсулы BounceBack для уменьшения DOMS после эксцентрических упражнений: рандомизированное, двойное слепое, плацебо-контролируемое, перекрестное пилотное исследование. J Int Soc Sports Nutr. 2009; 6: 14.
- Al-khateeb TH, Nusair Y.
 Влияние протеолитического фермента серрапептазы на отек, боль и тризм после хирургического удаления третьих моляров нижней челюсти.Int J Oral Maxillofac Surg. 2008; 37 (3): 264-8.
Влияние протеолитического фермента серрапептазы на отек, боль и тризм после хирургического удаления третьих моляров нижней челюсти.Int J Oral Maxillofac Surg. 2008; 37 (3): 264-8. - Бехит А.А., Хопкинс Д.Л., Гисинк Г., Бехит А.А., Фрэнкс П. Экзогенные протеазы для тендеризации мяса. Crit Rev Food Sci Nutr. 2014; 54 (8): 1012-31.
- Mcdermid AS, Mckee AS, Marsh PD. Влияние pH окружающей среды на активность ферментов и рост Bacteroides gingivalis W50. Заражение иммунной. 1988; 56 (5): 1096-100.
Используйте стрелки влево / вправо для навигации по слайд-шоу или проведите пальцем влево / вправо при использовании мобильного устройства
Трансмембранная сериновая протеаза связана с рецептором коронавируса тяжелого острого респираторного синдрома и активирует проникновение вируса
РЕФЕРАТ
Белки Spike (S), определяющие проекции коронавирусов в оболочке (CoV), опосредуют проникновение в клетку, соединяя вирусы с плазматической мембраной рецепторов и катализируя последующие слияния вирус-клеточная мембрана. Последнее слияние мембран требует конформационной гибкости S-белка, чему способствует протеолитическое расщепление. Мы предположили, что наиболее значимыми клеточными протеазами в этом процессе являются протеазы, тесно связанные с рецепторами клетки-хозяина. Первичным рецептором CoV тяжелого острого респираторного синдрома человека (SARS) CoV является ангиотензин-превращающий фермент 2 (ACE2). Иммунопреципитация ACE2 захватила трансмембранную протеазу / член подсемейства серина 2 (TMPRSS2), известную протеазу дыхательных путей человека и альвеолярную протеазу.ACE2 и TMPRSS2 совместно локализовались на поверхности клеток и усиливали проникновение в клетки как SARS S-псевдотипа ВИЧ, так и аутентичного SARS-CoV. Повышенный вход коррелировал с TMPRSS2-опосредованным протеолизом как S, так и ACE2. Эти результаты показывают, что комплекс клеточной поверхности, состоящий из первичного рецептора и отдельной эндопротеазы, действует как портал для активации входа в клетки SARS-CoV.
Последнее слияние мембран требует конформационной гибкости S-белка, чему способствует протеолитическое расщепление. Мы предположили, что наиболее значимыми клеточными протеазами в этом процессе являются протеазы, тесно связанные с рецепторами клетки-хозяина. Первичным рецептором CoV тяжелого острого респираторного синдрома человека (SARS) CoV является ангиотензин-превращающий фермент 2 (ACE2). Иммунопреципитация ACE2 захватила трансмембранную протеазу / член подсемейства серина 2 (TMPRSS2), известную протеазу дыхательных путей человека и альвеолярную протеазу.ACE2 и TMPRSS2 совместно локализовались на поверхности клеток и усиливали проникновение в клетки как SARS S-псевдотипа ВИЧ, так и аутентичного SARS-CoV. Повышенный вход коррелировал с TMPRSS2-опосредованным протеолизом как S, так и ACE2. Эти результаты показывают, что комплекс клеточной поверхности, состоящий из первичного рецептора и отдельной эндопротеазы, действует как портал для активации входа в клетки SARS-CoV.
Вирусы выходят из инфицированных клеток с энергией, необходимой для проникновения в новые клетки-хозяева. Когда вирусы сталкиваются с новыми клетками-хозяевами, энергия, запасенная в метастабильных поверхностных белках вируса, рассеивается за счет рефолдинга белков и используется для открытия вирусов и обеспечения доступа вирусных геномов к клетке.Это преобразование от высокоэнергетических метастабильных к низкоэнергетическим конечным стадиям пространственно и временно регулируется множеством триггеров, которые включены в поверхностные белки. В зависимости от вируса, одно или комбинация связывания с клеточным рецептором, протонирования в эндосоме, восстановления дисульфидов и протеолитического расщепления запускает рефолдинг и раскрытие вирусного белка. Понимание этих активирующих состояний расширило наше понимание взаимодействий вирус-хозяин и выявило новые подходы к противовирусной терапии.
Когда вирусы сталкиваются с новыми клетками-хозяевами, энергия, запасенная в метастабильных поверхностных белках вируса, рассеивается за счет рефолдинга белков и используется для открытия вирусов и обеспечения доступа вирусных геномов к клетке.Это преобразование от высокоэнергетических метастабильных к низкоэнергетическим конечным стадиям пространственно и временно регулируется множеством триггеров, которые включены в поверхностные белки. В зависимости от вируса, одно или комбинация связывания с клеточным рецептором, протонирования в эндосоме, восстановления дисульфидов и протеолитического расщепления запускает рефолдинг и раскрытие вирусного белка. Понимание этих активирующих состояний расширило наше понимание взаимодействий вирус-хозяин и выявило новые подходы к противовирусной терапии.
Эти активирующие события проникновения вируса могут быть дополнительно проанализированы с помощью исследований с человеческими CoV (HCoV). HCoV являются заметными патогенами (27, 48), один из которых вызывает тяжелый острый респираторный синдром (SARS) (12, 24). Эволюция CoV в их выступающих поверхностных или шиповых (S) белках может изменять условия активации вируса и допускать зоонозы (30, 40) и изменения вирулентности. Таким образом, выяснение активации S-белка является центральным для понимания тропизма, экологии и патогенеза HCoV.
Эволюция CoV в их выступающих поверхностных или шиповых (S) белках может изменять условия активации вируса и допускать зоонозы (30, 40) и изменения вирулентности. Таким образом, выяснение активации S-белка является центральным для понимания тропизма, экологии и патогенеза HCoV.
Белки S включают домены связывания рецепторов клетки (RBD) и домены слияния вирус-клеточная мембрана. Как и другие слитые белки вируса I класса, шипы HCoV требуют активации протеолитического прайминга (7). Примечательно, что большинство патогенных HCoV выходят из клеток-продуцентов с непраймированными S-белками (2, 34) и, таким образом, полагаются на протеазы клеток-мишеней для активации. Следовательно, факторы входа в клетки HCoV на клетках-мишенях включают связывающие вирус агенты (клеточные рецепторы), а также агенты, расщепляющие вирусные белки (клеточные протеазы).
SARS-CoV связывается со своим рецептором эктопептидазы, ангиотензинпревращающим ферментом 2 (ACE2), с очень высоким сродством (44).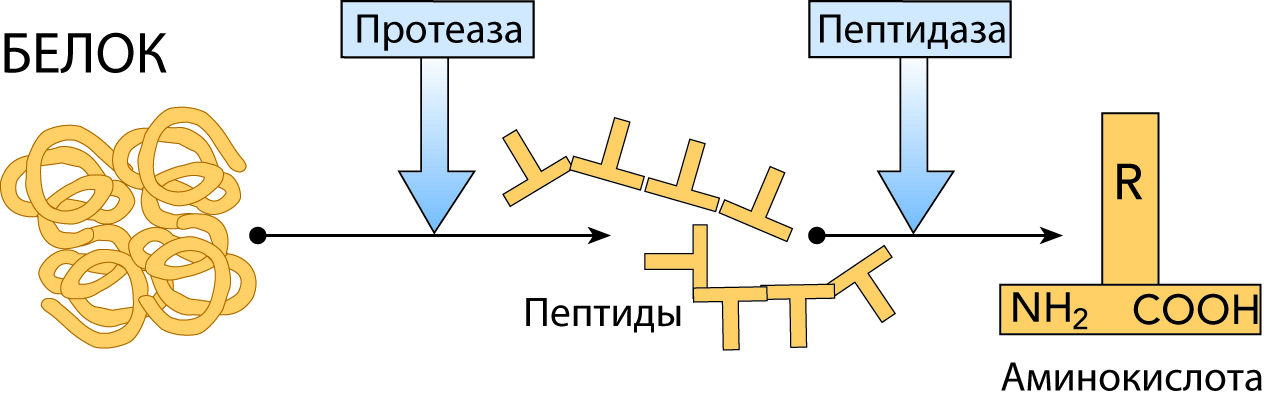 ACE2 без эктопептидазной активности также является эффективным рецептором SARS-CoV (30), а S-белки связываются далеко от ферментного кармана ACE2 (28), что дает понять, что ACE2 не является прямой S-активирующей протеазой. Однако существует несколько протеаз, которые могут действовать как кофакторы входа SARS-CoV, включая катепсин L, эластазу, трипсин, фактор Ха, термолизин и плазмин (13, 31, 42).В основном это растворимые протеазы, и неясно, как они могут удерживаться в непосредственной близости от рецепторов ACE2. Этот вопрос о субклеточном расположении протеазы и времени действия фермента актуален, потому что активация эндопротеолитического расщепления S-белка происходит только после вовлечения ACE2. Действительно, без предварительного связывания ACE2 эти растворимые протеазы чрезмерно расщепляют и инактивируют шипы вируса (31, 42). Учитывая, что продуктивная последовательность заключается в том, что S-белки связывают ACE2, а затем подвергаются активирующему протеолизу, разумно подозревать, что соответствующие протеазы, активирующие проникновение SARS-CoV, могут быть закреплены в плазматической мембране и соседствуют с рецепторами ACE2.
ACE2 без эктопептидазной активности также является эффективным рецептором SARS-CoV (30), а S-белки связываются далеко от ферментного кармана ACE2 (28), что дает понять, что ACE2 не является прямой S-активирующей протеазой. Однако существует несколько протеаз, которые могут действовать как кофакторы входа SARS-CoV, включая катепсин L, эластазу, трипсин, фактор Ха, термолизин и плазмин (13, 31, 42).В основном это растворимые протеазы, и неясно, как они могут удерживаться в непосредственной близости от рецепторов ACE2. Этот вопрос о субклеточном расположении протеазы и времени действия фермента актуален, потому что активация эндопротеолитического расщепления S-белка происходит только после вовлечения ACE2. Действительно, без предварительного связывания ACE2 эти растворимые протеазы чрезмерно расщепляют и инактивируют шипы вируса (31, 42). Учитывая, что продуктивная последовательность заключается в том, что S-белки связывают ACE2, а затем подвергаются активирующему протеолизу, разумно подозревать, что соответствующие протеазы, активирующие проникновение SARS-CoV, могут быть закреплены в плазматической мембране и соседствуют с рецепторами ACE2.
Среди кандидатов на роль заякоренных в мембране вирус-активирующих протеаз входят t ype II t ransmembrane s erine p roteases (TTSP), семейство сериновых протеаз, физиологические функции которых только начинают различаться. (9). TTSP экспрессируются на поверхности эпителиальных клеток дыхательных путей (11, 21, 49) и, таким образом, потенциально могут быть расположены соответствующим образом на стыках вирус-клетка. Важно отметить, что известно, что TTSP активируют проникновение некоторых респираторных вирусов, включая как сезонные, так и патогенные вирусы гриппа человека и метапневмовирусы человека (8, 10, 41).
Недавнее сообщение выявило участие конкретного TTSP, обозначенного как член подсемейства трансмембранных протеаз / серинов 11a (TMPRSS11a), в протеолизе белков SARS-CoV S (21). Этот ценный вклад стимулировал наш интерес к кофакторам входа в клетки и вызвал вопросы, касающиеся трансмембранных протеаз, их предпочтений в отношении субстратов и их потенциальной локализации с первичными рецепторами ACE2. Обсуждая эти вопросы, мы сделали открытия, которые касаются SARS-CoV и, возможно, других событий проникновения вирусов.
Обсуждая эти вопросы, мы сделали открытия, которые касаются SARS-CoV и, возможно, других событий проникновения вирусов.
МАТЕРИАЛЫ И МЕТОДЫ
Клетки. Клетки 293T и hACE2-293, которые были получены из Shibo Jiang, New York Blood Center, выращивали в модифицированной Дульбекко среде Игла (DMEM), содержащей 10% инактивированной нагреванием фетальной телячьей сыворотки (FBS). . Все питательные среды были забуферены 0,01 М натрием HEPES (pH 7,4).
Плазмидная ДНК. КДНК TMPRSS2, содержащая C-концевую метку эпитопа FLAG, амплифицировали с помощью ПЦР с использованием матрицы pCMV-Sport6-TMPRSS2 (Open Biosystems) и следующих праймеров: прямой, 5′-GGAGAGCTCCACCATGGCTTTGAACTCAGGGTC-3 ‘; обратный, 5’-CGACTCGAGCTACTTGTCATCGTCATCCTTGTAGTCTCCGCCGTCTGCCCTCAT-3 ‘.Впоследствии кДНК TMPRSS2 была клонирована в pCAGGS.MCS (35) между сайтами рестрикции SacI и XhoI. КДНК TMPRSS11a, содержащая C-концевую метку эпитопа FLAG, была амплифицирована с помощью ПЦР с использованием матрицы pCR-BluntII-TOPO-TMPRSS11a (Open Biosystems) и следующих праймеров: прямой, 5’-GGAGAATTCCACCATGATGTATCGGACAGTAGG-3 ‘; обратный, 5’-CGACCCGGGCTACTTGTCATCGTCATCCTTGTAGTCTCCGATGCCTGTTTTTGAAG -3 ‘. КДНК TMPRSS11d, содержащая С-концевую метку эпитопа FLAG, была амплифицирована с помощью ПЦР с использованием матрицы pCR-BluntII-TOPO-TMPRSS11d (Open Biosystems) и следующих праймеров: прямой, 5′-GGAGAATTCCACCATGTATAGGCCAGCACG-3 ‘; обратный, 5’-CGACCCGGGCTACTTGTCATCGTCATCCTTGTAGTCTCCGATCCCAGTTTGT TGC-3 ‘.Затем кДНК TMPRSS11a и TMPRSS11d были клонированы в pCAGGS.MCS между сайтами рестрикции EcoRI и XmaI. Каталитически неактивный мутант pCAGGS-TMPRSS2 (S441A) FLAG был получен из pCAGGS-TMPRSS2 FLAG с использованием мутагенных праймеров и протокола сайт-направленного мутагенеза. (QuikChange XL, номер в каталоге 200519-5; Stratagene). Плазмиды pcDNA3.1 SARS S и pcDNA3.1 ACE C9 были получены от Майкла Фарзана, Гарвардская медицинская школа, Бостон, Массачусетс. Плазмида pCDM8-NL63 S была получена от Hyeryun Choe, Гарвардская медицинская школа, Бостон, Массачусетс.pcDNA 3.1 Гликопротеин вируса Эбола Заир (Ebo GP) и pHEF-VSV G (гликопротеин вируса везикулярного стоматита [VSV G]) были получены от Lijun Rong, Университет штата Иллинойс, Чикаго.
КДНК TMPRSS11d, содержащая С-концевую метку эпитопа FLAG, была амплифицирована с помощью ПЦР с использованием матрицы pCR-BluntII-TOPO-TMPRSS11d (Open Biosystems) и следующих праймеров: прямой, 5′-GGAGAATTCCACCATGTATAGGCCAGCACG-3 ‘; обратный, 5’-CGACCCGGGCTACTTGTCATCGTCATCCTTGTAGTCTCCGATCCCAGTTTGT TGC-3 ‘.Затем кДНК TMPRSS11a и TMPRSS11d были клонированы в pCAGGS.MCS между сайтами рестрикции EcoRI и XmaI. Каталитически неактивный мутант pCAGGS-TMPRSS2 (S441A) FLAG был получен из pCAGGS-TMPRSS2 FLAG с использованием мутагенных праймеров и протокола сайт-направленного мутагенеза. (QuikChange XL, номер в каталоге 200519-5; Stratagene). Плазмиды pcDNA3.1 SARS S и pcDNA3.1 ACE C9 были получены от Майкла Фарзана, Гарвардская медицинская школа, Бостон, Массачусетс. Плазмида pCDM8-NL63 S была получена от Hyeryun Choe, Гарвардская медицинская школа, Бостон, Массачусетс.pcDNA 3.1 Гликопротеин вируса Эбола Заир (Ebo GP) и pHEF-VSV G (гликопротеин вируса везикулярного стоматита [VSV G]) были получены от Lijun Rong, Университет штата Иллинойс, Чикаго. pNL4.3-Luc R — E — был получен из NIH AIDS Research and Reference Program 3418. Плазмида pRL-TK, кодирующая люциферазу Renilla , была приобретена у Promega. Плазмиды pCAGT7 и pT7EMC-Luc (36) были получены от Ричарда Лонгнекера, Школа медицины Файнберга Северо-Западного университета, Чикаго, Иллинойс.
pNL4.3-Luc R — E — был получен из NIH AIDS Research and Reference Program 3418. Плазмида pRL-TK, кодирующая люциферазу Renilla , была приобретена у Promega. Плазмиды pCAGT7 и pT7EMC-Luc (36) были получены от Ричарда Лонгнекера, Школа медицины Файнберга Северо-Западного университета, Чикаго, Иллинойс.
Анализ слияния клеток с клетками. Слияние клеток с клетками выполняли, как описано ранее (32). Вкратце, эффекторные (293Т) клетки временно трансфицировали pCAG-T7 pol и pcDNA3.1-SARS S через фосфат кальция. Клетки-мишени были получены котрансфекцией клеток 293Т с pT7EMC-luc, которая кодирует люциферазу светлячка под контролем промотора Т7; pcDNA3.1-ACE2 C9 ; и pCAGGS-TMPRSS2 FLAG . Примерно через 24 часа после трансфекции (hptf) клетки-мишени быстро обрабатывали трипсином и добавляли к прикрепленным эффекторным клеткам в соотношении 1: 1 эффекторные клетки-мишени.После ~ 3-часового периода сокультивирования активность люциферазы определяли, как описано выше.
Псевдотипированные вирионы и трансдукции. Для создания псевдотипированных частиц ВИЧ клетки 293T котрансфицировали через фосфат кальция с pNL4.3-Luc и различными конструкциями оболочки. Через 2 дня среды собирали, осветляли в течение 10 минут при 2000 × г и затем хранили при -20 ° C. Для трансдукции частицы ВИЧ концентрировали в клетки 293Т путем центрифугирования при 1600 × g в течение 2 часов при 25 ° C, процесс, известный как спинокуляция.Впоследствии инокулят удаляли и заменяли DMEM-10% FBS. Через 2 дня после трансдукции клетки промывали физиологическим раствором и растворяли в буфере для лизиса люциферазы (Promega E397A). Люминесценцию измеряли при добавлении субстрата люциферазы (Promega E1501) с использованием люминометра для микропланшетов Veritas (Turner BioSystems).
Медикаментозная обработка во время трансдукции. Целевые клетки 293T, посеянные в шестилуночные планшеты, котрансфицировали pcDNA3.1-ACE2 C9 и pRL-TK вместе с pCAGGS-TMPRSS2 FLAG или pCAGGS. MCS через фосфат кальция. Через 2 дня после трансфекции клетки инкубировали с бафиломицином A1 (Sigma) при 300 нМ или NH 4 Cl (Sigma) при 25 мМ в полной среде DMEM в течение 1 часа при 37 ° C. Параллельные культуры инкубировали в диметилсульфоксиде (ДМСО) и воде, контрольных носителях для исходного бафиломицина A1 и NH 4 Cl соответственно. После 1-часовой инкубации частицы HIV-SARS S в DMEM-10% FBS спинокулировали на клетки-мишени в присутствии эндосомотропных агентов. После спинокуляции клетки инкубировали при 37 ° C в течение еще 27 ч до лизиса и оценки накоплений люциферазы Renilla и светлячка (E1910; Promega).
MCS через фосфат кальция. Через 2 дня после трансфекции клетки инкубировали с бафиломицином A1 (Sigma) при 300 нМ или NH 4 Cl (Sigma) при 25 мМ в полной среде DMEM в течение 1 часа при 37 ° C. Параллельные культуры инкубировали в диметилсульфоксиде (ДМСО) и воде, контрольных носителях для исходного бафиломицина A1 и NH 4 Cl соответственно. После 1-часовой инкубации частицы HIV-SARS S в DMEM-10% FBS спинокулировали на клетки-мишени в присутствии эндосомотропных агентов. После спинокуляции клетки инкубировали при 37 ° C в течение еще 27 ч до лизиса и оценки накоплений люциферазы Renilla и светлячка (E1910; Promega).
Иммунофлуоресцентная микроскопия. Клетки 293T, посеянные на покровные стекла, покрытые фибронектином, котрансфицировали через полиэтиленимин с постоянным количеством pcDNA3.1-ACE2 C9 и различными дозами pCAGGS-TMPRSS2 FLAG . При 24 час / сутки клетки фиксировали 3,7% формальдегидом (Polysciences) в 0,1 М пиперазин- N , N ‘-бис (2-этансульфоновая кислота) (PIPES, pH 6,8). После блокирования 10% ослиной сывороткой покровные стекла инкубировали с первичными антителами в фосфатно-солевом буфере (PBS), содержащем ослиную сыворотку.ACE2 на клеточной поверхности детектировали с использованием SARS-RBD Fc , тогда как TMPRSS2 детектировали с использованием кроличьих антител против FLAG (каталожный номер Sigma F1804). Белок SARS-RBD Fc содержал 15-аминокислотную сигнальную последовательность CD5 и остатки 318–510 шипа SARS в модифицированном векторе pCEP4. Белок SARS-RBD Fc продуцировали в клетках 293-EBNA, собирали в бессывороточной среде и очищали с использованием гранул протеина A-сефарозы (GE Healthcare). После тщательной промывки в PBS покровные стекла инкубировали с козьим вторичным антителом против человека, конъюгированным с AlexaFluor488 (молекулярные зонды), и с козьим вторичным антителом против мыши, конъюгированным с Cy5 (Jackson Immunoresearch).Ядра визуализировали с помощью красителя 4 ‘, 6-диамидино-2-фенилиндола (DAPI) (Invitrogen).
После блокирования 10% ослиной сывороткой покровные стекла инкубировали с первичными антителами в фосфатно-солевом буфере (PBS), содержащем ослиную сыворотку.ACE2 на клеточной поверхности детектировали с использованием SARS-RBD Fc , тогда как TMPRSS2 детектировали с использованием кроличьих антител против FLAG (каталожный номер Sigma F1804). Белок SARS-RBD Fc содержал 15-аминокислотную сигнальную последовательность CD5 и остатки 318–510 шипа SARS в модифицированном векторе pCEP4. Белок SARS-RBD Fc продуцировали в клетках 293-EBNA, собирали в бессывороточной среде и очищали с использованием гранул протеина A-сефарозы (GE Healthcare). После тщательной промывки в PBS покровные стекла инкубировали с козьим вторичным антителом против человека, конъюгированным с AlexaFluor488 (молекулярные зонды), и с козьим вторичным антителом против мыши, конъюгированным с Cy5 (Jackson Immunoresearch).Ядра визуализировали с помощью красителя 4 ‘, 6-диамидино-2-фенилиндола (DAPI) (Invitrogen). Покровные стекла помещали на предметные стекла с помощью флуоро-геля (EMS) и визуализировали с помощью микроскопа деконволюции Deltavision.
Покровные стекла помещали на предметные стекла с помощью флуоро-геля (EMS) и визуализировали с помощью микроскопа деконволюции Deltavision.
Иммунопреципитация (IP) и иммуноблоттинг (IB). Клетки 293T котрансфицировали через фосфат кальция с pcDNA3.1-ACE2, пустым вектором pcDNA3.1, пустым вектором pCAGGS, pCAGGS-TMPRSS2 TMPRSS2 (FLAG и pCAGGS2 ( S441A) FLAG в указанных комбинациях. При 35 hptf монослои клеток лизировали в буфере HNB (25 мМ Na HEPES, 150 мМ NaCl, 0.01% бычий сывороточный альбумин), содержащий 0,5% NP-40, 0,5% дезоксихолата натрия (DOC) и 0,1% ингибитора протеазы (Sigma P2714). Лизаты клеток сначала осветляли центрифугированием при 2000 × g в течение 5 минут, а затем 150000 клеточных эквивалентов смешивали с 0,9 мкг антитела против FLAG (каталожный номер Sigma F7425), 0,9 мкг антитела 1D4 или 0,9 мкг мышиного IgG и 0,06 мл магнитных шариков с протеином G (NEB Corporation, Inc.) в течение 14 ч при 4 ° C. Гранулы промывали трижды буфером HNB, содержащим 0,5% NP-40 и 0. 5% ДОК. Белки элюировали с шариков добавлением буфера для образцов для электрофореза (0,125 М Трис [pH 6,8], 10% дитиотреитола, 2% додецилсульфата натрия [SDS], 10% сахарозы, 0,004% бромфенолового синего), нагревали при 95 ° C в течение 5 дней. мин, а затем подвергали электрофорезу в SDS-полиакриламидном геле (SDS-PAGE). SDS-гели переносили на поливинилидендифторидные мембраны, которые затем блокировали в течение 1 часа 5% обезжиренным сухим молоком в TBS-T (25 мМ Tris-HCl [pH 7,5], 140 мМ NaCl, 2,7 мМ KCl, 0.05% Твин 20). Белки ACE2 C9 были обнаружены с помощью разведения 1: 5000 антитела 1D4 (полученного от Hyeryun Choe, Гарвардская медицинская школа, Бостон, Массачусетс). Белки TMPRSS2 FLAG и TMPRSS2-S441A FLAG были обнаружены с помощью кроличьих антител против FLAG (1: 1000 в TBS-T).
5% ДОК. Белки элюировали с шариков добавлением буфера для образцов для электрофореза (0,125 М Трис [pH 6,8], 10% дитиотреитола, 2% додецилсульфата натрия [SDS], 10% сахарозы, 0,004% бромфенолового синего), нагревали при 95 ° C в течение 5 дней. мин, а затем подвергали электрофорезу в SDS-полиакриламидном геле (SDS-PAGE). SDS-гели переносили на поливинилидендифторидные мембраны, которые затем блокировали в течение 1 часа 5% обезжиренным сухим молоком в TBS-T (25 мМ Tris-HCl [pH 7,5], 140 мМ NaCl, 2,7 мМ KCl, 0.05% Твин 20). Белки ACE2 C9 были обнаружены с помощью разведения 1: 5000 антитела 1D4 (полученного от Hyeryun Choe, Гарвардская медицинская школа, Бостон, Массачусетс). Белки TMPRSS2 FLAG и TMPRSS2-S441A FLAG были обнаружены с помощью кроличьих антител против FLAG (1: 1000 в TBS-T).
Инфекции SARS-CoV. Для аутентичных вирусных инфекций SARS клетки 293T трансфицировали в двух экземплярах через фосфат кальция с pcDNA3.1-ACE2 C9 и каждой из указанных плазмид pCAGGS-TTSP FLAG . При 20 hptf клетки инфицировали HCoV-SARS (Urbani) при множественности инфицирования (MOI) 0,1. Затем, через 6 часов после инфицирования (hpi), один набор инфицированных образцов растворяли в Trizol (Invitrogen) и собирали общую клеточную РНК. РНК, специфичные для гена SARS CoV N и глицеральдегид-3-фосфатдегидрогеназы (GAPDH) человека, были количественно определены с помощью ПЦР в реальном времени с использованием термоциклера ABI Prism7700 и программного обеспечения. Были использованы следующие праймеры: для мРНК нуклеокапсида (N) SARS-CoV, прямой праймер 5′-ATATTAGGTTTTTACCCAGG-3 ‘и обратный праймер 5′-CTTGCCCCATTGCGTCCTCC-3′; для гена GAPDH человека — прямой праймер 5’-CCACTCCTCCACCTTTGAC-3 ‘и обратный праймер 5′-ACCCTGTTGCTGTAGCCA-3’.Уровни ампликонов гена SARS N были нормализованы к уровням ампликонов GAPDH.
При 20 hptf клетки инфицировали HCoV-SARS (Urbani) при множественности инфицирования (MOI) 0,1. Затем, через 6 часов после инфицирования (hpi), один набор инфицированных образцов растворяли в Trizol (Invitrogen) и собирали общую клеточную РНК. РНК, специфичные для гена SARS CoV N и глицеральдегид-3-фосфатдегидрогеназы (GAPDH) человека, были количественно определены с помощью ПЦР в реальном времени с использованием термоциклера ABI Prism7700 и программного обеспечения. Были использованы следующие праймеры: для мРНК нуклеокапсида (N) SARS-CoV, прямой праймер 5′-ATATTAGGTTTTTACCCAGG-3 ‘и обратный праймер 5′-CTTGCCCCATTGCGTCCTCC-3′; для гена GAPDH человека — прямой праймер 5’-CCACTCCTCCACCTTTGAC-3 ‘и обратный праймер 5′-ACCCTGTTGCTGTAGCCA-3’.Уровни ампликонов гена SARS N были нормализованы к уровням ампликонов GAPDH.
Другой набор инфицированных клеточных культур собирали при 24 hpi, и лизаты белков в буфере для образцов для электрофореза оценивали вестерн-блоттингом на SARS N с использованием кроличьих антител против SARS N (Imgenex IMG-549), на SARS S с использованием анти- Антитело SARS S (Imgenex IMG-541) и против β-актина с использованием мышиных антител против β-актина (Sigma). Вся работа с инфекционным SARS-CoV проводилась в лаборатории уровня биобезопасности 3 Университета Айовы.
Вся работа с инфекционным SARS-CoV проводилась в лаборатории уровня биобезопасности 3 Университета Айовы.
РЕЗУЛЬТАТЫ
Влияние TTSP на трансдукцию псевдовирусов. Для исследования были выбраны три из 17 известных человеческих TTSP, TMPRSS2, TMPRSS11a и TMPRSS11d (также известный как трипсин дыхательных путей человека или HAT), поскольку они экспрессируются в легких человека и являются известно об активации проникновения в клетки выбранных штаммов вируса гриппа (8, 10). При трансфекции трех кДНК TTSP, меченных FLAG, в клетки 293T, все синтезировали меченные FLAG белки с ожидаемой молекулярной массой (рис. 1A). TTSP синтезируются как неактивные одноцепочечные проферменты (зимогены) и подвергаются саморасщеплению на активные формы во время или после транспорта на клеточную поверхность (1, 33).Связанные с клеткой C-концевые фрагменты расщепления наблюдались для TMPRSS11a и TMPRSS2, но не для TMPRSS11d, возможно, потому что член TMPRSS11d сбрасывает свой периферический ферментативный домен во внеклеточную среду (49).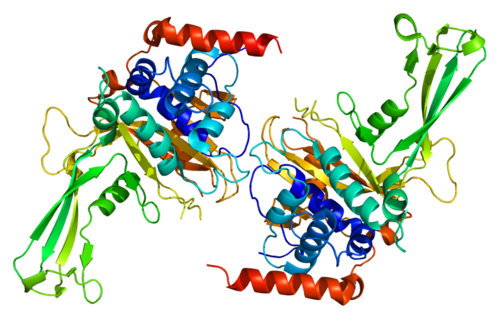 Чтобы подтвердить, что расщепленные формы одного TTSP, TMPRSS2, действительно были созданы в результате автокаталитической активности, мы создали неактивный мутант, несущий замену серина на аланин в положении 441 (S441A) (1). Как и ожидалось, мутант TMPRSS2 S441A присутствовал только в виде полноразмерной формы зимогена ∼70 кДа (рис.1А).
Чтобы подтвердить, что расщепленные формы одного TTSP, TMPRSS2, действительно были созданы в результате автокаталитической активности, мы создали неактивный мутант, несущий замену серина на аланин в положении 441 (S441A) (1). Как и ожидалось, мутант TMPRSS2 S441A присутствовал только в виде полноразмерной формы зимогена ∼70 кДа (рис.1А).
TTSP и влияние на проникновение ВИЧ-SARS S. (A) Клетки 293T (10 6 ) трансфицировали 1 мкг образцами плазмид, кодирующих указанные конструкции TTSP с меткой FLAG. Клетки лизировали через 2 дня после трансфекции, и белки из аликвот 5 × 10 4- клеток оценивали с помощью IB с антителами против FLAG. Звездочка обозначает неспецифическую полосу 34 кДа. Значения слева — это размеры молекул в килодальтонах. (B) Клетки 293T (10 6 ) трансфицировали ACE2 (1 мкг) вместе с указанными количествами плазмид TTSP.Через 2 дня после трансфекции клетки инокулировали ВИЧ-SARS S, а через 27 часов оценивали накопление люциферазы. Пунктирная линия представляет уровень трансдукции в клетках-мишенях, трансфицированных ACE2 и пустым вектором. (C) Клетки 293T, котрансфицированные равными количествами либо ACE2 плюс пустой вектор (белые столбцы), либо ACE2 плюс TMPRSS2 (заштрихованные столбцы), инокулировали ВИЧ-VSVG, -Ebo GP или -SARS S псевдовирусом через 2 дня после трансфекции. Накопление люциферазы оценивали через 27 часов.Планки погрешностей на панелях B и C представляют собой стандартные отклонения ( n = 3). Эксперименты были повторены трижды с аналогичными результатами. FL, люцифераза светлячков.
Пунктирная линия представляет уровень трансдукции в клетках-мишенях, трансфицированных ACE2 и пустым вектором. (C) Клетки 293T, котрансфицированные равными количествами либо ACE2 плюс пустой вектор (белые столбцы), либо ACE2 плюс TMPRSS2 (заштрихованные столбцы), инокулировали ВИЧ-VSVG, -Ebo GP или -SARS S псевдовирусом через 2 дня после трансфекции. Накопление люциферазы оценивали через 27 часов.Планки погрешностей на панелях B и C представляют собой стандартные отклонения ( n = 3). Эксперименты были повторены трижды с аналогичными результатами. FL, люцифераза светлячков.
Чтобы выявить влияние TTSP на проникновение HCoV, мы котрансфицировали клетки 293T постоянными количествами плазмиды ACE2 C9 вместе с различными дозами различных плазмидных ДНК TTSP FLAG . Через 2 дня эти клетки трансдуцировались псевдовирусами ВИЧ-SARS S, что измерялось по накоплению продукта репортерного гена люциферазы, который кодируется в векторе трансдукции ВИЧ.Мы выбрали клетки 293T в качестве мишеней, потому что они поддерживают ранние события ВИЧ-инфекции и потому, что они не экспрессируют эндогенные TMPRSS2 или TMPRSS4 (1, 5, 10).
Все три TTSP усиливали проникновение псевдовирусов, опосредованных SARS S. Эффекты увеличения варьировались следующим образом: TMPRSS2> TMPRSS11d> TMPRSS11a (рис. 1B). Пиковые эффекты TMPRSS2 и TMPRSS11d наблюдались после трансфекции 0,2 мкг ДНК, а затем снижались при более высокой дозе ДНК 1 мкг; предположительно это было связано с токсичностью, вызванной сверхэкспрессией TTSP.На трансдукцию ВИЧ, опосредованную спайками VSV G и Ebo GP, не влияло присутствие TMPRSS2 (рис. 1C), что указывает на то, что этот конкретный TTSP проявляет ограниченные S-специфические усиливающие эффекты.
TMPRSS2 функционирует на поверхности клетки. Мы сосредоточили внимание на наиболее мощном TTSP, TMPRSS2, и определили, активирует ли эта протеаза SARS S для локализованного слияния на плазматической мембране, используя анализ слияния клеток. Вкратце, эффекторные клетки 293T котрансфицировали плазмидами, кодирующими РНК-полимеразу SARS S и T7, тогда как клетки-мишени 293T котрансфицировали плазмидами, кодирующими ACE2, TMPRSS2, и репортер люциферазы под контролем промотора РНК-полимеразы T7 (см.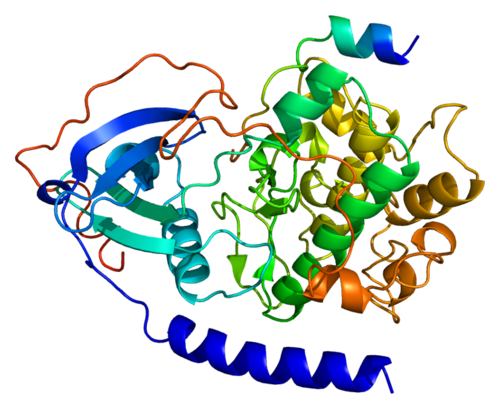 рис.2А). После 3-часового совместного культивирования эффекторных клеток и клеток-мишеней слияния клеток с клетками, четко различимые как микроскопические синцитии из 10-20 клеток, были подтверждены анализами люциферазы, которые указали на увеличение слияния мембран в 10 раз (рис. 2Б). Опосредованное белком NL63 S слияние мембран HCoV также усиливалось TMPRSS2, хотя и менее эффективно, чем SARS-CoV S (рис. 2B). Эти данные подтвердили, что протеаза TMPRSS2 может оказывать стимулирующее слияние эффекты на два несколько отдаленно родственных белка S HCoV и что эти эффекты могут иметь место на поверхности клеток.
рис.2А). После 3-часового совместного культивирования эффекторных клеток и клеток-мишеней слияния клеток с клетками, четко различимые как микроскопические синцитии из 10-20 клеток, были подтверждены анализами люциферазы, которые указали на увеличение слияния мембран в 10 раз (рис. 2Б). Опосредованное белком NL63 S слияние мембран HCoV также усиливалось TMPRSS2, хотя и менее эффективно, чем SARS-CoV S (рис. 2B). Эти данные подтвердили, что протеаза TMPRSS2 может оказывать стимулирующее слияние эффекты на два несколько отдаленно родственных белка S HCoV и что эти эффекты могут иметь место на поверхности клеток.
Влияние TMPRSS2 на слияние мембран, опосредованное SARS S. (A) Схематическая диаграмма слияния клеток. Эффекторные клетки 293T получали котрансфекцией плазмид, кодирующих указанные спайковые конструкции, вдоль pCAG-T7pol (1 мкг ДНК на 10 6 клеток). Клетки-мишени 293T получали котрансфекцией pcDNA3.1-ACE2 плюс пустой вектор pCAGGS (-) или pcDNA3.1-ACE2 плюс pCAGGS-TMPRSS2 (+) вместе с pEMC-T7pro-luc. (B) Показания люциферазы через 3 часа после совместного культивирования эффекторных клеток и клеток-мишеней (соотношение 1: 1) представлены как n -кратные изменения слияния по сравнению с отрицательными контролями без S-белков.
(B) Показания люциферазы через 3 часа после совместного культивирования эффекторных клеток и клеток-мишеней (соотношение 1: 1) представлены как n -кратные изменения слияния по сравнению с отрицательными контролями без S-белков.
Эндосомный катепсин L — известная S-активирующая протеаза (6, 42). Чтобы определить, может ли TMPRSS2 на поверхности клетки-мишени свести на нет любые требования для этой и связанных с ней кислотных pH-зависимых протеаз во время проникновения SARS S-опосредованного вируса, эндосомный H + / ингибитор АТФазы бафиломицин A1 или эндосомотропное слабое основание NH 4 Cl применяли к клеткам-мишеням непосредственно перед и во время инокуляции ВИЧ-SARS S. Эти ингибиторы эндосомального закисления сильно подавляли S-опосредованные трансдукции (рис.3), с 2- и 3-log 10 восстановлением NH 4 Cl и бафиломицином A1 соответственно. Подавления были устранены с помощью TMPRSS2 (рис. 3), что указывает на то, что TMPRSS2 полностью активирует SARS S-опосредованное проникновение (~ 1000 раз), когда кислотная pH-зависимая протеаза (ы) отсутствует. Таким образом, результаты на рис. 3 показывают неизбирательную природу функций входа SARS S, когда в качестве катализатора входа действует либо сериновая протеаза TMPR с нейтральным pH клеточной поверхности, либо эндосомальная цистеиновая протеаза, требующая кислотного pH (вероятно, катепсин).
Таким образом, результаты на рис. 3 показывают неизбирательную природу функций входа SARS S, когда в качестве катализатора входа действует либо сериновая протеаза TMPR с нейтральным pH клеточной поверхности, либо эндосомальная цистеиновая протеаза, требующая кислотного pH (вероятно, катепсин).
Влияние TMPRSS2 на проникновение ВИЧ-SARS S в клетки, обработанные лекарством. Клетки 293T котрансфицировали (1 мкг на 10 6 клеток) ACE2 плюс пустой вектор (белые столбцы) или ACE2 плюс TMPRSS2 (заштрихованные столбцы). Через день и за 1 час до трансдукции псевдовирусами ВИЧ-SARS S клетки инкубировали с бафиломицином A1 (300 нМ) или NH 4 Cl (25 мМ). Контрольными носителями были ДМСО и вода для бафиломицина А1 и NH 4 Cl соответственно. Затем частицы HIV-SARS S концентрировали на клетках путем 2-часового спинокуляции.Бафиломицин и NH 4 Cl оставались на клетках во время и после спинокуляции до 6 ч после трансдукции, после чего клетки промывали и заполняли свежей средой. Накопление люциферазы определяли через 28 ч после трансдукции. Планки погрешностей представляют собой стандартные отклонения ( n = 3). Эксперимент повторили трижды с аналогичными результатами. FL, люцифераза светлячков.
Накопление люциферазы определяли через 28 ч после трансдукции. Планки погрешностей представляют собой стандартные отклонения ( n = 3). Эксперимент повторили трижды с аналогичными результатами. FL, люцифераза светлячков.
Расщепление белка SARS S с помощью TMPRSS2. Мы предположили, что белки S будут соответствующими субстратами TTSP для увеличения проникновения вируса.Протеолиз в двух положениях, обозначенных S1-S2 и S2 ‘, необходим для усиления S-опосредованного слияния мембран (4), и в обоих этих сайтах расщепления присутствуют аргинины, которые могут составлять субстраты TTSP (21). Чтобы определить, могут ли входящие S-белки на псевдовирусы специфически расщепляться TMPRSS2, мы генерировали клетки-мишени hACE2-293 с TMPRSS2 FLAG или без него и адсорбировали S-частицы ВИЧ-SARS путем спинокуляции. После стадий промывки клетки и связанные вирусы инкубировали в течение 1 ч при 37 ° C, лизировали, а S-белки визуализировали с помощью IB.Было небольшое, но убедительное свидетельство TMPRSS2-специфического расщепления SARS S, на что указывает присутствие С-концевых S-фрагментов ∼120 и ∼85 кДа (рис. 4). По общему признанию, степень протеолиза была низкой; однако, конечно, можно предположить, что эта очень небольшая часть S-белков, подвергающихся расщеплению, представляет собой активированные S-белки, действующие при проникновении псевдовирусов.
4). По общему признанию, степень протеолиза была низкой; однако, конечно, можно предположить, что эта очень небольшая часть S-белков, подвергающихся расщеплению, представляет собой активированные S-белки, действующие при проникновении псевдовирусов.
Расщепление белков SARS S при проникновении вируса. Псевдовирусы HIV-SARS S спинокулировали на клетки-мишени hACE2-293, трансфицированные двумя днями ранее пустым вектором pCAGGS или pCAGGS-TMPRSS2 (1 мкг на 10 6 клеток в двух экземплярах).После спинокуляции клетки инкубировали при 37 ° C в течение 1 ч, чтобы обеспечить расщепление S-белков TMPRSS2 клеточной поверхности. После удаления несвязанных псевдовирионов и промывки клетки лизировали и оценивали с помощью IB на S-белки с использованием антитела против метки C9. Значения слева — это размеры молекул в килодальтонах.
Расщепление белка ACE2 с помощью TMPRSS2. Открытие того, что белки S были нацелены на TMPRSS2, привело нас к рассмотрению вопроса о том, могут ли интегральные мембранные белки ACE2 также быть субстратами. Таким образом, мы ввели ступенчатые дозы плазмид TTSP, наряду с постоянными количествами pcDNA3.1-ACE2 C9 в клетки 293T и через 2 дня оценивали экспрессированные белки. Поразительным открытием было то, что все три TTSP нацелены на ACE2 для отличительного протеолиза (рис. 5A). В отдельном эксперименте культуры 293T с постепенно увеличивающимися уровнями TMPRSS2 выявили дозы, в конечном итоге устраняющие ACE2 полной длины, оставляя немного меньшую форму ∼115 кДа (возможно, недостаточно гликозилированную) и С-концевой фрагмент ACE2 ∼20 кДа (рис. 5B). ). Примечательно, что эти культуры с неопределяемым полным ACE2 были в ~ 30 раз более восприимчивы к трансдукции ВИЧ-S, чем контрольные (рис.5C), предполагая, что немногие рецепторы могут опосредовать эффективный вход при условии, что соответствующая протеаза находится поблизости, чтобы активировать входящие вирионы. Эти результаты подняли дополнительные вопросы об уровнях и распределении ACE2 и TMPRSS2 на поверхности чувствительных клеток.
Таким образом, мы ввели ступенчатые дозы плазмид TTSP, наряду с постоянными количествами pcDNA3.1-ACE2 C9 в клетки 293T и через 2 дня оценивали экспрессированные белки. Поразительным открытием было то, что все три TTSP нацелены на ACE2 для отличительного протеолиза (рис. 5A). В отдельном эксперименте культуры 293T с постепенно увеличивающимися уровнями TMPRSS2 выявили дозы, в конечном итоге устраняющие ACE2 полной длины, оставляя немного меньшую форму ∼115 кДа (возможно, недостаточно гликозилированную) и С-концевой фрагмент ACE2 ∼20 кДа (рис. 5B). ). Примечательно, что эти культуры с неопределяемым полным ACE2 были в ~ 30 раз более восприимчивы к трансдукции ВИЧ-S, чем контрольные (рис.5C), предполагая, что немногие рецепторы могут опосредовать эффективный вход при условии, что соответствующая протеаза находится поблизости, чтобы активировать входящие вирионы. Эти результаты подняли дополнительные вопросы об уровнях и распределении ACE2 и TMPRSS2 на поверхности чувствительных клеток.
Влияние экспрессии TTSP на трансдукцию ACE2 и HIV-SARS S. (A) Клетки (10 6 ), трансфицированные постоянным 1 мкг ACE2 и возрастающими дозами указанного пустого вектора (EV) TTSPsor pCAGGS, анализировали через 2 дня после трансфекции с помощью IB на наличие эпитопа C9, присоединенного к C-концу ACE2.(B) Клетки, трансфицированные 1 мкг ACE2 , C9 и указанными количествами TMPRSS2, анализировали через 2 дня после трансфекции с помощью антител против C9 и против FLAG tag соответственно. (C) Параллельные нелизированные культуры клеток трансдуцировали псевдовирусами ВИЧ-SARS S, и накопление люциферазы измеряли через 40 часов после трансдукции. FL, люцифераза светлячков. Значения справа от панелей A и B — это размеры молекул в килодальтонах.
Ассоциации ACE2 с TMPRSS2. Мы предположили, что ACE2 и TMPRSS2 взаимодействуют в клеточных экзоцитарных путях и на поверхности клеток и что расщепление ACE2 является результатом этих взаимодействий.Сначала это было оценено с помощью иммунофлуоресцентных анализов.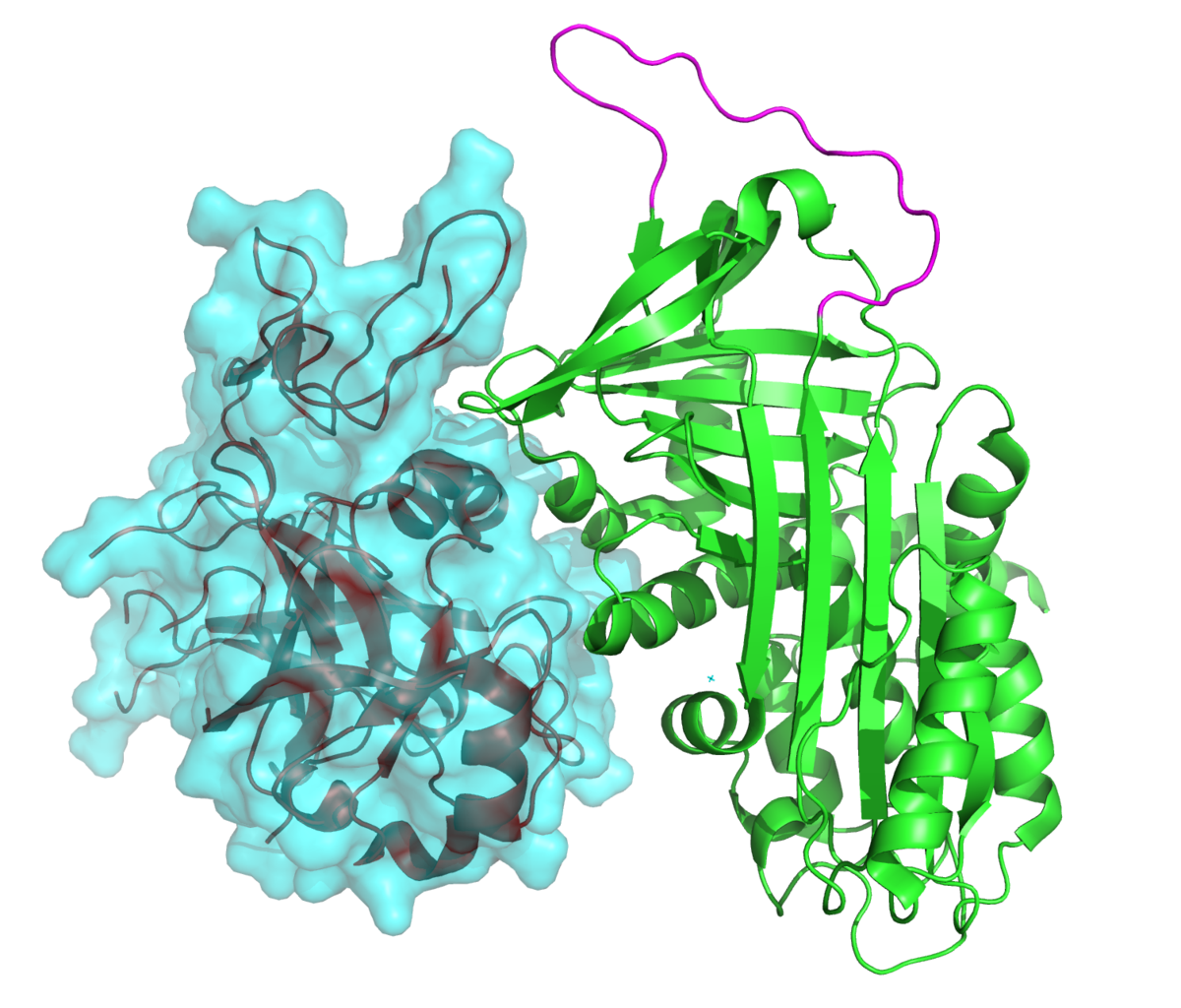 Здесь мы синтезировали ACE2 C9 и TMPRSS2 FLAG в клетках 293T, фиксированные клетки без пермеабилизации, а затем использовали человеческий IgG1 Fc-меченую форму SARS S RBD для обнаружения ACE2 и мышиные антитела против FLAG для обнаружения TMPRSS2. Конфокальные изображения (фиг. 6A) показали, что клетки, экспрессирующие поверхностный TMPRSS2, обычно не имеют ACE2. Таким образом, вероятно, что TMPRSS2 расщепляет ACE2 до того, как он достигнет клеточной поверхности или вскоре после этого.На слайдах клеток, трансфицированных небольшими количествами TMPRSS2 (соотношение плазмид ACE2-TMPRSS2 1: 0,1 и 1: 0,01), редкие клетки были идентифицированы как с ACE2, так и с TMPRSS2 (фиг. 6B). В этих клетках рецептор и протеаза совместно локализовались на плазматической мембране, хотя уровни каждого из них были снижены по сравнению с уровнями в клетках, экспрессирующих только один из белков. Следовательно, большинство клеток, экспрессирующих TMPRSS2, имели неопределяемый ACE2, но когда TMPRSS2 был недостаточным, ACE2 локализовался в областях, содержащих TMPRSS2.
Здесь мы синтезировали ACE2 C9 и TMPRSS2 FLAG в клетках 293T, фиксированные клетки без пермеабилизации, а затем использовали человеческий IgG1 Fc-меченую форму SARS S RBD для обнаружения ACE2 и мышиные антитела против FLAG для обнаружения TMPRSS2. Конфокальные изображения (фиг. 6A) показали, что клетки, экспрессирующие поверхностный TMPRSS2, обычно не имеют ACE2. Таким образом, вероятно, что TMPRSS2 расщепляет ACE2 до того, как он достигнет клеточной поверхности или вскоре после этого.На слайдах клеток, трансфицированных небольшими количествами TMPRSS2 (соотношение плазмид ACE2-TMPRSS2 1: 0,1 и 1: 0,01), редкие клетки были идентифицированы как с ACE2, так и с TMPRSS2 (фиг. 6B). В этих клетках рецептор и протеаза совместно локализовались на плазматической мембране, хотя уровни каждого из них были снижены по сравнению с уровнями в клетках, экспрессирующих только один из белков. Следовательно, большинство клеток, экспрессирующих TMPRSS2, имели неопределяемый ACE2, но когда TMPRSS2 был недостаточным, ACE2 локализовался в областях, содержащих TMPRSS2.
Сотовая локализация TMPRSS2 и ACE2. (A) Клетки котрансфицировали ACE2 и TMPRSS2 при различных соотношениях ACE2-TMPRSS2. При 24 час / час клетки фиксировали без пермеабилизации и инкубировали с анти-FLAG и SARS-RBD Fc . Вторичные антитела против IgG человека (зеленый) и против IgG мыши (красный) использовали для обнаружения связанных антител SARS-RBD , Fc и антител против FLAG, соответственно. Все изображения были получены с использованием идентичного времени получения и уровней отображения. (B) Типичная ячейка ACE2 + TMPRSS2 + из 1: 0.1 Соотношение ДНК ACE2-TMPRSS2.
Для дальнейшей оценки взаимодействий ACE2-TMPRSS2 мы использовали анализ IP-IB. Трансфицированные клетки 293T растворяли в буфере, содержащем Nonidet P-40 и DOC; Известно, что этот состав детергента полностью лизирует клетки, сохраняя при этом определенные взаимодействия мембранных белков (37). Из этих лизатов ACE2 C9 и TMPRSS2 FLAG были захвачены на гранулы магнитного белка G с использованием мышиных антител против C9 и кроличьих антител против FLAG соответственно, а затем белки были обнаружены с помощью IB с использованием тех же эпитоп-специфичных антител. Результаты (фиг. 7A) выявили специфический co-IP как TMPRSS2, так и ACE2 либо антителами C9, либо FLAG. Поскольку в этих культурах происходило переваривание формы ACE2 ~ 130 кДа (фиг. 5), преобладающая иммунопреципитированная форма ACE2 составляла ~ 115 кДа. Мы попытались определить, может ли полный ACE2 ~ 130 кДа коиммунопреципитироваться с каталитически неактивным TMPRSS2-S441A. В то время как анти-FLAG IPs эффективно связались как с диким типом, так и с неактивным мутантом TMPRSS2 (S441A) FLAG , совместный IP ACE2 наблюдался только с формой дикого типа (рис.7Б). Эти данные показали, что для ассоциации TMPRSS2 с ACE2 требуется ферментативная активность.
Результаты (фиг. 7A) выявили специфический co-IP как TMPRSS2, так и ACE2 либо антителами C9, либо FLAG. Поскольку в этих культурах происходило переваривание формы ACE2 ~ 130 кДа (фиг. 5), преобладающая иммунопреципитированная форма ACE2 составляла ~ 115 кДа. Мы попытались определить, может ли полный ACE2 ~ 130 кДа коиммунопреципитироваться с каталитически неактивным TMPRSS2-S441A. В то время как анти-FLAG IPs эффективно связались как с диким типом, так и с неактивным мутантом TMPRSS2 (S441A) FLAG , совместный IP ACE2 наблюдался только с формой дикого типа (рис.7Б). Эти данные показали, что для ассоциации TMPRSS2 с ACE2 требуется ферментативная активность.
Взаимодействие между TMPRSS2 и ACE2. (A) Клетки 293T, трансфицированные pCAGGS-TMPRSS2 FLAG (0,5 мкг на 10 клеток 6 ) и pcDNA3.1-ACE2 C9 (1 мкг на 10 клеток 6 ), по отдельности или в комбинации, лизировали. и затем инкубировали с кроличьими антителами против FLAG, мышиными анти-C9 или мышиными IgG на магнитных шариках с протеином G. Элюированные белки анализировали методом IB с использованием указанных антител.(B) Лизаты клеток 293T, трансфицированных pCAGGS-TMPRSS2 FLAG (0,5 мкг на 10 клеток 6 ) или pCAGGS-TMPRSS2 (S441A) FLAG (0,5 мкг на 10 клеток 6 ), по отдельности или в комбинации с pcDNA3.1-ACE2 C9 (1 мкг на 10 6 клеток) подвергали IP с использованием кроличьих антител против FLAG. Элюированные белки анализировали методом IB с использованием мышиных антител против С9. Значения слева — это размеры молекул в килодальтонах.
Элюированные белки анализировали методом IB с использованием указанных антител.(B) Лизаты клеток 293T, трансфицированных pCAGGS-TMPRSS2 FLAG (0,5 мкг на 10 клеток 6 ) или pCAGGS-TMPRSS2 (S441A) FLAG (0,5 мкг на 10 клеток 6 ), по отдельности или в комбинации с pcDNA3.1-ACE2 C9 (1 мкг на 10 6 клеток) подвергали IP с использованием кроличьих антител против FLAG. Элюированные белки анализировали методом IB с использованием мышиных антител против С9. Значения слева — это размеры молекул в килодальтонах.
ассоциации ACE2-TMPRSS2 в цис и транс .Некоторые TTSP, особенно HAT, будут расщеплять клеточные субстраты как в цис , так и в транс , т.е. когда они представлены из соседних клеток (3). Это связано с тем, что некоторые TTSP переносят свои каталитические C-концевые домены в среду (45, 49), тем самым создавая паракринную протеолитическую активность. Мы попытались определить, будет ли TMPRSS2, который способствует проникновению SARS S и расщепляет ACE2 в cis , делать то же самое в trans . С этой целью была создана смешанная популяция клеток-мишеней, половина из которых составляла ACE2 + , а другая половина — TMPRSS2 + .Эти клетки заражали вирусами псевдотипа SARS S и оценивали на расщепление ACE2. Если бы TMPRSS2 расширил свое действие в широком смысле, то смешанные популяции были бы очень восприимчивы к S-опосредованному проникновению, а также расщепили бы ACE2. В отличие от состояния, при котором ACE2 и TMPRSS2 экспрессировались в одних и тех же клетках, экспрессия этих двух белков в разных клетках не способствовала проникновению вируса на уровне, превышающем уровень, наблюдаемый при экспрессии только ACE2 (фиг. 8A). Кроме того, белки ACE2 не подвергались протеолизу, когда TMPRSS2 находился на отдельных клетках, даже если клетки TMPRSS2 + и ACE2 + контактировали друг с другом в монослоях (рис.8Б). Это резко контрастировало с перевариванием ACE2 во время презентации TMPRSS2 цис . Эти данные предполагают, что релевантные в vivo мишенях — это те, в которых факторы входа ACE2 и TMPRSS2 одновременно присутствуют в одних и тех же клетках и что внеклеточный или соседний TMPRSS2 не влияет на инфекцию.
С этой целью была создана смешанная популяция клеток-мишеней, половина из которых составляла ACE2 + , а другая половина — TMPRSS2 + .Эти клетки заражали вирусами псевдотипа SARS S и оценивали на расщепление ACE2. Если бы TMPRSS2 расширил свое действие в широком смысле, то смешанные популяции были бы очень восприимчивы к S-опосредованному проникновению, а также расщепили бы ACE2. В отличие от состояния, при котором ACE2 и TMPRSS2 экспрессировались в одних и тех же клетках, экспрессия этих двух белков в разных клетках не способствовала проникновению вируса на уровне, превышающем уровень, наблюдаемый при экспрессии только ACE2 (фиг. 8A). Кроме того, белки ACE2 не подвергались протеолизу, когда TMPRSS2 находился на отдельных клетках, даже если клетки TMPRSS2 + и ACE2 + контактировали друг с другом в монослоях (рис.8Б). Это резко контрастировало с перевариванием ACE2 во время презентации TMPRSS2 цис . Эти данные предполагают, что релевантные в vivo мишенях — это те, в которых факторы входа ACE2 и TMPRSS2 одновременно присутствуют в одних и тех же клетках и что внеклеточный или соседний TMPRSS2 не влияет на инфекцию.
ACE2-TMPRSS2 в цис и транс . Четыре популяции клеток 293Т трансфицировали контрольной плазмидой люциферазы Renilla (RL) вместе с пустым вектором (EV), плазмидами TMPRSS2 и ACE2, по отдельности или вместе, как указано.Один день спустя клеточные популяции сокультивировали, как указано знаками плюс. FL, люцифераза светлячков. (A) После 20-часового периода сокультивирования клетки трансдуцировали ВИЧ-SARS S. FL / RL измеряли через 27 часов после трансдукции. Планки погрешностей представляют собой стандартные отклонения ( n = 3). Эксперимент повторили трижды с аналогичными результатами. (B) После 20-часового периода сокультивирования клетки лизировали и оценивали расщепление ACE2 посредством IB с использованием антитела против метки C9. Значения справа — это размеры молекул в килодальтонах.
Влияние TTSP на инфекции SARS-CoV. Чтобы определить, увеличивает ли TMPRSS2 восприимчивость клеток к аутентичным инфекциям SARS-CoV, мы проверили трансфицированные клетки 293T аутентичным SARS-CoV (штамм Urbani).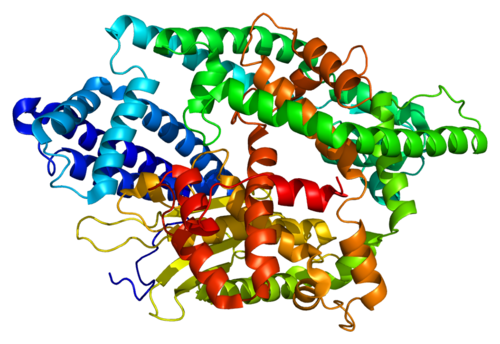 Мы оценили уровни SARS N РНК на 6 hpi с помощью количественной ПЦР с обратной транскрипцией (рис. 9A), а также уровни белка SARS S и N на 24 hpi с помощью IB (рис. 9B). В клетках, экспрессирующих TMPRSS2, было в 9 раз больше РНК SARS N, чем в клетках, экспрессирующих ферментативно неактивный TMPRSS2 (S441A) [ P <0.0005]. Эти вирусные РНК транслировались с образованием значительно большего количества N-белков в клетках TMPRSS2 + (фиг. 9B). Кроме того, в клетках TMPRSS2 + было значительно больше S-белка. Эти данные, особенно сравнение протеолитически активных и неактивных TMPRSS2, позволили нам отнести протеолиз к естественной усиливающей инфекцию активности.
Мы оценили уровни SARS N РНК на 6 hpi с помощью количественной ПЦР с обратной транскрипцией (рис. 9A), а также уровни белка SARS S и N на 24 hpi с помощью IB (рис. 9B). В клетках, экспрессирующих TMPRSS2, было в 9 раз больше РНК SARS N, чем в клетках, экспрессирующих ферментативно неактивный TMPRSS2 (S441A) [ P <0.0005]. Эти вирусные РНК транслировались с образованием значительно большего количества N-белков в клетках TMPRSS2 + (фиг. 9B). Кроме того, в клетках TMPRSS2 + было значительно больше S-белка. Эти данные, особенно сравнение протеолитически активных и неактивных TMPRSS2, позволили нам отнести протеолиз к естественной усиливающей инфекцию активности.
Влияние TTSP на инфекции SARS-CoV. Клетки, трансфицированные ACE2, и каждый TTSP заражали SARS-CoV с MOI 0.1. (A) РНК, специфичные для гена SARS-CoV N и GAPDH человека, были количественно определены с помощью ПЦР в реальном времени, и уровни ампликонов гена SARS N были нормализованы к уровням ампликонов GAPDH.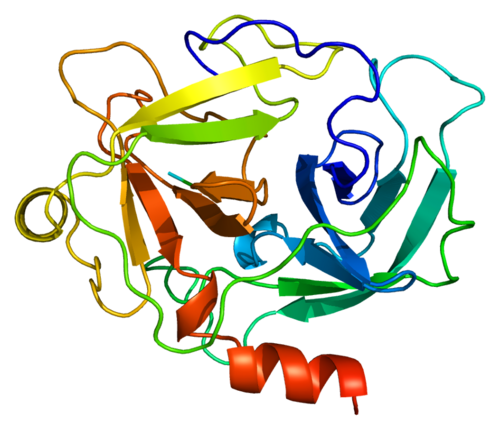 Данные представлены как отношение каждой РНК к РНК пустого вектора (EV). Статистический анализ проводился с использованием критерия Стьюдента t для непарных выборок по значениям порогового цикла ( n = 3). Эксперимент проводился дважды. (B) Уровни белка SARS S и N и β-актина оценивались через 24 часа на дюйм с помощью IB с использованием антител против SARS S, против SARS N и против β-актина.
Данные представлены как отношение каждой РНК к РНК пустого вектора (EV). Статистический анализ проводился с использованием критерия Стьюдента t для непарных выборок по значениям порогового цикла ( n = 3). Эксперимент проводился дважды. (B) Уровни белка SARS S и N и β-актина оценивались через 24 часа на дюйм с помощью IB с использованием антител против SARS S, против SARS N и против β-актина.
ОБСУЖДЕНИЕ
Вирусные белки протеолитически процессируются для обеспечения структурной гибкости безоболочечных и оболочечных вирусов, особенно в поверхностных гликопротеинах, выходящих из вирионных мембран. Поверхностные гликопротеины, способствующие слиянию вирус-клеточная мембрана, синтезируются и поддерживаются в промежуточных состояниях фолдинга-предшественника, а протеолиз обеспечивает рефолдинг и высвобождение энергии, необходимые для создания стабильных связей вирус-клетка и слияния мембран. Здесь мы оценили протеолитическое праймирование белков SARS-CoV S, которые действуют при связывании вируса с клеткой и слиянии вирус-клеточной мембраны. Поскольку это праймирование происходит после того, как S-белки связываются со своими рецепторами (31, 42) и включает несколько ступенчатых эндопротеолитических расщеплений (4), мы спросили, могут ли соответствующие протеазы образовывать комплекс с рецептором SARS, обеспечивая быструю и эффективную активацию проникновения вируса.
Поскольку это праймирование происходит после того, как S-белки связываются со своими рецепторами (31, 42) и включает несколько ступенчатых эндопротеолитических расщеплений (4), мы спросили, могут ли соответствующие протеазы образовывать комплекс с рецептором SARS, обеспечивая быструю и эффективную активацию проникновения вируса.
TTSP отображаются на поверхности клеток и, таким образом, потенциально могут быть связаны с ACE2, рецептором SARS-CoV. Мы начали с оценки нескольких TTSP для активации входа S-белка в клетки 293T и обнаружили, что TMPRSS2, член подсемейства Hepsin / TMPRSS (9), был более эффективен в усилении S-опосредованного входа, чем TMPR11a или TMPR11d (HAT). .Уровни TMPRSS2, обеспечивающие ∼10-кратное увеличение S-опосредованного входа SARS, были аналогичны уровням, обнаруженным эндогенно в легкоподобных клетках Calu3 (T.H.-S. и T. G., неопубликованные данные). Примечательно, что TMPRSS2 экспрессируется в эпителиальных клетках, выстилающих нос, трахею и дистальные дыхательные пути, включая альвеолы и пневмоциты типа II, как определено с помощью в исследованиях гибридизации situ (11).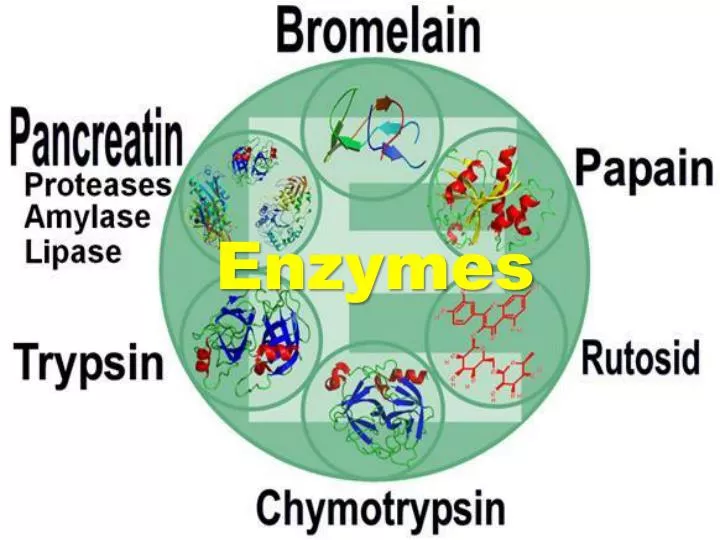 Таким образом, TMPRSS2 может быть релевантной протеазой для инфекций SARS-CoV нижних дыхательных путей.
Таким образом, TMPRSS2 может быть релевантной протеазой для инфекций SARS-CoV нижних дыхательных путей.
Опосредованное TMPRSS2 усиление проникновения вируса SARS сопровождалось значительными изменениями в ACE2.При низких дозах TMPRSS2 преобразовывал ACE2 из формы с массой около 130 кДа в форму с массой около 115 кД, что, как мы полагаем, происходит либо из-за дегликозилирования ACE2, либо из-за неспособности первоначально гликозилировать шесть предсказанных сайтов N-гликанов в эктодомене ACE2 (46 ). Известно, что TMPRSS2 и родственный ему гепсин препятствуют гликозилированию белка N по неизвестному механизму (5), поэтому возможно, что недостаточно или негликозилированные мембранные белки являются общими для клеток, экспрессирующих различные TTSP. Возрастающие количества TMPRSS2 превращали детектируемую часть ACE2 в С-концевой фрагмент ~ 20 кДа.Мы не идентифицировали сестринский фрагмент эктодомена в культуральной среде, но легко обнаружили растворимый ACE2, высвобождаемый из клеток альфа-конвертирующим ферментом фактора некроза опухоли (TACE), несвязанной протеазой, расщепляющей ACE2 (20, 26). Возможно, что TTSP расщепляют несколько аргининов и лизинов на всем протяжении ACE2, оставляя только короткие пептиды (17). В любом случае, это уменьшение ACE2 равносильно «выпадению», хорошо известному явлению, которое до сих пор приписывается только TACE. Исходя из подвижности фрагментов ∼20 кДа на рис.4B, TMPRSS2 расщепляет больше N-конца, чем TACE (19, 20), и действительно, мы обнаружили, что TACE-устойчивый ACE2 (20) подвергается шеддингу TMPRSS2 (данные не показаны), что указывает на различные мишени протеазы. То, что шеддинг ACE2 достигается по крайней мере двумя дивергентными протеазами, предполагает множественную посттрансляционную регуляцию этого эктофермента, что свидетельствует о важности регуляции ACE2 в патогенезе SARS (25) и гомеостазе легких в целом (18). Уменьшение ACE2 в ответ на TMPRSS2 также было легко выявлено с помощью иммунофлуоресцентной микроскопии.Действительно, обратная взаимосвязь между уровнями TMPRSS2 и ACE2 на поверхности клеток (рис. 6A) снова указывает на то, что TMPRSS2 ассоциируется с ACE2 во время или после экзоцитарного транспорта и что TMPRSS2 блокирует, разрушает и / или сбрасывает подавляющее большинство ACE2, способного связывания с вирусными S-белками.
Возможно, что TTSP расщепляют несколько аргининов и лизинов на всем протяжении ACE2, оставляя только короткие пептиды (17). В любом случае, это уменьшение ACE2 равносильно «выпадению», хорошо известному явлению, которое до сих пор приписывается только TACE. Исходя из подвижности фрагментов ∼20 кДа на рис.4B, TMPRSS2 расщепляет больше N-конца, чем TACE (19, 20), и действительно, мы обнаружили, что TACE-устойчивый ACE2 (20) подвергается шеддингу TMPRSS2 (данные не показаны), что указывает на различные мишени протеазы. То, что шеддинг ACE2 достигается по крайней мере двумя дивергентными протеазами, предполагает множественную посттрансляционную регуляцию этого эктофермента, что свидетельствует о важности регуляции ACE2 в патогенезе SARS (25) и гомеостазе легких в целом (18). Уменьшение ACE2 в ответ на TMPRSS2 также было легко выявлено с помощью иммунофлуоресцентной микроскопии.Действительно, обратная взаимосвязь между уровнями TMPRSS2 и ACE2 на поверхности клеток (рис. 6A) снова указывает на то, что TMPRSS2 ассоциируется с ACE2 во время или после экзоцитарного транспорта и что TMPRSS2 блокирует, разрушает и / или сбрасывает подавляющее большинство ACE2, способного связывания с вирусными S-белками. Результаты также подчеркивают крошечные, практически необнаруживаемые уровни ACE2, которые будут поддерживать проникновение вируса SARS, пока доступна протеаза TMPRSS2. В соответствии с этой точкой зрения, клетки 293T, которые, как считается, имеют мало, если вообще имеют ACE2 (34), стали восприимчивыми к проникновению SARS S только с помощью TMPRSS2 (рис.8Б). Здесь легко определяемой детерминантой восприимчивости хозяина является протеаза, а не первичный рецептор вируса.
Результаты также подчеркивают крошечные, практически необнаруживаемые уровни ACE2, которые будут поддерживать проникновение вируса SARS, пока доступна протеаза TMPRSS2. В соответствии с этой точкой зрения, клетки 293T, которые, как считается, имеют мало, если вообще имеют ACE2 (34), стали восприимчивыми к проникновению SARS S только с помощью TMPRSS2 (рис.8Б). Здесь легко определяемой детерминантой восприимчивости хозяина является протеаза, а не первичный рецептор вируса.
Тот факт, что TMPRSS2 разрушает ACE2, затрудняет микроскопическую идентификацию клеток, в которых присутствовали оба этих белка. Однако, когда были обнаружены редкие клетки ACE2 + TMPRSS2 + , сразу же стали очевидны четкие колокализации. Мы ожидали этих колокализаций, во-первых, потому что наши данные утверждают, что заражение вирусов зависит одновременно от этих двух белков, а во-вторых, потому что оба белка могут разделяться на липидные микродомены.ACE2 — это известный белок, заключенный в липидный рафт (14), а TMPRSS2 отличается от других TTSP своим более длинным, потенциально пальмитоилированным цитоплазматическим хвостом из 84 остатков (9), который может обеспечивать позиционирование в липидных рафтах. Клетка, восприимчивая к SARS-CoV, может быть определена тенденциями ACE2 и TMPRSS2 к объединению вместе.
Клетка, восприимчивая к SARS-CoV, может быть определена тенденциями ACE2 и TMPRSS2 к объединению вместе.
Результаты анализа ко-IP подтверждают точку зрения на объединение лигандов ACE2 и TMPRSS2. В то время как каталитически неактивный TMPRSS2 (S441A) не соосаждал ACE2, TMPRSS2 дикого типа делал, и это соединение ACE2-TMPRSS2 было поразительным, учитывая, что общие уровни ACE2 были низкими в присутствии активной протеазы TMPRSS2.Эти данные указывают на необычно стабильную связь активного фермента, но не неактивного зимогена, с одним из его субстратов. Будет интересно и полезно определить спектр субстратов TTSP в клетке.
TMPRSS2 и родственные протеазы клеточной поверхности, как известно, сбрасывают свои ферментно-активные домены во внеклеточную среду (49), а экзогенные сериновые протеазы, такие как трипсин и эластаза, как известно, активируют белки SARS S (31). Таким образом, мы спросили, может ли TMPRSS2 действовать в « trans », чтобы активировать SARS S-опосредованный вход в соседние клетки ACE2 + . Мы не обнаружили никаких доказательств этого — соседний TMPRSS2 не влиял на вход SARS S-опосредованный. Подтверждая это открытие, мы также продемонстрировали, что TMPRSS2 не переваривает ACE2, когда два мембранных белка экспрессируются в соседних клетках. Поэтому мы предполагаем, что наиболее восприимчивыми к инфекции SARS-CoV являются клетки, в которых одновременно присутствуют ACE2 и TTSP, и что по крайней мере TMPRSS2 на ACE2-отрицательных клетках имеет ограниченную паракринную активность в отношении инфекций ACE2 или SARS-CoV.
Мы не обнаружили никаких доказательств этого — соседний TMPRSS2 не влиял на вход SARS S-опосредованный. Подтверждая это открытие, мы также продемонстрировали, что TMPRSS2 не переваривает ACE2, когда два мембранных белка экспрессируются в соседних клетках. Поэтому мы предполагаем, что наиболее восприимчивыми к инфекции SARS-CoV являются клетки, в которых одновременно присутствуют ACE2 и TTSP, и что по крайней мере TMPRSS2 на ACE2-отрицательных клетках имеет ограниченную паракринную активность в отношении инфекций ACE2 или SARS-CoV.
Комплексы ACE2-TMPRSS2, действующие в цис для усиления проникновения вируса, могут оставаться на протяжении всего цикла инфекции, что вызывает вопросы об их влиянии на S-белки, синтезируемые и включаемые в инфекционные потомки вирусов.Например, расщепление S-белков может быть активировано TMPRSS2 во время их транспорта в экзоцитарных путях, аналогично активации HA0 вируса гриппа (8) и многочисленным вирусным гликопротеинам, расщепленным фурином (23). На сегодняшний день у нас нет доказательств активации TTSP-опосредованного расщепления S-белка в подлинных клетках, инфицированных SARS-CoV. Однако этот вопрос заслуживает дальнейшего рассмотрения, особенно в определенных в vivo средах с высокой локализованной плотностью TTSP. Вполне возможно, что спайки SARS-CoV преждевременно протеолизируются и инактивируются в этих условиях.Интересно, что заболевание SARS на поздней стадии, которое, как известно, коррелирует с низкой вирусной инфекционностью (39), тем не менее может включать образование вирусных частиц, которые могут вызывать провоспалительные реакции, характерные для иммунопатологий SARS на поздних стадиях (47).
На сегодняшний день у нас нет доказательств активации TTSP-опосредованного расщепления S-белка в подлинных клетках, инфицированных SARS-CoV. Однако этот вопрос заслуживает дальнейшего рассмотрения, особенно в определенных в vivo средах с высокой локализованной плотностью TTSP. Вполне возможно, что спайки SARS-CoV преждевременно протеолизируются и инактивируются в этих условиях.Интересно, что заболевание SARS на поздней стадии, которое, как известно, коррелирует с низкой вирусной инфекционностью (39), тем не менее может включать образование вирусных частиц, которые могут вызывать провоспалительные реакции, характерные для иммунопатологий SARS на поздних стадиях (47).
SARS-CoV, по-видимому, обладает замечательной находчивостью, поскольку либо эндосомные ацидофильные протеазы, либо TMPRSS2 клеточной поверхности могут обеспечить эквивалентное усиление входа в ~ 1000 раз. Эти две разные протеазные активности полностью избыточны, или существуют контексты, в которых TTSP особенно необходимы? Наша гипотеза состоит в том, что определенные из vivo инфекций требуют TTSP; с этим можно справиться фармакологически путем инфицирования эпителиальных культур дыхательных путей человека (43) в присутствии типоспецифичных ингибиторов протеаз (38) и генетически путем заражения мышей, лишенных выбранных трансмембранных протеаз (22). Мы предполагаем, что TTSPs являются критическими в vivo кофакторов входа, потому что они активируют S на поверхности клеток и, таким образом, поддерживают быстрое распространение вируса через синцитии (Fig. 2). Более того, TTSP могут обеспечивать определенную «непосредственность» активации S, которая может быстро привязывать поступающие вирусы к клеткам через их домены слияния с S-белками мембран. Напротив, локализованные в эндосомах активации откладываются до субклеточного транспорта вируса (31) и требуют, чтобы вирусы оставались прикрепленными к рецепторам ACE2 в течение гораздо более длительного времени.Следовательно, TTSP могут особенно поддерживать CoV, имеющую низкое сродство к своим рецепторам, например, зоонозные CoV, проникающие в новые организмы-хозяева, несущие ортологичные рецепторы (30). Вирусы, попадающие в этих новых хозяев, слабо связываются с рецепторами (30), и преимущества быстро запускаемой активации S-белка могут заключаться в создании дополнительных S-основанных соединений до того, как вирусы элюируются.
Мы предполагаем, что TTSPs являются критическими в vivo кофакторов входа, потому что они активируют S на поверхности клеток и, таким образом, поддерживают быстрое распространение вируса через синцитии (Fig. 2). Более того, TTSP могут обеспечивать определенную «непосредственность» активации S, которая может быстро привязывать поступающие вирусы к клеткам через их домены слияния с S-белками мембран. Напротив, локализованные в эндосомах активации откладываются до субклеточного транспорта вируса (31) и требуют, чтобы вирусы оставались прикрепленными к рецепторам ACE2 в течение гораздо более длительного времени.Следовательно, TTSP могут особенно поддерживать CoV, имеющую низкое сродство к своим рецепторам, например, зоонозные CoV, проникающие в новые организмы-хозяева, несущие ортологичные рецепторы (30). Вирусы, попадающие в этих новых хозяев, слабо связываются с рецепторами (30), и преимущества быстро запускаемой активации S-белка могут заключаться в создании дополнительных S-основанных соединений до того, как вирусы элюируются.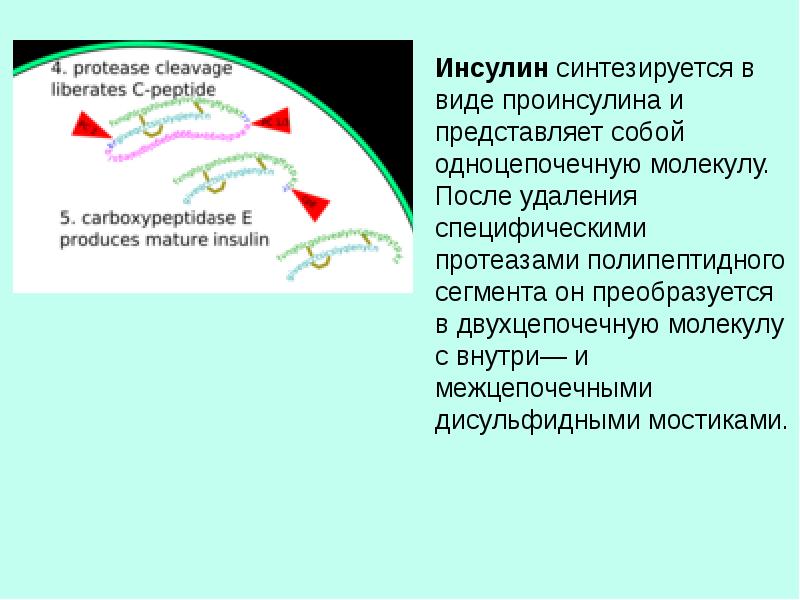 Таким образом, зоонозные CoV могут развить сродство к тем рецепторам, которые связаны с S-активирующими TTSP, о чем может свидетельствовать существование SARS-CoV и HCoV NL63, дивергентные S-белки которых связываются с рецепторами ACE2 (15, 16, 29). .Эволюция вируса и адаптация к конкретным рецепторам могут иметь прямое отношение к соответствующим активирующим протеолитическим ферментам.
Таким образом, зоонозные CoV могут развить сродство к тем рецепторам, которые связаны с S-активирующими TTSP, о чем может свидетельствовать существование SARS-CoV и HCoV NL63, дивергентные S-белки которых связываются с рецепторами ACE2 (15, 16, 29). .Эволюция вируса и адаптация к конкретным рецепторам могут иметь прямое отношение к соответствующим активирующим протеолитическим ферментам.
БЛАГОДАРНОСТИ
Мы особенно признательны Эдварду Кэмпбеллу (Университет Лойолы) за советы экспертов по микроскопии. Мы благодарим Chandra Tangudu и Anna Mielech за техническую помощь и полезные обсуждения.
Эта работа была поддержана грантом NIH AI060030.
СНОСКИ
- Получено 28 сентября 2010 г.
- Принято 3 ноября 2010 г.
- Принятая рукопись размещена в Интернете 10 ноября 2010 г.
- Авторские права © 2011, Американское общество микробиологов
Протеаза Lon Pseudomonas putida участвует в регуляции определения кворума N-ацил гомосерин-лактона | BMC Microbiology
Fuqua C, Greenberg EP: Прислушиваясь к бактериям: передача сигналов ацил-гомосерин-лактона. Nat Rev Mol Cell Biol. 2002, 3 (9): 685-695. 10.1038 / nrm907.
Артикул CAS PubMed Google ученый
Waters CM, Bassler BL: Определение кворума: межклеточная коммуникация у бактерий. Annu Rev Cell Dev Biol. 2005, 21: 319-346. 10.1146 / annurev.cellbio.21.012704.131001.
Артикул CAS PubMed Google ученый
Ruby EG: Уроки совместной ассоциации бактерий и животных: симбиоз легких органов Vibrio fischeri-Euprymna scolopes. Annu Rev Microbiol. 1996, 50: 591-624. 10.1146 / annurev.micro.50.1.591.
Артикул CAS PubMed Google ученый
Камара М., Уильямс П., Хардман А: Контроль инфекции путем настройки и уменьшения громкости бактериальной болтовни. Lancet Infect Dis. 2002, 2 (11): 667-676. 10.1016 / S1473-3099 (02) 00447-4.
Артикул CAS PubMed Google ученый
Фон Бодман С.Б., Бауэр В.Д., Коплин Д.Л.: Определение кворума в патогенных для растений бактериях. Анну Рев Фитопатол. 2003, 41: 455-482. 10.1146 / annurev.phyto.41.052002.095652.
Артикул CAS PubMed Google ученый
Джухас М., Эберл Л., Туммлер Б. Определение кворума: сила сотрудничества в мире Pseudomonas. Environ Microbiol. 2005, 7 (4): 459-471. 10.1111 / j.1462-2920.2005.00769.x.
Артикул CAS PubMed Google ученый
Лаздунски А.М., Вентре И., Стерджис Дж. Н.: Регуляторные цепи и связь у грамотрицательных бактерий. Nat Rev Microbiol. 2004, 2 (7): 581-592. 10.1038 / nrmicro924.
Артикул CAS PubMed Google ученый
Вентури V: Регулирование распознавания кворума у Pseudomonas. FEMS Microbiol Rev.2006, 30 (2): 274-291. 10.1111 / j.1574-6976.2005.00012.x.
Артикул CAS PubMed Google ученый
Hentzer M, Wu H, Andersen JB, Riedel K, Rasmussen TB, Bagge N, Kumar N, Schembri MA, Song Z, Kristoffersen P, Manefield M, Costerton JW, Molin S, Eberl L, Steinberg P , Кьеллеберг С., Хойби Н., Гивсков М.: Ослабление вирулентности Pseudomonas aeruginosa ингибиторами кворума.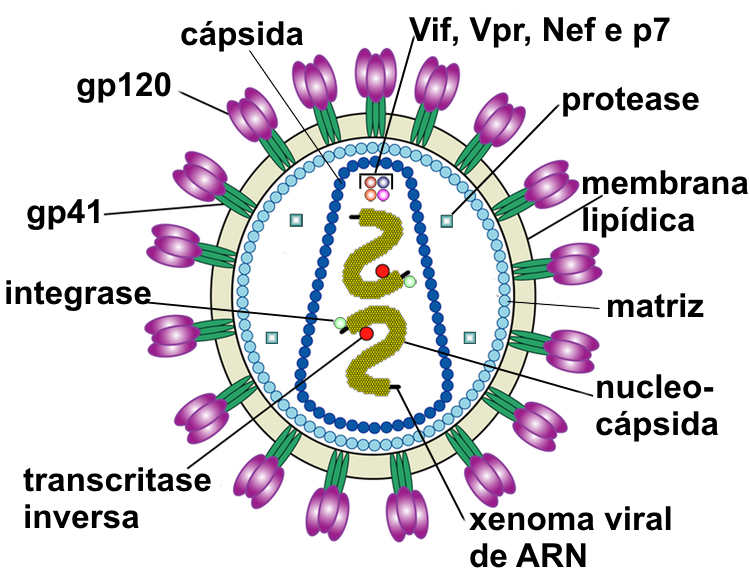 Эмбо Дж. 2003, 22 (15): 3803-3815. 10.1093 / emboj / cdg366.
Эмбо Дж. 2003, 22 (15): 3803-3815. 10.1093 / emboj / cdg366.
PubMed Central Статья CAS PubMed Google ученый
Шустер М., Лостро С.П., Оги Т., Гринберг Е.П.: Идентификация, время и сигнальная специфичность кворум-контролируемых генов Pseudomonas aeruginosa: анализ транскриптома. J Bacteriol. 2003, 185 (7): 2066-2079. 10.1128 / JB.185.7.2066-2079.2003.
PubMed Central Статья CAS PubMed Google ученый
Вагнер В.Е., Бушнелл Д., Пассадор Л., Брукс А.И., Иглевски Б.Х .: Анализ микроматрицы кворум-чувствительных регулонов Pseudomonas aeruginosa: влияние фазы роста и окружающей среды. J Bacteriol. 2003, 185 (7): 2080-2095. 10.1128 / JB.185.7.2080-2095.2003.
PubMed Central Статья CAS PubMed Google ученый
Rampioni G, Bertani I, Zennaro E, Polticelli F, Venturi V, Leoni L: Кворум-чувствительный негативный регулятор RsaL Pseudomonas aeruginosa связывается с промотором lasI.J Bacteriol. 2006, 188 (2): 815-819. 10.1128 / JB.188.2.815-819.2006.
PubMed Central Статья CAS PubMed Google ученый
Рэмпиони Г., Полтичелли Ф., Бертани И., Ригетти К., Вентури В., Зеннаро Е., Леони Л.: Регулятор кворума псевдомонад RsaL принадлежит к тетрагелическому суперклассу H-T-H белков. J Bacteriol. 2007, 189 (5): 1922-1930. 10.1128 / JB.01552-06.
PubMed Central Статья CAS PubMed Google ученый
Бертани I, Вентури V: Регулирование N-ацил-гомосерин-лактон-зависимой системы определения кворума в ризосфере Pseudomonas putida WCS358 и перекрестный разговор с сигма-фактором RpoS стационарной фазы и глобальным регулятором GacA. Appl Environ Microbiol. 2004, 70 (9): 5493-5502. 10.1128 / AEM.70.9.5493-5502.2004.
PubMed Central Статья CAS PubMed Google ученый
Яо Ф., Чжоу Х., Лесси Т.Г.: Характеристика мутантов Burkholderia multivorans ATCC 17616, сверхпродуцирующих N-ацилгомосеринлактон.FEMS Microbiol Lett. 2002, 206 (2): 201-207. 10.1111 / j.1574-6968.2002.tb11010.x.
Артикул CAS PubMed Google ученый
http://www.pseudomonas. com:.
com:.
Цилибарис В., Маенхаут-Мишель Г., Ван Мелдерен Л.: Биологические роли Lon-АТФ-зависимой протеазы. Res Microbiol. 2006, 157 (8): 701-713. 10.1016 / j.resmic.2006.05.004.
Артикул CAS PubMed Google ученый
Zhu J, Winans SC: Чувствительный к кворуму регулятор транскрипции TraR требует своего родственного сигнального лиганда для сворачивания белка, устойчивости к протеазам и димеризации. Proc Natl Acad Sci U S. A. 2001, 98 (4): 1507-1512. 10.1073 / pnas.98.4.1507.
PubMed Central Статья CAS PubMed Google ученый
Манухов И.В., Котова В.Ю., Завильгельский Г. Б.: Шаперон GroEL / GroES и протеаза Lon регулируют экспрессию оперона Vibrio fischeri lux в Escherichia coli .Molec Biol. 2006, 40: 277-283.
Б.: Шаперон GroEL / GroES и протеаза Lon регулируют экспрессию оперона Vibrio fischeri lux в Escherichia coli .Molec Biol. 2006, 40: 277-283.
Артикул CAS Google ученый
Бретц Дж., Лосада Л., Лисбоа К., Хатчесон С.В.: Lon протеаза действует как негативный регулятор секреции белка типа III в Pseudomonas syringae. Mol Microbiol. 2002, 45 (2): 397-409. 10.1046 / j.1365-2958.2002.03008.x.
Артикул CAS PubMed Google ученый
Marr AK, Overhage J, Bains M, Hancock RE: Lon протеаза Pseudomonas aeruginosa индуцируется аминогликозидами и участвует в образовании биопленок и подвижности.Микробиология. 2007, 153 (Pt 2): 474-482. 10.1099 / mic.0.2006 / 002519-0.
Артикул CAS PubMed Google ученый
Whistler CA, Stockwell VO, Loper JE: Lon протеаза влияет на выработку антибиотиков и устойчивость Pseudomonas fluorescens Pf-5 к УФ-излучению. Appl Environ Microbiol. 2000, 66 (7): 2718-2725. 10.1128 / AEM.66.7.2718-2725.2000.
PubMed Central Статья CAS PubMed Google ученый
McClean KH, Winson MK, Fish L, Taylor A, Chhabra SR, Camara M, Daykin M, Lamb JH, Swift S, Bycroft BW, Stewart GS, Williams P: Определение кворума и Chromobacterium violaceum: использование производства виолончели и ингибирование обнаружение N-ацилгомосериновых лактонов. Микробиология. 1997, 143 (Pt 12): 3703-3711.
Артикул CAS Google ученый
Ханахан Д: Исследования трансформации Escherichia coli плазмидами. J Mol Biol. 1983, 166 (4): 557-580. 10.1016 / S0022-2836 (83) 80284-8.
J Mol Biol. 1983, 166 (4): 557-580. 10.1016 / S0022-2836 (83) 80284-8.
Артикул CAS PubMed Google ученый
Sambrook J, Fritsch EF, Maniatis T: Молекулярное клонирование: лабораторное руководство, 2-е изд. Отредактировано: Press CSHL. 1989, Колд-Спринг-Харбор, Нью-Йорк
Google ученый
Birnboim HC: метод быстрой щелочной экстракции для выделения плазмидной ДНК.Методы Энзимол. 1983, 100: 243-255.
Артикул CAS PubMed Google ученый
Беттер М., Льюис Б., Корбин Д., Дитта Г., Хелински Д.Р.: Структурные отношения между симбиотическими промоторами Rhizobium meliloti.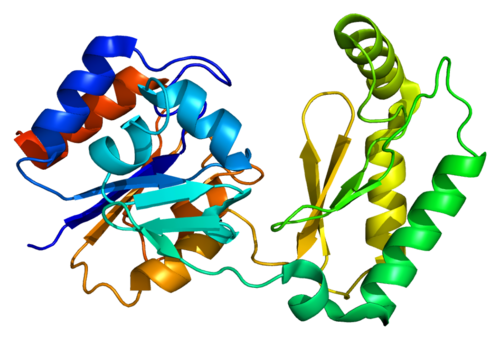 Клетка. 1983, 35 (2 Pt 1): 479-485. 10.1016 / 0092-8674 (83)
Клетка. 1983, 35 (2 Pt 1): 479-485. 10.1016 / 0092-8674 (83)
Артикул CAS PubMed Google ученый
Фигурски Д.Х., Хелински Д.Р.: Репликация производного плазмиды RK2, содержащего ориджин, в зависимости от функции плазмиды, представленной в транс.Proc Natl Acad Sci U S. A. 1979, 76 (4): 1648-1652. 10.1073 / pnas.76.4.1648.
PubMed Central Статья CAS PubMed Google ученый
Миллер Дж. Х .: Эксперименты в молекулярной генетике. Под редакцией: Лаборатория ЦСХ. 1972, Колд-Спринг-Харбор, Нью-Йорк,
Google ученый
Stachel SE, An G, Flores C, Nester EW: Транспозон Tn3 lacZ для случайной генерации слитых генов b-галактозидазы: применение для анализа экспрессии генов в Agrobacterium. Эмбо Дж. 1985, 4 (4): 891-898.
Эмбо Дж. 1985, 4 (4): 891-898.
PubMed Central CAS PubMed Google ученый
Winson MK, Swift S, Fish L, Throup JP, Jorgensen F, Chhabra SR, Bycroft BW, Williams P, Stewart GS: Создание и анализ плазмидных сенсоров на основе luxCDABE для исследования N-ацилгомосерин-лактон- опосредованное определение кворума. FEMS Microbiol Lett. 1998, 163 (2): 185-192. 10.1111 / j.1574-6968.1998.tb13044.x.
Артикул CAS PubMed Google ученый
Shaw PD, Ping G, Daly SL, Cha C, Cronan JE, Rinehart KL, Farrand SK: Обнаружение и характеристика сигнальных молекул N-ацил-гомосерина лактона с помощью тонкослойной хроматографии. Proc Natl Acad Sci U S. A. 1997, 94 (12): 6036-6041. 10.1073 / pnas. 94.12.6036.
94.12.6036.
PubMed Central Статья CAS PubMed Google ученый
Geels FP, Schippers B: Уменьшение депрессии урожайности в почве для высокочастотных посевов картофеля после обработки семенных клубней флуоресцентными антагонистами Pseudomonas spp.Phytopathol Z. 1983, 108: 207-221.
Артикул Google ученый
Джейкобс М.А., Алвуд А., Тайписуттикул И., Спенсер Д., Хауген Э, Эрнст С., Уилл О, Каул Р., Раймонд С., Леви Р., Чун-Ронг Л., Гентнер Д., Бови Д., Олсон М. В., Manoil C: Полная библиотека мутантов транспозонов Pseudomonas aeruginosa . Proc Natl Acad Sci U S. A. 2003, 100 (24): 14339-14344. 10.1073 / pnas.2036282100.
PubMed Central Статья CAS PubMed Google ученый
Ковач М.Э., Эльзер PH, Хилл Д.С., Робертсон Г.Т., Фаррис М.А., Руп Р.М., Петерсон К.М.: четыре новых производных вектора клонирования широкого диапазона хозяев pBBR1MCS, несущие различные кассеты устойчивости к антибиотикам. Ген. 1995, 166 (1): 175-176. 10.1016 / 0378-1119 (95) 00584-1.
Артикул CAS PubMed Google ученый
O’Toole GA, Kolter R: Инициирование образования биопленок у Pseudomonas fluorescens WCS365 происходит через множественные конвергентные пути передачи сигналов: генетический анализ.Mol Microbiol. 1998, 28 (3): 449-461. 10.1046 / j.1365-2958.1998.00797.x.
Артикул PubMed Google ученый
Протеаза ClpXP незаменима для деградации развернутых белков у Staphylococcus aureus
Одна аминокислотная замена в последовательности распознавания ClpP ClpX предотвращает деградацию известных субстратов ClpXP
АТФазы Clp, взаимодействующие в комплексах с ClpP, обладают открытой поверхностью трипептид, необходимый для взаимодействия с ClpP 10 . В ClpX S. aureus консервативный трипептид распознавания ClpP локализован в положении 265–267. Чтобы создать мутант S. aureus , в котором отсутствует протеаза ClpXP, но при этом сохраняется активность протеазы ClpCP, мы использовали сайт-направленный мутагенез и аллельную замену, чтобы ввести замену I 265 E в трипептиде IGF ClpX, как описано в экспериментальном разделе. . В качестве родительского штамма мы использовали S. aureus JE2, производное внебольничного клона USA300 с множественной устойчивостью к антибиотикам, который быстро распространяется по всему миру 21 .Чтобы проверить, не обладают ли клетки S. aureus , экспрессирующие вариант ClpX I265E протеолитической активности ClpXP, мы оценили, накапливаются ли два известных субстрата ClpXP, регулятор транскрипции Spx и автолизин Sle1, в мутанте ClpX I265E , 23 . Вестерн-блоттинг с использованием Sle1 и Spx-специфических антител выявил сильное накопление Sle1 и Spx в мутантном штамме ClpX I265E (рис.
В ClpX S. aureus консервативный трипептид распознавания ClpP локализован в положении 265–267. Чтобы создать мутант S. aureus , в котором отсутствует протеаза ClpXP, но при этом сохраняется активность протеазы ClpCP, мы использовали сайт-направленный мутагенез и аллельную замену, чтобы ввести замену I 265 E в трипептиде IGF ClpX, как описано в экспериментальном разделе. . В качестве родительского штамма мы использовали S. aureus JE2, производное внебольничного клона USA300 с множественной устойчивостью к антибиотикам, который быстро распространяется по всему миру 21 .Чтобы проверить, не обладают ли клетки S. aureus , экспрессирующие вариант ClpX I265E протеолитической активности ClpXP, мы оценили, накапливаются ли два известных субстрата ClpXP, регулятор транскрипции Spx и автолизин Sle1, в мутанте ClpX I265E , 23 . Вестерн-блоттинг с использованием Sle1 и Spx-специфических антител выявил сильное накопление Sle1 и Spx в мутантном штамме ClpX I265E (рис.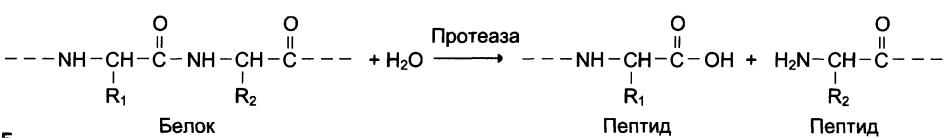 1). Клеточные уровни Spx и Sle1, экспрессирующие вариант ClpX I265E , сравнимы с уровнями в клетках, лишенных ClpP или ClpX, подтверждая, что внесенное изменение аминокислоты в ClpX действительно устраняет активность S.aureus протеаза ClpXP. Антитело Sle1 распознало две полосы схожего размера, которые обе исчезают, если нарушается ген sle1 , и мы предполагаем, что эти две полосы представляют Sle1 с сигнальной последовательностью и без нее (верхняя панель, рис. 1). Затем мы использовали ClpX-специфические антитела для определения количества ClpX I265E , экспрессируемого в мутантном штамме. Как видно на фиг.1 (нижняя панель), вариант ClpX I265E экспрессировался в том же количестве, что и ClpX в клетках дикого типа, что исключает, что дифференциальная экспрессия ClpX способствует накоплению Spx и Sle1 в мутанте. экспрессирующий вариант ClpX I265E .
1). Клеточные уровни Spx и Sle1, экспрессирующие вариант ClpX I265E , сравнимы с уровнями в клетках, лишенных ClpP или ClpX, подтверждая, что внесенное изменение аминокислоты в ClpX действительно устраняет активность S.aureus протеаза ClpXP. Антитело Sle1 распознало две полосы схожего размера, которые обе исчезают, если нарушается ген sle1 , и мы предполагаем, что эти две полосы представляют Sle1 с сигнальной последовательностью и без нее (верхняя панель, рис. 1). Затем мы использовали ClpX-специфические антитела для определения количества ClpX I265E , экспрессируемого в мутантном штамме. Как видно на фиг.1 (нижняя панель), вариант ClpX I265E экспрессировался в том же количестве, что и ClpX в клетках дикого типа, что исключает, что дифференциальная экспрессия ClpX способствует накоплению Spx и Sle1 в мутанте. экспрессирующий вариант ClpX I265E .
ClpXP-специфических субстратов накапливаются в клетках S.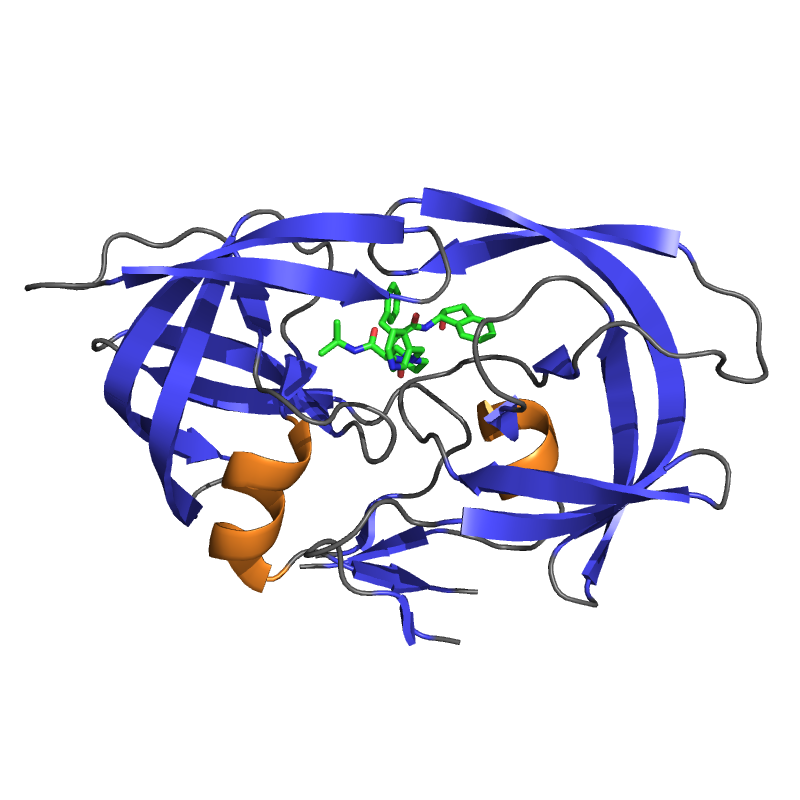 aureus , экспрессирующих вариант ClpX I265E . Клетки были получены из экспоненциально растущих (OD 600 = 0,8 +/- 0,1) культур штаммов JE2 и 8325-4 дикого типа и мутантных производных, перечисленных на рисунке (* the sle1 — штамм экспрессирует вариант ClpX I265E ). Экстракты клеток разделяли с помощью SDS / PAGE, электропереносили на PVDF-мембрану и подвергали иммуноблоттингу с использованием антител, специфичных для Sle1 ( a ), Spx ( b ) или ClpX ( c ).Каждый вестерн-блот-анализ выполнялся дважды с аналогичными результатами. Полноразмерные блоты представлены на дополнительном рисунке 1.
aureus , экспрессирующих вариант ClpX I265E . Клетки были получены из экспоненциально растущих (OD 600 = 0,8 +/- 0,1) культур штаммов JE2 и 8325-4 дикого типа и мутантных производных, перечисленных на рисунке (* the sle1 — штамм экспрессирует вариант ClpX I265E ). Экстракты клеток разделяли с помощью SDS / PAGE, электропереносили на PVDF-мембрану и подвергали иммуноблоттингу с использованием антител, специфичных для Sle1 ( a ), Spx ( b ) или ClpX ( c ).Каждый вестерн-блот-анализ выполнялся дважды с аналогичными результатами. Полноразмерные блоты представлены на дополнительном рисунке 1.
В E. coli замена I на E не препятствовала ClpP-независимой способности ClpX повторно сворачивать шаперонные субстраты ClpX, такие как MU-транспозаза, демонстрируя, что этот мутантный вариант ClpX сохраняет ClpP-независимый шаперон. деятельность 10 . Из-за отсутствия подтвержденных шапероновых субстратов ClpX у S.aureus , мы не смогли напрямую проверить, сохраняется ли ClpP-независимая активность шаперона ClpX в варианте S. aureus ClpX I265E . Однако из предыдущих исследований мы знаем, что ClpX независимо от ClpP необходим для роста S. aureus при 30 ° C 23 . Этот дефект роста мутанта clpX устраняется мутациями в ltaS (LTA-синтаза), что указывает на то, что ClpX независимо от ClpP помогает процессам, связанным с биогенезом клеточной стенки 23 .Поэтому мы использовали этот фенотип для косвенной оценки того, сохраняет ли вариант ClpX I265E шаперонную активность. С этой целью ранние экспоненциальные клетки дикого типа и различные мутанты помещали на чашку TSA и инкубировали при 30 ° C в течение 24 часов. Из этого анализа ясно, что мутант с делецией clpX имеет серьезный дефект роста при 30 ° C, который полностью дополняется введением копии гена clpX дикого типа (фиг.
Из-за отсутствия подтвержденных шапероновых субстратов ClpX у S.aureus , мы не смогли напрямую проверить, сохраняется ли ClpP-независимая активность шаперона ClpX в варианте S. aureus ClpX I265E . Однако из предыдущих исследований мы знаем, что ClpX независимо от ClpP необходим для роста S. aureus при 30 ° C 23 . Этот дефект роста мутанта clpX устраняется мутациями в ltaS (LTA-синтаза), что указывает на то, что ClpX независимо от ClpP помогает процессам, связанным с биогенезом клеточной стенки 23 .Поэтому мы использовали этот фенотип для косвенной оценки того, сохраняет ли вариант ClpX I265E шаперонную активность. С этой целью ранние экспоненциальные клетки дикого типа и различные мутанты помещали на чашку TSA и инкубировали при 30 ° C в течение 24 часов. Из этого анализа ясно, что мутант с делецией clpX имеет серьезный дефект роста при 30 ° C, который полностью дополняется введением копии гена clpX дикого типа (фиг. 2). Важно отметить, что этот серьезный дефект роста не характерен для клеток, экспрессирующих ClpX I265E , что позволяет предположить, что вариант ClpX I265E сохраняет независимую от ClpP шаперонную активность.В заключение, представленные результаты подтверждают, что аминокислотная замена I 265 E в мотиве распознавания ClpP ClpX S. aureus предотвращает взаимодействие ClpX-ClpP, не мешая независимым от ClpP функциям ClpX.
2). Важно отметить, что этот серьезный дефект роста не характерен для клеток, экспрессирующих ClpX I265E , что позволяет предположить, что вариант ClpX I265E сохраняет независимую от ClpP шаперонную активность.В заключение, представленные результаты подтверждают, что аминокислотная замена I 265 E в мотиве распознавания ClpP ClpX S. aureus предотвращает взаимодействие ClpX-ClpP, не мешая независимым от ClpP функциям ClpX.
S. aureus , экспрессирующие вариант ClpX I265E , чувствительны к холоду, но не к теплу. Штамм JE2 S. aureus дикого типа и указанные мутанты экспоненциально росли в TSB при 37 ° C.При OD 600 = 0,5 культуры разводили в 10 1 , 10 2 , 10 3 и 10 4 -кратно, и 10 мкл каждого разведения наносили на чашки с TSA, которые затем инкубировали при указанные температуры.
При нормальных лабораторных условиях роста мутант ClpX I265E растет со временем генерации, которое лишь незначительно (<10%) сокращается по сравнению с Родительский штамм USA300 JE2.Однако мутантная культура ClpX I265E достигла конечного урожая (OD 600 = 8,3 +/- 0,1), который был значительно ниже, чем урожай, достигнутый культурой дикого типа JE2 (OD 600 = 12,0 +/- 0,6). Несмотря на эти различия в конечной OD, мы не наблюдали значительных различий в количестве КОЕ / мл в ON-культурах дикого типа и мутантного штамма (приблизительно 1 × 10 10 КОЕ / мл для обоих штаммов). Это побудило нас измерить размер мутантных клеток ClpX I265E и действительно средний диаметр мутантных клеток (= 0.92 мкм +/- 0,06) значительно снижается (P <0,001) по сравнению со средним диаметром клеток дикого типа (= 1,16 мкм +/- 0,09). Обнаруженное уменьшение диаметра клеток эквивалентно двукратному уменьшению объема мутантных клеток. Следовательно, протеаза ClpXP участвует в процессах, определяющих размер клеток S. aureus .
Обнаруженное уменьшение диаметра клеток эквивалентно двукратному уменьшению объема мутантных клеток. Следовательно, протеаза ClpXP участвует в процессах, определяющих размер клеток S. aureus .
Как показано выше, clpX I265E Мутант растет лучше, чем мутант, полностью лишенный clpX при 30 ° C.Однако JE2 clpX I265E Мутант и мутант clpP JE2 также образуют колонии немного меньшего размера, чем JE2 дикого типа при 30 ° C (рис. 2), что позволяет предположить, что активность протеазы ClpXP важна для роста при низких температурах. В подтверждение этого, JE2 clpX I265E Мутант и мутант clpP JE2 , в отличие от клеток дикого типа, были неспособны образовывать колонии после 72 часов инкубации при 22 ° C.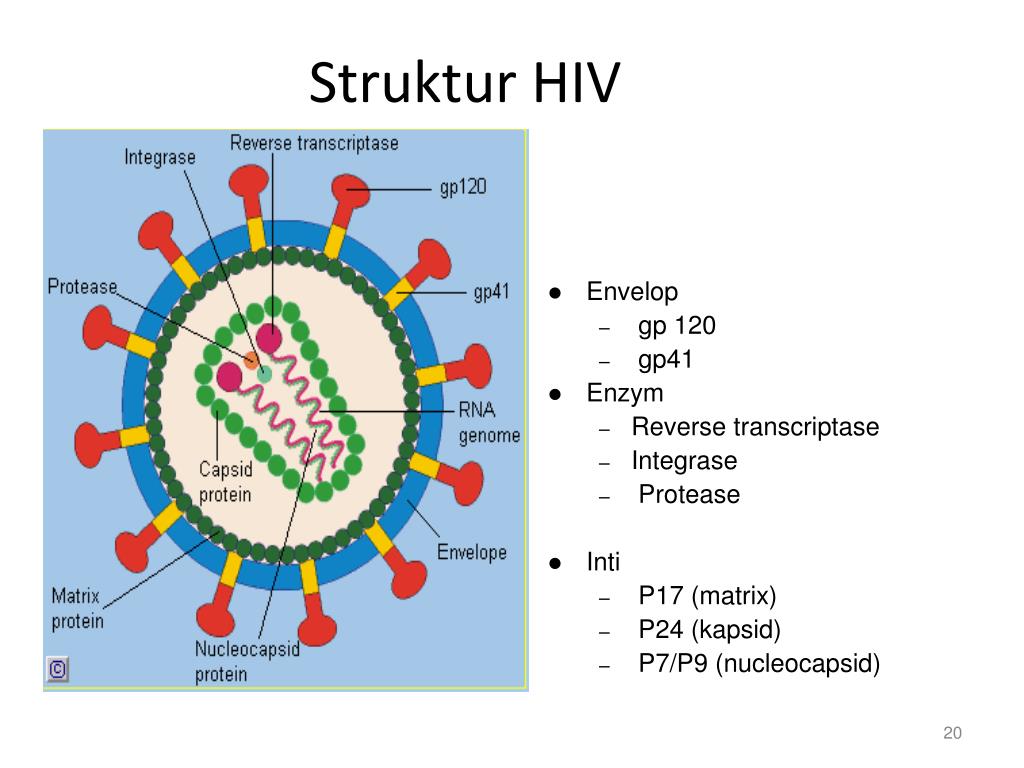 Это открытие согласуется с предыдущими сообщениями, показывающими сильно сниженный рост мутантов с делецией clpP при 20 ° C или 15 ° C, и здесь мы приписываем этот фенотип отсутствию активности ClpXP 17,24 .
Это открытие согласуется с предыдущими сообщениями, показывающими сильно сниженный рост мутантов с делецией clpP при 20 ° C или 15 ° C, и здесь мы приписываем этот фенотип отсутствию активности ClpXP 17,24 .
Чувствительный к холоду фенотип, связанный с делецией clpP , предположительно был вызван накоплением неправильно свернутых и агрегированных белков в клетках, лишенных активности протеазы ClpP 24 . Чтобы проверить, требуется ли активность протеазы ClpXP для роста S.aureus в условиях, которые, как известно, вызывают разворачивание белков, рост исследовали в условиях теплового стресса. Ранние экспоненциальные клетки JE2 дикого типа и мутантных штаммов помещали на чашки с TSA и инкубировали в течение 24 ч при 37 ° C или 45 ° C. Как показано на фиг.2, клетки, экспрессирующие варианты ClpX I265E , аналогичные мутантам с делецией clpX , растут так же, как и клетки дикого типа при 45 ° C, в то время как клетки, лишенные clpP , не могут расти при эта температура (рис. 2). Сходные результаты были получены, когда тепловая чувствительность мутанта ClpX I265E была исследована на различных штаммах-фонах (клинический изолят, SA564, и лабораторные штаммы, 8325-4 и Newman) — данные не показаны. Взятые вместе, эти данные предполагают, что активность ClpXP клеток S. aureus более важна для роста S. aureus при низких температурах, чем для роста при высоких температурах.
2). Сходные результаты были получены, когда тепловая чувствительность мутанта ClpX I265E была исследована на различных штаммах-фонах (клинический изолят, SA564, и лабораторные штаммы, 8325-4 и Newman) — данные не показаны. Взятые вместе, эти данные предполагают, что активность ClpXP клеток S. aureus более важна для роста S. aureus при низких температурах, чем для роста при высоких температурах.
Из-за воздействия гидрофобных остатков, обычно скрытых в нативной структуре, неправильно свернутые белки склонны к агрегированию.Чтобы более точно оценить уровень неправильно свернутого белка в различных штаммах, агрегированные белки выделяли из штаммов JE2 дикого типа и мутантных штаммов, выращенных при 37 ° C или 45 ° C в течение 3 часов. Как показано на фиг. 3, аналогичные количества агрегированного белка были выделены из клеток JE2 дикого типа, инкубированных при 37 ° C и 45 ° C. Напротив, количество агрегированного белка, выделенного из клеток, полностью лишенных активности ClpP, было значительно повышено после инкубации при 45 ° C, демонстрируя, что ClpP важен для предотвращения агрегации белка в клетках, подвергшихся тепловому шоку.Более того, поскольку уровень агрегированных белков в мутанте clpP был значительно выше, чем уровень дикого типа даже в нестрессовых условиях (37 ° C), ClpP-опосредованный протеолиз также важен для предотвращения агрегации белка в нестрессированных клетки. Интересно, что уровень агрегированных белков в клетках JE2ΔclpX и JE2, подвергшихся тепловому шоку, экспрессирующих вариант ClpX I265E , не превышал уровень дикого типа, что показывает, что ни протеаза ClpXP, ни шаперон ClpX не требуются для борьбы с агрегацией белка на высокие температуры в С.aureus . Примечательно, что в то время как профиль агрегированного белка, выделенного из мутантов clpX дикого типа и двух мутантов clpX при высокой температуре, имел сходный внешний вид, образец агрегированных белков, выделенных из культур при 37 ° C мутантов clpX , отличался от диких.
Напротив, количество агрегированного белка, выделенного из клеток, полностью лишенных активности ClpP, было значительно повышено после инкубации при 45 ° C, демонстрируя, что ClpP важен для предотвращения агрегации белка в клетках, подвергшихся тепловому шоку.Более того, поскольку уровень агрегированных белков в мутанте clpP был значительно выше, чем уровень дикого типа даже в нестрессовых условиях (37 ° C), ClpP-опосредованный протеолиз также важен для предотвращения агрегации белка в нестрессированных клетки. Интересно, что уровень агрегированных белков в клетках JE2ΔclpX и JE2, подвергшихся тепловому шоку, экспрессирующих вариант ClpX I265E , не превышал уровень дикого типа, что показывает, что ни протеаза ClpXP, ни шаперон ClpX не требуются для борьбы с агрегацией белка на высокие температуры в С.aureus . Примечательно, что в то время как профиль агрегированного белка, выделенного из мутантов clpX дикого типа и двух мутантов clpX при высокой температуре, имел сходный внешний вид, образец агрегированных белков, выделенных из культур при 37 ° C мутантов clpX , отличался от диких. -типа, поскольку наиболее многочисленная полоса в профиле дикого типа при обеих температурах отсутствовала у мутантов при 37 ° C (рис. 3).
-типа, поскольку наиболее многочисленная полоса в профиле дикого типа при обеих температурах отсутствовала у мутантов при 37 ° C (рис. 3).
Белковые агрегаты накапливаются в мутанте JE2 Δ clp P, подвергнутом тепловому шоку, но не в JE2, экспрессирующем вариант ClpX I265E .( A ) Бактериальные клетки штаммов JE2 дикого типа и мутантных штаммов выращивали в аэробных условиях при 37 ° C в 25 мл TSB в колбе на 250 мл в течение 3 часов. На этом этапе культуры в каждой колбе разделяли поровну: одну половину инкубировали при 37 ° C, а другую при 45 ° C в течение дополнительных 3 часов. Белковые агрегаты выделяли из 10 мл культуры. Солюбилизированные белковые агрегаты нормализовали до общего белка в неочищенном экстракте и анализировали с помощью SDS-PAGE. ( B ) Белковые агрегаты были количественно определены денситометрически из гелей, окрашенных кумасси синим G-250, с использованием программного обеспечения изображения J (среднее ± SD, n = 3, однофакторный ANOVA, пост-тест Тьюки; * P <0. 05, ** P <0,005; *** P <0,0005).
05, ** P <0,005; *** P <0,0005).
Мы пришли к выводу, что клеток S. aureus , экспрессирующих вариант ClpX I265E , в отличие от клеток, лишенных ClpP, не чувствительны к тепловому стрессу и не накапливают белковые агрегаты при высоких температурах, показывая, что ClpXP незаменим для деградации развернутые белки в S. aureus .
Транскриптомный анализ поддерживает различные роли протеаз ClpXP и ClpCP
В S.aureus , делеция clpP резко изменяет глобальную экспрессию генов, затрагивая сотни генов и белков, принадлежащих к различным путям 17,24,25 . Имея в наличии вариант ClpX I265E , мы теперь могли более точно определять изменения в экспрессии генов, вызванные инактивацией только одной протеазы Clp, и, таким образом, дополнительно анализировать глобальное влияние протеаз ClpP на физиологию клеток S. aureus . Для этого РНК-секвенирование было выполнено на образцах РНК, полученных из среднеэкспоненциальных культур JE2 дикого типа, clpP и clpX . I265E мутанты.Гены, которые изменяют экспрессию из-за инактивации протеазы ClpXP, могут быть идентифицированы напрямую путем сравнения транскриптома JE дикого типа и clpX I265E мутант. Ожидается, что гены, регулируемые ClpXP, будут иметь сходную экспрессию в мутанте clpP и в мутанте clpX I265E мутант. Гены, которые по-разному экспрессируются между мутантом clpP и clpX I265E Мутанты , вероятно, представляют собой гены, которые изменяют экспрессию из-за отсутствия ClpCP.
I265E мутанты.Гены, которые изменяют экспрессию из-за инактивации протеазы ClpXP, могут быть идентифицированы напрямую путем сравнения транскриптома JE дикого типа и clpX I265E мутант. Ожидается, что гены, регулируемые ClpXP, будут иметь сходную экспрессию в мутанте clpP и в мутанте clpX I265E мутант. Гены, которые по-разному экспрессируются между мутантом clpP и clpX I265E Мутанты , вероятно, представляют собой гены, которые изменяют экспрессию из-за отсутствия ClpCP.
ClpXP затронутые гены
Полный список генов, дифференциально экспрессируемых между JE2 дикого типа и clpX I265E Мутант можно найти в дополнительной таблице 1.
Гены активированы в JE2clpX
I265E относительно дикого типа Гены активированы более чем в 3 раза в clpX I265E Мутантные клетки по сравнению с клетками дикого типа показаны в таблице 1.Гены с наибольшей активацией (5–10 раз) у clpX I265E Мутант расположен в одном из четырех генетических локусов: оперон уреазы ( ureABCEFGHD ), оперон, кодирующий ферменты, участвующие в захвате и синтезе пиримидинов ( pyrPBC-carAB-pyrFE ), стафилококковый остров фатогенности5 (= SaPBC). обсуждается ниже), или оперон betA-betB и нижестоящий ген betT , кодирующие, соответственно, ферменты, катализирующие образование глицинбетаина из холина, и систему захвата холина 26 .В бактериях глицин бетаин и другие небольшие органические молекулы действуют как осмопротекторы во время осмотического стресса 27 и, в частности, оперон OpuCA-OpuCD , кодирующий систему захвата ABC, OpuC, участвующий в поглощении совместимого растворенного карнитина 28 , также является одним из наиболее значительно активированы гены в clpX I265E мутант.
Дополнительные локусы, которые кодируют белки с различными или неизвестными функциями, были в значительной степени индуцированы в clpX I265E мутант; среди них некоторые поверхностные белки, важные для вирулентности S. aureus , такие как связывающие фибронектин белки, FnbA и FnbB, а также большая адгезия SraP, дополнительная таблица 1 30 . sraP является последним геном в опероне, дополнительно кодирующем белки, необходимые для гликозилирования и экспорта адгезина SraP, и весь оперон значительно активирован в clpX I265E мутант 29 .
Гены с пониженной регуляцией в JE2clpX
I265E по сравнению с генами дикого типа Гены подавлены более чем в 3 раза в clpX I265E Мутант по сравнению с JE2 дикого типа показан в таблице 2.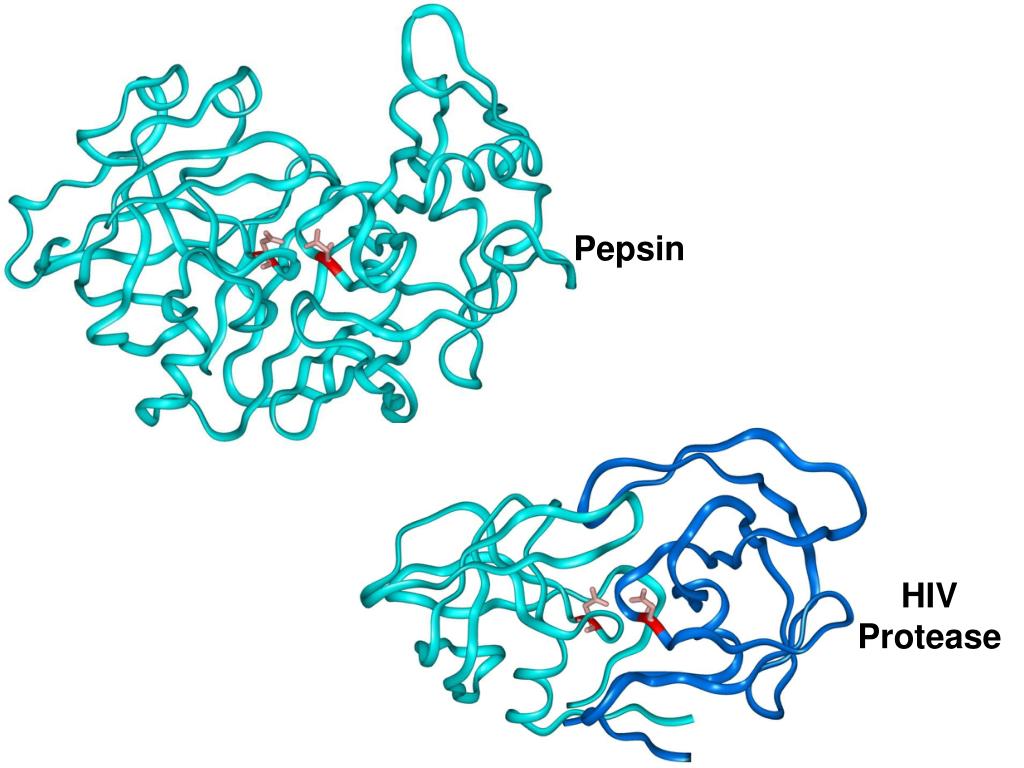 Наиболее резко подавляемый локус в клетках, экспрессирующих вариант ClpX I265E , представляет собой два соседних гена, SAUSA300_2453 и SAUSA300_2454, кодирующих белок, гомологичный связывающему АТФ протеин переносчиков ABC и предполагаемый протеин, покрывающий мембрану, соответственно.Список включает дополнительные гены, кодирующие белки с предполагаемой транспортной функцией, а также несколько локусов, кодирующих липопротеины. Поразительно, однако, что в списке локусов с очень значительной подавляемой регуляцией преобладают гены, выполняющие функцию регуляции вирулентности и вирулентности. Среди наиболее подавляемых генов вирулентности — гены spa и sbi , кодирующие IgG-связывающие белки, протеин A и Sbi. Примечательно, что ген spa является наиболее экспрессируемым геном в экспоненциально растущих клетках JE2 дикого типа (дополнительная таблица 1).Другие гены вирулентности с пониженной регуляцией кодируют секретируемые ферменты, такие как nuc (нуклеаза), tig (липаза) и sak (стафилокиназа).
Наиболее резко подавляемый локус в клетках, экспрессирующих вариант ClpX I265E , представляет собой два соседних гена, SAUSA300_2453 и SAUSA300_2454, кодирующих белок, гомологичный связывающему АТФ протеин переносчиков ABC и предполагаемый протеин, покрывающий мембрану, соответственно.Список включает дополнительные гены, кодирующие белки с предполагаемой транспортной функцией, а также несколько локусов, кодирующих липопротеины. Поразительно, однако, что в списке локусов с очень значительной подавляемой регуляцией преобладают гены, выполняющие функцию регуляции вирулентности и вирулентности. Среди наиболее подавляемых генов вирулентности — гены spa и sbi , кодирующие IgG-связывающие белки, протеин A и Sbi. Примечательно, что ген spa является наиболее экспрессируемым геном в экспоненциально растущих клетках JE2 дикого типа (дополнительная таблица 1).Другие гены вирулентности с пониженной регуляцией кодируют секретируемые ферменты, такие как nuc (нуклеаза), tig (липаза) и sak (стафилокиназа). Список генов, кодирующих регуляторы вирулентности, которые у мутанта подавляются более чем в 2 раза, включает гены mgrA, sarS, sarZ, agrA , rnaIII, и arlR .
Список генов, кодирующих регуляторы вирулентности, которые у мутанта подавляются более чем в 2 раза, включает гены mgrA, sarS, sarZ, agrA , rnaIII, и arlR .
Гены с измененной экспрессией между мутантом clpP JE2 и JE2clpX
I265E (предполагаемые гены, пораженные ClpCP)Полный список генов, дифференциально экспрессируемых между мутантом clpP JE 2 и clpX I265E Мутант перечислены в дополнительной таблице 2.
Гены, активируемые в мутанте JE2clpP
— по сравнению с JE2clpX I265E Гены с наиболее высокой (> 4-кратной) активацией в мутанте JE2 clpP по сравнению с JE2, экспрессирующим clpX I265E Вариант перечислены в таблице 3. Интересно, что почти все эти гены принадлежат только к трем функциональным группам: первая группа включает локусы, отвечающие на стресс окисления белка (оперон ahpC-ahpF и расположенный ниже ген SAUSA300_0381) или сворачивание белка. стресса (оперон ctsR-mcsA-mcsB-clpC и ген clpB ).Кроме того, оперон hrcA-grpE-dnaK-dnaJ-prmA и оперон groEL-groES значительно активированы — дополнительная таблица 2. Эти гены экспрессируются на уровнях дикого типа или слегка повышены в clpX . I265E мутант. Вторая функциональная группа генов с высокой степенью активации у мутанта clpP по сравнению с clpX I265E Мутант — это гены, участвующие в метаболизме железа: девять генов, принадлежащих к оперону, кодирующему белки, катализирующие биосинтез стафилоферрина B ( sbnABCDEFGHI ), относятся к числу наиболее высокоиндуцированных генов.
Интересно, что почти все эти гены принадлежат только к трем функциональным группам: первая группа включает локусы, отвечающие на стресс окисления белка (оперон ahpC-ahpF и расположенный ниже ген SAUSA300_0381) или сворачивание белка. стресса (оперон ctsR-mcsA-mcsB-clpC и ген clpB ).Кроме того, оперон hrcA-grpE-dnaK-dnaJ-prmA и оперон groEL-groES значительно активированы — дополнительная таблица 2. Эти гены экспрессируются на уровнях дикого типа или слегка повышены в clpX . I265E мутант. Вторая функциональная группа генов с высокой степенью активации у мутанта clpP по сравнению с clpX I265E Мутант — это гены, участвующие в метаболизме железа: девять генов, принадлежащих к оперону, кодирующему белки, катализирующие биосинтез стафилоферрина B ( sbnABCDEFGHI ), относятся к числу наиболее высокоиндуцированных генов. Точно так же другие гены с подтвержденной ролью в гомеостазе железа, такие как гены, кодирующие белки, участвующие в транспорте и синтезе стафилоферрина А ( htsAB; sfaCBAD ), и оперон кластерного биосинтеза Fe-S sufCDSUB также являются одними из самых значительно активированы гены в мутанте clpP по сравнению с clpX I265E мутант (таблица 3 и дополнительная таблица 2). Транскрипция генов синтеза сидерофоров контролируется регулятором захвата железа, Fur, семейством транскрипционных регуляторов, и ген, принадлежащий к этому семейству (SAUSA300_1448), является одним из наиболее сильно регулируемых генов между мутантом clpP JE2 и clpX JE2 I265E мутант.В целом гены, участвующие в метаболизме железа, транскрибируются на уровнях дикого типа в JE2 clpX I265E , показывающий, что потеря активности ClpXP не изменяет экспрессию этих генов.
Точно так же другие гены с подтвержденной ролью в гомеостазе железа, такие как гены, кодирующие белки, участвующие в транспорте и синтезе стафилоферрина А ( htsAB; sfaCBAD ), и оперон кластерного биосинтеза Fe-S sufCDSUB также являются одними из самых значительно активированы гены в мутанте clpP по сравнению с clpX I265E мутант (таблица 3 и дополнительная таблица 2). Транскрипция генов синтеза сидерофоров контролируется регулятором захвата железа, Fur, семейством транскрипционных регуляторов, и ген, принадлежащий к этому семейству (SAUSA300_1448), является одним из наиболее сильно регулируемых генов между мутантом clpP JE2 и clpX JE2 I265E мутант.В целом гены, участвующие в метаболизме железа, транскрибируются на уровнях дикого типа в JE2 clpX I265E , показывающий, что потеря активности ClpXP не изменяет экспрессию этих генов.
Третий кластер генов, который сильно активируется в clpP по сравнению с clpX I265E Мутант состоит из генов профага ϕSA3usa 29 .Индуцированные гены-профаги кодируют белки, выполняющие функцию литического образа жизни фага, такие как основной белок хвоста фага (SAUSA300_1934), белок хвостовой ленты (SAUSA300_1930) и предсказанный фаговый автолизин (SAUSA300_1923). Примечательно, что ген (SAUSA300_1939), кодирующий белок с 30% идентичностью clpP , находится среди индуцированных генов профага ϕSA3usa. Насколько нам известно, функция этой предполагаемой протеазы, кодируемой профагом φSA3usa, не исследована. Ген SAUSA300_1939, аналогичный другим литическим генам профага, транскрибируется на очень низких уровнях в клетках дикого типа или в мутанте ClpX I265E, что исключает, что эта предполагаемая протеаза вносит вклад в фенотип клеток, лишенных протеолитической активности ClpXP. Однако мы не можем исключить, что индукция этой предполагаемой протеазы может вносить вклад в фенотип штаммов с делецией clpP . Интересно, что гены в другом мобильном генетическом элементе, острове патогенности стафилококков, SaPI5, также были значительно усилены у мутанта clpP по сравнению с clpX . I265E Мутант и, кроме того, между clpX I265E мутант и дикого типа (таблица 1).
Однако мы не можем исключить, что индукция этой предполагаемой протеазы может вносить вклад в фенотип штаммов с делецией clpP . Интересно, что гены в другом мобильном генетическом элементе, острове патогенности стафилококков, SaPI5, также были значительно усилены у мутанта clpP по сравнению с clpX . I265E Мутант и, кроме того, между clpX I265E мутант и дикого типа (таблица 1).
Гены с пониженной регуляцией в JE clpP :: ΦNΣ по сравнению с JE2clpX
I265E Наиболее подавляемые локусы в мутанте clpP по сравнению с clpX I265E Мутант приведен в таблице 4. Поразительно, что локус agr , кодирующий центральный регулятор вирулентности S. aureus , систему контроля кворума Agr, а также эффекторную молекулу, rnaIII , относятся к числу локусов, экспрессия которых наиболее редка. между мутантом clpP и clpX I265E мутант.В соответствии с этим открытием, соседние гены (SAUSA300_1067 и SAUSA300_1068), кодирующие AgrA-контролируемые токсины, фенолорастворимый модулин бета1 и фенолрастворимый модулялин бета1 / 2, также входят в 10 наиболее подавляемых генов между мутантом с делецией clpP . и clpX I265E мутант. Интересно, что транскрипция rnaIII и оперона agrACDB также значительно ниже в JE2 clpX . I265E , чем в клетках дикого типа.Соответственно, этот центральный регуляторный локус зависит как от протеазы ClpCP, так и от протеазы ClpXP для полной транскрипции в штамме JE2. Помимо этих локусов, список генов, позитивно регулируемых ClpCP, включает большое количество локусов, кодирующих белки с неизвестными функциями — Таблица 4 и дополнительная таблица 2.
между мутантом clpP и clpX I265E мутант.В соответствии с этим открытием, соседние гены (SAUSA300_1067 и SAUSA300_1068), кодирующие AgrA-контролируемые токсины, фенолорастворимый модулин бета1 и фенолрастворимый модулялин бета1 / 2, также входят в 10 наиболее подавляемых генов между мутантом с делецией clpP . и clpX I265E мутант. Интересно, что транскрипция rnaIII и оперона agrACDB также значительно ниже в JE2 clpX . I265E , чем в клетках дикого типа.Соответственно, этот центральный регуляторный локус зависит как от протеазы ClpCP, так и от протеазы ClpXP для полной транскрипции в штамме JE2. Помимо этих локусов, список генов, позитивно регулируемых ClpCP, включает большое количество локусов, кодирующих белки с неизвестными функциями — Таблица 4 и дополнительная таблица 2.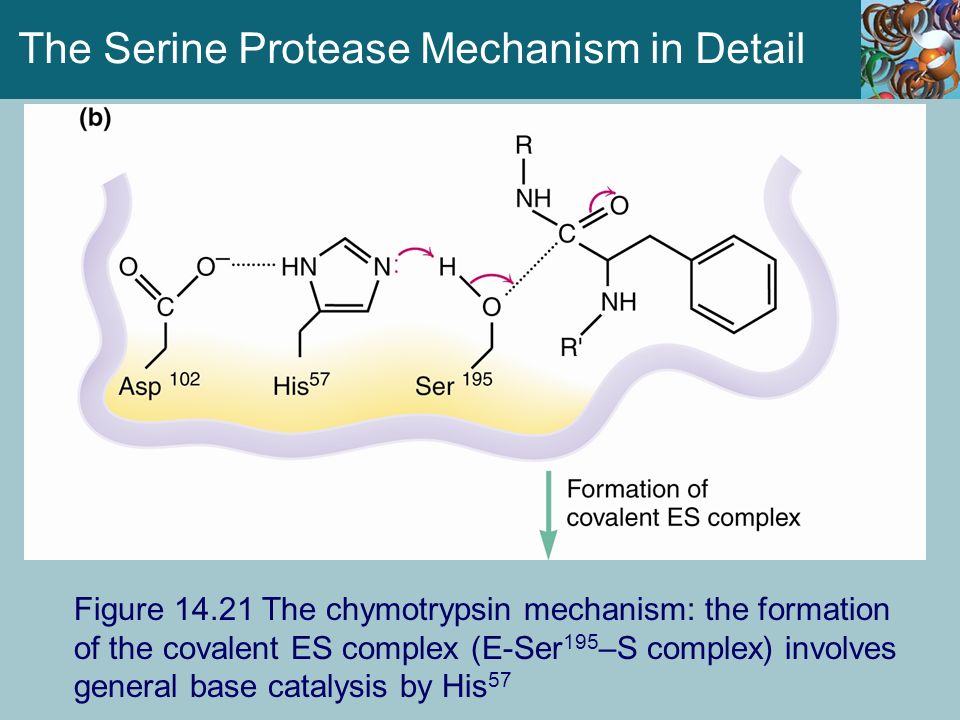
Протеаза — Протеопедия, жизнь в 3D
Протеазы — это класс белков, расщепляющих другие белки.Их еще называют протеолитическими ферментами.
Протеазы классифицируются по аминокислотам или лигандам, которые катализируют реакцию гидролиза. Например, сериновые протеазы содержат в активном сайте. Серину помогает соседний и. Эта комбинация называется каталитической триадой и сохраняется во всех сериновых протеазах. Сериновые протеазы работают в два этапа; во-первых, они образуют a с расщепляемым белком; на втором этапе входит и высвобождает вторую половину расщепленного белка.Цистеиновые протеазы используют цистеин в качестве нуклеофила, так же как сериновые протеазы используют серин в качестве нуклеофила.
Сериновые протеазы включают ряд пищеварительных ферментов, включая трипсин, химотрипсин и эластазу. Хотя все они содержат одни и те же три аминокислоты, которые работают вместе, чтобы катализировать реакцию, называемую, они различаются местом, где они расщепляют белки. Эта специфичность обусловлена связывающим карманом, который содержит разные функциональные группы. Химотрипсин предпочитает большой гидрофобный остаток; его карман большой и содержит гидрофобные остатки.На этом представлении гидрофобный фенилаланин субстрата показан зеленым цветом, а гидрофобность окружающих аминокислот показана серыми (гидрофобные) или пурпурными (гидрофильными) шариками. Трипсин специфичен для положительно заряженных остатков, таких как лизин, и содержит отрицательную аминокислоту на дне кармана. Эластаза предпочитает небольшой нейтральный остаток; у него очень маленький карман.
Хотя все они содержат одни и те же три аминокислоты, которые работают вместе, чтобы катализировать реакцию, называемую, они различаются местом, где они расщепляют белки. Эта специфичность обусловлена связывающим карманом, который содержит разные функциональные группы. Химотрипсин предпочитает большой гидрофобный остаток; его карман большой и содержит гидрофобные остатки.На этом представлении гидрофобный фенилаланин субстрата показан зеленым цветом, а гидрофобность окружающих аминокислот показана серыми (гидрофобные) или пурпурными (гидрофильными) шариками. Трипсин специфичен для положительно заряженных остатков, таких как лизин, и содержит отрицательную аминокислоту на дне кармана. Эластаза предпочитает небольшой нейтральный остаток; у него очень маленький карман.
Цистеиновые протеазы включают ферменты, которые играют роль в регуляции клеточных процессов, такие как каспазы и деубиквитиназа.Каспазы гидролизуют белки во время апоптоза. Деубиквитиназы играют роль в регуляции деградации белков, например Cdu1 от Chlamydia.

 Влияние протеолитического фермента серрапептазы на отек, боль и тризм после хирургического удаления третьих моляров нижней челюсти.Int J Oral Maxillofac Surg. 2008; 37 (3): 264-8.
Влияние протеолитического фермента серрапептазы на отек, боль и тризм после хирургического удаления третьих моляров нижней челюсти.Int J Oral Maxillofac Surg. 2008; 37 (3): 264-8.