
Ферменты необходимы буквально для каждого химического воздействия, которое происходит в нашем организме — от пищеварения до иммунной функции и кровотока. Действие протеазы в организме направлено на то, чтобы мы хорошо видели, думали и дышали. Что такое протеаза? Это фермент, который позволяет расщеплять белки в организме.
Из-за этого протеолитические ферменты находятся на переднем крае биологических исследований. Они стали основным направлением для фармацевтической промышленности. Согласно научному обзору, опубликованному в «Биохимическом журнале»:
«Преобладающее использование протеаз было при лечении сердечно-сосудистых заболеваний. Однако протеазы становятся полезными агентами при лечении сепсиса, расстройств пищеварения, воспаления, кистозного фиброза. А также заболеваний сетчатки, псориаза и много другого»
Но что именно делает протеаза, и почему она так важна для нашего общего здоровья? Это сложные ферменты, и исследователи все еще изучают их роль в организме человека. Давайте попробуем разобраться и понять их важность.
Что такое протеаза? Определение протеазы и роль в организме
Протеазы были названы биологической версией швейцарских армейских ножей, способных разрезать длинные последовательности белков на фрагменты. Протеаза — это фермент, который расщепляет длинные, цепочечные молекулы белков, чтобы они могли перевариваться. Этот процесс называется протеолизом. Он превращает белковые молекулы в более короткие фрагменты, называемые пептидами, а в конечном итоге в их компоненты, называемые аминокислотами. Нам нужен постоянный запас аминокислот для правильного роста и восстановления.
Белки — жесткая, сложная, свернутая структура, и их можно разбить или разобрать только с помощью ферментов протеазы. Процесс переваривания белков начинается в желудке, где соляная кислота раскрывает белки, а фермент пепсин начинает их разбирать. Поджелудочная железа выделяет ферменты протеазы (главным образом, трипсин). А в кишечнике они разрывают белковые цепи на более мелкие кусочки. Затем ферменты на поверхности и внутри кишечных клеток разрушают кусочки еще больше. Они превращают их в аминокислоты, которые готовы к употреблению во всем организме.
Когда эти ферменты протеазы не присутствуют в организме для расщепления белковых молекул, кишечная оболочка не сможет их переварить. Это может привести к серьезным проблемам со здоровьем.
Протеазы вырабатываются поджелудочной железой, а также обнаруживаются в некоторых фруктах, бактериях и других микробах. Пищеварительный тракт продуцирует три различных формы протеазы: трипсиноген, химотрипсиноген и прокарбоксипептидазу. Эти три протеазы атакуют разные пептидные связи, что позволяет генерировать аминокислоты, строительные блоки белка.
В чем заключается действие протеазы в организме? Практически во всем! Эти ферменты обеспечивают правильную работу нашей пищеварительной и иммунной систем, почек, печени, селезенки, поджелудочной железы и кровотока. Протеаза играет роль в регулировании метаболической функции и позволяет витаминам и минералам, которые мы принимаем, работать должным образом. И, кроме того, протеазы необходимы для нормального функционирования гормонов и способствуют восстановлению мышц и заживлению тканей.
Типы протеаз
Ферменты протеазы часто классифицируются на основании их происхождения. Некоторые протеазы вырабатываются в нашем организме, некоторые в растениях, а другие имеют микробное происхождение. Различные типы протеаз имеют разные биологические процессы и механизмы.
Наша пищеварительная система естественным образом производит три типа протеаз: пепсин, трипсин и химотрипсин. Вот разбивка этих трех типов протеаз:
Пепсин
Пепсин — это природная протеаза, которая содержится в кишечнике. Он необходим для расщепления и переваривания белков. Клетки желудка начинают вырабатывать неактивный фермент, называемый пепсиноген, превращающийся в пепсин, когда он попадает в кислую среду желудка. Затем пепсин разрушает химические связи в белках, производя более мелкие молекулы, называющиеся пептидами. Это первая фаза переваривания белка.
трипсин
Трипсин — это протеазный фермент, который вырабатывается в поджелудочной железе в неактивной форме, называемой трипсиногеном. Затем он смешивается с желчью и попадает в тонкий кишечник, где превращается в активный трипсин. Трипсин работает с пепсином и химотрипсином для расщепления белков на пептиды и аминокислоты.
Chymotrypsin
Химотрипсин также вырабатывается в поджелудочной железе и действует как компонент сока поджелудочной железы в тонкой кишке. Он расщепляет молекулы белка на пептиды. Химотрипсин активируется в присутствии трипсина.
Протеазы также содержатся в определенных пищевых продуктах и доступны в виде добавок. Существуют два типа ферментов протеаз на растительной основе:
Бромелайн
Бромелайн — протеаза, которая содержится в стебле и соке ананаса. Добавки бромелайна обычно используются при расстройствах пищеварения, более быстром восстановлении после операций или травм. А также симптомов аллергии, синусовых инфекций и болей в суставах.
Папаин
Папаин — это протеазный фермент, который содержится в латексе папайи, особенно когда он незрелый. Папаин стимулирует пищеварение и улучшает общее усвоение питательных веществ, поэтому его часто используют в пищеварительных ферментных добавках.
ТОП-6 польза протеазы
1.Действие протеазы в организме для улучшения пищеварения

Ферменты играют важную роль в нашем пищеварительном здоровье, и правильное пищеварение зависит от протеазных процессов. Они обладают отчетливой способностью разрушать пептидные связи и выделять аминокислоты. Протеазы необходимы для расщепления белков, чтобы они могли перевариваться. Они также расщепляют другие отходы, включая токсины. Это важно для пищеварительной и иммунной функций, поскольку предотвращает токсическую перегрузку, которая может вызвать у нас заболевания.
Исследования показывают, что протеолитические ферменты, особенно бромелайн, помогают уменьшить тяжесть симптомов, связанных с воспалительными заболеваниями кишечника. А также язвенным колитом, благодаря их противовоспалительным свойствам.
2.Действие протеазы в организме — способствование поглощению аминокислот
Протеаза позволяет поглощать аминокислоты, которые жизненно необходимы для построения и восстановления тканей. Белок состоит из определенной последовательности аминокислот. Когда протеаза разделяет эти последовательности на части, это позволяет нам использовать аминокислоты для ряда функций организма. Нам необходим оптимальный баланс аминокислот для поддержания гомеостаза в организме. Поскольку они регулируют основные метаболические пути, необходимые для роста, поддержания иммунитета и репродукции.
3.Действие протеазы в организме — повышает иммунную функцию
Протеазные ферменты увеличивают активность естественных клеток-киллеров и разрушают патогенные комплексы, способные снижать нормальную иммунную функцию. Исследования показывают, что папаин, трипсин и другие протеазы могут предотвращать или разрушать существующие патогенные иммунные комплексы. Тем самым усиливая лимфодренаж и укрепляя иммунную систему.
Патогенные комплексы являются нормальной частью иммунной системы. Однако, когда они возникают в избытке, то могут вызывать определенные заболевания. В том числе заболевания почек, ревматологические заболевания и воспаления нервов.
4.Действие протеазы в организме — предотвращает образование тромбов и атеросклероз
Протеаза улучшает качество наших клеток крови. Эти ферменты ответственны за образование и растворение сгустков крови. Они также обладают антикоагулянтным, противовоспалительным и антигипертензивным действием.
Протеазные добавки были разработаны и используются для лечения тромботических заболеваний с 1970-х годов. Папаин, протеаза, найденная в папайях, может помочь предотвратить утолщение кровеносных сосудов, заболевание сердца, называемое атеросклерозом. Бромелайн, протеаза, содержащаяся в ананасе, обладает антикоагулянтными свойствами и может снизить риск образования тромбов. Они приводят к таким опасным осложнениям, как ишемическая болезнь сердца, легочная эмболия и инсульт.
5.Действие протеазы в организме — ускоряет восстановление тканей
С древних времен протеазы использовались для содействия восстановлению тканей. Согласно научному обзору, опубликованному в журнале «Advances in Therapy»
«Трипсин и химотрипсин помогают уменьшить воспаление и способствуют более быстрому восстановлению острого повреждения ткани»
Комбинация этих ферментов обычно используется в оральных протеолитических ферментных добавках для восстановления травматических, хирургических и ортопедических повреждений. Наряду с их противовоспалительными эффектами, ферменты протеазы также работают как антиинфекционные, антиоксидантные, анти-сгусток крови и противоотечные агенты.
6.Действие протеазы в организме — помогает предотвратить рак толстой кишки
Исследования показывают, что протеазы, содержащиеся в некоторых продуктах (например, папайя) способны связываться с канцерогенными токсинами в толстой кишке. Они удерживают их вдали от здоровых клеток толстой кишки. Согласно исследованиям, опубликованным в Мировом журнале гастроэнтерологии, ферменты протеазы участвуют в деградации раковой инвазии и метастазировании. Исследователи указывают, что протеазы служат потенциальными целевыми молекулами для терапевтических агентов при лечении колоректального рака.
Протеаза в сравнении с протеиназой и протеасомы
Легко запутаться во многих терминах, которые используются при обсуждении протеазы. Протеаза является общим термином для ферментов, которые разлагают белки путем гидролиза пептидных связей. Исследователи поняли, что существуют два разных типа протеазных ферментов, хотя они обычно группируются вместе. Согласно исследованию, опубликованному в Biochemical Journal,
«Одна группа протеазных ферментов лучше всего действует на интактные белки. В то время как другие ферменты отдают предпочтение небольшим пептидам в качестве субстратов»
Протеиназа представляет собой тип протеазы, которая предпочитает интактные белки. Протеиназа работает, чтобы разорвать внутренние пептидные связи длинных пептидных цепей. Это важно для нормальных физиологических функций и используется в фармацевтических целях.
Протеасомы также являются протеазными комплексами, которые участвуют в протеолизе, воздействуя на расщепление белков в организме. Протеасомы ответственны за деградацию внутриклеточных белков.
Протеаза в сравнении Амилазой, Липазой и Пепсином
Протеаза
Протеаза — это общий термин, который используется для описания любого фермента, расщепляющего белок. Пепсин начинает этот процесс в желудке, а трипсин и химотрипсин вырабатываются в поджелудочной железе и высвобождаются в тонкую кишку. Эти три типа протеазы работают для полного усвоения белка, расщепляя его на простые аминокислоты, всасывающиеся в кровоток.
амилаза
Амилаза — пищеварительный фермент, который расщепляет крахмал на простые сахара, чтобы их можно было использовать для получения энергии. Во-первых, амилаза выделяется слюнными железами. Поэтому она может начать процесс пищеварения, как только мы начнем пережевывать пищу. Это вызывает начало эффекта домино, который составляет пищеварительный процесс. В двух словах, желудочная амилаза способствует разложению частично переваренной пищи в химус, что вызывает высвобождение гормона секретина. Это позволяет поджелудочной железе высвобождать панкреатические ферменты, которые завершат процесс пищеварения.
Липаза
Липаза — это пищеварительный фермент, который расщепляет пищевые жиры, чтобы кишечник мог их усваивать. Липаза высвобождается в основном поджелудочной железой в виде липазы поджелудочной железы. Однако, она также обнаруживается в крови, желудочном соке, кишечном соке и жировой ткани. Желчь начинает процесс переваривания жира, превращая жиры в маленькие жировые шарики. Затем липаза превращает эти глобулы в жирные кислоты и глицерин, простое соединение, которое содержится во всех липидах. Оно используется нашими клетками для получения энергии. Поскольку липаза необходима для правильного переваривания жира, она влияет на многие функции организма. Включая всасывание питательных веществ, регуляцию холестерина и обмен веществ.
Пепсин
Пепсин — это тип протеазы, который вырабатывается в желудке. Как и все протеазы, пепсин расщепляет белки на пептиды. Это одна из трех протеаз в пищеварительной системе человека — две другие — трипсин и химотрипсин. Пепсин участвует в первой фазе переваривания белка.
Добавки протеазы и дозировка
Множество препаратов с протеазой используются как часть лечения инсульта, гемофилии, острого инфаркта миокарда, сепсиса, травматического кровотечения. А также расстройств пищеварения и мышечных спазмов.
В настоящее время на рынке существует несколько различных типов безрецептурных добавок протеазы. Возможно найти добавки с бромелайном и папаином в Интернете или в магазинах по продаже диетических продуктов. А также приобрести трипсин, который обычно производится из бактерий, грибов или свинины. Продукты, содержащие химотрипсин, также доступны и обычно производятся из бычьего или свиного источника.
Согласно информации, представленной в материалах Клиники Майо, в статье, предназначенной для информирования врачей о ферментных добавках, использование и дозировка ферментных добавок протеазы выглядят следующим образом:
- Бромелайн — до 400 мг в день при отеках, ожогах, воспалениях и аллергических ринитах
- Папаин — до 1500 мг в день при воспалении, для пищеварения, симптомах опоясывающего лишая, хронической диарее и фарингите
- Трипсин — до 50 мг в день (обычно в сочетании с бромелайном) для лечения остеоартрита и пищеварительных ферментов
- Химотрипсин — до 100 000 единиц четыре раза в день для уменьшения воспаления и отеков, связанных с язвами, операциями, абсцессами или травматическими повреждениями
Протеазы обычно принимают в сочетании с двумя другими жизненно важными ферментами: амилазой, расщепляющей углеводы, и липазой, расщепляющей жиры. Когда эти пищеварительные ферменты работают должным образом в нашем организме, пищеварительная система будет работать оптимально. Прием добавок с пищеварительными ферментами может помочь людям с заболеваниями пищеварения, возрастной недостаточностью ферментов. А также пониженной кислотностью (так называемой гипохлоргидрией), болезнями печени и недостатком питательных веществ.
В случае, если вы приняли решение принимать добавки с протеазой, рекомендуем рассмотреть следующие варианты:
- Американское здоровье, фермент папайи с хлорофиллом, 250 жевательных таблеток
- Американское Здоровье, Супер энзим папайи плюс, 360 жевательных таблеток
- 21st Century, пищеварительные ферменты, 60 капсул
- Теперь Еда, Жевательные ферменты папайи, 360 леденцов
- Kyolic, Выдержанный экстракт чеснока, Candida Cleanse & Digestion, формула 102, 200 вегетарианских капсул
- Now Foods, Бетаина гидрохлорид, 648 мг, 120 растительных капсул
- Now Foods, Жевательные ферменты папайи, 180 пастилок
Ингибиторы протеазы и дефицит протеазы
Что такое ингибитор протеазы? Это противовирусный препарат, который обычно используется для лечения пациентов с ВИЧ и гепатитом С. Ингибиторы протеазы предотвращают репликацию вируса, блокируя протеазу. Поэтому новый ВИЧ не станет зрелым вирусом, который может инфицировать другие клетки (в частности, клетки CD4). В основном, эти препараты предназначены для уменьшения количества ВИЧ в организме, чтобы замедлить развитие вируса.
Чтобы размножиться, вирус ВИЧ использует иммунные клетки в организме, называемые клетками CD4, поэтому он будет распространяться. Ферменты протеазы допускают эту репликацию, но лекарства-ингибиторы протеазы ВИЧ блокируют ферменты, не позволяя вирусу размножаться.
Эти виды лекарств имеют хорошо известные побочные эффекты и взаимодействуют с другими лекарствами. Поэтому, если вы живете с ВИЧ или гепатитом С, то должны проконсультироваться с врачом, прежде чем добавлять ингибиторы протеазы в свой план лечения.
Люди, которые не инфицированы ВИЧ или гепатитом С, должны убедиться, что они производят достаточно протеазы. Когда организм функционирует должным образом, он произведет достаточно протеазы, чтобы расщепить бело. Однако, когда организм не вырабатывает достаточное количество протеазы, это может привести к заболеваниям, влияющим на метаболическую, пищеварительную. А также сердечно-сосудистую и иммунную системы.
Каковы признаки дефицита протеазы? Тот, кто не потребляет или не производит достаточное количество протеазных ферментов, может испытывать следующие симптомы дефицита:
- газообразование
- спазмы
- изжога
- расстройство желудка
- дискомфорт в животе
- понос
- запор
- тугоподвижность суставов
- усталость
- преждевременные морщины кожи
- седые волосы
Топ-10 продуктов с протеазой и как их получить
Вы найдете ферменты протеазы в некоторых фруктах, овощах и ферментированных продуктах. А также в обработанных, жареных, запеченных, вареных или даже консервированных продуктах. Приготовление или обработка продуктов питания, даже фруктов и овощей, убивает ферменты. Таким образом, необходимо сосредоточиться на употреблении свежих фруктов, сырых овощей и ферментированных продуктов. Например, квашеная капуста, кефир, йогурт и мисо. Другие богатые ферментами продукты включают пророщенные орехи и семена, а также сырые или слегка приготовленные зерновые продукты. Например, зародыши пшеницы.
Основные продукты с протеазой, которые необходимо добавить в свой рацион для улучшения пищеварения, иммунной функции. А также здоровья сердечно-сосудистой системы (это лишь некоторые из преимуществ), включают:
- Ананас
- Имбирь
- Киви
- Йогурт
- Сыр
- Кефир
- Суп мисо
- Квашенная капуста
- Темпе
Чтобы повысить уровень протеазы и других ферментов, необходимо увеличить потребление сырой и ферментированной пищи. Необходимо тщательно пережевывать пищу. Когда пища смешивается со слюной и расщепляется во рту, начинается процесс пищеварения. Чем больше вы жуете, тем меньше работы нужно выполнять в желудке и тонкой кишке.
Действие протеазы в организме – исторические факты
- Первый доклад о протеазах был опубликован в Журнале биологической химии в 1905 году. С тех пор было написано более 350 000 научных статей об этих ферментах.
- Более 2% наших генов кодируют протеазы.
- Наиболее распространенными генами протеаз у людей являются металлопротеазы, за которыми следуют гены серина, цистеина, треонина и аспартила.
- Первым одобренным препаратом протеазы был u-PA (урокиназа), который одобрен для клинического применения в 1978 году. Он до сих пор используется для растворения тромбов в кровеносных сосудах и внутривенных катетерах.
- Протеаза составляет около 60% всего рынка ферментов в мире. Это делает ее наиболее важным промышленным ферментом, представляющим интерес на сегодняшний день.
Меры предосторожности
Побочные эффекты протеазных добавок варьируются в зависимости от типа протеазы, которую вы потребляете. Но обычно это желудочно-кишечные проблемы, такие как спазмы и диарея, аллергические реакции. А также жжение при местном применении протеазных ферментов.
Если вы принимаете протеазы, имейте в виду, что они могут мешать свертывающим кровь и разжижающим кровь препаратам. В случае приема этих лекарств, проконсультируйтесь с лечащим врачом перед использованием любой новой пищевой добавки.
Действие протеазы в организме — последние мысли
- Функция протеаз необходима для всех живых организмов.
- Ферменты протеаз обеспечивают протеолиз, процесс, который разрушает длинные цепочечные молекулы белков, чтобы они могли перевариваться.
- Протеазы вырабатываются поджелудочной железой, а также обнаруживаются в некоторых фруктах, бактериях и других микробах. Три различных типа протеаз включают пепсин, трипсин и химотрипсин.
- Бромелайн — это тип протеазы, который можно найти в стеблях ананаса, а папаин — в латексе папайи. Протеазы также можно найти в ферментированных продуктах, таких как мисо, квашеная капуста и темпе.
- Главные преимущества протеазы включают ее способность усваивать белки и поглощать аминокислоты, улучшать иммунную функцию. А также укреплять здоровье сердечно-сосудистой системы, ускорять восстановление тканей и, возможно, предотвращать рак толстой кишки.
ЧИТАЙТЕ ДАЛЕЕ: Действие амилазы в организме, как антидиабетического фермента, повышающего энергию
Поделиться с друзьями:
В частности, протеолитические ферменты помогают расщеплять и переваривать белок. Они содержатся в организме, а также в некоторых продуктах и пищевых добавках.
Добавки протеолитических ферментов в последнее время приобрели популярность благодаря их многочисленным полезным свойствам.
В этой статье рассматривается потенциальная польза протеолитических ферментов для здоровья, где они содержатся и как их использовать.

Протеолитические ферменты – что это такое, каково их действие, полезные свойства и в каких продуктах они содержатся
Что такое протеолитические ферменты?
Протеолитические ферменты необходимы для многих важных процессов в вашем организме. Их также называют пептидазами, протеазами или протеиназами.
В организме человека они вырабатываются поджелудочной железой и желудком.
Хотя протеолитические ферменты наиболее известны своей ролью в переваривании диетического белка, они также выполняют много других важных задач.
Например, они необходимы для деления клеток, свертывания крови, иммунной функции и рециркуляции белка, среди других жизненно важных процессов (1).
Как и люди, растения также на протяжении всего жизненного цикла зависят от протеолитических ферментов.
Эти ферменты не только необходимы для правильного роста и развития растений, они также помогают поддерживать их здоровье, выступая в качестве защитного механизма от вредителей, таких как насекомые (2, 3).
Интересно, что люди могут получить пользу от приема протеолитических ферментов растительного происхождения.
В результате добавки протеолитических ферментов могут содержать как ферменты животного, так и растительного происхождения.
Резюме:
Протеолитические ферменты – это особые типы ферментов, которые играют важную роль в переваривании белков, иммунной функции и других жизненно важных процессах. Ваш организм производит их, но вы также можете потреблять их, употребляя определенные продукты или принимая добавки.
Источники протеолитических ферментов
Три основных протеолитических фермента, вырабатываемых естественным путем в вашей пищеварительной системе – это пепсин, трипсин и химотрипсин.
Ваш организм производит их, чтобы помочь расщепить пищевые белки, такие как мясо, яйца и рыба, на более мелкие фрагменты, называемые аминокислотами. Они могут тогда быть должным образом переварены и усвоены.
Протеолитические ферменты можно найти в определенных продуктах, а также они доступны в виде добавок.
Пищевые источники
Двумя лучшими пищевыми источниками протеолитических ферментов являются папайя и ананас.
Папайя содержит фермент папаин, также известный как протеиназа папайи. Папаин содержится в листьях, корнях и плодах растения папайи.
Папаин является мощным протеолитическим ферментом. Фактически, он использовался на протяжении тысячелетий в качестве смягчителя мяса благодаря своей способности расщеплять белок (4).
Между тем ананасы содержат мощный протеолитический фермент, называемый бромелайн.
Бромелайн содержится во фруктах, кожуре и сладком соке растения ананаса и веками использовался коренными жителями Центральной и Южной Америки в качестве естественного средства для лечения ряда заболеваний (5).
Вы можете получить папаин и бромелайн, съев сырую папайю и ананас, соответственно. Вы также можете купить эти протеолитические ферменты в форме концентрированных добавок.
Хотя ананасы и папайя являются наиболее распространенными источниками протеолитических ферментов, вот другие продукты, содержащие протеолитические ферменты (6, 7, 8):
Добавки протеолитических ферментов
Добавки протеолитических ферментов выпускаются в форме капсул, жевательных таблеток, порошков и таблеток.
Некоторые добавки содержат протеолитический фермент одного типа, в то время как другие содержат комбинацию.
Бромелайн, папаин, панкреатин, трипсин и химотрипсин являются протеолитическими ферментами, которые обычно включают в смеси в добавки.
Производители получают протеолитические ферменты из растений и животных.
Например, трипсин и химотрипсин, полученные из свиней и коров, являются одними из наиболее распространенных протеолитических ферментов животного происхождения, добавляемых в смеси добавок, в то время как папаин и бромелайн получают из фруктов.
При покупке добавок протеолитических ферментов, ищите информацию об их активности. Некоторые бренды только перечисляют вес каждого фермента в миллиграммах, что не информирует покупателя об их активности.
Предлагаемые уровни активности зависят от фермента, и все еще обсуждаются. Тем не менее заслуживающие доверия бренды будут указывать единицы активности, и вы можете сравнить единицы активности конкретного фермента между брендами (9).
Обычные единицы маркировки активности протеолитических ферментов включают HUT, USP и SAP.
Резюме:
Добавки протеолитических ферментов доступны во многих формах и могут содержать как растительные, так и животные ферменты. Ищите бренды, которые перечисляют активность своих ферментов в единицах активности на этикетке.
Потенциальные полезные свойства протеолитических ферментов
Прием добавок протеолитических ферментов связан с рядом полезных эффектов в отношение здоровья.
Могут улучшить пищеварение
Одним из наиболее распространенных применений протеолитических ферментов является улучшение переваривания и усвоения диетического белка.
Заместительная ферментная терапия поджелудочной железы (ЗФТ) часто используется при лечении недостаточности поджелудочной железы, муковисцидоза, некоторых видов рака, таких как рак поджелудочной железы, колоректальный рак и рак желудка, или после операций на желудке или поджелудочной железе (10, 11, 12, 13).
Прием добавок протеолитических ферментов помогает людям с дефицитом или недостатком этих ферментов при расщеплении диетического белка.
Как пищевые продукты, так и добавки, содержащие протеолитические ферменты, могут помочь улучшить усвоение белка.
Несколько исследований на животных показали, что экстракт киви помогает улучшить расщепление и усвоение белков, особенно мяса, молока, сыра, рыбы и яиц (14, 15).
Другое исследование показало, что, когда люди с несварением принимали добавки, содержащие протеолитические ферменты, они испытывали значительное улучшение при вздутии живота, болях в животе, отрыжке, изжоге и потере аппетита (16).
Могут уменьшить воспаление
Несколько исследований показали, что протеолитические ферменты эффективны в уменьшении воспаления и симптомов, связанных с воспалительными заболеваниями.Одно исследование показало, что инъекция протеолитических ферментов химотрипсина, трипсина и серратиопептидазы крысам уменьшает воспаление больше, чем аспирин (17).
Было выявлено, что некоторые типы этих ферментов являются безопасным и эффективным средством для лечения артрита.
Обзор 10 исследований показал, что протеолитический фермент бромелайн был эффективен в уменьшении таких симптомов, как боль, отек и скованность суставов у людей с остеоартрозом (18).
Другое исследование показало, что добавка, содержащая бромелайн и трипсин, была так же эффективна, как и традиционные противовоспалительные препараты, в уменьшении боли, связанной с остеоартрозом (19).
Бромелайн также эффективен в уменьшении воспаления и облегчении симптомов у людей с синуситом – заболеванием, которое вызывает воспаление носовых пазух (20).
Могут способствовать исцелению и быстрому восстановлению
Прием добавок протеолитических ферментных может быть эффективным способом ускорения заживления ран.
Например, исследования на животных показали, что как папаин, так и бромелайн ускоряют заживление ран и ускоряют рост новых тканей при непосредственном нанесении на кожу (21, 22).
Кроме того, было обнаружено, что протеолитические ферменты сокращают время восстановления после операции.
Одно исследование с участием 24 человек, которые только что перенесли хирургическую стоматологическую операцию, показало, что прием добавки, содержащей 5 мг протеолитического фермента серрапептазы, уменьшал отек и интенсивность боли (23).
Некоторые исследования показали, что послеоперационное лечение бромелайном может помочь уменьшить отеки и синяки после косметической операции (24, 25).
Могут помочь при синдроме раздраженного кишечника и воспалительном заболевании кишечника
Несколько исследований показали, что протеолитические ферменты могут уменьшать распространенные симптомы, связанные с синдромом раздраженного кишечника (СРК), такие как вздутие живота, газы, запоры и боли в животе.
Например, одно исследование с участием 126 человек с СРК показало, что добавка, содержащая папаин, приводит к значительному улучшению при запорах, вздутии живота и болезненных дефекациях (26).
Другое исследование, в котором участвовали 90 человек с СРК, показало, что добавка пищеварительных ферментов, включающая протеолитические ферменты, облегчает такие симптомы, как вздутие живота, газы и боль в животе (27).
Кроме того, было выявлено, что бромелайн уменьшает воспаление у людей с воспалительными заболеваниями кишечника, включая язвенный колит и болезнь Крона (28).
Могут уменьшить болезненность мышц
Продолжительность болезненности мышц может составлять до четырех дней после тренировки.
Протеолитические ферменты могут помочь уменьшить болезненность мышц и ускорить восстановление мышц после интенсивной тренировки.
В одном небольшом исследовании на мужчинах смесь протеолитических ферментов, содержащая бромелайн и куркумин, значительно снижала мышечную чувствительность и боль после тренировки по сравнению с плацебо (29).
Другое исследование показало, что люди, которые потребляли добавки, содержащие трипсин, бромелайн, папаин и химотрипсин до и после бега с горы, испытывали мышечную меньшую слабость и более быстрое восстановление мышц, чем те, кто принимал плацебо (30).
Некоторые протеолитические ферменты могут обладать противораковыми свойствами
Исследования в пробирке и на животных показали, что некоторые протеолитические ферменты могут помочь бороться с раковыми клетками.
Одно исследование в пробирке продемонстрировало, что бромелайн ингибирует рост и вызывает гибель клеток рака желудка и толстой кишки человека (31).
Аналогичное исследование показало, что бромелайн, извлеченный из стеблей ананаса, оказывал противораковое действие на клетки рака толстой кишки. Предполагается, что как бромелайн, так и содержащие бромелайн продукты, такие как ананас, могут помочь предотвратить рак толстой кишки (32).
Другое недавнее исследование в пробирке показало, что как бромелайн, так и папаин останавливали рост и вызывали гибель клеток в раковых клетках желчного протока человека (33).
Хотя эти результаты являются многообещающими, для изучения эффективности и безопасности протеолитических ферментов при лечении некоторых видов рака необходимы исследования на людях.
Резюме:
Протеолитические ферменты могут помочь перевариванию белка, уменьшить симптомы синдрома раздраженного кишечника, уменьшить воспаление, облегчить болезненность мышц и ускорить восстановление после операции. Исследования также предполагают, что они могут даже помочь бороться с раковыми клетками.
Применение протеолитических ферментов
Вы можете использовать протеолитические ферменты разными способами, в зависимости от ваших целей.
Если вы хотите естественным образом увеличить потребление этих впечатляющих ферментов, сфокусируйтесь на добавлении в свой рацион большего количества продуктов, богатых протеолитическими ферментами.
Папайя, ананас, киви и ферментированные продукты – все это отличные источники.
Если вы желаете принимать добавку протеолитических ферментов, обязательно приобретите ее у известного бренда, который добровольно проверяет свои продукты на активность и качество.
Активность каждого фермента в единицах активности, а не только в весе, должна быть четко указана на этикетке.
Существует бесчисленное множество добавок протеолитических ферментов, каждая с различными комбинациями ферментов.
Поскольку они могут сильно различаться по составу, оптимальную дозировку и продолжительность приема вы можете узнать непосредственно на упаковке отдельно взятого средства.
Прежде чем начинать прием добавок всегда консультируйтесь с врачом.
Резюме:
Вы можете получить протеолитические ферменты, употребляя папайю, ананас, киви и ферментированные продукты, или можете принимать добавки. Обязательно ознакомьтесь с информацией на упаковке перед покупкой добавок, проверяя активность, качество, тип фермента и инструкции по дозировке.
Потенциальный вред и побочные эффекты
Протеолитические ферменты обычно считаются безопасными, но у некоторых людей они могут вызывать побочные эффекты.
Возможно, у вас могут возникнуть проблемы с желудочно-кишечным трактом, такие как диарея, тошнота и рвота, особенно если вы принимаете очень высокие дозы (34).
Хотя пищевые добавки чаще вызывают побочные эффекты, употребление большого количества фруктов с высоким содержанием протеолитических ферментов также может вызвать расстройство пищеварения.
Также могут возникнуть аллергические реакции. Например, у людей, которые имеют аллергию на ананас, также может быть аллергия на бромелайн, и его прием может вызвать побочные реакции, такие как кожная сыпь (35).
Кроме того, протеолитические ферменты, такие как бромелайн и папаин, могут мешать разжижающим кровь препаратам. Папаин также может повышать концентрацию определенных антибиотиков в крови (36).
Поэтому прежде чем принимать протеолитические ферменты важно проконсультироваться с врачом.
Резюме:
Чтобы воспользоваться полезными свойствами протеолитических ферментов, потребляйте больше богатых ими продуктов или принимайте высококачественную добавку. У некоторых людей они могут вызывать побочные эффекты, в том числе расстройство пищеварения, и могут реагировать с некоторыми лекарствами.
Подведем итог
- Протеолитические ферменты имеют много важных функций в организме, в том числе помогают расщеплять пищу для получения энергии, и содержатся в определенных продуктах и добавках.
- Исследования показывают, что они могут улучшить пищеварение, уменьшить воспаление, облегчить боль при артрите и, возможно, уменьшить симптомы, связанные с СРК.
- Более того, предварительные исследования показали, что они могут помочь в борьбе с раком, хотя необходимы дополнительные исследования.
- Включение протеолитических ферментов в ваш рацион с помощью цельных продуктов или пищевых добавок может несколькими способами принести пользу вашему здоровью.
Поделиться новостью в соцсетях Метки: Протеолитические ферменты
 « Предыдущая запись
« Предыдущая запись  Следующая запись »
Следующая запись »NSP: Протеаза Плюс — расщепление и усвоение белков
Протеаза Плюс
 Слово «ферменты» обычно отождествляют с процессом переваривания пищи в желудочно-кишечном тракте. Однако подавляющая часть ферментов находится во внутренней среде организма, обеспечивая его работу и обмен веществ. С возрастом наш организм производит все меньше ферментов, на синтез которых могут также влиять факторы внешней среды, инфекция, содержание белка, микроэлементов, витаминов.
Слово «ферменты» обычно отождествляют с процессом переваривания пищи в желудочно-кишечном тракте. Однако подавляющая часть ферментов находится во внутренней среде организма, обеспечивая его работу и обмен веществ. С возрастом наш организм производит все меньше ферментов, на синтез которых могут также влиять факторы внешней среды, инфекция, содержание белка, микроэлементов, витаминов.
Протеолитические ферменты уже несколько десятилетий успешно применяют в комплексной терапии различных заболеваний, что сокращает сроки лечения. Так протеолитические ферменты можно принимать при заболеваниях, связанных с деструкцией хряща (артрозы, артриты, остеохондроз), гнойных и воспалительных заболеваниях (бронхит с обильной мокротой, плеврит, нагноение раны, трофические язвы и др.). Процессы разрушения и восстановления тканей при различных деструктивных заболеваниях также происходят при участии протеолитических ферментов. Применение СЭ эффективно при синдроме диабетической стопы, что в несколько раз снижает частоту некротических осложнений, при хроническом простатите. Сообщают об успешном применении ферментов при фиброзно-кистозной мастопатии, спаечной кишечной непроходимости, при витилиго, где в большинстве случаев отмечают стабилизацию процесса и репигментацию кожи. Все шире внедряются СЭ в ортопедию и травматологию. Западные онкологи убедились в том, что системные энзимные препараты могут быть использованы в высоких дозах в течение длительного времени на всех стадиях развития злокачественных новообразований, особенно в период радио- или химиотерапии, а также для облегчения состояния у больных в терминальной стадии.
Компания NSP разработала уникальный ферментный комплекс Протеаза Плюс, который может быть использован для проведения системной энзимотерапии. В этом случае его следует назначать между приёмами пищи. В состав препарата входят растительные протеазы, а также пищевые волокна из свеклы. Протеаза Плюс обладает способностью активировать макрофаги и иммунные клетки-киллеры, что оправдывает применение комплекса при иммуннодефицитных состояниях и в онкологии.
Растительные волокна свеклы обыкновенной (Beta vulgaris) могут играть роль переносчика протеолитических ферментов в процессе их продвижения в желудочно-кишечном тракте во время приема комплекса натощак.
Комплекс ферментов Протеаза Плюс также можно использовать для усиления пищеварительной функции желудка. В этом случае перед употреблением необходимо открыть капсулу и высыпать её содержимое в любой негорячий пищевой продукт (во избежание тепловой инактивации ферментов). БАД к пище Протеаза Плюс является дополнительным источником протеолитических ферментов.
Применение и рекомендации
Применение «Протеаза Плюс»: для улучшения переваривания пищи взрослым применять по 1 капсуле во время еды. Для проведения противовоспалительной терапии и иммунокоррекции принимать 1-3 капсулы между приемами пищи 3-4 раза в день. Перед применением рекомендуется проконсультироваться с врачом.
Противопоказания «Протеаза Плюс»: индивидуальная непереносимость компонентов продукта, беременность и кормление грудью.
Условия хранения: хранить в сухом, недоступном для детей месте, при температуре не выше +25°С.
Обратите внимание!
Компания Nature’s Sunshine Products производит свою продукцию отдельно для каждой страны с учетом норм суточной потребности человека в пищевых веществах, утвержденных службой по надзору в сфере защиты прав потребителей и благополучия человека. В каждой стране существует свое Министерство здравоохранения, поэтому состав, показания и противопоказания одних и тех же продуктов NSP в разных странах могут существенно отличаться.
Протеаза Плюс
Россия, Беларусь, Казахстан, Грузия, Армения, Монголия
Protease Plus
90 капсул по 600 мг
Состав «Протеаза Плюс»: 1 капсула: Растительные протеазы — 203 мг; растительное волокно свеклы обыкновенной (Beta vulgaris) — 267 мг. Желатиновая капсула: желатин, вода.
Protease Plus
Украина, Молдова
Протеаза Плюс
90 капсул по 500 мг
Состав «Protease Plus»: 1 капсула: Смесь протеолитических ферметов (протеаз) разной активности — 500 мг. Протеазная активность — 60.000 од/кап.
Информация на сайте дана для ознакомления. Продукцию NSP можно купить самостоятельно в любом официальном магазине компании NSP, адреса магазинов можно просмотреть здесь Продукция в официальных магазинах продается только при наличии дисконтной карты NSP. Оплата производится непосредственно при получении товара наличными деньгами в национальной валюте по курсу доллара на момент покупки.
Дисконтную карту NSP можно оформить здесь или заполнить форму регистрации ниже.
Оформление дисконта ни к чему не обязывает. Всех зарегистрированных на нашем сайте мы бесплатно консультируем и сопровождаем на разных этапах прохождения программ. Не каждая структура NSP имеет в штате активных нутрициологов с подобным стажем и опытом, продолжающих повышать квалификацию.
БАДы: Протеаза плюс
Протеолитические ферменты, расщепление и усвоение белка, микрофлора кишечника, противовоспалительное и противоотечное средство
Источником энергии для человека и основой всех тканей его организма являются белки. Человек получает белки из пищи. Но до тех пор, пока белки пищи не будут расщеплены в процессе пищеварения до аминокислот, они не усвоятся, следовательно, не принесут никакой пользы. Кроме того, неполное расщепление белков в желудочно-кишечном тракте ведет к возникновению многих достаточно тяжелых заболеваний. Гидролиз белков – комплекс сложных биохимических реакций, в которых участвуют протеолитические ферменты, или протеазы, роль которых заключается в расщеплении пептидных связей между аминокислотами в белках.
Протеазы синтезируются самим организмом, но этот процесс по некоторым причинам может быть замедлен или даже нарушен. Основными среди этих причин можно назвать естественное старение организма, хронические и инфекционные заболевания, неполноценное питание, вредные привычки, экологическая обстановка. В результате сниженного синтеза протеолитических ферментов или их низкой активности из желудочно-кишечного тракта в кровяное русло поступают не аминокислоты, а чужеродные агенты – молекулы белков пищи. Это служит причиной нарушения обменных процессов, резкого снижения иммунитета, тяжелых аутоиммунных болезней и др.
Компания Nature’s Sunshine Products предлагает вашему вниманию дополнительный источник протеолитических ферментов – биологически активную добавку Протеаза Плюс (Protease Plus).
БАД Протеаза Плюс NSP является полиферментным препаратом и создана в соответствии с новейшими разработками СЭТ (системная энзимотерапия). Протеаза Плюс представляет собой комплекс протеолитических ферментов (энзимов), которые не только восполняют их недостаток в организме, но и оказывают комплексное воздействие: иммуномодулирующее, противовоспалительное, фибринолитическое и некролитическое, а также способствуют ускорению регенеративных процессов и улучшению региональной микроциркуляции крови. Известно, что устранение патологического процесса в каком-либо органе или системе основано на усиленном поступлении крови в зону патологии. Энзимы БАД Протеаза Плюс улучшают качественный состав крови, снижают ее вязкость, укрепляют стенки сосудов, активизируя тем самым кровоток и способствуя снабжению клеток кислородом и питательными веществами, а также ускоренному разрушению и вымыванию токсинов, рассасыванию гематом и отеков.
Протеаза Плюс НСП действует на начальной стадии заболевания и предотвращает ее дальнейшее развитие (например, в случае применения препарата в комплексной терапии сердечно-сосудистых заболеваний, можно на 90 % снизить риск таких осложнений, как инфаркт или инсульт). Протеаза Плюс (Protease Plus)способна бороться и с бактериальными и вирусными инфекциями: во-первых, стимулирует неспецифическую защиту организма, а во-вторых, помогает снизить симптомы.
По результатам клинических исследований, интенсивно проводимых в последние годы, энзимы способны значительно увеличивать чисто Т-хелперов и цитоксических Т-лимфоцитов, что позволяет как воздействовать на злокачественные новообразования, так и облегчать состояние больных в период облучения или химиотерапии. Разработки в этом направлении ведутся в ведущих онкоцентрах мира.
БАД НСП Протеаза Плюс рекомендуется принимать при следующих заболеваниях:
- тромбофлебит, атеросклероз, облитерирующий эндартериит
- цистит, простатит, нефрит
- стенокардия, подострая стадия инфаркта миокарда
- бронхит, пневмония, синусит
- гепатит, панкреатит
- хронический простатит
- нарушения обмена веществ (углеводного и липидного)
- артрит (в т.ч. ревматоидный)
- аутоиммунные заболевания
- аллергическая и угревая сыпь
Протеаза Плюс будет способствовать ускоренному заживлению хирургических ран, ожогов, переломов, предотвращению таких послеоперационных осложнений, как спайки, гематомы, отеки.
Состав: смесь протеолитических энзимов – 203 мг; растительное волокно (свекла) – 197 мг; бентонит – 100 мг.
Суммарная протеолитическая активность – 60000 единиц.
Способ применения Протеаза плюс (Protease Plus):по 1 капсуле во время еды (1–3 раза в день).
Противопоказания: индивидуальная непереносимость продукта
Медицинская энциклопедия — протеазы
Протеазы (по новой классификации — пептидгидролазы) — ферменты, расщепляющие пептидные связи в белках и продуктах их распада. Относятся к классу гидролаз, т. е. ферментов, которые осуществляют разрыв внутримолекулярных связей с присоединением элементов воды:
Некоторые протеазы, кроме того, катализируют реакции транспептидации.
Протеазы — одна из наиболее многочисленных групп ферментов; они найдены во всех животных и растительных тканях и у микроорганизмов. Протеазы участвуют в процессах белкового обмена, расщепляя белки до свободных аминокислот. Протеазы желудочно-кишечного тракта выделяются в неактивной форме в виде проферментов или зимогенов. Под действием различных факторов (рН среды, действие других ферментов и др.) они затем переходят в активную форму. Большое количество протеаз выделено в настоящее время в кристаллическом виде.
По характеру действия протеазы делятся на две группы: экзопептидазы (по старой классификации — пептидазы) и эндопептидазы (или протеиназы). Экзопептидазы гидролизуют дипептиды, а также пептидные связи полипептидов и белков, образованные концевыми аминокислотными остатками. Экзопептидазы делятся на дипептидазы, гидролизующие дипептиды, аминопептидазы, гидролизующие пептидную связь, образованную аминогруппой полипептидной цепи и карбоксильной группой концевой аминокислоты, и карбоксипептидазы, действующие на пептидную связь, образованную карбоксильной группой полипептидной цепи и аминогруппой концевой аминокислоты. Аминопептидазы и карбоксипептидазы иногда называют полипептидазами. Карбоксипептидаза, образующаяся в поджелудочной железе, выделяется в кишечник в виде неактивного предшественника — прокарбоксипептидазы, который активируется затем трипсином. Карбоксипептидаза обнаружена также в ряде других органов и тканей млекопитающих. Большинство известных экзопептидаз является металлоферментами.
Эндопептидазы — ферменты, гидролизующие внутренние пептидные связи белковой молекулы. Специфичность их действия зависит от структуры радикалов, прилегающих к пептидной связи. Так, например, пепсин предпочтительнее разрывает связи, образованные аминогруппой ароматической аминокислоты и карбоксильной группой аспарагиновой или глютаминовой кислоты, а химотрипсин более легко разрывает пептидные связи, в образовании которых принимает участие карбоксильная группа тирозина или фенилаланина.
Протеазы находят широкое применение в медицине: некоторые из них применяют для очищения раневых поверхностей, при глазных операциях, в борьбе с тромбозами и т. д.; трипсин используют в качестве противовоспалительного средства. См. также Ферменты.
Протеазы (пептидгидролазы) — Студопедия
Белок и пептиды расщепляют ферменты, объединяемые в подкласс пептидгидролаз (К.Ф.3.4.). Их называют также протеазами, протеолитическими ферментами.
Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и пептидов:
Расщепление пептидной связи в точках, удаленных от конца молекулы, катализируют эндопептидазы. Их делят на четыре группы: сериновые (К.Ф.3.4.21), тиоловые (К.Ф.3.4.22), карбоксильные (К.Ф.3.4.23) и металлосодержащие (К.Ф.3.4.24).
Отщепление концевых аминокислот и дипептидов, а также гидролиз дипептидов катализируют экзопептидазы, которые разделяют на пять групп. Аминопептидазы (К.Ф.3.4.11) катализируют отщепление единичных аминокислот от N-конца полипептидной цепи, карбоксипептидазы (К.Ф.3.4.16, 3.4.17) – от С-конца. Дипептидазы (К.Ф.3.4.13) гидролизуют дипептиды. Дипептидилпептидазы (К.Ф.3.4.14) и пептидилдипептидазы (К.Ф.3.4.15) катализируют отщепление дипептидов соответственно от N-конца и от С-конца полипептидной цепи. Схема классификации дана на рис 7.1
 |
Существующая классификация пептидгидролаз несовершенна, поскольку в ней используются в качестве разграничительных различные признаки: деление пептидаз на группы проведено по характеру действия на субстрат, а протеиназ – по структуре каталитического центра. В настоящее время описано несколько сот пептидгидролаз различного происхождения. На основании этого обширного материала предлагаются новые варианты классификации, в частности, только по структуре каталитического центра.
Скорость ферментативного гидролиза белковых соединений определяется наличием в них пептидных связей, специфичных для действия фермента, а также пространственной структурой субстрата.
На доступность пептидных связей гидролизу влияют вторичная, третичная и четвертичная структура белков. Белки могут иметь один или два типа упорядоченных вторичных структур (α-спиральной и β-складчатой), представленных в различных сочетаниях и охватывающих более или менее значительную часть полипептидной цепи.
В упорядоченных структурах определенные участки полипептидной цепи экранированы и недоступны действию ферментов. Чем выше степень упорядоченности структуры, тем менее белок подвержен протеолизу.
Третичная структура белка, его геометрическая форма определяет соотношение экспонированной и экранированной частей молекулы (то есть доступной и недоступной протеолизу),
Наименее доступны протеолизу молекулы с наименьшей удельной поверхностью, то есть приближающиеся по форме к шару.
Четвертичную структуру имеют белковые молекулы, состоящие из субъединиц. Последние могут быть ассоциированы за счет ковалентных, ионных и водородных связей. Ассоциация субъединиц снижает относительную величину экспонированной части молекулы, увеличивает ее конформационную стабильность за счет внутримолекулярных взаимодействий. Ассоциированные молекулы менее доступны действию ферментов, чем диссоциированные.
Денатурация белков сопровождается развертыванием полипептидной цепи, демаскированием прежде экранированных групп. Снимаются ограничения доступности субстрата, обусловленные вторичной, третичной четвертичной структурой. Денатурированные белки гидролизуются, целом быстрее и полнее нативных.
Сериновые протеиназы объединяют группу эндопептидаз, имеющих в каталитическом центре остаток серина. У большинства сериновых протеиназ в каталитическом центре находят аминокислотные остатки Асп 102, Гис 57 и Сер 195. Сериновыё протеазы ингибируют агентами, взаимодействующими с остатком серина, такими как диизопропилфторфосфат (DFP), фенилметилсульфонилфторид (PMSF), сульфогалогениды, а также природными протеолитическими ингибитора животного, растительного и микробного происхождения. Все сериновые протеиназы проявляют максимальную активность в нейтральной или щелочной среде. Молекулярная масса составляет от 12-15 кДа у ферментов с единственной полипептидной цепью, до 200-300 кДа – у ферментов с субъединичной структурой.
К группе сериновых протеиназ относятся ферменты животного, растительного и микробного происхождения, многие из которых хорошо изучены и выпускаются в виде промышленных препаратов.
В поджелудочной железе человека и млекопитающих животных синтезируются сериновыё протеиназы – трипсин (К.Ф.3.4.21.4), химотрипсины А и В (К.Ф.3.4.21.1), химотрипсин С (К.Ф.3.4.21.2). Эти ферменты образуются первоначально в виде предшественников (трипсиногена и химотрипсиногенов), которые превращаются в активные формы под действием трипсина. При протеолитическом процессинге трипсиногена от его молекулы отщепляется N-концевой гексапептид, реакция активируется кальцием.
Активная форма трипсина – однокомпонентный белок, состоящий из единственной полипептидной цепи. Фермент, выделенный из поджелудочной железы человека и различных млекопитающих, имеет молекулярную массу 22,9-25,5 кДа, оптимальный рН 7-8. Стабилен при рН не выше 6. В щелочной среде происходит самопереваривание. В организме трипсин стабилизируется с помощью ингибитора, с которым образует неактивный комплекс, устойчивый к протеолизу. Ингибитор синтезируется в поджелудочной железе. Трипсин гидролизует пептидные связи, образованные карбоксилами аргинина или лизина. Существенно наличие свободной аминогруппы диаминокислот по соседству с расщепляемой связью. Фермент гидролизует не только амидные, но также сложноэфирные связи. Он расщепляет различные животные и растительные белки, проявляет высокую активность в отношении белковых компонентов клеточных стенок микроорганизмов. Комплекс трипсина и литической мурамидазы – лизоцима, секретируемого слизистой кишечника, является важнейшим фактором регуляции состава микрофлоры пищеварительного тракта животных и человека.
Химотрипсины образуются из химотрипсиногенов после отщепления пептида, состоящего из 15 аминокислотных остатков. Молекулярная масса химотрипсинов составляет 24-25,8 кДа, оптимальный рН 7-9. Химотрипсины стабильны в кислой среде. Ферменты предпочтительно катализируют расщепление в белках пептидных связей, в образовании которых участвуют карбоксилы ароматических аминокислот. Гидролизуют также связи, образованные карбоксилами лейцина, метионина, триптофана. Химотрипсины, как и трипсин, расщепляют сложные эфиры. Разнообразие типов гидролизуемых связей определяет широкую специфичность действия химотрипсинов.
В группу сериновых входят многие внеклеточные и внутриклеточные протеиназы микроорганизмов. Классическими представителями секретируемых сериновых протеиназ бактерий являются субтилизины А, В и BPN’ из культуры В. subtilis – белки молекулярной массы 26,3-27,5 кДа с оптимумом действия при рН 8-11. Многие бациллы продуцируют субтилизиноподобные сериновыё протеиназы.
Для внеклеточных сериновых протеиназ бактерий характерен оптимум действия в щелочной зоне (рН 8-12,5), при температуре 50-70° С. Ферменты стабильны в зоне рН от 6 до 13, при температуре не выше 50° С. В качестве стабилизатора могут использоваться соли кальция.
Сериновыё протеиназы входят в состав комплексных ферментных препаратов, выделяемых из грибов аспергиллов. У Asp. oryzae найдены разновидности сериновых протеиназ, которые при действии на казеин проявляют максимальную активность при рН 7-8,5 и 9-11,5.
Многие виды микроскопических грибов (p. p. Acremonium, Alternaria, Aspergillus, Cephalosporium, Fusarium, Penicillium, Trichoderma, Verticillium и др.) синтезируют внеклеточные сериновыё протеиназы. Большинство исследованных ферментов этой группы имеют молекулярную массу 18-35 кДа, оптимум действия – при рН от 5 до 12 и температуре 55-60° С. Многие сериновыё протеиназы грибов стабилизируются ионами кальция.
В соке растений присутствуют растворимые формы субтилизиноподобных сериновых протеиназ. Их выделили из плодов дыни, различных видов тыквы, из томатов, плодов маклюры (сем. тутовых), из листьев подсолнечника, корней одуванчика, клубеньков ольхи. Все исследованные растительные субтилизины – гликопротеины, фермент из маклюры содержит 25,6% углеводов. Они синтезируются в виде препроферментов, которые после протеолитического процессинга превращаются в активные формы. Молекулярная масса активных форм — 50-70 кДа, у подсолнечника – 25 кДа. Оптимальный рН действия – в интервале 7,3-11, при температуре 55-70° С. Стабильны при температуре не выше 50-60° С. Растительные субтилизины имеют широкую зону рН-стабильности: фермент из тыквы – 5-10, дыни – 4-12, подсолнечника – 4-10. Гидролизуют казеин, азоказеин, азоколлаген, гемоглобин и другие белки, преимущественно расщепляя связи, образованные гидрофобными аминокислотами (лейцином, фенилаланином, тирозином), с меньшей скоростью – образованные цистеином, дикарбоновыми аминокислотами и их амидами.
Растения синтезируют различные ингибиторы ферментов, среди которых наиболее широко представлены ингибиторы сериновых протеиназ, в частности, ингибиторы трипсина. Они найдены в семенах бобовых (сои, фасоли, гороха), злаков (пшеницы, ржи, кукурузы), гречихи, в клубнях картофеля, корнеплодах моркови, яблоках, листьях капусты и других источниках. Ингибиторы трипсина предотвращают инфицирование растений микроорганизмами и повреждение насекомыми, поскольку большая часть патогенных микроорганизмов и насекомых-вредителей синтезирует трипсиноподобные ферменты. В семенах гречихи найден медленно взаимодействующий и прочно связывающийся ингибитор трипсина, подавляющий прорастание спор и рост мицелия патогенного гриба Alternaria alternata. В клубнях картофеля присутствуют две разновидности ингибиторов сериновых протеиназ с молекулярной массой 21 и 22 кДа. Первый подавляет активность трипсина, химотрипсина и эластазы, второй – только двух первых ферментов. Среди ингибиторов химотрипсина, синтезирующихся в тканях картофеля, нашли высокоэффективный пептид массы всего 5 кДа. Расшифровка структуры низкомолекулярного ингибитора перспективна в целях создания синтетических аналогов для применения в качестве средств защиты растений и медицинских препаратов.
В семенах сои – две разновидности ингибиторов трипсина: ингибитор Кунитца и ингибитор Баумана-Бирк (ББИ). Второй способен одновременно и независимо связывать на одном центре – трипсин, а на другом – эластазу лейкоцитов человека и химотрипсиноподобные ферменты, за что получил название «двухголового». Показано, что ББИ обладает антиканцерогенным действием, препятствуя метастазированию и росту злокачественных опухолей, происходящему при участии лейкоцитарных ферментов химотрипсинового типа. Содержание ББИ в разных сортах сои составляет от 0,5 до 1,5 мг/г семян, в некоторых видах коммерческой соевой муки – до 1,9 мг/г. В семенах сои ББИ представлен несколькими изоформами, число которых, в зависимости от сорта сои, составляет от 2 до 7. Высокая биологическая активность ББИ побудила пересмотреть выводы об антипитательных свойствах соевых ингибиторов. Считают, что антипитательные свойства связаны с присутствием в сое большого количества таннинов – неспецифических ферментных ингибиторов широкого спектра, а также гемаглютининов.
Помимо ингибиторов собственно сериновых протеиназ, растения синтезируют бифункциональные ингибиторы, подавляющие активность α-амилазы и сериновых протеиназ. Такие ингибиторы характерны для семян злаков. В процессах гидролиза растительных белков необходимо принимать во внимание присутствие ингибиторов в растительном сырье.
Сериновыё протеиназы животного и микробного происхождения прочно вошли в номенклатуру промышленных феррментных препаратов. Из животного сырья производят трипсин, химотрипсин и комплексный препарат панкреатин с активностью обоих этих ферментов. Из микробного сырья получают Проназу, Римопротелин, Протосубтилин щелочной, Амилопроторизин, Лизосубтилин и другие препараты.
Тиоловые (цистеиновые) протеиназы. В эту группу входят эндопептидазы, для проявления каталитической активности которых существенна сульфгидрильная группа цистеина. Тиоловые протеиназы ингибируются парахлормеркурибензоатом (PCMB), монойодуксусной кислотой (MIA) и другими окислителями, а также ионами тяжелых металлов. Активируются восстановителями (2-меркаптоэтанолом, дитиотреитолом, цистеином, бисульфитом натрия и пр.).
Большинство тиоловых протеиназ имеют рН-оптимум в слабокислой или нейтральной зоне. К тиоловым принадлежат широко применяемые в практике протеиназы растительного происхождения – папаин, химопапаины А и В, бромелаин, фицин.
Папаин (К.Ф.3.4.22.2) и химопапаины А и В (К.Ф.3.4.22.6) выделяют из млечного сока дынного дерева. Это ферменты молекулярной массы 23,4-28 кДа с оптимумом рН 6-7. Папаин стабилен в зоне рН 3-11. Наибольшая стабильность наблюдается при рН 5. В присутствии окислителей папаин быстро теряет активность, поэтому при работе с ним необходимо следить за окислительным потенциалом среды.
Бромелаин (К.Ф.3.4.22.4) выделяют из сока зрелых стеблей ананаса, фермент имеет массу 35 кДа, оптимальный рН 5-6.
Фицин (К.Ф.3.4.22.3) получаемый из латекса тропического инжира, имеет молекулярную массу 23,8кДа и оптимальный рН 6,5-9,5.
Папаин, бромелаин, фицин — протеиназы широкой субстратной специфичности. Они гидролизуют в белках пептидные связи, образованные лейцином или глицином. Другие типы связей, в том числе характерные для специфичности пепсина, трипсина, химотрипсина, карбоксипептидазы, также могут расщепляться, хотя и с меньшей скоростью. Благодаря этому растительные тиоловые протеиназы более глубоко гидролизуют белки, чем сериновыё и карбоксильные протеиназы животного происхождения.
В растениях найдены ингибиторы цистеиновых протеиназ. Из клубней картофеля изолирован белок молекулярной массы 23 кДа, подавляющий активность папаина, бромелаина и фицина. В семенах тыквы – ингибитор молекулярной массы 7,5 кДа, эффективно подавляющий фицин и папаин, менее – химопапаин, на бромелаин не действует. В семенах сои содержатся две формы ингибитора цистеиновых протеиназ основная, с молекулярной массой 14 кДа, и минорная – 8,2 кДа. Основной компонент ингибирует папаин, бромелаин, фицин, химопапаин. В его молекуле три дисульфидных моста, разрыв которых под действием восстановителей (цистеина, цистамина) приводит к обратимой инактивации. Окислители реактивируют ингибитор.
Тиоловые протеиназы продуцируют эубактерии (клостридии, стрептококки, стафилококки) и архебактерии. У грибов их находят редко. Микробные тиоловые протеиназы наиболее активны при рН 7-8,8.
Карбоксильные протеиназы распространены у животных и эукариотических микроорганизмов. В каталитическом центре карбоксильных протеиназ – две карбоксильные группы. Активность подавляют эпоксисоединения, диазокетоны, природные ингибиторы типа пепстатина.
Карбоксильные, или кислые, протеиназы, за малыми исключениями, проявляют активность в кислой среде.
К числу кислых протеиназ относятся пепсины млекопитающих пепсин А (К.Ф.3.4.23.1), пепсин В (К.Ф.3.4.23.2) и пепсин С (К.Ф.3.4.23.3). Это белки молекулярной массы 31-40 кДа с оптимумом действия при рН2-4.
В слизистой желудка человека синтезируется предшественник пепсина – пепсиноген (42 кДа), который превращается в пепсин (34-35 кДа)| в присутствии кислоты или автокаталитически, в результате гидролиза активным пепсином.
Пепсин проявляет специфичность в отношении связей, образованных аминофуппами тирозина или фенилаланина. Наличие свободной аминофупиы вблизи пептидной связи препятствует гидролизу белка, а карбоксильной – увеличивает скорость гидролиза. Пепсин расщепляет различные животные и растительные белки, в том числе казеин, коллаген, глютин, эластин, кератин, гистон.
Способность синтезировать кислые протеиназы широко распространена у микроскопических грибов – аспергиллов, пенициллов, мукоров, Rhizopus, Trichoderma и др. Внеклеточные кислые протеиназы грибов – ферменты молекулярной массы от 30 до 100 кДа (чаще 32-39 кДа), с оптимумом действия при рН 2-4,6. Стабильны в кислой среде (рН 2,5-6), в нейтральной среде быстро и необратимо инактивируются. Оптимальная температура действия 55-75°С, большинство исследованных кислых протеиназ устойчивы при температуре до 55° С, некоторые при 60-65° С. По специфичности действия кислые протеиназы грибов сходны с пепсином.
Внеклеточные кислые протеиназы грибов, наряду с другими видами протеолитических ферментов, входят в состав комплексных ферментных препаратов, таких как Амилоризин, Амилопроторизин, Пектаваморин, Пектофоетидин, Целловиридин, Целлюлаза-100 и др. Из аспергиллов выделяют очищенные препараты кислойпротеиназы, предназначенные для пищевой промышленности и медицины.
Металлосодержащие протеиназы – это ферменты, в каталитический центр которых входит ион или ионы металлов, существенные для проявления каталитической активности. Такими металлами чаще всего являются цинк, кобальт или марганец. Некоторые металлопротеиназы содержат как единственный металл кальций или магний. Кальций может входить в молекулу фермента также как ион-стабилизатор. Так в металлопротеиназе В. subtilis цинк является каталитически активным металлом, а кальций – стабилизатором.
Металлы играют важную роль в каталитическом акте. С их помощью образуется тройной координационный комплекс: фермент-металл-субстрат. При этом стабилизируется высшее валентное состояние металла. Ионы металлов могут образовывать координационные связи с атомами азота, серы, кислорода, имеющими неподеленные пары электронов. Отток электронов от групп >С=0 и -NH- к иону металла облегчает разрыв пептидной связи.
Все металлопротеиназы ингибируются хелатными агентами (EDTA, EGTA, о-фенантролином и др.). Инактивация чаще всего носит обратимый характер.
Металлопротеиназы широко распространены у бактерий встречаются и у микроскопических грибов. Бактериальные металлопротеиназы – белки с молекулярной массой 28-48 кДа, проявляющие максимальную активность при рН 6,5-9 и температуре 50-75° С.
В. subtilis – продуцент протеолитического ферментного препарата Протосубтилина выделяет в среду две металлопротеиназы – А и Б, с молекулярной массой 44 и 40 кДа. Первая имеет оптимум при рН 7, вторая – при рН 7,5 и 11.
Микроскопические грибы синтезируют металлопротеиназы молекулярной массы 20–45 кДа. Среди них выделяют группу кислых ферментов, с оптимальным рН 5-6, и нейтральных, с оптимумом рН около 7 Температурный оптимум лежит обычно в пределах 45-55 С, у металлопротеиназы Asp. sojae – при 650С.
Среди металлопротеиназ аспергиллов и пенициллов находят цинксодержащие ферменты (1 ион цинка на молекулу).
Карбоксипептидазы широко представлены у животных, растений и микроорганизмов, они играют важную роль в белковом обмене. Среди карбоксипептидаз встречаются сериновыё и металлоферменты, редко – тиоловые.
В поджелудочной железе синтезируются карбоксипептидазы А и В. Предшественники этих ферментов активируются под действием трипсина. Карбоксипептидаза А – металлофермент, содержит один атом цинка на молекулу
Молекулярная масса фермента 34,3 кДа, оптимальный рН 7,5, зона стабильности – рН 6-10,2. Карбоксипептидаза В идентична по массе и содержанию цинка, стабильна при рН 7-9. Оба фермента имеют как пептидазную, так и эстеразную активность.
Карбоксипептидазы есть у многих покрытосеменных (томата, арбуза, фасоли, шпината и др.). В клетках растений присутствуют, как связанные, так и растворимые формы карбоксипептидаз. Максимальную активность находят во фракции митохондрий.
Все растительные карбоксипептидазы – кислые белки с изоэлектрической точкой при рН 4,3-5,4. Молекулярная масса 90-175 кДа. Оптимальный рН 5-5,6, стабильны в зоне рН 4-6. Оптимальная температура действия 40-50° С.
Большинство растительных карбоксипептидаз относится к сериновым ферментам. Из их числа – уникальная карбоксипептидаза фасоли, способная отщеплять с С-концов белков все аминокислоты, за исключением аспарагиновой. Предпочтительно наличие на С-конце аминокислоты с длинной алифатической цепью, а по соседству с ней – ароматаческой аминокислоты.
Карбоксипептидаза из кожуры апельсина является металлоферментом, содержащим 3,6 атома цинка на молекулу. Фермент отщепляет с С-конца белков ароматические, кислые аминокислоты и пролин. Приведенные примеры свидетельствуют о широкой субстратной специфичности растительных карбоксипептидаз.
Микробные карбоксипептидазы – белки молекулярной массы от 30 до 160 кДа. Оптимальный рН действия для грибных карбоксипептидаз – 3,0-6,8, для бактериальных — 8,0-9,8. Оптимальная температура действия карбоксипептидаз Asp. oryzae — 40-50° С.
Карбоксипептидазы микроорганизмов могут иметь различную структуру активного центра. У некоторых грибов и актиномицетов они являются металлоферментами, для проявления активности которых необходимы ионы цинка, марганца, магния, кальция.
Карбоксипептидазы микроскопических грибов характеризуются широкой субстратной специфичностью, что в значительной мере определяет способность грибных ферментных препаратов катализировать глубокое расщепление растительных и животных белков. Карбоксипептидазы пенициллов отщепляют от пептидов остатки пролина, лизина, аргинина, глицина, дикарбоновых аминокислот. Кислая карбоксипептидаза Asp. saitoi последовательно отщепляет все аминокислоты от нативного инсулина и некоторых других пептидов. Аналогичный фермент Asp. sojae глубоко расщепляет соевый белок.
Протеолитические ферменты семян растений. В семенах злаковых и бобовых культур содержится целый комплекс протеолитических ферментов, участвующих в расщеплении запасных белков до аминокислот в процессе прорастания семян.
В настоящее время известно, что протеолиз белков в семенах растений осуществляется комплексом ферментов, различающихся по своим функциям, механизму действия и другим показателям. Некоторые из этих ферментов были выделены в виде высокоочищенных препаратов и подробно охарактеризованы. Так, например, из семян пшеницы были выделены несколько типов протеолитических ферментов, различающихся по оптимуму рН: кислые протеиназы с оптимумом рН 3,7-4,0; нейтральные протеиназы с оптимумом рН 6,5-7,0; щелочные протеиназы с оптимумом рН > 8,0.
Из трех групп протеиназ наибольшего внимания технологов заслуживают нейтральные протеиназы. По активности они в несколько раз превосходят кислые и в условиях теста способны эффективно расщеплять белки клейковины. Одна из особенностей нейтральных протеиназ состоит в том, что они не растворяются в водных, солевых и буферных растворах. Они прочно связаны с белками клейковинного комплекса и извлекаются при частичном растворении клейковины в щелочном растворе. Максимальное извлечение нейтральных протеиназ происходит при обработке измельченного зерна, муки или лиофилизированной клейковины 0,35%-м раствором карбоната натрия созревших семян пшеницы нейтральные протеиназы и их белковые ингибиторы образуют единый неактивный комплекс, связанный с клейковиной. Соотношение активности протеиназ и их ингибиторов в созревшем зерне определяет стабильность белкового комплекса, его устойчивости в процессе тестирования.
Нейтральные протеиназы не активируются восстановленным глута-тионом или цистеином и поэтому не могут быть отнесены к тиоловым ферментам, в отличие от кислых протеиназ. Нейтральные протеиназы ингибируются хлоридом натрия, фенольными соединениями, фенольными соединениями, ароматическими аминокислотами, продуктами сахаро-аминной реакции (меланоидинами).
Хлорид натрия является обязательным компонентов рецептуры и, внесенный в таком количестве, снижает активность нейтральных протеиназ и соответственно интенсивность автолиза на 60-70%.
При переработке слабой муки необходимо как можно раньше вводить соль, тогда как для муки с чрезмерно крепкой клейковиной желательно активизировать протеолиз, и соль следует вносить на более поздних стадиях.
В связи с этим необходимо еще раз подчеркнуть важность изучения собственных эндогенных ферментных систем биологического сырья, факторов, влияющих на их активность с точки зрения их огромной роли в процессах, происходящих при созревании, хранении и переработке пищевого сырья.
Усвояемость пищи во многом зависит от качества ее переработки в организме человека. Переваривание пищи считается сложным процессом, в котором участвуют высокоактивные соединения белкового происхождения, способные ускорять процесс расщепления белковых, углеводных, липидных молекул до более мелких фрагментов.
Пищеварительные энзимы
Ферменты пищеварительной системы продуцируются клетками желез, секрет которых выделяется в пищеварительный тракт. Процесс расщепления сложных соединений является строго избирательным, поэтому существуют основные группы ферментов, способные воздействовать только на нуклеотидные, белковые, углеводные, жировые молекулы.
Действие пищеварительных ферментов
Ферменты пищеварительного тракта делятся на липазы, протеазы, амилазы, нуклеазы, нуклеотидазы.
Липазами называют ферменты, продуцируемые секреторными клетками в поджелудочной железе и желудке. Основное их назначение заключается в расщеплении липидов и поступлении их в кровь.
Амилазы служат для переваривания углеводных составляющих пищи, чтобы отдельные их фрагменты могли легко проникнуть в кровоток. К таким энзимам относят амилазу и мальтазу в слюне ротовой полости, лактазу в поджелудочном и кишечном соке.

Нуклеазы панкреатического секрета способны расщеплять кислоты нуклеиновые до нуклеотидов, а те в свою очередь под действием нуклеотидаз кишечного сока распадаются на нуклеозиды.
Ферментный состав слюны
В ротовой полости начинается процесс переваривания пищи, который связан с размачиванием сухих частиц слюной и первичным расщеплением углеводных составляющих. Ферменты слюны, в частности амилазы, оказывают воздействие на молекулы крахмала, превращая их в мальтозу. Жиры и белки пищи не подвергаются никаким химическим превращениям в полости рта.
Существуют и такие ферменты слюны, которые способны подвергать разрушению клеточную стенку вредоносных бактерий. Происходит это за счет гидролиза муреиновых структур оболочки. Именно поэтому слюна обладает бактерицидным действием.
Характеристика пищеварительных ферментов
Только соблюдение правильного питания и отсутствие вредных привычек позволит работать органам пищеварения в полную силу.
Подходящей температурой для нормального функционирования энзимов в организме является 36,6-37 градусов. Горячие блюда вызывают ожог слизистой оболочки в пищеводе и разрушение ферментных соединений. Происходит спазм гладких мышц желудочной стенки, вследствие чего неподготовленная пища поступает в 12-перстную кишку. Это приводит к расстройствам кишечника и всевозможным заболеваниям органов пищеварения.
Водородный показатель среды влияет на свойства ферментов, в частности на их активность. При разных концентрациях ионов водорода активные участки ферментного белка и субстрат ионизируются в разной степени.
Специфические свойства ферментов связаны с распознаванием химической структуры веществ, которые подвергаются расщеплению. Даже для двух изомеров одного вещества существуют свои энзимы.
Что такое протеолитические ферменты?
Протеазы являются гидролитическими ферментами, способными расщеплять связи пептидов и белков и восстанавливать полезные бактерии в кишечнике. Наличие химозина и пепсина в желудочном соке, химотрипсина, трипсина, эрепсина в кишечном секрете, карбоксипептидазы в панкреатическом соке говорит о разнообразии протеолитических ферментов.
Благодаря позиционной и субстратной специфичности этих энзимов происходит выбор участок разрыва в длинной пептидной цепочке гидролизуемой белковой или пептидной молекулы.
Протеолитические ферменты, в зависимости от места действия, бывают экзопептидазами, которые способны разрывать концевые связи, и эндопептидазами, осуществляющие гидролиз внутренних связей в белковой молекуле.
Пептидные связи на С- и N-конце белковой цепочки расщепляются карбоксипептидазой и аминопептидазой, относящимися к экзопептидазам. Существуют еще дипептидазы, разрывающие связь в дипептидах.
Эндопептидазы, в зависимости от структуры активного элемента, разделяются на:
- сериновые, в составе их активного центра содержится сериновый и гистидиновый остаток;
- цистеиновые, в составе их активного центра содержится SH-группа от цистеинового остатка;
- карбоксильные, в составе их активного центра содержится СООН-группа от остатка аспарагината;
- металлопротеиназу, в составе активного центра содержится ион металла.
На избирательность действия протеаз влияет аминокислотная структура остатков, их радикалы, пространственная конфигурация субстрата. Большинство протеаз реагируют на определенную структуру аминокислотных остатков, расположенных возле связи, которую разрывают. Например, трипсиновый фермент катализирует расщепление соединения между основными аминокислотами (лизином и аргинином), имеющими карбоксильную группу.
Протеолитические ферменты типа химотрипсина, пепсина реагируют на гидрофобный фенилаланиновый, тирозиновый, триптофановый и лейциновый остаток и разрывают возле них связи. Для действия эластазы поджелудочного сока важно наличие у аминокислотного остатка небольшого бокового ответвления, которые имеются у аланина и серина.
Структура протеолитических ферментов
Молекула протеазы представляет собой линейную цепочку из аминокислот, свернутую в глобулу и обладающую уникальным действием на белки. Поверхность протеолитических ферментов имеет впадину для связывания субстрата.
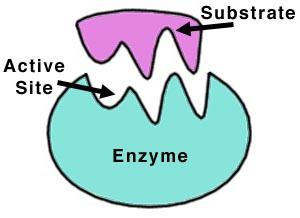
Несколько белковых цепочек могут объединяться в комплекс, а собранные таким образом глобулы образуют третичную структуру ферментов. Для активации многих протеаз кофакторами являются ионы Са2+ и Mg2+.
Существуют протеолитические ферменты, которые соединены с мембранной оболочкой клеток и воздействуют на определенную белковую структуру. Примером может служить сигнальная протеаза, ответственная за транспорт белковых молекул из клеток в межклеточную область.
Ингибирование протеолитических ферментов
Некоторые заболевания пищеварительной системы вызваны чрезмерной деятельностью протеаз, например, состояние острого панкреатита. Активаторами ферментов, продуцируемых поджелудочной железой, являются цитокиназы. С их помощью образуется трипсин из трипсиногена, происходят превращения проэластазы, калликреиногена, химотрипсиногена в активные формы ферментов. В результате их действия в поджелудочной железе наблюдается переваривание ткани собственным секретом, а затем отек и кровоизлияние этого органа.
Ингибиторы протеолитических ферментов направлены на подавление их ферментативной деятельности. Использование для внутривенных инъекций лекарственных средств на основе тразилола, пантрипина и контрикала позволяет снизить активность протеаз и снять воспалительные процессы в поджелудочной железе.
Острота заболевания во многом зависит от трипсин-ингибиторной системы. При достаточном содержании ингибиторного вещества происходит нейтрализация активированного фермента с восстановлением равновесия. Недостаток ингибитора приводит к дальнейшему развитию заболевания.
Роль протеаз
На многие процессы в организме человека влияет действие протеолитических ферментов. Без их участия не произойдет оплодотворение, свертывание белка крови, фибринолиз, биосинтез белковых молекул, иммунные реакции, гормональная регуляция.
Нарушение работы протеаз вызывает мышечную дистрофию, заболевания аутоиммунного характера, легочную эмфизему, воспаление поджелудочной железы.
На основе протеолитических ферментов разработан ряд препаратов, позволяющих корректировать пищеварение, заживлять ранения и ожоги.
Протеазы применяют для изготовления питания для парэнтерального введения, для производства препаратов на основе гормонов и антибиотических средств.
Получают ферменты из внутренних органов и желез животных (крупный рогатый скот и свиньи) и из растительного субстрата (плодовый латекс дынного дерева).
Что такое протеаза? (с картинками)
Протеаза является членом очень большой группы ферментов, которые выполняют различные функции в организме. Первичным является пищеварительный фермент для переработки белка. Без протеазы организм не сможет переваривать белок в пище. Другие типы протеаз участвуют в регуляции клеточных событий, таких как свертывание крови. Их также называют протеолитическими ферментами или протеиназами .
 Без протеазы организм не сможет переваривать белок в пище.
Без протеазы организм не сможет переваривать белок в пище.Белки — это длинные цепочки аминокислот, которые удерживаются вместе пептидными связями.Небольшие фрагменты белков известны как пептидов , а более крупные фрагменты упоминаются как полипептидов . Ферменты, которые расщепляют пептиды, называются пептидазами .
 Желудок содержит пищеварительную протеазу пепсин.
Желудок содержит пищеварительную протеазу пепсин.Протеазы — это типы белков, которые ускоряют деградацию других. Они отличаются тем, как они выполняют эту деятельность. Экзопептидазы отщепляют концевые аминокислоты и грызут белки. Они разрушают пептидные связи, освобождая аминокислоты.Напротив, эндопептидазы действуют внутри белка, а также расщепляют пептидные связи, продуцируя полипептиды в результате их активности.
 Ферменты играют ключевую роль в пищеварительном процессе.
Ферменты играют ключевую роль в пищеварительном процессе.Существует несколько классов протеаз, в зависимости от типа аминокислоты в месте, где происходит реакция, и любой дополнительной молекулы, необходимой для активности. Например, многие белки требуют, чтобы атом металла был активным. Они известны как металлопротеиназы .Другие протеазы имеют аминокислоту, известную как серин, в своем активном сайте, и известны как сериновых протеаз .
Первоначальные исследования протеаз в физиологии человека были проведены для определения их роли в пищеварении в желудочно-кишечной системе. Цель ферментативного пищеварения — разбить большие молекулы на более мелкие.Несколько протеаз работают совместно с пептидазами, чтобы разложить белки в пищевых продуктах до небольших пептидов и аминокислот. Такие маленькие молекулы могут поглощаться клетками кишечника и использоваться в качестве топлива или для создания новых белковых молекул.
Одна из общих черт всех этих пищеварительных протеаз состоит в том, что они синтезируются в виде более крупных неактивных форм, предотвращающих ферментативное повреждение содержащейся в них ткани.Такие предшественники известны как зимогенов . Другая особенность, которую они разделяют, заключается в том, что все они являются эндопептидазами, хотя они различаются по своему предпочтению, какую часть белков они расщепляют. Эта субстратная специфичность основана на расположении специфических аминокислот в целевых белках.
Желудок содержит пищеварительную протеазу пепсина , которая стимулируется соляной кислотой желудка.Пепсин расщепляет белки на полипептиды, которые попадают в кишечник. В этом месте они разбиваются на еще более мелкие кусочки с помощью дополнительных пищеварительных протеаз трипсина и химотрипсина. Все эти ферменты являются сериновыми протеазами.
Другие типы протеаз действуют для регуляции активности других белков. Расщепляя определенный сайт на белке, они могут включать или выключать их.Это может быть частью механизма сигнализации физиологических изменений. Другой функцией протеаз является помощь в процессинге белков, которые продуцируются в более крупных формах, таких как белок-предшественник амилоида. Другие протеазы разлагают белки, которые больше не нужны для клеточной функции.
 У некоторых протеаз есть активная аминокислота, известная как серин.,
У некоторых протеаз есть активная аминокислота, известная как серин.,Как они работают, виды и побочные эффекты
Лечение ВИЧ включает в себя прием антиретровирусных препаратов. Ингибиторы протеазы являются одним из семи классов антиретровирусных препаратов.
Антиретровирусные препараты предназначены для лечения ВИЧ. Разные препараты имеют разные механизмы действия. Ингибиторы протеазы работают, блокируя активность протеазы ВИЧ, которая является ферментом, который должен размножаться ВИЧ.
Медицинский работник обычно назначает три или более лекарств для лечения ВИЧ, которые называются антиретровирусной терапией (HAART), комбинированной антиретровирусной терапией (cART) или антиретровирусной терапией (ART).Одним из них может быть ингибитор протеазы.
В этой статье мы обсуждаем ингибиторы протеазы, включая их работу, фирменные наименования и возможные побочные эффекты.
Когда ВИЧ попадает в организм человека, он копирует себя, вставляя свою вирусную ДНК в определенные клетки иммунной системы, называемые клетками CD4. Клетки CD4 координируют иммунную систему, направляя ее на борьбу с инфекциями.
Когда ВИЧ попадает внутрь клеток CD4, он теряет способность работать. Затем ВИЧ инструктирует клетки CD4 создавать новые белки ВИЧ и генетический материал ВИЧ, которые он использует для создания большего количества вирусов, которые могут поражать больше клеток CD4.
Со временем это повреждает иммунную систему, уменьшая количество работающих клеток CD4 в организме, делая человека более восприимчивым к болезням и инфекциям.
Ингибиторы протеазы препятствуют способности ВИЧ создавать новые вирусы в клетках CD4. В частности, они блокируют фермент, известный как протеаза. Протеаза расщепляет белки ВИЧ, используя эти более мелкие частицы для создания новых вирусов, которые могут созревать и распространяться.
Когда ингибитор протеазы блокирует протеазу, ВИЧ не может расщеплять свои белки, создавая новые вирусы.В результате он не может размножаться и прекращает распространение.
Ингибиторы протеазы не являются лекарством от ВИЧ, но при приеме в сочетании с другими эффективными антиретровирусными препаратами ингибиторы протеазы могут снизить уровень ВИЧ до неопределяемого уровня в организме. Когда вирус не обнаруживается, он больше не передается половым путем.
Это означает, что человек, живущий с ВИЧ, который придерживается эффективного плана лечения, может вести здоровый образ жизни без риска передачи ВИЧ другим.
Доступно много различных ингибиторов протеазы, и люди должны принимать их с другими лекарствами от ВИЧ.
Медицинский работник может назначить ингибитор протеазы наряду с другими лекарствами; иногда ингибитор протеазы уже включен в комбинированное лекарство от ВИЧ.
FDA-одобренные ингибиторы протеазы включают в себя:
- атазанавир, торговая марка Reyataz
- дарунавир, торговая марка Prezista
- фосампренавир, торговая марка Lexiva
- саквинавир, торговая марка Invirase
- типранавир, торговая марка Aptivus0002 ингибитор протеазы, называемый ритонавир (норвир), может усиливать действие других ингибиторов протеазы, что означает, что человек может принимать его вместе с другим ингибитором протеазы.
Ингибиторы протеазы могут иметь побочные эффекты, в том числе:
- тошнота
- рвота
- диарея
- головокружение
- слабый красный, зуд сыпь
- увеличение или уменьшение жира в организме
- высокий уровень сахара в крови (гипергликемия) и диабет
- камни в почках, которые могут вызвать кровь в моче, болезненное мочеиспускание и боль в пояснице
Антиретровирусные препараты могут вызывать воспалительный синдром восстановления иммунодефицита (ИРИС), который может происходить при укреплении иммунной системы.IRIS может вызвать вспышку инфекции, о которой человек даже не подозревал.
Это может также вызвать сверхактивный иммунный ответ на перенесенную инфекцию. Это признак того, что иммунная система человека восстанавливается. Ирис может быть легкой или тяжелой.
Некоторые побочные эффекты ингибиторов протеазы могут быть серьезными. Эти побочные эффекты, хотя и редки, требуют неотложной медицинской помощи. Они включают в себя:
- повреждения печени. Симптомы повреждения печени могут включать желтуху, которая представляет собой пожелтение кожи или белых глаз, стул бледного цвета или мочу темного цвета.Если это произойдет, обратитесь за неотложной медицинской помощью.
- Проблемы с желчным пузырем. Симптомы включают боль в правой части живота или верхней части живота, лихорадку, тошноту, рвоту или желтуху.
- Проблемы с сердцем.
- Проблемы с печенью.
- Сильная сыпь.
Человек, который испытывает какие-либо побочные эффекты от ингибиторов протеазы, должен поговорить с врачом.
Люди часто могут справиться с легкими побочными эффектами, и они могут уйти самостоятельно. При необходимости, поставщик медицинских услуг может помочь человеку найти другое лекарство, которое лучше ему подходит.В целом, риск не лечить ВИЧ намного выше, чем риск побочных эффектов от лекарств.
Ингибиторы протеазы могут иметь опасные взаимодействия с другими лекарствами, добавками, витаминами и травами.
Очень важно сообщить врачу о любых других лекарствах или добавках, прежде чем принимать ингибиторы протеазы или другие лекарства от ВИЧ. Это может помочь человеку избежать серьезных взаимодействий.
В некоторых случаях ВИЧ может стать устойчивым к ингибиторам протеазы.Это означает, что вирус больше не отвечает на лекарства.
Лекарственная устойчивость может возникнуть, когда ВИЧ изменяется или мутирует в организме человека. Вирусы делают это, чтобы попытаться выжить. Когда он мутирует, он может стать устойчивым к лекарствам, которые принимает человек.
В некоторых случаях человек может заразиться лекарственно-устойчивым штаммом ВИЧ. Это означает, что тип ВИЧ, который они имеют, не реагирует на определенные лекарства.
Лучший способ избежать лекарственной устойчивости ВИЧ — это принимать лекарства от ВИЧ каждый день, точно так, как это предписывает врач.Не пропускайте дозы, не меняйте дозы и не прекращайте прием лекарств, не поговорив с врачом.
Использование 7-дневной упаковки таблеток, приложения для напоминания о приеме лекарств или другой системы напоминаний может напомнить людям о необходимости принимать лекарства каждый день. Если у них есть побочные эффекты, они могут поговорить со своим врачом.
Когда человек принимает ингибиторы протеазы и другие антиретровирусные препараты, его лечащий врач проведет специальные тесты, чтобы убедиться, что его лекарства работают, в том числе:
Количество клеток CD4
Количество клеток CD4 измеряет количество клеток CD4 в образце крови.Человек может пройти тест CD4 до начала лечения, а затем периодически во время лечения.
Высокое или увеличивающееся количество CD4 обычно означает, что иммунная система человека здорова и часто является признаком того, что лекарства от ВИЧ работают должным образом. Нормальное количество клеток CD4 составляет около 500–1200 клеток на кубический миллиметр (клеток / мм 3 ).
Вирусные нагрузки ВИЧ
Вирусная нагрузка или уровни РНК ВИЧ сообщают медицинскому работнику о том, сколько ВИЧ находится в крови человека.Более низкий показатель вирусной нагрузки означает, что в крови меньше копий ВИЧ.
Лечение ВИЧ направлено на снижение вирусной нагрузки до необнаружимых уровней. Это означает, что показатель ВИЧ настолько низок, что тест не может его определить. Это свидетельствует о том, что у человека с ВИЧ хорошее здоровье и что он не может распространить болезнь среди половых партнеров.
Однако, даже после того, как человек достигает неопределяемой вирусной нагрузки, он должен продолжать принимать лекарства в соответствии с предписаниями. Во время лечения важно посещать все обследования и приемы, чтобы измерить успешность лечения и поговорить о побочных эффектах или вопросах лечения ВИЧ.
Ингибиторы протеазы — это класс антиретровирусных препаратов, которые люди используют вместе с другими препаратами против ВИЧ для эффективного лечения ВИЧ. Ингибиторы протеазы работают, останавливая активность ферментов протеазы ВИЧ, поэтому предотвращая размножение ВИЧ.
Люди могут принимать несколько таблеток каждый день, но многие схемы антиретровирусного лечения включают прием одной таблетки один раз в день.
Существует много доступных ингибиторов протеаз, включая атазанавир (Реятаз), дарунавир (Презиста), Фосампренавир (Лексива) и Саквинавир (Инвираза).
ВИЧ является излечимым заболеванием. Прием всех лекарств против ВИЧ в соответствии с назначением помогает человеку контролировать ВИЧ. Это предотвращает повреждение иммунной системы и устраняет риск распространения ВИЧ среди половых партнеров. В течение 3–6 месяцев после эффективного лечения вирусная нагрузка человека обычно не определяется.
Более 150 000 человек в США имеют ВИЧ и не знают об этом. Это означает, что они не получают жизненно необходимое лечение, в котором они нуждаются.
Современные современные антиретровирусные препараты позволяют людям, живущим с ВИЧ, жить долго и вести здоровый образ жизни.Тестирование и диагностика — первый шаг к эффективному лечению.
определение протеазы по Свободный словарь
Резюме: В этом отчете о рынке лечения ингибиторами протеазы С1 в плазме анализируется текущий и будущий сценарий мирового рынка. Животные, растения и микроорганизмы продуцируют протеазу и играют важную роль в многочисленных физиологических и патологических процессах, таких как катаболизм белка и клеток. рост и миграция, свертывание крови, оценки морфогенеза тканей в процессе развития, опухолевый рост и метастазирование, воспаление, выработка гормонов, активация зимогенов и фармакологически активные пептиды из белка-предшественника, а также транспорт этого белка через мембрану (Sawant & Nagendran.2014; Souza et al. Хотя использование экзогенных ферментных смесей (то есть углеводов, фитазы и протеазы) хорошо известно и широко признано для улучшения усвояемости питательных элементов [8,10], использование отдельных протеаз все еще находится в стадии изучения для широкого применения. . Ключевым фактором, определяющим гидролиз и эффективность усвоения поглощенных белков, является присутствие протеазных ферментов в пищеварительном тракте (Divakaran et al., 2004). Микробные протеазные ферменты широко используются в большинстве отраслей промышленности (Degering et al.2010; Ramnani et al., 2005), например, в моющих средствах, пищевых продуктах, фармацевтических препаратах, коже, в синтезе пептидов (Horikoshii, 1999) и т. Д. Незрелый вирус высвобождается из инфицированной клетки, и в процессе созревания ферменты протеазы вырезаются сырье и собирать в функционирующий вирус [6]. Микроорганизмы могут быть использованы в качестве отличного источника протеазы. Неспособность растительных и животных протеаз удовлетворить нынешнюю глобальную потребность в ферментах увеличила интерес к микробной протеазе.Соответственно, в этом исследовании мы стремились оценить влияние GA на воспаление эпителия дыхательных путей с использованием грибкового протеазного аллергена для индукции повреждения эпителия, как описано ранее [17, 18]. Органические экстракты их жидких культур оценивали по их ингибированию вирус гепатита С (HCV) NS3-NS4A протеаза. В результате, F.M2 EQUITYBITES-6 сентября 2016-Лаборатории WOUNDCHEK проходит рыночную очистку для статуса протеазы WOUNDCHEK в АвстралииM2 PHARMA-6 сентября 2016-Лаборатории WOUNDCHEK проходит рыночную очистку для статуса протеазы WOUNDCHEK в Австралии ,ВИЧ: руководство по ингибиторам протеазы
За последние годы перспективы ВИЧ значительно улучшились.
Это во многом благодаря лекарствам, называемым антиретровирусными препаратами. Эти лекарства действуют на человека с ВИЧ, блокируя проникновение вируса в определенные клетки его тела и копирование себя. Эти препараты называются антиретровирусными, потому что они работают против ретровирусов, таких как ВИЧ.
Ингибиторы протеазы являются одним из видов антиретровирусных препаратов, используемых для лечения ВИЧ. Целью этих препаратов является снижение количества вируса ВИЧ в организме (так называемая вирусная нагрузка) до уровней, которые невозможно обнаружить.Это замедляет прогрессирование ВИЧ и помогает лечить симптомы.
Продолжайте читать, чтобы узнать больше об ингибиторах протеазы, таких как, как они работают и каковы их потенциальные побочные эффекты и взаимодействия.
Основная цель ВИЧ-инфекции — копировать себя как можно чаще. Однако у ВИЧ нет механизма, необходимого для самовоспроизводства. Вместо этого он вводит свой генетический материал в иммунные клетки организма, называемые клетками CD4. Затем он использует эти клетки как своего рода фабрику вирусов ВИЧ.
Протеаза — это фермент в организме, который важен для репликации ВИЧ.Препараты ингибиторов протеаз блокируют действие ферментов протеаз. Это препятствует тому, чтобы ферменты протеазы вносили свой вклад в размножение ВИЧ, что приводит к прерыванию жизненного цикла ВИЧ. Это может остановить размножение вируса.
Препараты-ингибиторы протеазы, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения ВИЧ, включают:
- атазанавир (Реятаз)
- дарунавир (Презиста)
- фосампренавир (лексива)
- индинавир (криксиван)
- лоп / ритонавир (Калетра)
- нелфинавир (Вирасепт)
- ритонавир (Норвир)
- саквинавир (Инвираза)
- типранавир (Aptivus)
- атазанавир / кобицистат (Evotaz)
протеазиквиат/219 ингибитор протеиназа (9189) протеинаксаваризат ( - изменений в вкусе продуктов питания
- перераспределение жира (хранение жира в организме в разных местах)
- понос
- резистентность к инсулину (когда организм не может хорошо использовать гормон инсулин)
- высокий уровень сахара в крови
- высокий уровень холестерина или триглицеридов
- проблемы с печенью
- тошнота
- рвота
- сыпь
- желтуха (пожелтение кожи или белых глаз), которая чаще всего связана с применением атазанавира
9 / коабицит) необходимо принимать вместе с другими лекарствами для эффективного лечения ВИЧ.Чтобы быть полностью эффективными, почти все ингибиторы протеазы необходимо принимать с ритонавиром или кобицистатом.
Кроме того, обычно назначают два других лекарства от ВИЧ вместе с ингибитором протеазы и ритонавиром или кобицистатом. Эти лекарства могут быть даны индивидуально в виде отдельных таблеток или вместе в комбинированных таблетках, которые содержат несколько препаратов.
Как и большинство лекарств, ингибиторы протеазы могут вызывать побочные эффекты. Они могут включать:
Ингибиторы протеазы могут взаимодействовать с другими лекарственными средствами.Люди, живущие с ВИЧ, должны поговорить со своим лечащим врачом обо всех лекарствах, которые они принимают. Это включает любые отпускаемые по рецепту лекарства, безрецептурные (OTC) лекарства, травы и добавки.
Медицинские работники могут предложить наиболее полную и актуальную информацию о любых известных взаимодействиях с препаратами против ВИЧ в плане лечения человека.
Взаимодействие с отпускаемыми по рецепту лекарствами
Отпускаемые по рецепту лекарства, которые могут взаимодействовать с ингибиторами протеазы, включают препараты статина, которые используются для снижения уровня холестерина.Примеры этих препаратов включают:
Прием ингибиторов протеаз с симвастатином или ловастатином может увеличить количество статинов в организме. Это может повысить риск побочных эффектов от статинов. Эти побочные эффекты могут включать мышечные боли и повреждение почек.
Симвастатин и ловастатин противопоказаны ко всем ингибиторам протеазы. Это означает, что эти лекарства никогда не должны использоваться с ингибиторами протеазы, потому что они могут вызывать опасные для жизни побочные эффекты.
Ингибиторы протеазы также могут быть вовлечены во многие другие лекарственные взаимодействия.Типы лекарств, которые могут взаимодействовать с ингибиторами протеазы, включают:
Ваш врач или фармацевт может рассказать вам больше об этих возможных взаимодействиях.
Взаимодействие с безрецептурными препаратами
Ингибиторы протеазы, такие как атазанавир, могут также взаимодействовать с безрецептурными препаратами, которые уменьшают желудочную кислоту.
Эти препараты включают омепразол (Prilosec), лансопразол (Prevacid), циметидин (Tagamet), фамотидин (Pepcid), низатидин (Axid), ранитидин (Zantac) и антациды, такие как Tums.
Медицинские работники могут запретить людям с ВИЧ принимать эти препараты вместе или принимать их в разное время дня.
Флутиказон (Flonase) является лекарством от аллергии OTC, которое также может взаимодействовать с ингибиторами протеазы. Кроме того, зверобой, растительная добавка, обычно используемая при депрессии, также может взаимодействовать с ингибиторами протеазы и не должна использоваться с этими препаратами.
Люди, живущие с ВИЧ, должны поговорить со своим врачом о том, являются ли ингибиторы протеазы хорошим выбором для них.При использовании с другими лекарственными средствами эти препараты могут быть очень эффективными в ослаблении симптомов и замедлении прогрессирования ВИЧ.
Тем не менее, эти лекарства имеют заметные побочные эффекты и взаимодействия. Медицинские работники могут рассмотреть преимущества и недостатки, чтобы решить, подходят ли ингибиторы протеазы.
