Аналитикум » Blog Archive » Трипсин
Трипсин
Синонимы: Cocoonase; Parenzyme; Parenzymol; Pseudotrypsin.
Молекулярная формула: C6h25O12P3
Молекулярный вес: 372.10
CAS Регистрационный номер: 9002-07-7
Температура плавления: 115 ºC
Внешний вид: субстанция трипсина — это кристаллический порошок от почти белого до светло-коричневого.
Безопасность: при сгорании выделяются токсичные пары углекислого газа / угарного газа и оксиды азота (NO x).
Условия хранения: хранить в прохладном, хорошо проветриваемом помещении. Держать контейнер плотно закрытым. Хранить под аргоном при -20 ° C только в оригинальной упаковке.
Биосинтез: трипсин образуется в тонкой кишке, когда активируется его проферментная форма — трипсиноген, вырабатываемый поджелудочной железой. Трипсин расщепляет пептидные цепи в основном на карбоксильной стороне аминокислот лизина или аргинина. Используется для многочисленных биотехнологических процессов.
Описание: трипсин является членом семейства сериновых протеаз S1. Он состоит из одноцепочечного полипептида из 223 аминокислотных остатков. Нативная форма трипсина упоминается как β-трипсин. Аутолиз β-трипсина (который расщепляется по Lys131-Ser132 в бычьей последовательности) приводит к α-трипсину, удерживаемому вместе дисульфидными мостиками. Активный сайт аминокислотных остатков трипсина включает His46 и Ser1.
Действие: трипсиноген, проферментная (зимоген) форма трипсина, вырабатывается в ацинарных экзокринных клетках поджелудочной железы. Три изоформы выводятся из поджелудочной железы человека. Катионная и анионная формы являются преобладающими изоформами человека. Устойчивый к ингибитору мезотрипсиноген обнаруживается только в следовых количествах. Проэнзим активируется после того, как он достигает просвета тонкой кишки.
Трипсин расщепляет пептиды на С-концевой стороне аминокислотных остатков лизина и аргинина. Скорость гидролиза медленнее, если кислотный остаток находится по обе стороны от места расщепления. Не происходит расщепления совсем, если пролиновый остаток находится на карбоксильной стороне места расщепления.
Биологическая функция трипсина: трипсин играет важную роль в гидролизе и всасывании белка у млекопитающих. При преобразовании из его зимогена трипсиногена трипсин доступен в форме активной пептидгидролазы для расщепления пептидных цепей, главным образом на карбоксильной стороне аминокислот лизина или аргинина. Трипсин содержит нуклеофильный остаток Ser в активном центре фермента, который атакует карбонильную часть пептидной связи субстрата с образованием промежуточного звена ацил-фермента 1. Эта нуклеофильная атака облегчается каталитической триадой, состоящей из гистидина-57, аспартата-102 и серин-195. Трипсин также содержит оксианионное отверстие, которое стабилизирует отрицательный заряд на карбонильном атоме кислорода, образованном в результате расщепления пептидных связей.
Использование: трипсин, представляя собой сериновую протеазу, широко применяется в биофармацевтическом производстве для специфического расщепления С-конца аргинина и лизина в пептидных цепях. Субстанцию трипсина используют в производстве биологических и фармацевтических препаратов, как правило изолированного от тканей животных, и подвергают строгому контролю.
Лекарственные формы трипсина получают из очищенных экстрактов поджелудочной железы свиньи или быка. Они предназначены для облегчения пищеварения при пероральном введении.
Компания «Аналитуниверсал» предлагает купить субстанцию трипсина различной концентрации (согласно спецификациям) и необходимого количества. Заказать и купить сырье можно на сайте analytuniversal.ru или по телефонам +7(985)3060776, +7(910)4749031.
Лабораторная диагностика панкреатита
Комплексный анализ, включающий все необходимые лабораторные маркеры функции поджелудочной железы и предназначенный для диагностики острого и хронического панкреатита.
Синонимы русские
Лабораторные маркеры панкреатита, лабораторное обследование поджелудочной железы.
Синонимы английские
Laboratory pancreas panel, Tests to diagnose pancreatitis, Pancreas check-up.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Поджелудочная железа обеспечивает секрецию гормонов и синтез пищеварительных ферментов и, таким образом, является как эндокринной, так и экзокринной железой. Многие факторы (желчные камни, алкоголь, тупая травма живота) оказывают на поджелудочную железу отрицательное влияние и приводят к развитию панкреатита. Различают две основные формы этого заболевания: острый и хронический панкреатит.
Липаза – это фермент поджелудочной железы, необходимый для расщепления жиров. Он образуется только в поджелудочной железе и является специфическим маркером этого органа. Значительное повышение уровня липазы крови (как правило, более чем в 3 раза) наблюдается в 90 % случаев острого панкреатита. При хроническом панкреатите уровень липазы может оставаться в пределах нормы. Следует отметить, что липаза не является специфическим именно для панкреатита маркером. Повышение концентрации липазы может наблюдаться, например, при раке поджелудочной железы.
Амилаза – другой фермент поджелудочной железы, необходимый для расщепления углеводов. Значительное повышение амилазы наблюдается при остром панкреатите. Следует отметить, что амилаза – это менее специфический маркер панкреатита, чем липаза. Повышение амилазы также может наблюдаться при многих других заболеваниях, в том числе гипертиреозе, раке легкого, заболеваниях слюнных желез и приеме некоторых лекарственных средств. При хроническом панкреатите уровень амилазы может оставаться в пределах нормы. Одновременное повышение липазы и амилазы очень характерно для острого панкреатита. Уровень липазы дольше остается повышенным, чем уровень амилазы. Скорость, с которой происходит нормализация уровня липазы и амилазы, зависит от тяжести панкреатита и поэтому может быть использована для оценки прогноза заболевания.
Поджелудочная железа тесно связана с печенью и системой желчных протоков. Поэтому часто заболевания печени и билиарного тракта приводят к возникновению панкреатита. В действительности самой частой причиной острого панкреатита является холелитиаз и закупорка желчными камнями сфинктера Одди. Если панкреатит развивается на фоне желчнокаменной болезни (билиарный панкреатит), часто наблюдается повышение печеночных ферментов (АЛТ, АСТ) и билирубина. У пациентов с характерными клиническими симптомами панкреатита превышение уровня АЛТ более 150 Ед/л свидетельствует в пользу билиарного панкреатита.
У пациентов с характерными клиническими симптомами панкреатита превышение уровня АЛТ более 150 Ед/л свидетельствует в пользу билиарного панкреатита.
Поджелудочная железа играет ведущую роль в метаболизме глюкозы. Часто при остром и хроническом панкреатите наблюдается недостаточность поджелудочной железы, которая проявляется нарушением синтеза инсулина и гипергликемией. Нарушение толерантности к глюкозе наблюдается в 9-70 % случаев острого панкреатита. Концентрация глюкозы выше 200 мг/дл является одним из критериев оценки тяжести острого панкреатита (по шкале Ренсона). Как правило, гипергликемия при остром панкреатите носит транзиторный характер. Напротив, более чем у 80 % пациентов с длительно текущим хроническим панкреатитом в итоге возникает сахарный диабет.
Также для оценки тяжести панкреатита используют общеклинические анализы: общий анализ крови и лейкоцитарную формулу. С помощью общего анализа крови можно получить важную информацию, позволяющую судить о степени секвестрации жидкости (гематокрит) и развитии ДВС-синдрома (количество тромбоцитов). Падение гематокрита на 10 % и лейкоцитоз выше 16 000*109/л является одним из критериев оценки тяжести острого панкреатита (по шкале Ренсона).
Копрограмма также является полезным дополнительным тестом, позволяющим диагностировать панкреатит. Этот тест имеет наибольшее значение при диагностике хронического панкреатита, он сопровождается недостаточностью пищеварительных ферментов поджелудочной железы, в том числе амилазы, липазы, химотрипсина, трипсина и других. Дефицит этих ферментов приводит к нарушению расщепления сахаров, жиров и белков в пищеварительном тракте и появлению характерных изменений в копрограмме.
Лабораторные методы являются важными, но не единственными диагностическими исследованиями, которые необходимы для постановки диагноза «панкреатит».
Для чего используется исследование?
- Для диагностики острого и хронического панкреатита.
Когда назначается исследование?
- При профилактическом осмотре пациента;
- при обследовании пациента с факторами риска панкреатита: желчнокаменная болезнь, злоупотребление алкоголем, перенесенная травма живота, диагностические процедуры на поджелудочной железе (например, РХПГ), прием некоторых лекарственных средств (азатиоприн, диданозин, вальпроевая кислота) и другие;
- при наличии симптомов острого панкреатита: боли в животе разной интенсивности с иррадиацией в область спины, тошноты, рвоты, лихорадки, желтухи;
- при наличии симптомов хронического панкреатита: постоянной или периодической боли в области живота, снижения аппетита, тошноты, рвоты, вздутия живота, запоров, потери веса, стеатореи.

Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
Скачать пример результатаТакже рекомендуется
[06-025] Лактатдегидрогеназа (ЛДГ) общая
[06-020] Кальций в сыворотке
[06-050] С-реактивный белок, количественно (высокочувствительный метод)
[06-034] Мочевина в сыворотке
[06-013] Гамма-глютамилтранспептидаза (гамма-ГТ)
[06-045] Фосфатаза щелочная общая
[03-015] Коагулограмма №2 (протромбин (по Квику), МНО, фибриноген)
[08-026] Инсулин
[06-134] С-пептид в суточной моче
Кто назначает исследование?
Гастроэнтеролог, хирург, терапевт, врач общей практики.
Литература
- Otsuki M, Takeda K, Matsuno S, Kihara Y, Koizumi M, Hirota M, Ito T, Kataoka K, Kitagawa M, Inui K, Takeyama Y. Criteria for the diagnosis and severity stratification of acute pancreatitis. World J Gastroenterol. 2013 Sep 21;19(35):5798-805.
- Andersson B, Pendse ML, Andersson R. Pancreatic function, quality of life and costs at long-term follow-up after acute pancreatitis. World J Gastroenterol. 2010 Oct 21;16(39):4944-51.
- McPhee S.J., Papadakis M. CURRENT Medical Diagnosis and Treatment / S. J. McPhee, M. Papadakis; 49 ed. — McGraw-Hill Medical, 2009.
Трипсин, гидролиз белков — Справочник химика 21
Единственная химическая реакция, которая здесь будет рассматриваться, —это гидролиз. Он может осуществляться как ферментативным, так и химическим путем. Горячая разбавленная минеральная кислота медленно расщепляет амидные связи с образованием с учайных фрагментов, в конечном итоге приводя к простым аминокислотам. Контролируемый кислотный гидролиз разрушает белок с образованием смеси пептидов. Возможен также ферментативный гидролиз протеолитические ферменты очень разнообразны по своему специфическому действию. Некоторые из них, такие, как папаин или фицин, фактически неспецифичны и расщепляют белки до свободных аминокислот, в то время как другие — трипсин, химотрипсин и пепсин— гидролизуют только особые связи в белковых молекулах (ср. мальтаза, эмульсин и т. д., разд. 17.6 и 17.7). Так, пепсин расщепляет амидную связь между карбоксильной группой ди-карбоновой ь-аминокислоты и аминогруппой ароматической ь-аминокислоты при условии, что вторая карбоксильная кислотная группа дикарбоновой аминокислоты не связана. Химотрипсин менее специфичен и расщепляет амидную связь с карбонильной стороны ароматической ь-аминокислоты. Трипсин гидролизует амидные связи, включающие карбоксильные груп- [c.296]
Некоторые из них, такие, как папаин или фицин, фактически неспецифичны и расщепляют белки до свободных аминокислот, в то время как другие — трипсин, химотрипсин и пепсин— гидролизуют только особые связи в белковых молекулах (ср. мальтаза, эмульсин и т. д., разд. 17.6 и 17.7). Так, пепсин расщепляет амидную связь между карбоксильной группой ди-карбоновой ь-аминокислоты и аминогруппой ароматической ь-аминокислоты при условии, что вторая карбоксильная кислотная группа дикарбоновой аминокислоты не связана. Химотрипсин менее специфичен и расщепляет амидную связь с карбонильной стороны ароматической ь-аминокислоты. Трипсин гидролизует амидные связи, включающие карбоксильные груп- [c.296]Например, серин-протеаза гидролизует белок в том месте, где находится фрагмент серина. Пепсин — фермент, действующий в желудке и имеющий максимальную активность при pH 1.0, принадлежит к группе карбокси-протеазы. Ферменты этой группы гидролизуют амидные связи, в которых участвуют карбоксигруппы аспарагиновой кислоты. Трипсин преимущественно катализирует гидролиз пептидных связей, в которых карбоксигруппа входит в состав лизина или аргинина. Химотрипсин избирательно расщеп- [c.522]
Белок, содержащий цистин и, следовательно, имеющий дисуль-фидные связи, подвергают ферментативному гидролизу. Следует подобрать такой фермент, который обеспечит получение мелких пептидов, т. е. расщепит цепь во многих точках. Наименее пригоден для этой цели трипсин из-за высокой избирательности действия, а также из-за хорошо известной устойчивости белков, содержащих дисульфидные связи, к триптическому гидролизу. [c.106]
Метод составления пептидных карт, получивший образное название метод отпечатков пальцев , используется при определении сходства или различия гомологичных белков по первичной структуре. Белок инкубируют с каким-либо протеолитическим ферментом. Часто порции белка инкубируют как с пепсином, так и с трипсином. При этом вследствие гидролиза строго определенных пептидных связей образуется смесь коротких пептидов, легко разделяемых с помощью хроматографии в одном направлении и электрофореза-в другом, под углом 90° от первого (пептидная карта). [c.56]
При этом вследствие гидролиза строго определенных пептидных связей образуется смесь коротких пептидов, легко разделяемых с помощью хроматографии в одном направлении и электрофореза-в другом, под углом 90° от первого (пептидная карта). [c.56]
После того как установлена первичная структура- какого-либо белка, обычно нет необходимости проводить полное изучение аминокислотной последовательности у гомологичных белков из близких (соответствующих) источников. Быстрый ответ можно получить, используя технику трипсинового фингерпринта . Для этого подвергают гидролизу трипсином белок с известной структурой и параллельно ему гомологичный белок полученные в результате гидролиза пептиды разделяют обычно с помощью двумерного электрофореза или хроматографии. Если разница в последовательностях невелика, то больщинство пептидов должны занимать идентичное положение на двумерном фингерпринте. Те немногие пептиды, которые отличаются по подвижности, необходимо элюи-.ровать и подвергнуть аминокислотному анализу по Эдману. Эта техника особенно полезна при изучении аномальных гемоглобинов, которые отличаются от нормального природой только одного участка. [c.276]
Ферментативные методы гидролиза особенно ценны благодаря присущей им во многих случаях специфичности. Трипсин, представляющий собой так называемую эндопептидазу, быстро расщепляет пептидные связи лишь в том случае, если карбонильная группа расщепляемой амидной связи принадлежит одной из основных аминокислот — лизину или аргинину. Таким образом, трипсин превращает белок в сравнительно малое число триптических пептидов, которые можно разделить и охарактеризовать. Трипсин расщепляет только денатурированные белки, причем для получения хороших результатов нужно предварительно разорвать дисульфидные мостики. [c.166]
Предположим, что исследуемый белок имеет последовательность, предстааленную на схеме. При действии на него трипсином гидролизуются связи Lys—Val и Arg—Ser, а при обработке бром-цианом (Br N) расщепляются связи Met—Туг и Met—Ala. [c.33]
[c.33]
Исследуемый белок гидролизуют трипсином и гидролизат подвергают электрофорезу на бумаге. Ориентируясь по контрольной полоске, вырезают полоску для аналитического диагонального электрофореза и осторожно опрыскивают ее карбоксипептидазой В, растворенной в 0,1%-ном бикарбонате аммония. Опрысканную полоску на 1 ч помещают в эксикатор, содержащий воду, при 37°С. После инкубации полоску высушивают и подвергают вновь электрофорезу под прямым углом к первоначальному направлению. [c.113]
Гемоглобин (и миоглобин) пищи, находящийся в ней в денатурированном состоянии, легко гидролизуется, распадаясь на простетическую группу и белок. Последний расщепляется далее пепсином и трипсином с образованием пептидов и аминокислот. Следовательно, глобиновая часть гемоглобина подвергается обычным превращениям в желудочно-кишечном тракте, которые свойственны простым белкам. Простетическая группа гемоглобина (оксигемоглобина) — гем — окисляется в гематин. Гематин, так же как и хлорофилл, всасывается в кишечнике очень плохо. Эти пигменты выделяются с калом частью в неизмененном виде, частью в внде различных продуктов, образующихся под влиянием бактерий кишечника. [c.364]
В качестве субстрата в данной работе выбран белок фибрин. Тщательно отмытый и высушенный при 160° фибрин окрашивается красителем. В реакционной среде с фосфатным буфером pH 8,2 фибрин не растворяется, и в отсутствии трипсина жидкость [ остается бесцветной. Если же в реакционную среду внести некоторое количество кристаллического трипсина и инкубировать при 37°, то жидкость окрасится. Окрашивание происходит вследствие того, что образовавшиеся при гидролизе Ф, с фибрина сравнительно низко-молекулярные продукты являются растворимыми и переходят в раствор вместе со связанным с ними красителем. По интенсивности окраски, которая пропорциональна степени процесса гидролиза, можно судить о скорости ферментативной реакции. Интенсивность окраски раствора определяют при помощи фотоэлектроколориметра (ФЭК). [c.83]
[c.83]
Химический состав и строение белков. При кипячении с кислотами, щелочами, а также под действием ферментов белковые вещества распадаются на более простые соединения, образуя в конце концов смесь а-аминокислот. Такое расщепление белков получило название гидролиза белка. Гидролиз белков имеет большое биологическое значение и широко представлен в растительном и животном организмах. Попадая в желудок И кишечник животного и человека, белок расщепляется под действием ферментов пепсин желудочного сока, трипсин поджелудочной железы и эрепсин стенок кишок) на аминокислоты образовавшиеся аминокислоты в дальнейшем усваиваются животным организмом и под влиянием ферментов снова преобразуются в белки, свойственные данному организму. [c.340]
Основы метода. Белок гидролизуют трипсином до обработки реагентом, вызывающим окраску. [c.118]
Переваривание белков представляет собой сложный процесс и совершается в несколько этапов. Начинается этот процесс в желудке под действием фермента пепсина. Дальнейший гидролиз пептидов происходит в тонком кишечнике протеазами поджелудочной железы трипсином, химотропсином, карбоксипептидазами. В переваривании пептидов участвуют также ферменты слизистой кишечника аминопептидаза и дипептидазы. Благодаря последовательному воздействию на белковую молекулу всех ферментов желудочно-кишечного тракта белок распадается на аминокислоты, которые всасываются в кровь. [c.160]
Бифункциональные реагенты типа R—О—R с различными реакционноспособными группировками применяются для исследования аминокислотных остатков вблизи активного центра. При взаимодействии химотрипсина с л-нитрофениловым эфиром бромацетил-а-аминоизомасляной кислоты [219, 255] вначале идет модификация активированного остатка серина, затем вторая реакционноспособная группировка атакует ближайший к нему (третий в цепи) остаток метионина. После гидролиза промежуточного продукта получают белок, в котором модифицирован только остаток метионина. В трипсине на месте остатка метионина располагается остаток глутамина, поэтому под действием данного реагента модификация идет лишь по активированному серину. [c.374]
В трипсине на месте остатка метионина располагается остаток глутамина, поэтому под действием данного реагента модификация идет лишь по активированному серину. [c.374]
Методика получения пептидных карт или отпечатков пальцев очень полезна при определении идентичности полипептидных цепей. Согласно этой методике, белок обрабатывают трипсином, который избирательно гидролизует пептидные связи, образованные карбоксильными группами основных аминокислот, аргинина и лизина. Образующаяся смесь пептидов разделяется с помощью хроматографии и электрофореза. Эквивалентный вес полипептидной цепи рассчитывают по количеству аргинина и лизина в белке и числу разных пептидов, получаемых при триптическом гидролизе. Теоретически общее число пептидов должно равняться сумме числа остатков аргинина и лизина плюс один, [c.401]
Осуществленный таким способом гидролиз пептидньк связей-это необходимый шаг в определении аминокислотного состава белков и последовательности составляющих их аминокислотных остатков. Пептидные связи могут быть гидро-лизованы также под действием некоторых ферментов, таких, как трипсин и химотрипсин, представляющие собой протеолитические (белок-расщепляю-щие) ферменты, секретируемые в кишечник и способствующие перевариванию, т. е. гидролитическому расщеплению, белков, входящих в состав пищи. Если кипячение пептидов с кислотой или щелочью приводит к гидролизу всех пептидных связей независимо от природы и последовательности соединенных при их помощи аминокислотных звеньев, то трипсин и химотрипсин осуществляют каталитическое расщепление пептидов избирательным образом. Трипсин гидролизует только те пептидные связи, в образовании которьсс участвуют карбоксильные группы лизина или аргинина. Химотрипсин же атакует только те пептидные связи, которые были образованы с участием карбоксильных групп фенилаланина, триптофана и тирозина. Как мы увидим дальше, такой избирательный ферментативный гидролиз оказьшается очень полезным при анализе аминокислотных последовательностей белков и пептидов.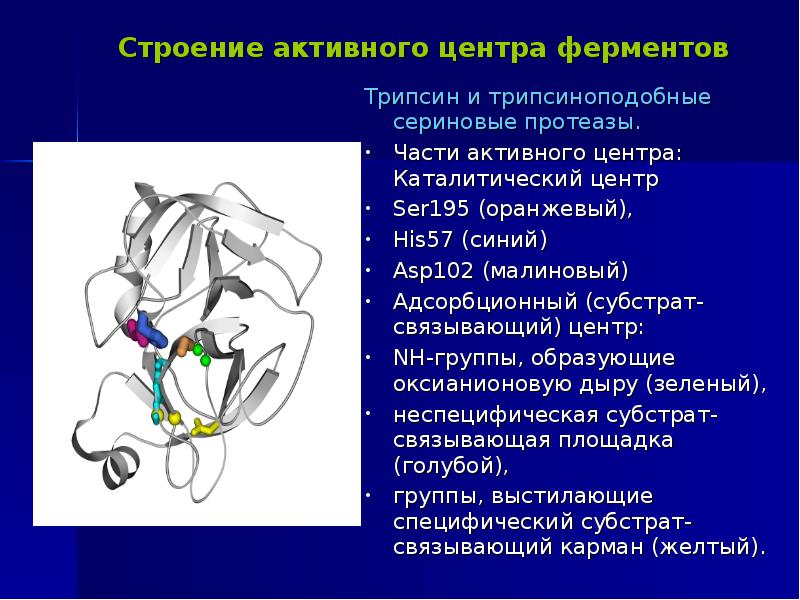 [c.130]
[c.130]
Такая модификация ограничивает действие трипсина расщеплением по остаткам аргинина, что приводит к большим фрагментам, чем те, которые образуются после действия фермента на не-модифицированный белок. Малеильную группировку можно удалить при pH 2—3 при комнатной температуре для того, чтобы выделенные в результате первого расщепления фрагменты можно было гидролизовать на более мелкие с помощью того же фермента. Такая процедура помогает при определении порядка связи пептидов в исходном белке. Альтернативно, е-аминогруппу лизиновых остатков можно модифицировать S-этилтрифторацетатом, что приводит к Л -трифторацетильным производным схема (28) . После расщепления по остаткам аргинина Л -трифторацетильную группу можно удалить обработкой водным пиперидином при 0°С. [c.275]
Промышленность очистки. Так как протеолитические ферменты обладают моющим действием, их используют в определенных количествах при стирке белья, для чистки одежды и обивочных тканей мебели, автомобилей, для удаления белковых нятен. Чаще всего применяются ферменты бактерий, затем грибов и, реже, панкреатин (трипсин), причем для чистки выпускаются специальные патентованные препараты. Они служат, в частности, для выведения пятен крови, что весьма важно при стирке в медицинских учреждениях, госпиталях, а также для выведения пятен молока, яиц и др. Органические растворители таких пятен не снимают, а, наоборот, закрепляют их на ткани. Протеиназы же снимают их легко, гидролизуя белок и переводя его в растворимое состояние. В настоящее время для подобных целей применяют не только протеиназы, но и, как мы видели, амплазу, гидролизующую крахмал, а также липазу, расщепляющую жир. В связи с увеличением количества общественных прачечных и цехов чистки, обслуживающих миллионы людей и тысячи разнообразных учреждений, масштаб использования ферментов в данной отрасли растет. Можно сказать с уверенностью, что синтетические моющие средства, применяемые в специальных препаратах вместе с ферментами (протеиназами, липазами и амилазами), при соответствующих физико-химических условиях и надлежащем составе дают значительно лучшие результаты, чем обычные моющие препараты при удалении стойких пятен, образованных белками, крахмалом или жирами. [c.250]
[c.250]
ДО полного изменения в расположении пептидных цепей. Развертывание пептидных цепей при денатурации подтверждается тем, что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. Это было впервые установлено для реакций на сульфгидрильные группы цистеина и на дисульфидные группы цистина [136]. Реакция с нитропуссидом, титрование железосинеродистым калием [39], ацетилирование [137] и полярография [138] — все эти методы определения сульфгидрильных и дисульфидных групп показали, что число этих групп в денатурированных белках больше, чем в тех же белках, находящихся в нативном состоянии. Денатурированные белки дают также более интенсивные цветные реакции на тирозин с фосфорномолибденовой кислотой [139, 140] и с диазореактивом [141], а на аргинин с реактивом Сакагуши [142] и присоединяют большие количества иода [143]. В то время как в нативном лакто-глобулине только 12 -аминогрупп лизина реагируют с динитрофторбензолом, в денатурированном лактоглобулине эту реакцию дает 31 е-аминогруппа, т. е. все содержащиеся в нем е-аминогруппы [144]. Таким образом, все приведенные данные подтверждают ту точку зрения, что при денатурации в связи с развертыванием пептидных цепей становятся доступными те активные группы, которые в нативных белках недоступны для соответствующих реактивов. Подобным же образом можно объяснить меньшую устойчивость ряда денатурированных белков по отношению к действию трипсина. Как известно, многие денатурированные белки гораздо легче расщепляются трипсином, чем те же самые белки в нативном состоянии. Это можно рассматривать как следствие того, что при денатурации разрываются связи, тесно удерживающие пептидные цепи друг около друга, и обнажаются те пункты, на которые может воздействовать фермент [146, 147]. Можно полагать, что трипсин, гидролизуя (хотя и медленно) нативные белки, гидролизует, в сущности, содержащиеся в них следы денатурированных белков. При этом процессе должно происходить непрерывное нарушение равновесия в системе нативный белок—денатурированный белок и смещение этого равновесия в правую сторону. [c.149]
[c.149]
Ферментативное расщепление. Хорошие результаты дают протеолитические ферменты, в первую очередь трипсин и химотрипсин а также пепсин Известно, что трипсин разрушает белок преимущественно но пептидным связям, образованным карбоксильными группами аргинина и лизина химотрипсин гидролизует нентидные связи, в образовании которых участвуют карбоксильные группы ароматических аминокислот (фенилаланина, тирозина и триптофана). Снецифичностт. пепсина менее ясно выражена, хотя в принципе близка к химотрипсину (атака вблизи ароматических аминокислот). Другие ферменты, такие, как термолизин плесневая нротеаза папаин тоже находят применение при гидролизе белков. Ферментативный гидролиз проводят при 37—40° С в течение нескольких часов при оптимальном для данного фермента значении pH. Ниже показано действие протеолитических ферментов на полипептидную цепь восстановленного лизоцима белка яиц (Т — трипсин, X — химотрипсин, П — пепсин, СМС — карбоксиметилцистеин) [c.79]
Как уже отмечалось, нуклеиновые кислоты очень перспективны для использования в качестве полимерных носителей биологически активных веществ с целью защиты последних от ферментативного гидролиза и облегчения их достави к органу- или клетке-мишени. Нами была исследована устойчивость комплексов ДНК с инсулином, пепсином и кортексином к гидролизу ДНКазой и трипсином. Оказалось, что эти ферменты не разрушают комплексы и не гидролизуют белок, связанный в комплекс. Это, безусловно, свидетельствует о перспективности применения комплексов ДНК с белками и пептидами для создания пероральных лекарственных форм препаратов, обладающих регуляторными функциями. [c.155]
Гидролиз трипсином проводят в слегка щелочной среде (Nh5-бикарбонатный буфер, pH 8) в течение 2—3 ч при 37°. Весовое соотношение фермент/белок должно составлять примерно 1 50. Иногда трипсин добавляют двумя порциями с интервалом в 1 —1,5 ч, с тем чтобы уменьшить эффект автолиза фермента. По этой же причине растворять трипсин следует непосредственно перед его исполь. юва-иием. Вниду относительно малого количества фермента его, как правило, не удаляют из реакционной смеси, а всю ее лиофилизируют. [c.298]
По этой же причине растворять трипсин следует непосредственно перед его исполь. юва-иием. Вниду относительно малого количества фермента его, как правило, не удаляют из реакционной смеси, а всю ее лиофилизируют. [c.298]
ФалджериДьюш [48] запатентовали сходный процесс того же типа для модифицирования гидролизатов белков сои, арахиса, хлопчатника, кукурузы, рапса и сезама. После термической денатурации белок в суспензии гидролизуется на 60—80 % при добавлении кислотных или основных эндопептидаз животного или растительного происхождения, таких, как пепсин, трипсин, химотрипсин, папаин, фицин, либо экзопептидаз микробиального происхождения. Затем происходит реакция с ангидридом янтарной кислоты при pH 7,0 и температуре ниже 15 °С в результате продукты гидролиза теряют запах и вкус даже в кислом растворе, и в таком виде они рекомендуются для приготовления напитков, таких, как лимонный и томатный сок, или газированных вод. [c.610]
При активировании химотрипсиногена трипсином, в ходе которого наблюдается также аутолиз или действие химотрипсина на. химотрипсиноген, помимд ожидаемого гидролиза связи —Тир.Тре— происходит разрыв связей —Лей.Сер— и —Асп(ЫН2).Ала—, т. е. связей, образованных остатками, не содержащими боковых цепей ароматического характера. Таким образом, связь —Тир.Тре— представляет собой единственную связь, в которой участвует аминокислота с ароматическим заместителем в боковой цепи, хотя белок содержит четыре остатка тирозина, шесть остатков фенилаланина и шесть остатков триптофана. Это является еще одним доказательством устойчивости нативного белка к ферментативному гидролизу. [c.203]
На следующем этапе исследования белок подвергают ферментативному гидролизу на пептиды, например под действием трипсина, химотрипсина и пепсина. Разделение пептидов осуществляют с помощью хроматографии и электрофореза на бумаге. Затем, пользуясь ДНФБ-методом, определяют аминокислотную последовательность, начиная с Ы-конца. [c.289]
[c.289]
Последовательность аминокислотных остатков в полипептид-,ной цепи называется ее первичной структурой. Определение пер.-вичной структуры производится путем частичного гидролиза белка с помощью специфических протеаз, катализирующих расщепление пептидной связи лишь между определенными остатками. Так, трипсин атакует лишь те пептидные связи, которые образованы СО-группами остатков основных аминокислот — Apr или Лиз. В результате образуется смесь коротких полипептидных цепей, олигомеров. Такие короткие цепи называются пептидами. Их исследование производится посредством химических и физико-химических методов (хроматография, масс-спектроскопия). Воздействуя другим ферментом, можно разрезать белок по другим связям, получить смесь других пептидов. N- и С-конце-вые остатки белка (см. стр. 68) определяются в результате их химической модификации, предшествующей частичному гидролизу. Зная строение пептидов, полученных при специфическом расщеплении различными ферментами, можно установить первичную структуру белка. Допустим, что белковая цепь имеет структуру [c.73]
Вторая белковая фракция, названная в честь ее первооткрывателя белком Вольфграма, характерна тем, что растворяется в подкисленной соляной кислотой смесн хлороформа и метанола. Она имеет большую молекулярную массу и составляет 20% белка миелина. В отличие от белка Фолч-Пи данный белок гидролизуется трипсином и состоит по крайней мере из трех компонентов. [c.102]
Термолабильный энтеротоксин Е. сой представляет собой крупномолекулярный белок, способный к диссоциации, с молекулярной массой от 2000 до 5 10 Да, разрушается под действием проназы и устойчив к обработке трипсином. Слабый кислотный гидролиз и нагревание до 65 °С в течение 30 минут инактивирует токсин. [c.365]
Расщепление белковых веществ при кипячении с кислотами, щелочами или под действием ферментов (энзимов) называют гидролизом. Биологическое значение его очень велико, он всегда происходит в живых организмах. В кишечнике животных (и человека) белок пищи гидролизуется при участии ферментов (пепсина, трипсина и эрепсина) на аминокислоты, усваиваемые организмом и преобразуемые в свойственные ему белки. Конечные продукты гидролиза белков — а-аминокислоты, но сначала получаются более сложные альбумозы и пептоны. Гидролиз белка изображают схемой белок -> альбумозы -> пептоны -> полипептиды -> дипептиды —> аминокислоты. [c.379]
В кишечнике животных (и человека) белок пищи гидролизуется при участии ферментов (пепсина, трипсина и эрепсина) на аминокислоты, усваиваемые организмом и преобразуемые в свойственные ему белки. Конечные продукты гидролиза белков — а-аминокислоты, но сначала получаются более сложные альбумозы и пептоны. Гидролиз белка изображают схемой белок -> альбумозы -> пептоны -> полипептиды -> дипептиды —> аминокислоты. [c.379]
Химический состав и строение белков. При кипячении с кислотами, щелочами, а также под действием ферментов белковые вещества распадаются на более простые соединения, образуя в конце концов смесь а-аминокислот. Такое расщепление белков получило название гидролиза белка. Гидролиз белков имеет большое биологическое значение и щироко представлен в растительном и животном организмах. Попадая в желудок и кишечник животного и человека, белок расщепляется под действием ферментов (пепсин желудочного сока, трипсин поджелудочной железы и эрепсин стенок кищок) на аминокислоты образо-вавщиеся аминокислоты в дальнейшем усваиваются животным организмом и под влиянием ферментов снова преобразуются в белки, свойственные данному организму. Гидролиз белков не идет сразу до аминокислот. Выделены промежуточные продукты гидролиза, более сложные, чем аминокислоты, но проще, чем белки, известные под названием альбумоз и пептонов. [c.338]
В результате ферментативного воздействия, определяли последовательно после каждого отщепления Ы-концевого остатка по методу Эдмана (см. гл. 6). При изучении гемоглобина (Брауницер был удачно применен последовательный гидролиз белка разными про-теолитическими ферментами. В этом случае на белок действовали трипсином, а затем полученные пептиды гидролизовали пепсином, специфичность которого значительно повышали, ограничивая время реакции. Методические трудности, связанные с фракционированием сложных гидролизатов и определением полной структурной формулы белка, были преодолены в результате упорного труда нескольких групп ученых. Мы теперь знаем полную аминокислотную последовательность инсулина, глюкагона, рибонуклеазы, гемоглобина, белка вируса табачной мозаики, а также кортикотропина и других пептидных гормонов приближаются к завершению работы по установлению строения папаина, лизоцима, химотрипсиногена, трипсииогена, цитохрома с успешно продвигается изучение некоторых других белков. Изучение последовательности аминокислот проводилось на частичных кислотных гидролизатах или на гидролизатах, полученных при действии различных протеолитических ферментов. Чисто химические методы избирательного расщепления пептидных цепей не имели до сих пор значительного успеха, и эта область остается еще нерешенной задачей пептидно химии. [c.117]
Мы теперь знаем полную аминокислотную последовательность инсулина, глюкагона, рибонуклеазы, гемоглобина, белка вируса табачной мозаики, а также кортикотропина и других пептидных гормонов приближаются к завершению работы по установлению строения папаина, лизоцима, химотрипсиногена, трипсииогена, цитохрома с успешно продвигается изучение некоторых других белков. Изучение последовательности аминокислот проводилось на частичных кислотных гидролизатах или на гидролизатах, полученных при действии различных протеолитических ферментов. Чисто химические методы избирательного расщепления пептидных цепей не имели до сих пор значительного успеха, и эта область остается еще нерешенной задачей пептидно химии. [c.117]
Скорость гидролиза трипсином после 6 час очень невелика, и интенсивность нингидриновой окраски в конце процесса соответствует расщеплению двенадцати связей. Гндролиз химотрипсином протекает с постоянной скоростью в течение первых 20 час, завершаясь образованием 18 пептидов. Можно предполагать, что неспецифическое расщепление пептидных связей минимально, если скорость увеличения числа аминогрупп постоянна. При действии пепсина на белок при двух различных значениях отношения фермент/субстрат увеличение интенсгшности нингидриновой окраски теоретически соответствовало расщеплению 7 и 11 связей. В действительности приращение интенсивности окраски объясняется неполным гидролизом большего числа связей. [c.120]
Важная особенность пептидил-пептидгидролаз состоит в выборочном (селективном) характере их действия на пептидные связи в белковой молекуле. Например, пепсин избирательно ускоряет гидролиз пептидных связей, образованных ароматическими или дикарбоновыми аминокислотами, трипсин — связей, образованных аргинином и лизином, химотрипсин — ароматическими аминокислотами. Индивидуальный белок под действием определенного фермента расщепляется на строго определенное количество пептидов. Избирательное действие этих ферментов объясняется тем, что радикал аминокислоты, по соседству с которой гидролизуется пептидная связь, служит для образования фермент-субстратного комплекса. [c.121]
[c.121]
Выделение и установление строения. Ангиотензиноген представляет собой белок, из которого при действии ренина образуется ангиотензин он содержится в аг-глобулиновой фракции белков плазмы крови [1734, 1737]. До настоящего времени ангиотензиноген удалось выделить лишь в частично очищенном состоянии [853, 2130]. Скеггс и сотр. [2130], основываясь на том факте, что вся молекула ангиотензиногена не является необходимой для проявления субстратной специфичности по отношению к ренину, подвергли обработке трипсином наиболее чистый препарат ангиотензиногена. Из продуктов триптического гидролиза этим исследователям удалось выделить хроматографически чистое вещество, названное ими полипептидным субстратом ренина , которое сохраняло способность расщепляться ренином. [c.32]
Протеазы распространены в животном и растительном мире существуют клеточные протеазы, осуществляющие соответствующие реакции внутри клеток. Особенно известен папаин, который выделяют нз плодов папайи. Но наиболее важны и наиболее изучены протеазы пищеварительного тракта животных и человека. Стенки желудка выделяют неактивный белок профермент) —пепсиноген. Под влиянием кислого желудочного сока и готового находящегося в желудочном соке пепсина от пепсиногена отщепляется полипептидная цепь, и он превращается в активный фермент пепсин, имеющий молекулярный вес 35 000 и давно уже полученный в кристаллическом виде. Пепсин при оптимальном pH 1,5—2,5 разрывает белки преимущественно по месту нахождения обеих ароматических аминокислот (тирозин и фенилаланин) у их аминного конца. При этом необходимо, чтобы аминокислота, соседняя с ароматической, имела такие зацепки для пепсина, как остатки СООН или 5Н, и не имела свободной КНг-группы. Этих условий оказывается, однако, достаточно для того, чтобы в желудке произошел гидролиз макромолекул белков на сравиительно небольшие пептидные цепи. Дальнейшее переваривание пищи в двенадцатиперстной кишке и далее в тонких кишках происходит в условиях уже щелочной среды. Двенадцатиперстную кишку снабжает ферментами поджелудочная железа, которая выделяет проферменты — трипсиноген, химотрипсииоген и профермент, соответствующий карбоксипептидазе. Эти проферменты (как и пепсиноген, см. выше) превращаются в двенадцатиперстной кишке в ферменты—трипсин, химотрипсин и карбоксипептидазу. [c.701]
Двенадцатиперстную кишку снабжает ферментами поджелудочная железа, которая выделяет проферменты — трипсиноген, химотрипсииоген и профермент, соответствующий карбоксипептидазе. Эти проферменты (как и пепсиноген, см. выше) превращаются в двенадцатиперстной кишке в ферменты—трипсин, химотрипсин и карбоксипептидазу. [c.701]
Денатурация белков — это разрушение третичной и частично вторичной структур путем разрыва дисульфидных и слабых нековалентных взаимодействий (водородных, ионных, гидрофобных), сопровождающееся потерей функции белка. Иными словами, денатурация — это потеря нативной структуры. При денатурации не разрываются пептидные связи, т.е. первичная структура сохраняется. Денатурацию белков вызывают любые агенты, действующие на нековалентные взаимодействия. При этом белок выпадает в осадок, если теряются основные факторы устойчивости — заряд и гидратная оболочка. Если после удаления денатурирующего агента восстанавливается нативная структура белковой молекулы, то это явление называется ренатурацией (ренативацией). В пищеварительном тракте денатурация пищевых белков соляной кислотой приводит к доступности пептидных связей для ферментативного гидролиза первичной структуры (пепсин в желудке трипсин, химотрипсин, карбоксипеп-тидазы в двенадцатиперстной кишке дипептидазы, трипептидазы и аминопептидазы в тонком кишечнике). [c.37]
Поставка диагностических и лабораторных реагентов № 1
Позиция №1 Набор реагентов для иммуноферментного определения концентрации СА 19-9 в клиническом образце Набор реагентов для иммуноферментного определения концентрации СА 19-9 в клиническом образце. Чувствительность: 1 Ед/мл Диапазон измерений: 0-300 Ед/мл
Позиция №2
Интерферон ИВД, набор, иммуноферментный анализ (ИФА)
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения одного или множества типов интерферона (interferon) в клиническом образце методом иммуноферментного анализа (ИФА) № РЗН 2017/6008
Набор реагентов для иммуноферментного определения концентрации гамма-Интерферона в клиническом образце.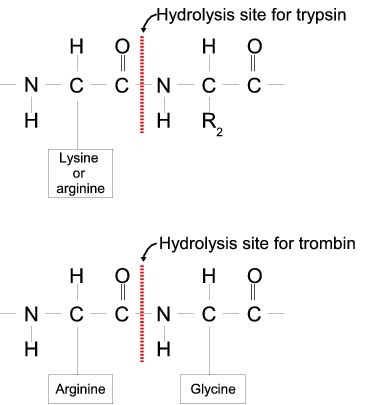
Позиция №3 Май-Грюнвальда красящий раствор ИВД Май-Грюнвальда (May-Grünwald) красящий раствор, предназначенный для использования отдельно или в сочетании с другими растворами/красителями, для обнаружения тканевых структур и/или внутри-/внеклеточных элементов в биологическом/клиническом образце. Количество выполняемых тестов — 1000 Назначение — для ручной постановки Краситель-фиксатор Эозин метиленовый синий по Май-Грюнвальду Упаковка — 1л
Позиция №4
Триглицериды ИВД, набор, ферментный спектрофотометрический анализ
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения триглицеридов (triglyceride) в клиническом образце с использованием метода ферментного спектрофотометрического анализа Набор предназначен для количественного определения концентрации триглицеридов в клиническом образце энзиматическим колориметрическим методом. Количество выполняемых тестов — ≥ 100;
Назначение — для анализаторов открытого типа и ручной постановки
Состав:
Реагент 1: 100 мл
Калибратор: 2 мл
Количество выполняемых тестов — ≥ 100;
Назначение — для анализаторов открытого типа и ручной постановки
Состав:
Реагент 1: 100 мл
Калибратор: 2 мл
Позиция №5 RPMI-1640 без L-глутамина Производитель: ПанЭко, 450 мл рН: от 7,0 до 7,4 Осмолярность: 280+/- 20 мосмоль/кг Буферная ёмкость: не менее 4,5 мл
Позиция №6
Мочевая кислота ИВД, набор, ферментный спектрофотометрический анализ
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения мочевой кислоты (uric acid) в клиническом образце методом ферментного спектрофотометрического анализа. Набор реагентов для ферментативного определения концентрации мочевой кислоты в сыворотке крови и моче.
Количество выполняемых тестов — 100
Набор реагентов для ферментативного определения концентрации мочевой кислоты в сыворотке крови и моче.
Количество выполняемых тестов — 100
Позиция №7 Общая амилаза ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения общей амилазы (ОА) (total amylase) в клиническом образце, с использованием метода ферментного спектрофотометрического анализа Набор для определения α-амилазы в биологических жидкостях методом Каравея. Количество выполняемых тестов — ≥ 100; Назначение — Для анализаторов открытого типа и ручной постановки
Позиция №8
Набор реагентов для иммуноферментного определения концентрации опухолевого маркера СА-125 в клиническом образце
Набор реагентов для иммуноферментного определения концентрации опухолевого маркера СА-125 в клиническом образце. Чувствительность: 1,5 Ед/мл
Диапазон измерений: 0-400 Ед/мл
Чувствительность: 1,5 Ед/мл
Диапазон измерений: 0-400 Ед/мл
Позиция №9 Множественные интерлейкины/интерлейкиновые рецепторы ИВД, набор, иммуноферментный анализ (ИФА) Набор реагентов и других связанных с ними материалов, предназначенный для качественного и/или количественного определения одного или множества интерлейкинов (interleukins) и/или интерлейкиновых рецепторов (interleukin receptors) в клиническом образце с использованием метода иммуноферментного анализа (ИФА). № РЗН 2014/2083 Набор реагентов для иммуноферментного определения концентрации интерлейкина -18 в клиническом образце
Позиция №10
Секреторный иммуноглобулин А (секреторный IgA) ИВД, набор, иммуноферментный анализ (ИФА)
Набор реагентов и других связанных с ними материалов, предназначенный для качественного и/или количественного определения секреторного иммуноглобулина А (secretory immunoglobulin A, secretory IgA) в клиническом образце с использованием метода иммуноферментного анализа (ИФА). № ФСР 2010/07853
Набор реагентов для иммуноферментного определения концентрации секреторного иммуноглобулина класса А в клиническом образце.
Чувствительность: 0,35 мг/л
Диапазон измерений: 0-20 мг/л
№ ФСР 2010/07853
Набор реагентов для иммуноферментного определения концентрации секреторного иммуноглобулина класса А в клиническом образце.
Чувствительность: 0,35 мг/л
Диапазон измерений: 0-20 мг/л
Позиция №11 Трипсин из поджелудочной железы свиньи 1:250 Трипсин из поджелудочной железы свиньи 1:250 Описание: для работы с культурами клеток Молекулярный вес 24 000 Внешний вид: белый порошок Остаточная влажность: не более 10 % Активность трипсина: 277 ЕД/мг Присутствие парвовируса отсутствует Соли аммония: не более 0,0002 % Условия хранения: от 2 до 8 0С Упаковка: 25 г
Позиция №12
C-реактивный белок (СРБ) ИВД, набор, реакция агглютинации
Набор реагентов и других связанных с ними материалов, предназначенный для полуколичественного определения С-реактивного белка (C-reactive protein (CRP)) в клиническом образце методом агглютинации. Набор «С-реактивный белок» предназначен для качественного и полуколичественного определения содержания С-реактивного белка (СРБ) в клиническом образце методом латекс- агглютинации.
Количество выполняемых тестов — ≥ 100
Назначение — для ручной постановки
Состав:
Реагент 1: 2 мл
Реагент 2: 10мл
Реагент 3: 0,1 мл
Реагент 4: 0,2 мл
Реагент 5: 0,2 мл
Набор «С-реактивный белок» предназначен для качественного и полуколичественного определения содержания С-реактивного белка (СРБ) в клиническом образце методом латекс- агглютинации.
Количество выполняемых тестов — ≥ 100
Назначение — для ручной постановки
Состав:
Реагент 1: 2 мл
Реагент 2: 10мл
Реагент 3: 0,1 мл
Реагент 4: 0,2 мл
Реагент 5: 0,2 мл
Позиция №13 Натрий (Na+) ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения натрия (sodium) (Na+) в клиническом образце методом ферментного спектрофотометрического анализа Набор предназначен для количественного определения содержания натрия в клиническом образце колориметрическим методом Количество выполняемых тестов — ≥ 50 Назначение — для анализаторов открытого типа и ручной постановки Состав: Реагент 1: 25 мл Реагент 2: 50мл Калибратор: 1 мл
Позиция №14 Железо ИВД, набор, спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения железа (iron) в клиническом образце методом спектрофотометрии Набор предназначен для количественного определения содержания железа в клиническом образце колориметрическим методом без депротеинизации Количество выполняемых тестов — ≥ 50 Назначение — для ручной постановки анализа и анализаторов открытого типа Состав: Реагент 1: 50 мл Калибратор: 2 мл
Позиция №15
4-Диметиламинобензальдегид 4-(Dimethylamino) benzaldehyde
Формула: С9Н11NO
Внешний вид:
Белый кристаллический порошок
Массовая доля — Содержит не менее 99,0 %. Упаковка — 100 г.
Упаковка — 100 г.
Позиция №16 Нитросиний тетразолий-п (хлорид) (НСТ) Формула: C40h40N10O6 х2Cl Mr=817,63 Фасовка: 500 мг. Концентрация: > 90 % Чистота: ч Внешний вид: желтый порошок. Содержание основного вещества – не менее 90%. Условия хранения: 2-8 С, закрытая темная тара. CAS 298-83-9
Позиция №17
Набор реагентов Моно — РИД — G,A,M
сыворотки диагностические моноспецифические против IgG (H+L), IgG (H), IgM (H), IgA (H) человека, сухие
Лиофилизат для диагностических целей. Представляют собой сыворотки крови кроликов, коз или овец, гипериммунизированных иммуно-глобулинами IgG, IgM, IgA человека, содержащие антитела против тяжелых цепей соответствующих иммуноглобулинов. Контрольная сыворотка — смесь сывороток крови человека (не менее 500 доноров) с установленным содержанием иммуноглобулинов IgG, IgM, IgA. Моноспецифические сыворотки предназначены для качественного и количественного определения соответствующих иммуноглобулинов в норме и патологии в сывороточных препаратах и биологических жидкостях.
Контрольная сыворотка — смесь сывороток крови человека (не менее 500 доноров) с установленным содержанием иммуноглобулинов IgG, IgM, IgA. Моноспецифические сыворотки предназначены для качественного и количественного определения соответствующих иммуноглобулинов в норме и патологии в сывороточных препаратах и биологических жидкостях.
Позиция №18 Мочевая кислота ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения мочевой кислоты (uric acid) в клиническом образце методом ферментного спектрофотометрического анализа. Набор реагентов предназначен для количественного определения содержания мочевой кислоты в клиническом образце колориметрическим методом Метод: реакция с железо-фенантролиновым реагентом; по конечной точке. Количество выполняемых тестов — ≥ 100 Назначение — для ручной постановки анализа и анализаторов открытого типа Состав: Реагент 1: 180 мл Реагент 2: 20 мл Калибратор: 2 мл
Позиция №19
Гемоглобин сухой
Порошок темно-бурого цвета, полученный методом фракционирования и распылительной сушки свиной крови. Фасовка: 1 кг
Фасовка: 1 кг
Позиция №20 Родамин Ж (6Ж, 6G) Синонимы: Родамин 6Ж, Родамин 6G. Химическая формула: C28h40N2O3 Квалификация: ЧДА Свойства: кристаллический порошок бордово-коричневого цвета. Флуоресцирует под действием ультрафиолетового света, испуская в свою очередь свет темно малинового цвета. Фасовка: 50 г
Позиция №21 Пенициллин-стрептомицин, 100-кратный лиофилизированный Препарат содержит: Пеницилина-25000 ед Стрептомицина-25000 мкг Упаковка: 10 х 5 мл
Позиция №22 Эмбриональная телячья сыворотка Сыворотка эмбриональная телячья, жидкая, для культур клеток, HyClone, стерильная, ПЭТ, 500 мл
Позиция №23
Калий (K+) ИВД, набор, нефелометрический/турбидиметрический анализ
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения калия (potassium) (К+) в клиническом образце методом нефелометрического/турбидиметрического анализа. Набор предназначен для количественного определения содержания калия в клиническом образце турбидиметрическим методом без депротеинизации.
Количество выполняемых тестов — ≥ 50
Состав:
Реагент 1: 50 мл
Калибратор: 1 мл
Набор предназначен для количественного определения содержания калия в клиническом образце турбидиметрическим методом без депротеинизации.
Количество выполняемых тестов — ≥ 50
Состав:
Реагент 1: 50 мл
Калибратор: 1 мл
Позиция №24 Индикаторы Применяется в общих тестах на щелочные или кислые реакции, а также в реакциях нейтрализации для проверки, произошло ли изменение с кислой среды до щелочной и наоборот. Тип теста индикаторная бумага Диапазон измерений pH 2.0-9.0. Шаг шкалы (основной) — «1» (единица) Количество в упаковке 100 индикаторных полосок
Позиция №25
Валинoмицин, 90%
Формула: C54 H90 N6 O18
Молекулярная масса: 1111. 34 г/моль
CAS номер: 2001-95-8
Чистота: 90%
Упаковка 10 мг
34 г/моль
CAS номер: 2001-95-8
Чистота: 90%
Упаковка 10 мг
Позиция №26 Амфотерицин B Синонимы: Амфотерицин В, Amphotericin B Химическая формула: C47H73NO17 Молекулярная масса 924.08 г/моль Внешний вид: Порошок лиофилизированный — пористая масса желтого цвета, без запаха или почти без запаха. Гигроскопичен. Растворим в воде. Стерильный. CAS № 1397-89-3 Упаковка: 100 мг
Позиция №27
Набор реагентов для определения активности лактатдегидрогеназы
Набор предназначен для количественного определения общей активности лактатдегидрогеназы (ЛДГ) в клиническом образце кинетическим методом. Состав:
Реагент 1: 50 мл
Реагент 2: 10 флаконов
Состав:
Реагент 1: 50 мл
Реагент 2: 10 флаконов
Позиция №28 Триглицериды ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения триглицеридов (triglyceride) в клиническом образце с использованием метода ферментного спектрофотометрического анализа Набор реагентов для определения содержания триглицеридов в сыворотке крови. Количество выполняемых тестов — ≥ 100; Назначение -Для анализаторов открытого типа и ручной постановки
Позиция №29 Кальций (Ca2+) ИВД, набор, спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения кальция (calcium (Ca2+)) в клиническом образце методом спектрофотометрического анализа Набор предназначен для количественного определения содержания кальция в клиническом образце колориметрическим методом (хромоген Арсеназо III) Количество выполняемых тестов — ≥ 100 Назначение — для анализаторов открытого типа и ручной постановки Состав: Реагент 1: 100 мл Калибратор: 2 мл
Позиция №30
Набор реагентов для иммуноферментного определения концентрации свободной фракции трийодтиронина в клиническом образце
Набор реагентов для иммуноферментного определения концентрации свободной фракции трийодтиронина в клиническом образце.
Позиция №31 Глюкоза ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения глюкозы (glucose) в клиническом образце методом ферментного спектрофотометрического анализа Предназначен для количественного определения содержания глюкозы в клиническом образце энзиматическим колориметрическим методом без депротеинизации. Количество выполняемых тестов ≥ 500 Назначение — для анализаторов открытого типа и ручной постановки Состав набора Реагент 1: 500 мл Реагент 2: 2 флакона Калибратор: 5 мл
Позиция №32
Тирозин-L
Синонимы: L-Тирозин
CAS-No. 60-18-4
Химическая формула C9h21NO3
Молекулярная масса 181,19 г/моль
Содержание основного вещества >99%
Растворимость (25°C) ,4 г/л (h3O)
Тест на пирогены соответствует
Другие амино кислоты макс. 0,5%
Аммоний макс. 0,1%
Хлориды макс. 0,02%
Сульфаты макс. 0,02%
As макс. 0,0001%
Fe макс. 0,001%
Pb макс. 0,001%
Квалификация: ХЧ
Упаковка: 100 г
60-18-4
Химическая формула C9h21NO3
Молекулярная масса 181,19 г/моль
Содержание основного вещества >99%
Растворимость (25°C) ,4 г/л (h3O)
Тест на пирогены соответствует
Другие амино кислоты макс. 0,5%
Аммоний макс. 0,1%
Хлориды макс. 0,02%
Сульфаты макс. 0,02%
As макс. 0,0001%
Fe макс. 0,001%
Pb макс. 0,001%
Квалификация: ХЧ
Упаковка: 100 г
Позиция №33 Нистатин 2-водный Синонимы: нистатин дигидрат, нистатин, Nystatin Химическая формула: C47H75NO17 Молекулярная масса 926.09 г/моль Характеристики: Нистатин 2-водный, для биохимии, МИН. 4400 ЕД/МГ Внешний вид: Светло-желтый порошок со специфическим запахом. Практически нерастворим в воде, очень мало в спирте. Гигроскопичен. Упаковка: 5 г CAS №: 1400-61-9
Позиция №34
Пластины для тонкослойной хроматографии
Пластины для тонкослойной хроматографии предназначены для анализа всех классов растворимых химических соединений и их смесей методом тонкослойной хроматографии. Тип сорбента-силикагель СТХ-1А
Зернение, мкм – 5-17
Толщина слоя, мкм 100-110
Связующее – силиказоль
УФ индикатор- УФ-254
Тип подложки ПЭТФ
Размер пластины 100×100
Количество, шт50
Тип сорбента-силикагель СТХ-1А
Зернение, мкм – 5-17
Толщина слоя, мкм 100-110
Связующее – силиказоль
УФ индикатор- УФ-254
Тип подложки ПЭТФ
Размер пластины 100×100
Количество, шт50
Позиция №35 Аденозин 5′-трифосфат динатриевая соль гидрат (Adenosine 5′-triphosphate disodium salt hydrate) BioXtra, ≥99% (HPLC), от микробного Эмпирическая формула: C10h24N5Na2O13P3 xh3O Молекулярная масса: 551.14 A7699 Sigma-Aldrich EC Number 213-579-1 Упаковка -1г
Позиция №36
Декальцинирующий раствор ИВД
Раствор, предназначенный для использования в качестве декальцинирующего агента при подготовке клинических образцов и биологических тканей для дальнейших анализов ИВД. Обычно это раствор неорганической кислоты [например, соляной (HCl)], органической кислоты [например, муравьиной (Ch3O2)] или хелатирующего агента [например, этилендиаминтетрауксусной кислоты (ЭДТА)]. Электролитный декальцинирующий раствор
Объем реагента – 2500мл/упак
Обычно это раствор неорганической кислоты [например, соляной (HCl)], органической кислоты [например, муравьиной (Ch3O2)] или хелатирующего агента [например, этилендиаминтетрауксусной кислоты (ЭДТА)]. Электролитный декальцинирующий раствор
Объем реагента – 2500мл/упак
Позиция №37 Креатинин ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения креатинина (creatinine) в клиническом образце методом ферментного спектрофотометрического анализа Набор реагентов для определения концентрации креатинина в сыворотке, плазме крови и моче колориметрическим методом по конечной точке (реакция Яффе, принцип Слота). Количество выполняемых тестов — ≥ 100;
Позиция №38
Общая амилаза ИВД, набор, ферментный спектрофотометрический анализ
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения общей амилазы (ОА) (total amylase) в клиническом образце, с использованием метода ферментного спектрофотометрического анализа Набор для определения α-амилазы в биологических жидкостях методом Каравея.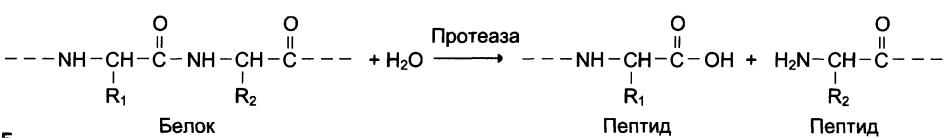 Количество выполняемых тестов — ≥ 100;
Назначение — Для анализаторов открытого типа и ручной постановки
Чувствительность: сыворотка- 0,33 мг/сек*л, моча- 2 мг/сек*л
Состав набора:
Реагент №1. Буфер
Реагент №2. Субстрат-крахмал 10 мг/мл
Реагент №3. Концентрированный раствор йода.
Реагент №4. KF
Реагент №5. Соляная кислота
Реагенты стабильны в течении 12 месяцев при температуре 2-8° С
Количество выполняемых тестов — ≥ 100;
Назначение — Для анализаторов открытого типа и ручной постановки
Чувствительность: сыворотка- 0,33 мг/сек*л, моча- 2 мг/сек*л
Состав набора:
Реагент №1. Буфер
Реагент №2. Субстрат-крахмал 10 мг/мл
Реагент №3. Концентрированный раствор йода.
Реагент №4. KF
Реагент №5. Соляная кислота
Реагенты стабильны в течении 12 месяцев при температуре 2-8° С
Позиция №39 Набор реагентов для иммунохроматографического выявления кардиомаркеров в клиническом образце «ИммуноХром-КАРДИО-Экспресс» ИммуноХром-КАРДИО-Экспресс» — тест-плашка для иммунохроматографического быстрого определения Тропонина I (cTnl) в клиническом образце как помощь в диагнозе острого инфаркта миокарда. Состав набора — Тест-плашка, запечатанная в индивидуальный фольгированный пакет с селикагелем (осушителем) – 20 шт. — Пипетка – 20 шт. — Ланцет-20 шт. Тест должен храниться при температуре 1-30 С.
Позиция №40
Холестерин липопротеинов высокой плотности ИВД, набор, ферментный спектрофотометрический анализ
Набор для ручного анализа, полуавтоматических и автоматических анализаторов. Количество выполняемых тестов — 250;
Назначение — для ручной постановки анализа и анализаторов открытого типа
Метод: с осаждением ХМ, ЛПОНП и ЛПНП.
Срок годности набора: 12 месяцев при +(2-8)ºС.
Количество выполняемых тестов — 250;
Назначение — для ручной постановки анализа и анализаторов открытого типа
Метод: с осаждением ХМ, ЛПОНП и ЛПНП.
Срок годности набора: 12 месяцев при +(2-8)ºС.
Позиция №41 Трипановый синий Трипановый синий, не менее 60% Упаковка, 25 г CAS-No. 72-57-1 Индекс цвета 23850 Химическая формулаC34h34N6O14S4Na4 Молярный вес 960,81 г/моль Содержание основного вещества, не менее 60 % Растворимость, 0,1% (в 50% этаноле) испытание Максимум светопоглощения (в 50% этаноле) 600-610 нм Потери при сушке (110 °С, 1 час), не более 10 % Условия хранения комнатная температура
Позиция №42
Тиобарбитуровая кислота
(2-тиоксодигидропиримидин-4,6(1H,5H)-дион)
Квалификация: ЧДА (чистый для анализа). Формула: C4h5N2O2S.
Молярная масса: 144.15 г/моль
Состояние: твёрдое.
Упаковка -100г
Формула: C4h5N2O2S.
Молярная масса: 144.15 г/моль
Состояние: твёрдое.
Упаковка -100г
Позиция №43 Общий холестерин ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения общего холестерина (total cholesterol) в клиническом образце методом ферментного спектрофотометрического анализа Набор реактивов для определения общего холестерина ферментативным методом. Количество выполняемых тестов -100; Назначение — Для ручной постановки
Позиция №44 Набор реагентов для иммуноферментного определения концентрации опухолевого маркера HE4 в клиническом образце Набор реагентов для иммуноферментного определения концентрации опухолевого маркера HE4 в клиническом образце Чувствительность: 1,5 пмоль/л Диапазон измерений: 0-1000 пмоль/л
Позиция №45 G7879-500MG D-глюкозо-6-фосфат натриевая соль D-Glucose 6-phosphate sodium salt формула: С 6 Н 12 NaO 9 Р Молекулярный вес: 282,12 Номер CAS: 54010-71-8 Упаковка- 500 мг
Позиция №46
Общий белок ИВД, набор, спектрофотометрический анализ
Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения общего белка (total protein) в клиническом образце методом спектрофотометрического анализа
Набор реагентов предназначен для определения содержания общего белка в клиническом образце биуретовым методом. Количество выполняемых тестов — ≥ 500
Назначение — для анализаторов открытого типа и ручной постановки
Состав набора
Реагент 1: 200 мл
Калибратор: 2 мл
Конечный объем реагента: 1000 мл
Количество выполняемых тестов — ≥ 500
Назначение — для анализаторов открытого типа и ручной постановки
Состав набора
Реагент 1: 200 мл
Калибратор: 2 мл
Конечный объем реагента: 1000 мл
Позиция №47 Холестерин липопротеинов высокой плотности ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенных для количественного измерения холестерина липопротеинов высокой плотности (ЛПВП) в клиническом образце методом ферментной спектрометрии. Набор предназначен для количественного определения концентрации холестерина липопротеинов высокой плотности в клиническом образце. Количество выполняемых тестов — ≥ 100 Назначение — для ручной постановки анализа и анализаторов открытого типа Состав: Реагент 1: 100 мл Калибратор: 5 мл
Позиция №48 Метиленовый синий раствор ИВД Раствор метиленового синего (methylene blue (MB)), предназначенный для использования отдельно или в сочетании с другими растворами/красителями, для обнаружения тканевых структур и/или внутри-/внеклеточных элементов в биологическом/клиническом образце. Метиленовый синий, чда Объем реагента – 100 г Метод окрашивания — Нейссера
Позиция №49 Общий холестерин ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения общего холестерина (total cholesterol) в клиническом образце методом ферментного спектрофотометрического анализа Набор предназначен для количественного определения энзиматическим колориметрическим методом концентрации общего холестерина в клиническом образце. Количество выполняемых тестов — ≥ 100 Назначение — для ручной постановки Состав: Реагент 1: 100 мл Калибратор: 2 мл
Позиция №50 L-Глутамин, стерильный Синонимы: L-глутаминовой кислоты гамма-амид; l-глутаминовой кислоты гамма-амид, (S)-2,5-Diamino-5-oxopentanoic acid, L-Glutamic acid 5-amide, Levoglutamide Формула: h3NCOCh3Ch3CH(Nh3) CO2H (или C5h20N2O3) Молекулярная масса: 146.14 г/моль Характеристики: сухой белый порошок, стерильный, для добавления питательным средам Игла МЕМ, RPMI-1640, F-10 и F-12. Разводится стерильной питательной средой из расчета 1 флакон на 450 мл среды. Квалификация: для культур клеток. Содержание основного вещества: более 99% Плотность: 1.321 г/см3 Точка кипения: 445.6°C при 760 мм рт. ст. Точка плавления: 185°C Температура хранения: 20°C Показатель преломления: 6.8 ° (C=4, h3O) Растворимость: h3O: 25 мг/мл.
Позиция №51 h3500 Гемоглобин из бычьей крови Форма — лиофилизированный порошок молекулярная масса М г ~ 4500 Температура хранения 2-8 ° С Номер CAS 9008-02-0 Упаковка -1г
Позиция №52 Глюкозо-6-фосфат натриевая соль Формула С6Н12NaO9P, Mr=282,12 Фасовка: 1 г Концентрация: сухой Чистота: чда CAS 56-73-5
Позиция №53 Этиленгликоль тетрауксусной кислоты (ЭГТА) для молекулярной биологии Синонимы: этиленгликоль тетрауксусной кислоты, этиленгликоль-ди-(2-аминоэтил )-тетрауксусная кислота; Ethylene Glycol-bis-(β-Aminoethyl Ether)-N,N,N’,N’-Tetraacetic Acid, Ethylenedioxy-bis-(Ethylenenitrilo)-Tetraacetic Acid Формула: C14h34N2O10 Характеристика: для молекулярной биологии, не менее 99%, отсутствие ДНКаз/РНКаз/протеаз Внешний вид: Белый порошок Молекулярный вес: 380,35 г/моль CAS No: 67-42-5 Фасовка 25 г
Позиция №54 Ингибитор трипсина из плодов сои Характеристики: стерильный, лиофилизированный порошок, содержит ингибитора на 10 мл 10-кратного р-ра во флаконе. Получен высаливанием из экстракта. Используется для нейтрализации активности трипсина, особенно при работе с бессывороточными средами. Квалификация: для культуры клеток. Хранится — от -10 до -20°С. Упаковка: 1 г CAS No: 9035-81-
Позиция №55 Моногидрат лимонной кислоты Упаковка – 1,0 кг 99,5-100,5% (RFE, USP, BP, Ph. Eur., JP)
Позиция №56 Изопреп, раствор для гистологической проводки (10 л/уп)
Позиция №57 Мочевина/азот мочевины ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения мочевины/азота мочевины в крови (blood urea nitrogen (BUN)) и/или в других биологических жидкостях в клиническом образце методом ферментного спектрофотометрического анализа. Набор предназначен для количественного определения содержания мочевины в клиническом образце уреазным фенол-гипохлоритным методом. Количество выполняемых тестов — ≥ 100 Назначение — для ручной постановки анализа и анализаторов открытого типа Состав набора Реагент 1: 10 мл Реагент 2: 100 мл Реагент 3: 100 мл Калибратор: 2 мл
Позиция №58 Общая щелочная фосфатаза (ЩФ) ИВД, набор, ферментный спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определенияобщей щелочной фосфатазы (ЩФ) (alkaline phosphatase (ALP)) в клиническом образце методом ферментного спектрофотометрического анализа Набор предназначен для количественного определения активности щелочной фосфатазы в клиническом образце методом по конечной точке. Количество выполняемых тестов — ≥ 500 Назначение — для анализаторов открытого типа и ручной постановки Состав набора: Реагент №1 – 80мл Реагент №2 – 100мл Реагент №3 – 20мл Калибровочный раствор – 15мл
Позиция №59 Креатинин ИВД, набор, спектрофотометрический анализ Набор реагентов и других связанных с ними материалов, предназначенный для количественного определения креатинина (creatinine) в клиническом образце методом спектрофотометрического анализа Набор реагентов предназначен для количественного определения содержания креатинина в клиническом образце методом на основе реакции Яффе с депротеинизацией. Количество выполняемых тестов — ≥ 200; Назначение — для анализаторов открытого типа и ручной постановки Состав: Реагент 1: 100 мл Реагент 2: 100 мл Реагент 3: 100 мл Калибратор: 10 мл
Позиция №60 Набор реагентов для определения концентрации общего и прямого билирубина Набор предназначен для количественного определения концентрации общего и прямого билирубина в клиническом образце колориметрическим методом. Состав: Реагент 1: 100 мл Реагент 2: 25 мл Реагент 3: 1 мл Реагент 4: 100 мл Калибратор: 1 шт
Позиция №61 Интерлейкин 10 ИВД, набор, иммуноферментный анализ (ИФА) Набор реагентов и других связанных с ними материалов, предназначенный для качественного и/или количественного определения интерлейкина 10 (ИЛ-10) (interleukin-10 (IL-10)) в клиническом образце методом иммуноферментного анализа (ИФА). № РЗН 2017/6011 Набор реагентов для иммуноферментного определения концентрации интерлейкина-10 в клиническом образце
Позиция №62 Раствор трипсина-ЭДТА 0,05% с солями Хенкса Формула: трипсин (HOOCCh3)2N(Ch3)2N(Ch3COOH)2 Фасовка: 0,5 л CAS 9002-07-7
|
УДК 615:632.95 МЕТОД ОПРЕДЕЛЕНИЯ ДИНИТРООРТОКРЕЗОЛА В ОРГАНАХ И ТКАНЯХ В.Д. Лукьянчук, д. м. н., проф., Д.С. Кравец Луганский государственный медицинский университет Высокий уровень применения пестицидных препаратов является одной из необходимых мер повышения эффективности сельскохозяйственного производства. Однако общеизвестны и негативные стороны влияния химических средств защиты растений на организм лиц, контактирующих с ними как в условиях промышленного производства, так и использования в аграрном секторе. Поступая в организм теплокровных, в том числе и человека, пестициды обладают материальной и/или функциональной кумуляцией, оказывая неблагоприятное в токсикологическом отношении влияние на различные органы и системы организма. Для разработки высокоэффективных средств лечения и профилактики острых и хронических отравлений ксенобиотиками различного химического строения важное значение имеют токсикокинетические исследования, направленные прежде всего на оценку содержания токсических веществ в различных биосредах организма. Это в полной мере относится и к динитрофенольным пестицидам, среди которых особую опасность в плане развития острых смертельных отравлений представляет динитроортокрезол (ДНОК). В литературе [1] описан метод количественного определения ДНОК только в крови. Однако для более полного суждения о судьбе ксенобиотика в организме необходимо располагать сведениями о характере распределения яда в различных органах и тканях. В связи с этим, целью настоящей работы была разработка высокочувствительного метода количественной индикации ДНОК в различных органах и тканях. Существующий метод идентификации ДНОК в крови [1] основан на его экстракции из плазмы крови метилэтилкетоном с последующим определением концентрации фотоэлектрокалориметрическим методом, однако он не пригоден для индикации соединения в органах и тканях. Это, с нашей точки зрения, может быть объяснено связыванием ДНОК (как биполярного соединения) с высокомолекулярными биомолекулами и прежде всего с тканевыми белками, что является главным препятствием для проведения необходимой экстракции вещества метилэтилкетоном. С целью расщепления высокомолекулярных белков и липопротеидов, составляющих основу клеточных и субклеточных мембран органов и тканей, нами был использован фармакопейный препарат из группы протеолитических ферментов – химопсин (производства п/о «Ленмясокомбинат»), который содержит комбинацию альфа-химотрипсина и трипсина. Трипсин, как известно, весьма активно гидролизует как низко-, так и высокомолекулярные белки. Он особенно легко расщепляет связи, в образовании которых участвуют карбоксильные группы аргинина и лизина. Если трипсин расщепляет только 1/3 всех пептидных связей в белковой молекуле, то химотрипсин гидролизует также и пептоны с образованием относительно низкомолекулярных пептидов, при этом химотрипсин расщепляет преимущественно те пептидные связи, на которые трипсин не действует. Химотрипсин ускоряет гидролиз связей, образованных остатками триптофана, тирозина и фенилаланина, он обладает более широкой (по сравнению с трипсином) субстратной специфичностью, катализируя гидролиз не только пептидов, но и эфиров, гидроксаматов, амидов и других ацилпроизводных [2, 3]. Предлагаемый нами метод основан на экстракции ДНОК метилэтилкетоном из органов и тканей, предварительно обработанных протеолитическим ферментом. Ход количественного определения ДНОК в органах и тканях: C =C1•1 мл / 0,5 г , где С1 — концентрация ДНОК в мг/мл; 1 мл — количество метилэтилкетона, применяемого для экстракции ДНОК в одной пробе; 0,5 г — масса исследуемого биоматериала. Чувствительность разработанного метода составляет 3,85•10-3 мг/г. Экспериментальная апробация разработанного нами метода проведена в лаборатории кафедры фармакологии ЛГМУ на модели острой интоксикации, развивающейся у белых нелинейных крыс обоего пола массой 170–220 г при однократном пероральном введении 1 % раствора аммонийной соли ДНОК в дозе 40 мг/кг (LD50). Контролем служила группа интактных животных, которым вводили аналогичный объем питьевой воды. Содержание ДНОК определяли через 6 ч после введения яда в следующих органах: почки, сердце, легкие, печень, мышечная ткань. Результаты представлены в таблице. Таким образом разработан высокочувствительный метод определения ДНОК в различных органах и тканях организма. ЛИТЕРАТУРА | Содержание | |
Долоцим® Форте Голд 90 капсул
ОПИСАНИЕ
«Долоцим® Форте Голд» — это премиум-продукт Biogena с протеолитическими ферментами и натуральными биофлавоноидами, который подходит для специализированной поддержки организма.
В его состав входят растительные ферменты бромелаин, папаин, а также трипсин и химотрипсин. Эти вещества обладают способностью расщеплять белки и помогают ускорить процессы восстановления при воспалении, уменьшают отек, снижают риск рецидивов.
Продукт подходит всем, кому необходима дополнительная помощь при хроническом и/или остром воспалительном процессе (ОРВИ, травмы, хронические инфекции, например гинекологические). Его также можно использовать как экспресс-средство при «простуде», чтобы не разболеться (одновременный прием до шести капсул).
Скачать подробную информацию Скачать сертификатИнгредиенты
| суточная доза в 1 капсуле | |
| Бромелаин | 100 мг |
| Папаин | 100 мг |
| Трипсин-химотрипсин | 50 мг |
| Химотрипсин | 1,6 мг |
| Кверцетин | 100 мг |
| Биофлавоноиды цитрусовых | 60 мг |
| Экстракт виноградных косточек | 10 мг |
Состав Гидроксипропилметилцеллюлоза (оболочка капсулы), кверцетин, биофлавоноид содержащий экстракт цитрусовых, бромелаин, папаин, наполнитель: порошок целлюлозы; трипсин-химотрипсин, экстракт виноградных косточек, химотрипсин.
Биологически активная добавка. Не является лекарством. Рекомендуемая суточная доза потребления не должна быть превышена. Не является заменой сбалансированного и разнообразного питания. Представленная информация не является рекомендацией к лечению. Перед приемом проконсультируйтесь со специалистом. Подходит для больных диабетом.
Принцип «чистого вещества»
Для создания нутриентов Biogena использует «чистые вещества» полностью свободные от красителей, консервантов, антиадгезивов, искусственных усилителей вкуса, средств против слеживания, вспомогательных веществ.
Примечание
Ферменты обладают антиагрегантным действием, поэтому не рекомендуется принимать их за один день до хирургического вмешательства.
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ.
Трипсиноген — Trypsinogen — qaz.wiki
Трипсиногена ( ) является формой предшественника (или зимоген ) из трипсина , А пищеварительный фермент . Он вырабатывается поджелудочной железой и содержится в панкреатическом соке вместе с амилазой , липазой и химотрипсиногеном . Он расщепляется до своей активной формы, трипсина , энтеропептидазой , которая содержится в слизистой оболочке кишечника . После активации трипсин может расщеплять больше трипсиногена до трипсина , этот процесс называется автоактивацией. Трипсин расщепляет пептидную связь на карбоксильной стороне основных аминокислот, таких как аргинин и лизин .
Функция
Трипсиноген является предшественником профермента трипсина . Трипсиноген (неактивная форма) хранится в поджелудочной железе, поэтому он может высвобождаться при необходимости для переваривания белка . В поджелудочной железе сохраняет неактивную форму трипсиногена , поскольку активный трипсин может вызвать серьезное повреждение ткани поджелудочной железы . Трипсиноген высвобождается поджелудочной железой во вторую часть двенадцатиперстной кишки через проток поджелудочной железы вместе с другими пищеварительными ферментами.
Активация трипсиногена
Трипсиноген активируется энтеропептидазой (также известной как энтерокиназа). Энтеропептидаза продуцируется слизистой оболочкой двенадцатиперстной кишки и расщепляет пептидную связь трипсиногена после остатка 15, который представляет собой лизин . N-концевой пептид отбрасывается, и происходит небольшая перестройка свернутого белка. Вновь образованный N-концевой остаток (остаток 16) вставляется в щель, где его α-аминогруппа образует ионную пару с аспартатом рядом с серином активного сайта и приводит к конформационной перестройке других остатков. Аминогруппа Gly 193 ориентируется в правильном положении, что завершает оксианионную дырку в активном центре, тем самым активируя белок. Поскольку трипсин также расщепляет пептидную связь после аргинина или лизина, он может расщеплять другой трипсиноген, и поэтому процесс активации становится автокаталитическим.
Меры предосторожности от активации трипсиногена
Трипсин вырабатывается, хранится и высвобождается в виде неактивного трипсиногена, чтобы гарантировать активацию белка только в соответствующем месте. Преждевременная активация трипсина может быть деструктивной и может вызвать серию событий, которые приводят к самоперевариванию поджелудочной железы. Считается, что в нормальной поджелудочной железе активируется около 5% трипсиногенов, поэтому существует ряд средств защиты от такой несоответствующей активации. Трипсиноген хранится во внутриклеточных пузырьках поджелудочной железы, называемых гранулами зимогена, мембранные стенки которых считаются устойчивыми к ферментативной деградации. Еще одной защитой от несоответствующей активации трипсина является присутствие ингибиторов, таких как бычий ингибитор трипсина поджелудочной железы (BPTI) и ингибитор сериновой протеазы Kazal-типа 1 ( SPINK1 ), который связывается с любым образующимся трипсином. Трипсиновая автокаталитическая активация трипсиногена также является медленным процессом из-за наличия большого отрицательного заряда на консервативном N-концевом гексапептиде трипсиногена, который отталкивает аспартат на обратной стороне кармана специфичности трипсина. Трипсин может также инактивировать другой трипсин путем расщепления.
Трипсиноген сыворотки
Трипсиноген в сыворотке измеряется с помощью анализа крови . Высокие уровни наблюдаются при остром панкреатите и муковисцидозе .
Изоформы трипсиногена
В соке поджелудочной железы человека можно найти три изоформы трипсиногенов. Это катионный, анионный и мезотрипсиноген, на их долю приходится 23,1%, 16% и 0,5% от общего количества секреторных белков поджелудочной железы соответственно. Другие формы трипсиногена были обнаружены у других организмов.
Болезни
Неправильная активация трипсиногена в поджелудочной железе может привести к панкреатиту . Некоторые типы панкреатита могут быть связаны с мутантными формами трипсиногена. Мутация Arg 117, чувствительного к трипсину сайта, в катионном трипсиногене была связана с наследственным панкреатитом, редкой формой генетического заболевания с ранним началом. Arg 117 может быть безотказным механизмом, с помощью которого трипсин, когда он активирован в поджелудочной железе, может стать инактивированным, и потеря этого сайта расщепления приведет к потере контроля и позволит самопереваривание, что приведет к панкреатиту. Также были обнаружены другие мутации, связанные с панкреатитом.
Рекомендации
внешние ссылки
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Трипсин | 9002-07-7
Химические свойства трипсина, использование, производство
Описание
Трипсин представляет собой сериновую протеазу в пищеварительной системе человека и животных. Основная функция этого фермента — гидролизовать белки до более мелких пептидов или даже аминокислот. Трипсин и другие пищеварительные протеазы, такие как химотрипсин, отвечают за переваривание пищевого белка в тонком кишечнике.Эта протеолитическая функция трипсина широко используется в химии белков, протеомике и исследованиях питания. На эту функцию влияют источники фермента и факторы окружающей среды, такие как pH, температура и присутствие ингибиторов трипсина в ферментативной реакционной среде.Трипсин используется в пищевой промышленности для улучшения таких функциональных свойств, как растворимость, эмульгирование, пенообразование и гелеобразование пищевых белков, для улучшения усвояемости белков овощей и семян.Он используется для снижения концентрации аллергенов в некоторых продуктах питания и для производства белковых гидролизатов и биоактивных пептидов, которые используются в детских смесях, а также для людей с особыми проблемами со здоровьем, такими как гипертония. В исследованиях в области пищевых продуктов трипсин используется для секвенирования пищевых белков и определения усвояемости пищевых белков in vitro. В сочетании с бромелайном и рутином трипсин используется при остеоартрите. Трипсин используется для удаления некротических тканей и мусора во время очистки ран и язв.Добавки трипсина могут использоваться для удаления мертвых клеток ткани, которые остаются после травмы, инфекции или хирургических процедур, позволяя расти новым клеткам кожи или тканей.
Список литературы
[1] http://www.cytospring.com/pages/TrypsinEDTA.pdf[2] Цзянмей Ю, Мохамед Ахмедна (2012) Функции / применения трипсина в пищевой промышленности и научных исследованиях, 75-95
[3] http://www.webmd.com/vitamins-supplements/ingredientmono-879-trypsin.aspx?activeingredientid=879&activeingredientname=trypsin
Химические свойства
Белый или почти белый кристаллический или аморфный порошок, гигроскопичный, если аморфный.использует
Протеолитический фермент.Определение
трипсин: фермент, переваривающий белки (см. протеазу). В неактивной форме (трипсиноген) он секретируется поджелудочной железой в двенадцатиперстную кишку. Там на трипсиноген воздействует фермент (энтерокиназа), вырабатываемый в двенадцатиперстной кишке, с образованием трипсина. Активный фермент играет важную роль в переваривании белков в передней части тонкой кишки, а также активирует другие протеазы в соке поджелудочной железы.фирменное наименование
Парензим; Трипсиллин.Продукты и сырье для получения трипсина
Сырье
Препараты
Раствор трипсинового фермента — стандартные и специальные рецептуры продукта
LnRiLWNvbnRhaW5lcltkYXRhLXRvb2xzZXQtYmxvY2tzLWNvbnRhaW5lcj0iYjVhNjdlNmM1NTEwMjNhZDE2NDQwNWE1Y2QzOTk2ZTIiXSB7IHBhZGRpbmc6IDI1cHg7ZGlzcGxheTptcy1mbGV4Ym94O2Rpc3BsYXk6ZmxleDstbXMtZmxleC1kaXJlY3Rpb246Y29sdW1uO2ZsZXgtZGlyZWN0aW9uOmNvbHVtbjstbXMtZmxleC1wYWNrOmNlbnRlcjtqdXN0aWZ5LWNvbnRlbnQ6Y2VudGVyOyB9IC50Yi1jb250YWluZXJbZGF0YS10b29sc2V0LWJsb2Nrcy1jb250YWluZXI9ImMyZDYwNzc5MGFhNjY4YmVkMjA4MDczYjVmMTllMmMzIl0geyBwYWRkaW5nOiAyNXB4O2Rpc3BsYXk6bXMtZmxleGJveDtkaXNwbGF5OmZsZXg7LW1zLWZsZXgtZGlyZWN0aW9uOmNvbHVtbjtmbGV4LWRpcmVjdGlvbjpjb2x1bW47LW1zLWZsZXgtcGFjazpjZW50ZXI7anVzdGlmeS1jb250ZW50OmNlbnRlcjsgfSAudGItY29udGFpbmVyW2RhdGEtdG9vbHNldC1ibG9ja3MtY29udGFpbmVyPSJjMmQ2MDc3OTBhYTY2OGJlZDIwODA3M2I1ZjE5ZTJjMyJdID4gLnRiLWNvbnRhaW5lci1pbm5lciB7IG1heC13aWR0aDogLTRweDsgfSA =
LnRiLWNvbnRhaW5lcltkYXRhLXRvb2xzZXQtYmxvY2tzLWNvbnRhaW5lcj0iYjVhNjdlNmM1NTEwMjNhZDE2NDQwNWE1Y2QzOTk2ZTIiXSB7IHBhZGRpbmc6IDI1cHg7ZGlzcGxheTptcy1mbGV4Ym94O2Rpc3BsYXk6ZmxleDstbXMtZmxleC1kaXJlY3Rpb246Y29sdW1uO2ZsZXgtZGlyZWN0 aW9uOmNvbHVtbjstbXMtZmxleC1wYWNrOmNlbnRlcjtqdXN0aWZ5LWNvbnRlbnQ6Y2VudGVyOyB9IC50Yi1jb250YWluZXJbZGF0YS10b29sc2V0LWJsb2Nrcy1jb250YWluZXI9ImMyZDYwNzc5MGFhNjY4YmVkMjA4MDczYjVmMTllMmMzIl0geyBwYWRkaW5nOiAyNXB4O2Rpc3BsYXk6bXMtZmxleGJveDtkaXNwbGF5OmZsZXg7LW1zLWZsZXgtZGlyZWN0aW9uOmNvbHVtbjtmbGV4LWRpcmVjdGlvbjpjb2x1bW47LW1zLWZsZXgtcGFjazpjZW50ZXI7anVzdGlmeS1jb250ZW50OmNlbnRlcjsgfSAudGItY29udGFpbmVyW2RhdGEtdG9vbHNldC1ibG9ja3MtY29udGFpbmVyPSJjMmQ2MDc3OTBhYTY2OGJlZDIwODA3M2I1ZjE5ZTJjMyJdID4gLnRiLWNvbnRhaW5lci1pbm5lciB7IG1heC13aWR0aDogLTRweDsgfSA =
Качественные и согласованные составы трипсина от надежного производителя биологических препаратов
Трипсин, часто используемый в протеомных исследованиях, представляет собой фермент, расщепляющий белки для отделения или отделения клеток от культурального сосуда.Этот процесс важен, когда клеткам необходимо перемещаться из сосуда в сосуд, и когда он завершится, клетки станут подвешенными и будут выглядеть округлыми. Biologos производит качественный трипсин, разработанный для стабильной работы во всех областях применения.
Команда Biologos работает напрямую с вами, чтобы разработать индивидуальный продукт, отвечающий требованиям вашего конкретного приложения. Благодаря таким опциям, как индивидуальная упаковка, надежные складские запасы и индивидуальные логистические планы, Biologos является идеальным партнером для каждого клиента.
Запросить цену / Дополнительная информация
Наши клиенты на первом месте!
Мы обеспечиваем быструю обработку предложений и запросов на настройку формул, чтобы обеспечить эффективное и точное удовлетворение ваших потребностей. Мы тесно сотрудничаем с вами для создания индивидуальных формул, размеров упаковки и систем доставки, которые соответствуют вашим конкретным требованиям и временным рамкам.
О компании Biologos
Biologos — это производитель стандартных и нестандартных сывороток, сред для культивирования клеток, реагентов и ферментных растворов с полным спектром услуг, специализирующийся на разработке и распространении продуктов с быстрой перестройкой.
Производство и опыт «под ключ» : Более 40 лет опыта в предоставлении высококачественных сред для культивирования сывороточных клеток, реагентов и индивидуальных рецептур.
Специалисты по индивидуальным рецептурам : Биологические растворы, адаптированные к вашим спецификациям, разработанные экспертами Biologos и доставленные в указанный вами срок.
Команда по работе с клиентами : Персонализированная и оперативная внутренняя команда по обслуживанию клиентов, которая поможет вам с настройкой, выполнением ваших запросов и соблюдением сроков.
Прямой доступ к производителю : Biologos является вашим производителем, складом и дистрибьютором, устраняя ненужные расходы и поддерживая эффективность.
Запросить цену
Позвоните по телефону 800-246-4088 или заполните эту форму[activedemand_form id = ’69844 ′]
Что такое трипсин?
Трипсин — это протеолитический фермент, вырабатываемый поджелудочной железой для расщепления белков на аминокислоты для пищеварения и других биологических процессов.PH и температура трипсина влияют на его способность функционировать, pH определяется температурой раствора и состава. Трипсин в неактивном состоянии имеет pH 3, а в активном состоянии — pH 8.
Каковы распространенные варианты рецептур трипсинового фермента (добавки и концентрации)?
Biologos предлагает продукты на основе фермента трипсина в различных рецептурах и концентрациях (см. Ниже), контейнерах настраиваемого размера (100 мл, 500 мл, 1 литр, 20 литров и т. Д.) И контейнерах различных типов (стерильные флаконы, стерильные пакеты и т. Д.)). В зависимости от области применения и типов клеток трипсин производится с различными компонентами и в различных концентрациях. Наиболее распространенные варианты:
- ЭДТА (динатрий этилендиаминтетрауксусная кислота) — Чтобы ослабить взаимодействия, ЭДТА часто добавляют в трипсин, который хелатирует двухвалентные катионы (Ca2 +, Mg 2+).
- Феноловый красный — Оптимальная активность трипсина достигается в диапазоне pH от 7 до 9. Включение фенолового красного в пределах указанного диапазона pH придает раствору розовый цвет.
- Разбавитель — Концентрированный трипсин солюбилизируется или разбавляется в забуференном солевом растворе, не содержащем Ca2 + или Mg2 +, например в сбалансированном солевом растворе Хэнка, который поддерживает pH и осмотический баланс. Некоторые продукты на основе трипсина содержат 0,9% NaCL в качестве разбавителя вместо сбалансированного солевого раствора Хэнка.
- Концентрация — в зависимости от типа клеток и области применения трипсин используется в различных концентрациях. Для линий прочно прикрепленных клеток используется трипсин в концентрации от 2,5% до 0,25% (в 10–1 раз больше). Для исследований, требующих целостности белков клеточной поверхности, более низкая концентрация (0.05% трипсина).
Почему трипсин используется в культуре клеток?
Трипсин может быть использован в исследованиях в области фармацевтики для здоровья человека и животных для преобразования белков в пептиды.
Каковы применения трипсина?
Трипсин имеет множество эффективных применений и часто используется в фармацевтике животных и человека для микробиологических сред и сбора клеток. Трипсин обычно используется для разработки протоколов культивирования клеток и тканей и идентификации белков, но может быть приготовлен с ингибиторами или активаторами для использования в других приложениях, например:
- Сбор клеток
- Диссоциация тканей
- Процедуры гемагглютинации
- Снижение плотности клеток в культуре клеток
- Субкультивирование клеток
Как приготовить трипсин?
Трипсин производится в асептических условиях и испытан на соответствие 9 CFR 113.26 Бесплодие. Сырой порошок трипсина проверяется на вирусы свиней и микоплазмы в соответствии с 9 CFR 113.53c.
Как хранить и транспортировать трипсин?
Трипсиновые продукты поставляются в стерильных бутылях из полиэтилентерефталата или полиэтилентерефталата, облученных гамма-излучением, а также в индивидуальных стерильных пакетах из полиэтилена низкой плотности. Biologos рекомендует хранить продукты на основе трипсина в замороженном виде при температуре от -50 ° C до -100 ° C.
Продукты трипсина отправляются замороженными воздухом на следующий день в грузовиках для доставки LTL с контролируемой температурой.
Как обращаться с трипсином? Это безопасно?
Нет известных опасностей, связанных с продуктами из трипсина, но всегда лучше использовать меры промышленной гигиены при контакте с любым биологическим продуктом и обращаться с продуктом в асептических условиях.
Трипсин — протеопедия, жизнь в 3D
Функция
Трипсин — глобулярный белок среднего размера, который функционирует как сериновая протеаза поджелудочной железы. Этот фермент гидролизует связи путем расщепления пептидов на С-конце аминокислотных остатков лизина и аргинина.Также было показано, что расщепление не произойдет, если есть остаток пролина на карбоксильной стороне сайта расщепления. Трипсин был впервые открыт в 1876 году Куном, который исследовал протеолитическую активность фермента. В 1931 году фермент был очищен кристаллизацией Норотропом и Куницем, а позже, в 1974 году, была определена трехмерная структура трипсина. На протяжении 1990-х годов была обнаружена роль трипсина в наследственном панкреатите и вызывающая его мутация. Сегодня трипсин используется при разработке протоколов для клеток и тканей, а также в области медицины для определения роли трипсина в заболеваниях поджелудочной железы [1] .
Трипсиноген- Катионный трипсин или трипсин-1 экспрессируется в поджелудочной железе. Он расщепляет связи лизина и аргинина. См. Катионный трипсин.
- Анионный трипсин или трипсин-2 экспрессируется в поджелудочной железе. Он расщепляет связи лизина и аргинина.
- Мезотрипсин или трипсин-3 экспрессируется в головном мозге и поджелудочной железе и устойчив к обычным ингибиторам трипсина. Он расщепляет связи лизина и аргинина.
- Трипсиноген — это форма-предшественник или зимоген трипсина. Зимогены — это предшественники ферментов, которые производятся и секретируются лизосомами клетки. Зимогены не активны до тех пор, пока они не пройдут химический процесс, такой как гидролиз, расщепление или другие расщепления, открывающие активный центр. Предшественник зимогена необходим для предотвращения разрушения клеточных белков и для того, чтобы фермент находился в активном состоянии только в соответствующих условиях.Трипсиноген вырабатывается экзокринными клетками поджелудочной железы. Поджелудочная железа секретирует три изоформы трипсиногена. Предшественник активируется только тогда, когда достигает просвета тонкой кишки. Эта активация происходит с помощью энтеропептидазы, и после активации трипсин стимулирует образование большего количества трипсиногена [2] . Структура бычьего трипсиногена показана на рисунке справа [3] .
Трипсин имеет множество применений, поскольку он легко очищается в больших количествах.Фермент трипсин часто используется в исследовательских целях для переваривания белков и последующей идентификации полученных пептидов с помощью масс-спектрометрии. Трипсин находит множество применений в медицине, например, для растворения тромбов и лечения воспалений. Другие применения включают его использование для предварительного переваривания детского питания, снятия отпечатков пальцев и определения последовательности, а также для мониторинга окружающей среды [4] . Для получения дополнительных сведений см.
Сериновые протеазы
Протеаза
Lotem haleva / тестовая страница
Трипсин (иврит).
Связывание лигандов и катализ
Структура этого конкретного бычьего трипсина была определена в комплексе с формулой C 20 H 29 N 5 O 2, а также двумя (выделено) и ионом кальция (зеленым). . Связывание лиганда UB-THR 10 включает прямое. На рисунке ниже эта привязка показана в двух измерениях.
Связывание трипсина с UB-THR 10 в некоторой степени имитирует связывание с его специфическими пептидными субстратами.Предпочтение лизина или аргинина в катализе трипсином обусловлено составом трипсина. Здесь (зеленый) Asp 189 и одна из двух важных цепей глицина, Gly 216, взаимодействуют с лигандом так же, как с Arg или Lys.
Двумерное представление трипсин-связывающего лиганда UB-THR 10The; Asp 102, His 57 и Ser 195, показанные здесь желтым цветом, расположены рядом с подложкой. Каталитически активные гистидиновые и сериновые боковые цепи находятся даже рядом с амидной связью в UB-THR 10, точно так же, как амидная связь, разорванная при гидролизе пептидов.Согласно FirstGlance в Jmol, эти группы не связываются с лигандом, за исключением незначительных ван-дер-ваальских взаимодействий с Hist 57. Если бы лиганд UB-Thr 10 был аналогом переходного состояния, некоторые ковалентные связи существовали бы в дополнение к водородным связям. . UB-THR 10 имитирует субстрат, но не гидролизуется ни по одной из двух своих амидных связей, вероятно, из-за локальных циклических групп, нетипичных для пептидных скелетов.
Постановление
Трипсин давно известен как уникальный в том смысле, что он является аллостерически регулируемым мономером [1].При просмотре трехмерной структуры аллостерическое зрение, скорее всего, представляет собой петлю подсайта, которая может связывать кальций. Новое исследование, включающее структурные сравнения трипсиноподобных сериновых протеаз, связанных и несвязанных с кальцием и другими эффекторами, проводится для лучшего понимания механизма этой регуляции [2].
Каталитический механизм
Механизм сериновой протеазы Каталитическая триадаФункция трипсина заключается в расщеплении пептидов на аминокислотные строительные блоки с помощью реакции гидролиза.Этот механизм является общим каталитическим механизмом, который используют все сериновые протеазы. Активный центр, в котором этот механизм происходит в трипсине, состоит из трех аминокислот и называется каталитической триадой. Три каталитических остатка — это серин 195, гистидин 57 и аспартат 102 [5] . Структура каталитической триады и механизма показаны на рисунках справа. В механизме серин связан с имидазольным кольцом гистидина. Когда гистидин принимает протон от серина, образуется алкоксидный нуклеофил.Этот нуклеофил атакует субстрат, когда субстрат присутствует. Роль остатка аспартата заключается в том, чтобы удерживать гистидин в нужном положении, чтобы сделать его хорошим акцептором протонов. Что заставляет этот механизм работать, так это то, что карман, если он образован из трех остатков, и три остатка функционируют, чтобы удерживать друг друга в правильном положении для нуклеофильной атаки. Этапы механизма включают два тетраэдрических промежуточных продукта и промежуточный продукт ацил-фермента [6] . Механизм можно увидеть более подробно на рисунке справа [7] .
Оксианионное отверстие
Важным мотивом, который образуется в этой реакции, является оксианионная дырка. Это также показано на рисунке справа [8] . Эта оксианионная дырка конкретно образуется между амидными атомами водорода серина 195 и глицина 193. Эта оксианионная дырка стабилизирует тетраэдрический промежуточный продукт посредством распределения отрицательного заряда по отщепленному амиду [9] .
Комплекс трипсин-BPTI
Основа трипсина показана розовым цветом, а ингибитор трипсина BPTI — желтым (код PDB 2ptc).Остатки [Ser195-His57-Asp102-Ser214] показаны зеленым, дисульфидная связь между остатками 14-38 показана желтым, а боковая цепь Lys 15 в сайте специфичности — розовым. Также Энн Тейлор 115.
Сравнение с химотрипсином и эластазой
Трипсин, химотрипсин и эластаза — все это пищеварительные ферменты, которые вырабатываются в поджелудочной железе и катализируют гидролиз пептидных связей. Каждый из этих ферментов имеет различную специфичность в отношении боковых цепей рядом с пептидной связью.Химотрипсин предпочитает большой гидрофобный остаток, трипсин специфичен для положительно заряженного остатка, а эластаза предпочитает небольшой нейтральный остаток. Химотрипсин, трипсин и эластаза — все это белки, которые содержат каталитический механизм и гидролизуют пептиды с использованием механизма сериновой протеазы. Химотрипсин и эластаза являются гомологами трипсина, поскольку они на 40% похожи по структуре и составу [10] . В показанной структуре альфа-спирали синего цвета, бета-листы зеленого цвета, а остаток белка — красного цвета.В показанной структуре альфа-спирали показаны красным, бета-листы — желтыми, а остаток белка — оранжевым.
Замечательная эффективность ингибитора протеиназы Pin-II без двух консервативных дисульфидных связей обусловлена повышенной гибкостью и плотностью водородных связей в реакционной петле. в царстве растений и были тщательно изучены как защитные молекулы растений, которые ингибируют гидролитические ферменты ( e.грамм. , окрашены в темно-пурпурный цвет ) кишечника насекомого [12] . Среди различных семейств PI семейство сериновых PI Pin-II / Pot-II демонстрирует замечательное структурное и функциональное разнообразие на уровне гена и белка [13] . Повышающая регуляция этих ИП, индуцированная ранами, травоядными животными и стрессом, четко связывает их с защитой растений [12] . Предыдущие исследования с использованием трансгенных систем или анализов in vivo положительно коррелировали с преимуществом экспрессии Pin-II PI в растениях против нападения насекомых [14] [15] .Белки-предшественники PI Pin-II состоят из 1-8-соединенных протеолитически чувствительными линкерами, которые высвобождают единицы IRD при расщеплении. (окрашены в зеленый цвет) с молекулярной массой ~ 6 кДа. Последовательность аа IRD показывает вариации, в то же время (окрашенный в желтый цвет) [16] [17] [18] [19] . Одной из структурных особенностей Pin-II IRD является неупорядоченная петля с трехцепочечным β-листовым каркасом. Неупорядоченная реакционная петля, открытая для растворителя, закреплена четырьмя консервативными дисульфидными связями (C4-C41, C7-C25, C8-C37 и C14-C50) [20] [21] .Было обнаружено, что среди четырех дисульфидных связей C8-C37 очень важен для поддержания активной конформации, тогда как C4-C41 играет важную роль в поддержании гибкости реактивной петли [22] . Таким образом, ожидается, что любая селективная потеря дисульфидной связи будет иметь эволюционное значение, ведущее к функциональной дифференциации ингибиторов [23] .
[A] Функциональность: Для оценки влияния вариаций аа на активность и структурную стабильность различные биохимические исследования и моделирование методом МД в течение 20 нс были выполнены на IRD-структурах.Кинетические исследования ингибирования показали сигмоидальный характер с увеличением концентраций ингибиторов, предполагая обратимое и конкурентное ингибирование с прочным связыванием. IRD-9 оказался более сильным ингибитором бычьего трипсина (IC50 ~ 0,0022 мМ), чем IRD-7 (IC50 ~ 0,135 мМ) и IRD-12 (IC50 ~ 0,065 мМ).
[B]: В соответствии со структурой типичного IRD, принадлежащего к семейству Pin-II PI, предсказанные структуры CanPI также имеют. Считалось, что дисульфидные связи действуют как структурный каркас, удерживая реактивный сайт в относительно жесткой конформации и обеспечивая термическую и протеолитическую стабильность.Одиночная спираль 3 10 с одним витком также присутствует в структуре, неупорядоченная петля удерживается дисульфидной связью в IRD-7 и -12, тогда как сеть внутримолекулярных водородных связей в IRD-9. (окрашенный в лососевый цвет) и (в Deepink) имеют 4 дисульфидные связи, тогда как (в пурпурном цвете) имеет только 2 дисульфидные связи. Кроме того, анализ внутримолекулярных водородных связей после моделирования показал, что IRD-9 с двумя дисульфидными связями (C7-C25 и C8-C37) меньше, имеет относительно более высокую плотность внутримолекулярных водородных связей по сравнению с IRD-7 и — 12.Эти внутримолекулярные водородные связи могут замещать две потерянные дисульфидные связи IRD-9 для стабилизации структуры белка в активной конформации и могут защищать молекулы от гидрофобного коллапса. Замещенные остатки серина вместо двух цистеинов C7 и C8 в IRD-9 могут способствовать увеличению количества водородных связей.
[C] Молекулярные модели IRD-связанного HaTry предсказали несколько атомных взаимодействий с реактивной петлей ингибиторов, что также объяснило вклад реактивной петли, открытой для растворителя.В. ARG-39 из реактивного центра образовывал две водородные связи с остатками активного центра HaTry. В каждой боковой цепи остатка LYS-39 реакционной петли образуется по одной водородной связи с карбоксильным атомом кислорода HIS-50. Моделирование методом МД обеспечивает структурное понимание важности меж / внутримолекулярных водородных связей и их влияния на взаимодействие между протеазой и ИП. Результаты этого анализа были подтверждены предыдущими отчетами. Анализ после моделирования также объяснил экспериментально наблюдаемое увеличение аффинности связывания, следовательно, активность IRD-9 в отношении протеаз.См. Также [24] [25] [26] [27] и Энн Тейлор 115.
3D-структуры трипсина
Трипсиновые 3D-структуры
Продукты питания | Бесплатный полнотекстовый | Сравнение традиционной и микроволновой обработки соевого молока для инактивации ингибиторов трипсина и усвояемости белков in vitro
1. Введение
Соевое молоко — это жидкость с высоким содержанием белка, содержащая значительное количество углеводов, жиров, основных витаминов и минералов, обычно получаемая путем измельчения замоченных соевых бобов в избыток воды, которую затем фильтруют, чтобы отделить молоко от твердых частиц и клетчатки.Это стабильная эмульсия масла в воде, в которой непрерывная фаза образована диспергированным соевым белком. Соевое молоко состоит из 94% воды, 3% белка, 1,5% жира и 1,5% углеводов. Он также содержит 7,36 и 0,33 мг / 100 мл рибофлавина и тиамина, соответственно, состав, подобный коровьему молоку, но с низким содержанием насыщенных жиров и без холестерина [1,2,3]. Профиль питания соевого и коровьего молока (3,25% молочного жира) представлен в таблице 1 [4]. В последние годы потребление соевого молока увеличилось, особенно среди потребителей с непереносимостью лактозы, вегетарианцев, веганов и / или потребителей здорового питания.Он также считается безопасным для детей с галактоземией [5], поскольку галактоза отсутствует в соевом молоке. В развивающихся странах соевое молоко используется как недорогой заменитель коровьего молока во многих пищевых продуктах [6,7]. Это увеличение потребления соевого молока также можно объяснить наличием высококачественного белка и низким содержанием жира [2]. В 1999 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило заявление о пользе для здоровья соевого белка, в котором говорится, что его потребление может снизить риск сердечных заболеваний за счет снижения уровня липопротеинов низкой плотности, что способствует его принятию широким кругом потребителей [8 ].Некоторые исследователи также связывают потребление соевых продуктов со снижением риска ишемической болезни сердца, атеросклероза, диабета 2 типа, колоректального рака, рака груди и рака простаты [9,10,11]. Несмотря на все положительные факторы, пищевая ценность соевое молоко снижается из-за наличия различных антипитательных факторов, таких как ингибиторы трипсина Кунитца (KTI), ингибиторы Боумена-Бирка (BBI) и липоксигеназа (LOX). Соя содержит наибольшее количество ингибиторов протеаз, на долю которых приходится от двух до шести процентов всего соевого белка [12].Эти протеазы (KTI и BBI) ингибируют ферментативную активность трипсина и химотрипсина, основных пищеварительных ферментов, ответственных за восстановление белков до дипептидов и трипептидов. KTI имеет молекулярную массу 20 кДа с двумя дисульфидными мостиками и проявляет специфичность в отношении ингибирования трипсина. BBI имеет молекулярную массу 8 кДа с семью дисульфидными связями и проявляет специфичность в отношении ингибирования химотрипсина и трипсина [13,14]. Rouhana et al. сообщили, что 60% активности ингибирования трипсина соевого молока (ТИА) было связано с KTI [15].Было показано, что высокие уровни активного KTI снижают перевариваемость белка и вызывают канцерогенез поджелудочной железы при употреблении [16]. У животных ингибиторы протеазы были связаны с подавлением роста и гипертрофией поджелудочной железы, что подчеркивает необходимость выявления и разработки эффективных методов уменьшения их присутствия в соевых продуктах [17,18,19]. Ингибиторы трипсина сои термостабильны и требуют длительного времени обработки. Согласно Юаню и др., Значения TIA снизились до 13% от исходных значений TIA сырого соевого молока при обработке традиционной термической обработкой (нагревание при 100 ° C в течение 20 минут) [20].Однако длительное время обработки может повлиять на другие питательные свойства соевых продуктов, поэтому этого следует избегать [20,21]. В то же время 100% инактивация ингибиторов трипсина (TI) вызывает перегрев и повреждает белки, разрушая лизин, триптофан и цистеин в соевом молоке. Таким образом, длительные периоды термической обработки эффективно инактивируют TI, но денатурируют основные белки сои, что приводит к деградации аминокислот, реакции потемнения и другим разрушительным реакциям [20,21].Вкус, цвет и содержание витаминов также зависят от типа используемой термической обработки [21,22]. Следовательно, переработка играет важную роль в сенсорной привлекательности и питательной ценности соевых бобов и соевых продуктов, включая соевое молоко. Для получения хорошего качества соевого молока во время переработки необходимо учитывать различные факторы: выход, питательность, антипитательный профиль, цветовые характеристики, размер частиц, профиль текстуры и органолептические качества [14,23]. Более того, все еще остаются вопросы относительно идеальных условий обработки для производства коммерчески стерильного соевого молока с минимальным разложением питательных веществ.Требуются производственные технологии, которые имеют более короткое время обработки, являются энергоэффективными (экологически безопасными), имеют более низкие производственные затраты и сохраняют качество соевого молока [24]. Автоклавирование, периодическое кипячение и нагнетание пара [25,26], сверхвысокая температура (UHT) [27], сочетание высоких температур и давления [28], омический нагрев [29] и обработка под высоким давлением (HPP) [17] методы обработки, которые были исследованы для инактивации TI в соевом молоке. Технология диэлектрической термообработки промышленного масштаба на частотах 42 МГц (радиочастота) и 2450 МГц (микроволновая печь) оказалась эффективной против TI в соевых бобах, и эти методы также улучшили общее качество белка.Время обработки, необходимое для достижения безопасных уровней инактивации TI, меньше при микроволновой обработке по сравнению с традиционными методами для соевых бобов [30]. Исследования Барака и его команды показали, что уровни TI были снижены до 13% от начального значения в сое во время обжарки в микроволновой печи при 2,45 ГГц в течение двух минут [31]. В исследовании, проведенном Yoshida et al., Для инактивации антипитательных факторов до безопасных пределов вымоченной сои на частоте 2,45 ГГц требуется всего четыре минуты [32]. Для сравнения, обычный процесс периодического кипячения занимает 15 минут при 100 ° C, чтобы инактивировать уровни TI до 20% [15].Насколько нам известно, исследований по инактивации ингибитора трипсина сои в соевом молоке с помощью микроволновой обработки не проводилось, несмотря на положительные стороны использования этого метода диэлектрической обработки. Это можно рассматривать как потенциальную альтернативу существующим традиционным методам обработки в пищевой промышленности для инактивации антипитательных факторов.В этом исследовании сообщается о влиянии микроволновой обработки на снижение TIA по сравнению с традиционной термической обработкой соевого молока.Исследования перевариваемости белка (IVPD) in vitro также проводились для оценки влияния микроволновой обработки на его усвояемость в различных временных и температурных условиях. Оптимизация этих методов обработки была выполнена с помощью анализа поверхности отклика.
2. Материалы и методы.
Соевые бобы (Glycine max) были закуплены в компании Goliath, QC, Канада. Было обнаружено, что исходное содержание влаги составляло 10,1% по влажной основе. Содержание влаги определялось официальным методом AOAC для определения содержания влаги в соевой муке методом горячего воздуха в печи.Соевую муку (5 г) сушили в сушильном шкафу при 130 ° C ± 3 ° C в течение двух часов, после чего вес становился постоянным [33]. Свежее соевое молоко было приготовлено из свежих соевых бобов перед термической и микроволновой обработкой.2.1. Soymilk Preparation
Соевые бобы промывали, очищали и замачивали в дистиллированной воде в соотношении 1:10 (вес: объем) (бобы: вода) в течение 18 часов при комнатной температуре (25 ° C) для полной гидратации. Соевое молоко получали путем влажного измельчения гидратированных соевых бобов вместе с водой в течение трех минут на высокой скорости в блендере из нержавеющей стали (Nutri Bullet, NutriBullet LLC, Пакойма, Калифорния, США).Суспензию фильтровали через двойной слой марли, чтобы отделить твердые частицы от соевого молока. Полученное сырое соевое молоко имело pH 6,5 [8,34].2.2. Растворители и реагенты
Все используемые реагенты и растворители были класса для высокоэффективной жидкостной хроматографии (ВЭЖХ) и были приобретены у Fisher Scientific (Оттава, Онтарио, Канада). Ферменты, используемые для определения перевариваемости белка in vitro (IVPD%) и анализа ингибитора трипсина, были приобретены у Sigma Aldrich (Оквилл, ОН, Канада).
2.3. Обычная термическая обработка
Для традиционной термической обработки 30 мл соевого молока помещали в водяную баню, которая была предварительно настроена и поддерживалась при температурах обработки 70 ° C, 85 ° C и 100 ° C. Образцы обрабатывали на водяной бане в течение 10, 20 и 30 мин. Все эксперименты проводились в трех повторностях. После охлаждения при комнатной температуре образцы собирали, хранили в течение ночи при 40 ° C, а затем лиофилизировали в лабораторной сублимационной сушилке (Gamma 1-16 LSC Freeze сушилка, Martin Christ Gefriertrocknungsanlagen GmbH, Остероде-ам-Харц, Германия) и хранили. в непрозрачных герметичных контейнерах при -20 ° C до проведения дальнейшего анализа.
2.4. Микроволновая обработка
Микроволновая обработка проводилась с использованием системы разложения MiniWAVE (SCP Science, Бэ-Д’Урф, Квебек, Канада), которая работает на частоте 2,45 ГГц при мощности 1000 Вт. Образцы соевого молока нагревали в цилиндрических кварцевых реакторах. Эксперименты проводились при температурах обработки 70 ° C, 85 ° C и 100 ° C в течение 2, 5 и 8 мин. Температура образца контролировалась с помощью инфракрасных (ИК) датчиков, расположенных на боковых стенках, и отображалась в реальном времени на экране контроллера во время прогона.В системе MiniWAVE используется один магнетрон, расположенный ниже дна камеры. После обработки сосуды реактора постепенно охлаждали до комнатной температуры с помощью охлаждающего устройства микроволновой системы. Образцы хранили до дальнейшего анализа таким же образом, как и образцы, обработанные обычным способом.
2,5. Химический анализ
2.5.1. Усвояемость белка in vitro (мультиферментный метод)
Перевариваемость белка in vitro (IVPD) соевого белка оценивали с использованием мультиферментного метода.Суспензию рабочего белка готовили растворением образцов с получением 312,5 мг белка в 50 мл дистиллированной воды, pH которой доводили до 8,0 с помощью 0,1 н. NaOH и 0,1 н. HCl. Готовили мультиферментную смесь, содержащую 1,6 мг / мл трипсина, 3,6 мг / мл химотрипсина и 1,3 мг / мл пептидазы, и ее pH доводили до 8,0. Смесь помещали в ледяную баню и непрерывно перемешивали [35,36,37,38]. К образцам добавляли пять миллилитров раствора мультифермента, которые выдерживали при 37 ° C на водяной бане для разложения при непрерывном перемешивании.PH измеряли через 10 минут после переваривания и рассчитывали IVPD с использованием уравнения (1) [37].IVPD% = 210,46 — (18,10 × pH 10 мин )
(1)
2.5.2. Анализ ингибитора трипсина
В этом исследовании общий анализ ингибитора трипсина оценивался с использованием процедуры, следуемой Hamerstrand et al. [39,40] с некоторыми модификациями. Высушенное сублимацией соевое молоко (0,5 г) экстрагировали 50 мл 0,01 М NaOH в течение трех часов при постоянном перемешивании при комнатной температуре.Затем суспензии давали постоять в течение двух часов при 4 ° C. Супернатант от каждого образца собирали и разбавляли так, чтобы 2 мл экстракта могли обеспечить 40-60% активности ингибитора трипсина. Трипсин (тип 1 × из поджелудочной железы крупного рогатого скота, Sigma Chemical Co.) использовали в качестве стандарта. Разбавленный супернатант соевого молока (1 мл) пипеткой переносили в пробирки в трех экземплярах, содержащих 2 мл раствора трипсина (20 мг в 0,001 М HCl). Контрольный образец (пустой) состоял из разбавленного экстракта образца и дистиллированной воды.Пробирки предварительно нагревали при 37 ° C в течение 10 минут, а затем 5 мл бензил-DL-аргинин-пара-нитроанилида (BAPNA) предварительно нагревали до 37 ° C, добавляли в каждую из пробирок и встряхивали. После инкубации этой смеси при 37 ° C в течение 10 мин реакцию останавливали добавлением 1 мл уксусной кислоты (30%). Образцы центрифугировали при 3000 g в течение 10 мин. Поглощение прозрачного супернатанта измеряли с помощью спектрофотометра при 410 нм [41,42]. ТИА рассчитывается как чистый трипсин на грамм взвешенного образца (мг / г).TIA = (2,632 × D × A I ) / S
(2)
где D — коэффициент разбавления (коэффициент, с помощью которого исходный образец соевого молока был разбавлен для получения ингибирования от 40% до 60% с помощью 1 мл разбавленного экстракта), S — вес образца, а A I — изменение оптической плотности. из-за ингибитора трипсина / мл экстрагированного разбавленного образца.2,6. Статистический дизайн и анализ
В этом исследовании использовалась методология поверхности отклика, включая планирование экспериментов, подгонку математической модели и оптимизацию условий обработки для образцов соевого молока.Центральная составная конструкция (CCD) с одинаковой точностью была применена для двух независимых факторов, а именно температуры (X 1 ) и времени (X 2 ), каждый на трех уровнях (-1, 0 и +1), как показано в таблице 2. План, использованный для планирования экспериментов, состоял в общей сложности из 14 комбинаций с комбинациями шести центральных, четырех факторных и четырех осевых точек, как показано в таблице 3. Ответы: TIA и IVPD были записаны. Программное обеспечение JMP версии 11 (SAS Institute Inc., Кэри, Северная Каролина, США) использовалось для экспериментального дизайна и анализа.Функциональная связь между факторами (X i , X j , X k и т. Д.) И ответами (Y) была неизвестна, поэтому для анализа фактического ответа использовалась регрессионная модель (уравнение (3)). поверхности [43,44,45].Y = β0 + ∑i = 1i = nβiXi + ∑i = 1i = nβiiXi2 + ∑i = 1i = n∑j = 1j = nβijXiXj
(3)
где β 0 — постоянный коэффициент, β i — линейный коэффициент, β ii — квадратичный коэффициент для основных параметров процесса, а β ij — коэффициент взаимодействия второго порядка переменных i и j, соответственно.Статистический план был подготовлен с учетом температуры в ° C и времени в мин. Отдельная ПЗС-матрица была подготовлена как для традиционной термической обработки, так и для метода микроволновой обработки. Значение F и его значимость, отсутствие соответствия (LOF) и коэффициент детерминации (R 2 ) были оценены, а анализ ANOVA прогностической модели с соответствующими значимыми членами был представлен в Таблице 5, Таблице 6, Таблице 8. , Таблица 9. Различия между обработками также были обнаружены с помощью многодиапазонного теста Дункана с использованием уровня вероятности 0.05 [46].Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Новый ингибитор трипсина Куница из чеснока — новый товарищ семьи Серпин
Аннотация
Назначение
Это исследование было направлено на очистку и определение характеристик ингибитора протеазы (ИП) растения Allium sativum (чеснок) с сильными лечебными свойствами, а также на изучение его фитопрепаратов.
Методы
Allium sativum Ингибитор протеазы (ASPI) очищали с использованием фракционирования сульфатом аммония и быстрой жидкостной хроматографии белков на анионообменной колонке Hi-Trap DEAE.Очищенный белок анализировали на его чистоту и молекулярную массу с помощью SDS PAGE. Подтверждение наличия ИП, ингибирующего трипсин, было выполнено с помощью MALDI TOF-TOF и проанализировано с помощью базы данных MASCOT. ASPI был дополнительно исследован на предмет его кинетических свойств и стабильности в экстремальных условиях pH, температуры и химических денатурантов. Вторичную структуру определяли с помощью спектроскопии кругового дихоризма (КД).
Результаты
ASPI ~ 15 кДа ингибировал трипсин и соответствовал «усеченному ингибитору трипсина Куница ( Glycine max)» в базе данных MASCOT.Очищенный ASPI показал удельную активность 30376,1371 ед. / Мг с кратностью чистоты 159,92 и выходом ~ 93%. ASPI был довольно стабильным в диапазоне pH 2–12, показывая снижение активности около pH 4–5, что позволяет предположить, что значение pI белка в виде ASPI агрегируется в этом диапазоне. ASPI показал стабильность в широком диапазоне температур (10–80 ° C), но упал ниже 80 ° C. Кроме того, детергенты, окислители и восстановители продемонстрировали изменение активности ASPI при различных концентрациях. Кинетический анализ выявил сигмоидальную зависимость скорости от концентрации субстрата с Vmax 240.8 (мкМ / мин) и значение Km 0,12 мкМ. ASPI показал неконкурентное ингибирование с Ki 0,08 ± 0,01 нМ). КД в дальнем УФ-диапазоне отображает 2,0% α-спиралей и 51% β-листов при естественном pH.
Выводы
В заключение, очищенный ~ 15 кДа ASPI продемонстрировал удовлетворительную стабильность в широком диапазоне pH и температуры. В целом, наблюдалось увеличение кратности очистки с замечательным выходом. Исследования химической модификации показали присутствие остатков лизина и триптофана в качестве основных аминокислот, присутствующих в реактивных сайтах.Следовательно, ASPI, обладающий свойством ингибирования трипсина, потенциально может использоваться в качестве нецитотоксических клинических агентов.
Образец цитирования: Шамси Т.Н., Парвин Р., Амир М., Баиг М.А., Куреши М.И., Али С. и др. (2016) Allium sativum Ингибитор протеазы: новый ингибитор трипсина Кунитца из чеснока — новый товарищ семейства Серпин. PLoS ONE 11 (11): e0165572. https://doi.org/10.1371/journal.pone.0165572
Редактор: Юджин А.Пермякова РАМН, РОССИЙСКАЯ ФЕДЕРАЦИЯ
Поступила: 17.08.2016; Одобрена: 13 октября 2016 г .; Опубликован: 15 ноября 2016 г.
Авторские права: © 2016 Shamsi et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Протеазы и их ингибиторы считаются преобладающими у всех живых существ, включая микроорганизмы, растения и животных. Эти биологические макромолекулы осуществляют несколько биологических процессов, таких как свертывание крови, процессинг гормонов, каскад комплемента и апоптоз [1].Ингибиторы протеаз (ИП), которые развиваются естественным путем, являются элементарными для модуляции работы соответствующих протеаз в этих путях [2]. Ингибиторы сгруппированы в 48 семейств и классифицированы по четырем механистическим классам, то есть ингибиторы цистеина, серина, металлопротеазы и аспарагиновой кислоты, в основе которых лежит активная аминокислота в их «реакционном центре» [3].
Применение ингибиторов протеазы в качестве терапевтических агентов, в частности, их предназначение для ингибирования клеточной трансформации, нарушений свертывания крови, остеопороза, ретровирусных заболеваний и рака, находится в стадии тщательного изучения.Одним из наиболее значительных биологических применений ИП является их способность использоваться в качестве противораковых агентов путем остановки роста трансформированных клеток [4–8]. ИП из растительных источников приобрели исключительное значение в качестве естественных средств защиты растений [9]. ИП, помимо подавления роста насекомых и вредителей, также обладают сдерживающей функцией против патогенных нематод, таких как Globodera tabaccum [10], и многих патогенных грибов, включая Candida tropicalis [11] и Trichoderma reesei [12].Ингибиторы протеазы были обеззаражены и определены из значительного числа растительных источников [13–17].
Чеснок ( Allium sativum , Liliaceae) — известное лекарственное растение, используемое для исцеления и лечения, и признано жизненно важной кулинарной специей во всем мире. С давних пор сообщалось о его неявной пользе для здоровья, и было выделено большое количество химических веществ из чеснока, демонстрирующих их применение при некоторых заболеваниях человека [18–20]. В течение последних двух десятилетий было показано, что чеснок обладает антибиотическим, противогрибковым [21] и антибактериальным действием [22].Текущие наблюдения подтвердили, что чеснок также может использоваться против антиартеросклероза, гиполипидемии [23–24] и против канцерогенеза [25–26]. Более того, несколько исследований показали, что чеснок является мощным иммуномодулятором.
В этом исследовании экстракт чеснока был обработан из съедобных частей зубчиков чеснока. По-видимому, ASPI был очищен впервые, и его биофизическая характеристика была проведена для оценки его стабильности. Далее были проведены кинетические исследования и сделаны выводы о значениях Vmax, Ki и Km.Предполагается, что это исследование будет полезно для изучения потенциала ASPI как фитопрепарата в контексте большого числа заболеваний.
Материалы и методы
Материалы
Allium sativum (PUSA-AG 102), широко известный как «чеснок», был получен из IARI, Нью-Дели. Химикаты; трипсин (трипсин поджелудочной железы крупного рогатого скота), Nα-бензоил-DL-аргинин-п-нитроанилид (BAPNA), фенилметилсульфонилфторид (PMSF), поливинилпирролидон (PVP), акриламид, бис-акриламид, тетраметилэтилендиамин (тетраметилэтилендиамин) (SDS), акриламид, бис-акриламид, TEMED, персульфат аммония и SDS были получены от Sigma-Aldrich.Все остальные реактивы и химикаты были аналитической чистоты.
Очистка ASPI
Луковицы чеснока гомогенизировали в 20 мМ Трис-2 мМ CaCl 2 (Трис) буфере (pH 8,2), содержащем 1 М NaCl. Гомогенат фильтровали через муслиновую ткань и перемешивали при 4 ° C в течение 4–5 часов. Добавляли ингибитор протеазы, такой как PVP и PMSF, чтобы избежать какой-либо протеолитической активности. Гомогенат центрифугировали при 9000 об / мин в течение 1 часа при 4 ° C. Полученный супернатант насыщали 30% сульфатом аммония.Супернатант собирали и подвергали осаждению 50% сульфатом аммония, и осадок получали после центрифугирования при 9000 об / мин в течение 1 часа. Этот осадок солюбилизировали в Трис-буфере (pH 8,2) с последующим обширным диализом с использованием целлюлозных трубок (обрезание 12 кДа) в том же буфере в течение 24 часов. Диализованный образец фильтровали и проводили слабую анионообменную хроматографию на колонке Hi Trap DEAE FF (1 мл, 7 мм × 25 мм) (GE Healthcare), предварительно уравновешенной Трис-буфером (pH 8,2). Образец вводили в колонку с помощью петли объемом 5 мл.Размер фракции элюента и расход буфера проверяли очистителем Akta. Несвязанные белки промывали до тех пор, пока поглощение при 280 нм не упало до нуля. Связанные белки элюировали 0-1 М NaCl в линейном градиенте в том же буфере. Первый пик, элюированный при 0,12 М NaCl, показал активность ингибирования трипсина. Далее элюент концентрировали с использованием фильтра Amicon (Merck, Германия). Затем белок анализировали на концентрацию и активность, как указано ниже. Таким образом, очищенный белок служил ASPI и был дополнительно охарактеризован для биохимических анализов.
Оценка белка
КонцентрацияASPI была измерена в соответствии с протоколом Lowry et al . с небольшими изменениями [27] с использованием альбумина бычьей сыворотки (1 мг / мл) в качестве стандарта.
Анализ SDS-PAGE
SDS-PAGE выполняли по методу Laemmli [28] с использованием 12% разделяющего геля и 5% стекирующего геля. Образцы смешивали с равным объемом загрузочного буфера и денатурировали нагреванием перед загрузкой в лунки. Белки разделяли при 100 В на установке Mini Protean II (Bio-Rad, США).После полного растворения гель был снят с гипсовой повязки с последующим окрашиванием кумасси бриллиантовым синим. Стандарт белка (от 10 до 250 кДа) использовали для определения молекулярной массы ASPI. Чистоту проверяли путем визуализации количества полос в пробе.
Идентификация белка с помощью MALDI-TOF-TOF
Полоса белка из геля SDS была вырезана и помещена в микроцентрифужную пробирку на 0,2 мл. Переваривание вырезанного белка трипсином проводили по методу Bagheri et al.[29]. Фингерпринтинг пептидной массы выполнялся на анализаторе MALDI-TOF-TOF MS (ABSCIEX TOF / TOF 5800, Applied Biosystems, США), а идентификация белка (ID) производилась с использованием зависимого от результата анализа (RDA) с помощью программного обеспечения ProteinPilot ™ (версия 3.2, США). Данные были проанализированы как ионный поиск MS / MS, и предварительная идентификация белка была выполнена путем поиска в базе данных NCBI с использованием алгоритма MASCOT (http://www.matrixscience.com). Для оценки идентификации белка рассматривался белок со значительным баллом.
Определение ингибирующей активности трипсина
Трипсин-ингибирующую активность ASPI определяли путем измерения остаточной ферментативной активности по отношению к субстрату 1,5 мМ BAPNA-HCl в 20% глицерине [30]. Суммарная реакционная смесь содержала ASPI и трипсин в соотношении (2: 1) и инкубировалась 15–30 мин при комнатной температуре. Добавляли хромогенный субстрат, то есть BAPNA, и реакционную смесь дополнительно инкубировали при комнатной температуре для анализа реакции несвязанного трипсина с BAPNA.Реакцию останавливали добавлением уксусной кислоты. Ферментативный гидролиз BAPNA определяли путем визуализации интенсивности желтого цвета, который соответствовал высвобождению п-нитроанилина и активности трипсина при 410 нм. Активность определялась активностью теста (ИП + трипсин) — активностью отрицательной (только трипсин). Активность трипсина рассчитывали по формуле: Где ΔA = изменение оптической плотности при 410 нм, D.F. = Коэффициент разбавления, ε BAPNA = Молярный коэффициент экстинкции BAPNA
Исследования стабильности
Влияние pH на ASPI.
Влияние pH на ингибирующий потенциал ASPI также проверяли путем предварительной инкубации с ферментом при желаемом pH (1–12) в течение 30 минут и затем анализа на остаточную активность фермента. Для получения желаемого pH использовали 100 мМ растворы следующих буферов: KCl-HCl (1,0), Gly-HCl (pH 2,0–4,0), ацетат натрия (5,0–6,0), фосфат натрия (pH 7,0–8,0) и Gly. -NaOH (pH 9,0–12,0). Тестовый образец, показывающий максимальную ингибирующую активность, был принят за 100%. Остальные образцы сравнивали для расчета остаточной активности в процентах.
Термическая стабильность ASPI.
Тест на термостабильность ASPI проводился в трис-буфере путем обработки образца в течение 30 минут при различных температурах в диапазоне 10–100 ° C в термостате. Затем образцы доводили до 37 ° C и проверяли на остаточную ингибирующую активность.
Действие моющих, восстановителей и окислителей.
ASPI инкубировали с неионогенными и ионными детергентами (Triton X 100, SDS и Tween-80) в концентрации 0,5 и 1% каждый в течение 30 мин с последующим диализом против трис-буфера.Остаточные ингибирующие активности рассчитывали при 410 нм, наблюдая хромогенное изменение после добавления трипсина с последующим добавлением субстрата.
Влияние восстанавливающих агентов β-меркаптоэтанола и подобных ему дитиотреитола (DTT) на активность ASPI анализировали путем инкубации ASPI с агентами 1, 2 и 3 ммоль / л в течение 3 часов и оценивали их остаточную ингибирующую активность.
Аналогичным образом, влияние окислителей, таких как диметилсульфоксид и перекись водорода, на активность ASPI было изучено путем их инкубации с ASPI в различных концентрациях 0.5, 1, 2, 3 и 4% (об. / Об.) В течение 30 мин. Позже была оценена остаточная ингибирующая активность трипсина.
Кинетический анализ
Кинетический анализ активности ASPI проводили для расчета значений Km и Vmax активности ASPI. Ингибирующий потенциал ASPI анализировали для трипсина с использованием BAPNA (0,005 и 0,01 ммоль / л). Начальный наклон «v» определяли для каждой ингибирующей концентрации. Также была нанесена зависимость скорости ASPI (V) от концентрации BAPNA (S). Скорость реакции обозначена как V (OD 410 мМ / мин / мл).Значения Vmax и Km рассчитывались по графику. Амидолитическую активность трипсина (30 мкг) определяли с различными концентрациями BAPNA (от 1,2 до 5,0 мкМ) в отсутствие ASPI. Затем анализы повторяли в присутствии 5 и 15 мкг ASPI. Значения Ki рассчитывали по графику Лайнуивера-Берка.
Определение структуры ASPI
Определение вторичной структуры ASPI проводили методом кругового дихоризма (CD). Спектры КД в дальнем УФ-диапазоне регистрировали на спектрополяриметре J-1500 Jasco, оборудованном компьютерным контролем температуры на основе Пельтье, и анализировали с помощью программного обеспечения Jasco.Длина кюветы составляла 0,1 см для измерений в диапазоне 200–250 нм.
Статистический анализ
Эксперименты проводили в трех повторностях. Результаты были представлены в виде графиков, представляющих среднее значение ± стандартное отклонение, с использованием программного обеспечения Graph Pad Prism 5. Таким образом, результаты подтверждают воспроизводимость данных.
Результаты
Очистка ASPI
В процессе очистки было получено ~ 10 мг белка из 100 г очищенных от кожуры свежих луковиц чеснока. Образец, полученный после осаждения сульфатом аммония и диализа, подвергался ингибирующей активности трипсина.Полученный таким образом фракт показал ингибирующую активность в отношении трипсина и был загружен в колонку Hi Trap DEAE FF. Было выполнено градиентное элюирование, и фракции элюировались с диапазоном концентраций NaCl (рис. 1). Собранные пики снова анализировали на активность против трипсина. Очищенный ASPI показал удельную активность 30376,1371 ед. / Мг при кратности чистоты 159,92, и полученный выход составил ~ 93% (таблица 1). Полученную таким образом активную фракцию в дальнейшем использовали для различных биофизических действий.
Рис. 1. FPLC-хроматограмма ASPI после насыщения сульфатом аммония и диализа, образец загружали на колонку Hi Trap DEAE FF и элюировали градиентом NaCl (0–100% в Трис-буфере).
Хроматограмма представляет концентрацию элюированного ASPI (миллиабсорбция мА 280 при 280 нм) по оси Y с количеством элюированной фракции (мл) по оси Y. Вторая кривая представляет градиент NaCl (0–100% B), где буфер A — 25 мМ Трис-HCl (pH 8,2), а B — 1,0 M NaCl в том же буфере.
https://doi.org/10.1371/journal.pone.0165572.g001
Оценка белка
Концентрации белка и ингибирующая активность трипсина определялись и сравнивались на каждой стадии очистки (таблица 1). Результаты отражают спад концентрации и общего белка с каждым этапом прохождения, в то время как удельная активность увеличивается и степень очистки увеличивается. Результаты интерпретируются в таблице 1.
Анализ SDS-PAGE
Электрофорез элюированного ASPI вSDS в полиакриламидном геле дает единственную толстую полосу, демонстрирующую чистоту и молекулярную массу белка.ASPI показал четкую полосу, соответствующую молекулярной массе примерно ~ 15 кДа (фиг. 2, дорожка 2).
Рис. 2. ASPI был запущен при разрешении 12%, SDS PAGE с накоплением 5%.
20 мкл образца с загрузочным буфером загружали в каждую лунку. Полосы визуализировали с помощью окрашивания Кумасси. Дорожка 1: стандартные белки, Дорожка 2: элюент Akta-DEAE, Дорожка 3: образец, насыщенный 30-50% сульфатом аммония (диализованный).
https://doi.org/10.1371/journal.pone.0165572.g002
Идентификация белка с помощью анализа MALDI-TOF-MS / MS
Полоса, вырезанная из SDS-PAGE (фиг. 2, дорожка 2), была идентифицирована с помощью MALDI TOF-TOF.Полоса ~ 15 кДа была расщеплена трипсином на 5 фрагментов в диапазоне 997,1549–1762,4725 Да, как показано на отпечатке пептидной массы (таблица 2). Было обнаружено, что эти фрагменты являются частью усеченного ингибитора трипсина (gi | 13375351) с максимальной оценкой талисмана 92, где gi | 1370187 представляет собой последовательность усеченного TI из Glycine max с молекулярной массой 16,124 Да и 27% белка. Покрытие последовательности. Поскольку последовательность гена PI из A . sativum до сих пор не определен; мы рассматривали очищенный белок как ИП, а именно ИП указанного растения.Другие совпадения, также похожие на ИП различных растений, подтвердили идентификацию очищенного белка. Оценка основывалась на «оценке MOWSE на основе вероятности», т.е. «ионная оценка», равной 10 x Log (P), где P — наблюдаемая вероятность, а совпадение — случайное событие. Пептидные последовательности, полученные после анализа MALDI-TOF-TOF, анализировали по базе данных Swiss-Prot и поиску MASCOT, который подтвердил, что очищенный белок является ингибитором трипсина.
Определение ингибирующей активности трипсина
ASPI проверяли на ингибирование трипсином с использованием BAPNA в качестве субстрата.Активность и удельную активность ИП рассчитывали на каждой стадии очистки. Общую активность (активность белка х общий объем белка) рассчитывали на каждом этапе. Специфическая ингибирующая активность трипсина, т.е. общая активность белка / общее количество белка во фракции, увеличивалась с каждым этапом очистки с ~ 190 Ед / мг до 30376,13711 Ед / мг в фракции элюента 159,15 мг и 9,912 мг FPLC соответственно. Очищенный ASPI показал степень очистки ~ 160 раз в несколько раз по сравнению с неочищенным экстрактом чеснока (таблица 1).
Исследования стабильности
Влияние температуры и pH на ASPI.
ASPI инкубировали с буферами с pH 1–12 в течение 12 часов при 4 ° C. Данные, представленные на фиг. 3, указывают на процентную остаточную активность ASPI в широком диапазоне pH, регистрируя максимальное падение активности при pH 4 (~ 61% активности) по сравнению с активностью, наблюдаемой при других значениях pH. Таким образом, ASPI показал высокую стабильность в экстремальных условиях pH, что свидетельствует о устойчивости ASPI к колебаниям pH.
Остаточную ингибирующую активность ASPI измеряли после предварительной обработки ASPI при различных температурах в течение 30 мин.Было обнаружено, что ASPI устойчив к термической денатурации, показывая, что он сохраняет свою активность до 80 ° C. ASPI показал наибольшую активность в диапазоне температур 30–40 ° C (рис. 4). Было отмечено, что активность ASPI упала выше 80 ° C, и он стал полностью неактивным при 100 ° C (ингибирование ~ 21%). Мы полагаем, что ASPI достаточно термостойкий, как показано на рис. 4.
Рис. 4. Исследования термостабильности ASPI проводились путем его инкубации при различных температурах от 10 до 100 ° C в течение 30 минут.
После этого ASPI анализировали на остаточную ингибирующую активность при комнатной температуре.
https://doi.org/10.1371/journal.pone.0165572.g004
Влияние детергентов, окислителей и восстановителей на активность АСПИ.
Результаты показали, что ионные и неионные детергенты, за исключением SDS, оказывают отрицательное влияние на активность PI. Было увеличение остаточной активности ASPI до ~ 143% в присутствии 1% SDS по сравнению с контролем. В случае Tween 80 и Triton X 100 остаточная ингибирующая активность снизилась до ~ 35% и ~ 58% соответственно (рис. 5).
Рис. 5. Влияние детергентов на ингибиторную активность ASPI при инкубации с детергентами в течение 30 мин при комнатной температуре. Затем
ASPI анализировали на остаточную ингибирующую активность при комнатной температуре.
https://doi.org/10.1371/journal.pone.0165572.g005
Окислители, такие как H 2 O 2 и ДМСО, снижали активность ASPI в зависимости от концентрации. Результаты показали, что 5 мМ H 2 O 2 почти полностью ингибировали активность ASPI, тогда как 5 мМ ДМСО снижали активность ASPI до ~ 21% (фиг. 6).Мы можем предположить, что окисление может быть ключевым элементом регуляции активности ASPI.
Рис. 6. Влияние окислителей на ингибирующую активность ASPI при инкубации с окислителями в течение 30 мин при комнатной температуре. Затем
ASPI анализировали на остаточную ингибирующую активность при комнатной температуре.
https://doi.org/10.1371/journal.pone.0165572.g006
Кроме того, восстановитель, такой как DTT, также снижает остаточную ингибирующую активность ASPI в зависимости от концентрации.Активность снижалась до 8% при концентрации DTT 5 мМ. В то время как β-ME (1,0–3,0 мМ) после 3 часов инкубации практически не влиял на активность ASPI, оставаясь на уровне 99–93%. Кроме того, увеличение концентрации β-ME также не могло ингибировать активность ASPI до заметного уровня, показывая максимальное падение до ~ 85% при 5 мМ β-ME (фиг. 7).
Рис. 7. Влияние восстановителей на активность ингибитора ASPI при инкубации ASPI с восстановителями в течение 30 мин при комнатной температуре. Затем
ASPI анализировали на остаточную ингибирующую активность при комнатной температуре.
https://doi.org/10.1371/journal.pone.0165572.g007
Кинетические исследования
График ингибирования с переменной концентрацией ASPI: трипсин при фиксированном объеме BAPNA предполагает резкое падение активности трипсина с увеличением отношения ASPI / trp. Это можно определить спектрофотометрически при 410 нм, наблюдая за уменьшением количества хромогенного вещества (рис. 8). Скорость ASPI определяли путем взятия переменной концентрации субстрата (BAPNA). Скорость показала сигмоидальную зависимость от концентрации субстрата с пересекающейся кривой, экстраполируя ось X в точку, эквивалентную -1 / км.ASPI показал Vmax 240,8 (мкМ / мин) и значение Km 0,12 мкМ (фиг.9). Низкое значение Km предполагает более высокое сродство фермента (трипсина) к субстрату (BAPNA).
Остаточная активность трипсина в отсутствие и в присутствии 2,5 мкг, 5 мкг и 7,5 мкг ASPI была рассчитана при различной концентрации субстрата (0,8–5 мкМ BAPNA). Двойной обратный график кинетических данных изображен на рис. 10. В присутствии ASPI наблюдалось снижение значения Vmax, и кривые пересекались друг с другом по оси X при -1 / км.Режим ингибирования трипсина с помощью ASPI был неконкурентоспособным. Значение Ki, рассчитанное по графику Диксона, составило 0,08 ± 0,01 нМ).
Определение структуры
ASPI представляет собой α + β-белок при pH 8,2, что демонстрирует дальний УФ-спектр, измеренный с помощью кругового дихроизма (рис. 11). Вторичное структурное содержание определяли по спектру КД нативного белка с использованием сервера K2D2, который выявил 2,0% α-спиралей и 51% β-листов в Трис-буфере (20 мМ, pH 8,2).
Обсуждение
Несколько растительных источников были проверены на наличие ИП, и результаты показали, что образцы обладают высокостабильным ФИ после насыщения сульфатом аммония.Выбор Allium sativum (чеснок, член семейства Liliaceae (Amaryllidaceae) ) был основан на том факте, что он имеет мощный ИП с высочайшей лекарственной ценностью, полезный в фармацевтике, биотехнологии и промышленности. Известно, что в нем меньше белка, чем в бобовых [31]. Настоящая работа становится важной и новой, поскольку до сих пор не было описано ни одного ИП из Allium sativum .
В нашем исследовании анализ SDS-PAGE показал, что элюированный белок обладает молекулярной массой ~ 15 кДа по сравнению со стандартом белка.Серпины представляют собой суперсемейство, состоящее из белков, которые ингибируют сериновую протеазу (трипсин, химотрипсин и т. Д.), А ASPI, являющийся мощным ингибитором трипсина, имеет тенденцию попадать в семейство серпинов. Кроме того, наблюдаемая молекулярная масса ASPI показала высокую гомологию с ингибиторами типа Kunitz, поскольку представители этого семейства, как полагают, имеют молекулярную массу до ~ 16–26 кДа [32–33]. Следовательно, на основе молекулярной массы нового ИП, о котором мы сообщаем, можно сделать вывод, что ASPI является членом семейства ингибиторов типа Куница и членом семейства серпинов.Способность ASPI ингибировать трипсин доказала, что он является сильным ингибитором трипсина и является новым. Это было дополнительно подтверждено MALDI TOF-TOF, который сопоставил базу данных с TI из Glycine max .
Результаты MALDI TOF-TOF показали, что белок после триптического расщепления и анализа MALDI соответствовал последовательности gi | 1370187, которая представляет собой TI из Glycine max с молекулярной массой 16,124 Да и покрытием последовательности белка 27%. ASPI, являющийся новым белком, не имеет последовательности гена, доступной в базе данных NCBI.Таким образом, очищенный белок, демонстрирующий ингибирующую активность по отношению к трипсину, имеет право стать ASPI. Результаты подтверждаются и дополнительно подкрепляются сходством с последовательностями, полученными из других TI различных растений.
Стабильность элюированного белка изучалась в присутствии нескольких химических и физических денатурантов, таких как pH, температура и различные химические агенты, такие как детергенты, восстановители и окислители. Предполагалось, что белок может быть функционально стабильным благодаря наличию внутримолекулярных дисульфидных мостиков в ИП [34].Когда белок подвергался воздействию жестких температурных условий, он термически дезактивировался из-за денатурации и разворачивания из-за нарушения и разрыва ковалентных и нековалентных взаимодействий [35]. Был очищен ряд ИПП из растительных источников, которые оказались очень стабильными и достаточно активными при температурах до 70 ° C [36]. Термическая денатурация нашего белка, то есть ASPI, при разных температурах (10 ° C-100 ° C) показала, что ASPI является устойчивым к высоким температурам белком. Исследование стабильности ASPI показало, что он был функционально более стабильным при различных значениях pH, начиная с 5.0–10,0, но наименее устойчив при pH 4–5 и в сильно кислых и щелочных условиях. Благодаря стабильности pH может использоваться в качестве биопестицидов. Это связано с тем, что из-за высокой толерантности к pH он ингибирует высокощелочные сериновые протеазы, обнаруженные во флоре кишечника насекомых, тем самым дезактивируя механизм переваривания пищевого материала и, следовательно, убивая их [37]. Для большинства биотехнологических применений высокотермостабильные белки необходимы, поскольку это повышает эффективность, что является ключевым требованием для их коммерческого использования [38].ASPI также подвергался воздействию различных моющих, окислителей и восстановителей различной концентрации. Результаты показали, что очищенный ASPI был высокоактивен против трипсина даже при воздействии высоких концентраций химических денатурантов, таких как DTT, бета-меркаптоэтанол, Triton-X-100, Tween 80 и т. Д. Детергенты обычно участвуют в солюбилизации белков липидных мембран, а также поддерживают белок. растворимость в растворе. Увеличение активности ASPI в присутствии SDS по сравнению с контролем предполагает, что он действует как стабилизатор для PI.Было высказано предположение, что окисление аминокислоты метионина, обнаруженной в белке, может быть одной из причин высокой активности белка [39].
Очищенный ASPI исследовали на кинетику. Когда использовался диапазон переменных концентраций соотношения ASPI: трипсин с фиксированной концентрацией субстрата BAPNA и строился график ингибирования, это приводило к резкому падению активности трипсина при повышении концентрации отношения ASPI / трипсин. Максимальная скорость и концентрация субстрата, при которых скорость реакции предполагается равной половине максимальной скорости i.е. Константу Михаэлиса (Km) также рассчитывали по сигмоидальной кривой зависимости скорости от концентрации субстрата. Значения Vmax и Km составили 240,8 (мкМ / мин) и 0,12 мкМ соответственно. Что касается механизма действия, ASPI продемонстрировал неконкурентное ингибирование, которое соответствует большинству ИП, демонстрирующих неконкурентную кинетику ингибирования [40]. Низкое значение Ki также указывает на высокое сродство ASPI к трипсину, а также на гомологию с другими ИП типа Куница, обладающими ингибиторной природой трипсина [41].
ВASPI, являющемся новым белком, отсутствует полная последовательность белка, поэтому выравнивание множественных последовательностей и моделирование гомологии ASPI с другими TI невозможно. Однако структурный анализ ASPI был выполнен с помощью измерений CD, которые показали большинство β-листов с небольшим количеством α-спиралей во вторичной структуре. ИП типа Кунитца обычно обладают небольшим количеством α-спиральных структур и 12 антипараллельными β-цепями, соединенными длинными петлями [42]. Это подтверждает, что ASPI является ингибитором сериновой протеазы типа Куниц.Результаты, полученные в этом исследовании, позволяют предположить, что ASPI демонстрирует удовлетворительную стабильность в широком диапазоне pH и температуры. Высокая термическая и pH-стабильность ASPI свидетельствует о его применении в различных отраслях промышленности, включая сельское хозяйство. Кроме того, ASPI может быть дополнительно исследован для его клинического и биотехнологического применения.
Благодарности
TNS, RP, MA и MAB выражают благодарность Центральному инструментальному центру, отделу биотехнологии, JMI и лаборатории биотехнологии цианобактерий и лаборатории микробиологических исследований, отделу биологических наук, JMI, Нью-Дели, за предоставление доступа к приборам для исследовательской работы.SF выражает благодарность доктору Md Imtaiyaz Hassan, Центр междисциплинарных исследований в области фундаментальных наук, Jamia Millia Islamia, Нью-Дели, Индия, за их руководство на протяжении всей исследовательской работы. SA благодарит DST-SERB за присуждение стипендии JC Bose Fellowship.
Вклад авторов
- Концептуализация: TNS SF.
- Обработка данных: TNS RP.
- Формальный анализ: TNS SF.
- Расследование: TNS.
- Методология: ТНС РП МА МАБ.
- Администрация проекта: TNS SF.
- Ресурсы: MIQ SF.
- Программное обеспечение: TNS.
- Надзор: SF.
- Подтверждение: SF MIQ SA.
- Визуализация: TNS RP.
- Написание — черновик: TNS.
- Написание — просмотр и редактирование: TNS RP SF.
Ссылки
- 1.Нейрат Х. Протеолитический процессинг и физиологическая регуляция. Trends Biochem Sci. Июль 1989 г .; 14 (7): 268–71. pmid: 2672446
- 2. Хабиб Х., Фазили К.М. Ингибиторы протеаз растений: стратегия защиты растений. Biotechnol Mol Biol Rev.2007, август; 2 (3): 068–085.
- 3. Койва Х., Брессан Р.А., Хасегава П.М. Регулирование ингибиторов протеиназ и защиты растений, Trends Plant Sci. 1997; 2: 379–84.
- 4. Север HN, Filipic N, Brzin J, Lah TT.Влияние ингибиторов цистеиновых протеиназ на инвазию клеток меланомы мыши B16 in vitro. Biol Chem. 2002 Май; 383 (5): 839–42. pmid: 12108549
- 5. Огава М., Джинг Х., Киттс Д.Д., Накаи С., Накамура С. Противораковая активность in vitro в клетках Caco-2 и HCT-116 рекомбинантного цистатина С, полученного с помощью системы экспрессии Pichia. J Med Food. 2003 Зима; 6 (4): 317–22. pmid: 14977439
- 6. Heidtmann HH, Salge U, Abrahamson M, Bencina M, Kastelic L., Kopitar-Jerala N et al.Ингибиторы катепсина B и цистеиновых протеиназ в клеточных линиях рака легких человека. Clin Exp Metastasis. 1997 Июль; 15 (4): 368–81. pmid: 9219725
- 7. Clawson GA. Ингибиторы протеаз и канцерогенез: обзор. Рак Инвест. 1996. 14 (6): 597–608. pmid: 8951363
- 8. Хокман Г. Химиопрофилактика рака: ингибитор протеазы. Int J Biochem. 1992 Сен; 24 (9): 1365–75. pmid: 1426518
- 9. Фермер EE, Райан CA. Связь с растениями: переносимый по воздуху метилжасмонат индуцирует синтез ингибиторов протеиназ в листьях растений.Proc Natl Acad Sci U S. A., октябрь 1990 г., 87 (19): 7713–6. pmid: 11607107
- 10. Shade RE, Schroeder HE, Pueyo JJ, Tabe LM, Murdoch LL, Higgins TJV et al. Трансгенные семена гороха, экспрессирующие ингибиторы α-амилазы фасоли обыкновенной, устойчивы к брухидеям. Biotechnol. 1994 август; 12 (8): 793–796.
- 11. Schroeder HE, Gollasch S, Moore A, Tabe LM, Craig S, Hardie DC et al. Ингибитор альфа-амилазы фасоли придает устойчивость к гороховому долгоносику (Bruchus pisorum) у трансгенного гороха ( Pisum sativum L.). Plant Physiol. 1995 Апрель; 107 (4): 1233–1239. pmid: 12228429
- 12. Ishimoto M, Sato T, Chrispeels MJ, Kitamura K. Устойчивость к брухидам трансгенных бобов адзуки, экспрессирующих ингибитор альфа-амилазы семян обыкновенных бобов, Ent Exp Appl. 1996 Май, 79 (3): 309–15.
- 13. Cherqui A, Cruz N, Simões N. Очистка и характеристика двух ингибиторов сериновой протеазы из гемолимфы Mythimna unipuncta . Насекомое Biochem Mol Biol. 2001, 22 июня; 31 (8): 761–9.pmid: 11378411
- 14. Шривастава Б, Гош АК. Очистка белка, клонирование кДНК и характеристика ингибитора протеазы индийского шелкопряда тасар, Antheraea mylitta . Насекомое Biochem Mol Biol. 2003 Октябрь; 33 (10): 1025–33. pmid: 14505696
- 15. Хак С.К., Хан Р.Х. Характеристика ингибитора протеиназы из Cajanus cajan (L.). J. Protein Chem. 2003 августа; 22 (6): 543–54. pmid: 14703988
- 16. Хак С.К., Атиф С.М., Хан Р.Х.Биохимическая характеристика, исследования стабильности и N-концевая последовательность бифункционального ингибитора из Phaseolus aureus Roxb. (Бобы мунг). Биохимия. 2005 декабрь; 87 (12): 1127–36. pmid: 16005140
- 17. Патил Д. Н., Прити, Чаудри А., Шарма А. К., Томар С., Кумар П. Очистка, кристаллизация и предварительные кристаллографические исследования ингибитора протеиназы типа Кунитца из семян тамаринда ( Tamarindus indica ). Acta Crystallogr Sect F Struct Biol Cryst Commun.1 июля 2009 г.; 65 (Pt 7): 736–8. pmid: 19574654
- 18. Ланзотти В. Анализ лука и чеснока. J Chromatogr A. 21 апреля 2006 г., 1112 (1–2): 3–22. pmid: 16388813
- 19. Рахман К., Лоу GM. Чеснок и сердечно-сосудистые заболевания: критический обзор. J Nutr. Март 2006 г .; 136 (3 доп.): 736S – 740S. pmid: 16484553
- 20. Lau BH. Подавление окисления ЛПНП чесноком. J Nutr. Март 2001 г .; 131 (3с): 985S – 8S. pmid: 11238802
- 21. Мур Г.С., Аткинс Р.Д.Фунгицидное и фунгистатическое действие водного экстракта чеснока на важные с медицинской точки зрения дрожжеподобные грибы Mycologia. Март-апрель 1977 г., 69 (2): 341–348. pmid: 865503
- 22. Chung JG, Chen GW, Wu LT, Chang HL, Yeh CC, Wang TF, Влияние диаллилсульфида и диаллилдисульфида соединений чеснока на активность ариламиннацетилтрансферазы в штаммах Helicobacter pylori от пациентов с язвенной болезнью. J Appl Toxicol. Март-апрель 1999 г., 19 (2): 75–81.
- 23. Кричевски Д. Влияние диетического чеснока на развитие сердечно-сосудистых заболеваний, Trends Food Sci.Technol. 1991; 2: 141–144.
- 24. Горинштейн С., Ястшебский З., Намиесник Дж., Леонтович Х., Леонтович М., Трахтенберг С. Атеросклеротическая болезнь сердца и защитные свойства чеснока: современные данные. Mol Nutr Food Res. 2007 ноябрь; 51 (11): 1365–81. pmid: 17966138
- 25. Деврим Э., Дурак И. Является ли чеснок многообещающим продуктом для лечения доброкачественной гиперплазии предстательной железы и рака простаты? Mol Nutr Food Res. 2007 ноябрь; 51 (11): 1319–23. pmid: 17918170
- 26. Сумиёси Х., Варгович МД.Химиопрофилактика 1,2-диметилгидразина, вызванного раком толстой кишки у мышей, с помощью встречающегося в природе сероорганического соединения. Cancer Res. 1990, 15 августа; 50 (16): 5084–7. pmid: 2379172
- 27. Лоури, Огайо, Розенбро, штат Нью-Джерси, Фарр А.Л., Рэндал Р.Дж. Измерение содержания белка с фенольным реагентом Folin. J Biol Chem. 1951 ноябрь; 193 (1): 265–75. pmid: 14 3
- 28. Laemmli UK. Расщепление структурных белков при сборке головки. Бактериофаг Т4. Природа. 1970, 15 августа; 227 (5259): 680–5.pmid: 5432063
- 29. Багери Р., Башир Х., Ахмад Дж. Икбал М., Куреши М.И. Шпинат ( Spinacia oleracea L.) по-разному модулирует свой протеом в ответ на соленость, кадмий и их комбинационный стресс. Plant Physiol Biochem. 2015 декабрь; 97: 235–45. pmid: 26497449
- 30. Эрлангер Б.Ф., Коковски Н., Коэн В. Получение и свойства двух новых хромогенных субстратов трипсина. Arch Biochem Biophys. 1961 ноябрь, 95: 271–8. pmid: 138
- 31.Kyo E, Uda N, Kasuga S, Itakura Y. Иммуномодулирующие эффекты выдержанного экстракта чеснока. J Nutr. Март 2001 г .; 131 (3с): 1075S – 9S. pmid: 11238820
- 32. Rodrigues Macedo ML, Machado Freire Md, Cabrini EC, Toyama MH, Novello JC, Marangoni S. Ингибитор трипсина из семян Pletophorum dubium , активный против протеазы вредителей и его влияние на выживание Anagasta kuehniella . Biochim Biophys Acta. 2 мая 2003 г.; 1621 (2): 170–82. pmid: 12726993
- 33.Ричардсон М. Запасные белки семян: ингибиторы ферментов. Методы биохимии растений. 1991; 5: 295–305.
- 34. Кидрич М., Фабиан Х., Брзин Дж., Попович Т., Пейн Р.Х. Сворачивание, стабильность и вторичная структура нового ингибитора цистеин-димерной протеиназы, Biochem. Биофиз. Res. Commun. 297 (2002) 962–67. pmid: 12359248
- 35. Лоутон Дж. М., Дунан С. Термическая инактивация и шаперон в опосредованной ренатурации митохондриальной аспартатаминотрансферазы. Биохим Дж.1998 15 августа; 334 (Pt 1): 219–24.
- 36. Prathibha S, Nambisan B, Leelamma S. Ингибиторы ферментов в клубневых культурах и их термическая стабильность. Растительная пища Hum Nutr. 1995 Октябрь; 48 (3): 247–57. pmid: 8833431
- 37. Райан CA. Ингибиторы протеиназ в растениях: гены для улучшения защиты от насекомых и патогенов, Annu. Преподобный Фитопат. 28 (1990) 425–49.
- 38. Pandhare J, Zog K, Deshpande VV. Дифференциальная стабильность ингибиторов щелочных протеаз актиномицетов: влияние различных добавок на термостабильность.Биоресур Технол. 2002 сентябрь; 84 (2): 165–9. pmid: 12139333
- 39. Мину Кришнан В.Г., Муруган К. Очистка, характеристика и кинетика ингибитора протеазы из плодов Solanum aculeatissimum Jacq . Food Sci. Человеческое благополучие. 2015 сен; 4 (3): 97–107.
- 40. Фогель Р., Траутшольд И., Верле Э. Природные ингибиторы протеиназ. Нью-Йорк, Academic Press. 1968.
- 41. Бхат А.В., Паттабираман Т.Н. Ингибиторы протеаз из семян джекфрута ( Artocarpus integrifolia ).J. Biosci. 1989; 14 (4): 351–365
- 42. Oliva ML, Silva MCC, Sallai RC, Brito MV, Sampaio MU. Новая подклассификация ингибиторов протеиназы Кунитца из семян зернобобовых культур. Биохимия. 2010; 92: 1667–1673. pmid: 20363284
Исследование ингибиторов трипсина, проведенное Министерством сельского хозяйства США. I. Предпосылки, цели и подробности процедуры
Американское общество химиков масел (1979) Труды Всемирной конференции по растительным пищевым белкам. Амстердам, Нидерланды: J Am Oil Chem Soc 56: 99–483
Google Scholar
Andren-Sandberg A, Ihse I (1983) Регулирующие эффекты на поджелудочную железу интрадуоденального панкреатического сока и трипсина у сирийского золотого хомячка. Scand J Gastroenterol 18: 697–706
PubMed Google Scholar
Ассоциация официальных химиков-аналитиков (1980) Метод № 7.009 Официальные методы анализа (13-е изд.) Вашингтон, округ Колумбия, стр. 125
Brabender Rapid Moisture Tester (1970) Руководство по эксплуатации 10-1 , CW Brabender Instruments, Inc., South Hackensack NJ, pp 1–11
Google Scholar
Чен И., Митчелл Х.Л. (1973) Ингибиторы трипсина в растениях. Фитохимия 12: 327–330
Google Scholar
Churella HR, Yao BC, Thomson WHB (1976) Активность ингибиторов трипсина сои в детских смесях сои и ее значение для питания крыс. J Agric Food Chem 24: 393–397
PubMed Google Scholar
Cohen S (1980) Патогенез желудочно-кишечных симптомов, вызванных кофе. N Engl J Med 303: 122–124
PubMed Google Scholar
Исследовательский фонд кукурузной промышленности (1965) Белковый метод A-18. Стандартные аналитические методы (1-е издание) Вашингтон, округ Колумбия
Crass RA, Morgan, RGH (1981) Быстрые изменения ДНК, РНК и белка поджелудочной железы у крыс во время увеличения и инволюции поджелудочной железы. Inter J Vitam Nutr Res 51: 85–91
Google Scholar
Crass, RA, Morgan, RGH (1982) Влияние длительного кормления соевой мукой на рост поджелудочной железы у крыс. Br J Nutr 47: 119–129
PubMed Google Scholar
Creutzfeldt, W (1982) Роль желудочно-кишечных пептидов в патофизиологии и болезнях. Сканд Дж. Гастроэнтерол 77: 7–20
Google Scholar
Дэвис М.Г., Томас А.Дж. (1973) Исследование гидролитических методов аминокислотного анализа пищевых продуктов.J Sci Food Agric 24: 1525–1540
PubMed Google Scholar
del Rio MD, Minetti M, Ferrer PR, de Valencia ME, Sambucetti ME, Sanahuja JC (1981) Питательная ценность супов из сухих смесей на основе сои, приготовленных из различных соевых продуктов. Nutr Rep Int 24: 67–73
Google Scholar
Dlugosz J, Folsch UR, Creutzfeldt WC (1983) Ингибирование интрадуоденального трипсина не стимулирует экзокринную секрецию поджелудочной железы у человека.Пищеварение 26: 197–204
PubMed Google Scholar
Doell BH, Ebden CJ, Smith CA (1981) Трипсиновая активность традиционных пищевых продуктов, которые являются частью британской диеты, и некоторых соевых продуктов. Qual Plant Plant Foods Hum Nutr 31: 139–150
Google Scholar
Fazio T, White RH, Dusold LR, Howard JW (1973) Нитрозопирролидин в приготовленном беконе. J Assoc Off Agric Chem 56: 919–921
Google Scholar
Fiddler RN (1977) Совместное исследование модифицированного метода AOAC для анализа нитритов в мясе и мясных продуктах. J Assoc Off Agric Chem 60: 594–599
Google Scholar
Figarella C, Negri GA, Guy O (1975) Два человеческих трипсиногена. Eur J Biochem 53: 457–463
PubMed Google Scholar
Folsch UR, Winckler K, Wormsley KG (1978) Влияние повторного введения холецистокинина и секреции на поджелудочную железу крысы.Scand J Gastroenterol 13: 663–671
PubMed Google Scholar
Folsch UR, Wormsley KG (1974) Секреция ферментов поджелудочной железы у крыс, получавших соевую диету. Scand J Gastroenterol 9: 679–683
PubMed Google Scholar
Green GM, Lyman RL (1972) Регулирование с обратной связью секреции ферментов поджелудочной железы как механизм индуцированной ингибитором трипсина гиперсекреции у крыс.Proc Soc Exp Biol Med 140: 6–12
PubMed Google Scholar
Green GM, Miyasaka K (1983) Поджелудочная реакция крысы на кишечную инфузию интактного и гидролизованного белка. Am J Physiol 245 (Gastrointest Liver Physiol 8): G394-G398
PubMed. Google Scholar
Green GM, Nasset ES (1977) Важность желчи в регуляции внутрипросветной активности протеолитических ферментов у крыс.Гастроэнтерол 79: 695–702
Google Scholar
Green GM, Nasset ES (1983) Роль диетического белка в секреторной реакции ферментов поджелудочной железы крыс на прием пищи. J Nutr 113: 2245–2252
PubMed Google Scholar
Green GM, Olds BA, Matthews G, Lyman, RL (1972) Белок как регулятор секреции ферментов поджелудочной железы у крыс. Proc Soc Exp Biol Med 142: 1162–1167
Google Scholar
Gumbmann MR, Spangler WL, Dugan GM, Rackis JJ, Liener IE (1985) Исследование ингибитора трипсина USDA. IV. Хроническое воздействие соевой муки и изолята соевого белка на поджелудочную железу у крыс через два года. Qual Plant Plant Foods Hum Nutr 35:
Ганн Р.А., Тейлор П.Р., Гангарос Э.Дж. (1980) Желудочно-кишечное заболевание, связанное с потреблением соевого протеинового наполнителя. J Food Sci 43: 525–527
Google Scholar
Hamestrand GE, Black LT, Glover JD (1981) Ингибиторы трипсина в соевых продуктах. Модификация стандартной аналитической методики. Cereal Chem. 58: 42–45
Google Scholar
Hasdai A, Liener IE (1983) Рост, усвояемость и ферментативная активность в поджелудочной железе и кишечнике хомяков, которых кормили сырой и нагретой соевой мукой. J Nutr 113: 662–668
PubMed Google Scholar
Hotz J, Ho SB, Go VLW, DiMagno EP (1983) Кратковременное ингибирование триптической активности двенадцатиперстной кишки не влияет на функцию желчных путей поджелудочной железы или желудка человека. J Lab Clin Med 101: 488–495
PubMed Google Scholar
Ihse I, Lilja P, Lindquist I (1977) Регулирование с обратной связью секреции ферментов поджелудочной железы кишечным трипсином у человека. Пищеварение 15: 303–308
PubMed Google Scholar
Jacobson D, Tillman R, Toskes P, Curington C (1982) Острое и хроническое ингибирование с обратной связью экзокринной секреции поджелудочной железы у людей (аннотация). Гастроентрол 82: 1091
Google Scholar
Johnson LR (1981) Влияние желудочно-кишечных гормонов на рост поджелудочной железы. Рак 47: 1640–1645
PubMed Google Scholar
Kakade ML, Rackis JJ, McGhee JE, Puski G (1974) Определение активности ингибитора трипсина соевых продуктов, совместный анализ улучшенной процедуры.Cereal Chem 51: 376–382
Google Scholar
Какаде М.Л., Симонс Н., Линер И.Е. (1969) Оценка естественных и синтетических субстратов для измерения антитриптической активности образцов сои. Cereal Chem 46: 518–526
Google Scholar
Krawisz BR, Miller LJ, DiMagno EP, Go VLW (1980) В отсутствие питательных веществ секреция желчных протоков поджелудочной железы в тонкой кишке не влияет на контроль функции поджелудочной железы или желудка человека с обратной связью.J Lab Clin Med 95: 13–18
PubMed Google Scholar
Krogdahl A, Holm H (1979) Ингибирование протеиназ поджелудочной железы человека и крысы неочищенными и очищенными ингибиторами протеиназ сои. J Nutr 109: 551–558
PubMed Google Scholar
Lebenthal E, Choi TS, Lee PC (1981) Развитие функции поджелудочной железы у недоношенных детей после смесей на основе молока и сои.Pediatric Res 15: 1240–1241
Google Scholar
Levison DA, Morgan RGH, Brimacombe JS, Hopwood D, Coghill G, Wormsley KG (1979) Канцерогенные эффекты ди- (2-гидроксипропил) нитрозамина (DHPN) у самцов крыс Wistar: стимулирование рака поджелудочной железы с помощью диета из сырой соевой муки. Scand J Gastroenterol 14: 217–224
PubMed Google Scholar
Lewis JH, Taylor FHL (1947) Сравнительное использование сырого и автоклавированного соевого белка человеком.Proc Soc Exp Biol Med 64: 85–87
Google Scholar
Liener IE (1981) Факторы, влияющие на питательные качества соевых продуктов. J Am Oil Chem Soc 58: 406–415
Google Scholar
Liner IE, Kakade ML (1980) Ингибиторы протеазы. В: Liener IE (ed) Токсичные компоненты растительной пищи. Нью-Йорк: Academic Press, стр. 7–71
Google Scholar
Liener IE, Nitzan Z, Srisangnam C, Rackis JJ, Gumbmann MR (1985) Исследование ингибитора трипсина USDA. II. Изменения в поджелудочной железе крыс, связанные со временем. Qual Plant Foods Hum Nutr 35:
Отдел исследований биологических наук Федерации американских обществ экспериментальной биологии (1979) Оценка аспектов здоровья изолятов соевого белка как пищевых ингредиентов Scogs — 101. Подготовлено для Бюро пищевых продуктов, пищевых продуктов и медикаментов, Вашингтон, округ Колумбия, по контракту №FDA 223-75-2004 by Life Sciences Office, Besthesda, MD, pp4 и A-1 to A-27
Mc Guinness EE, Hopwood D, Wormsley KG (1982) Дальнейшие исследования воздействия сырой сои мука на поджелудочной железе крысы. Scand J Gastroenterol 17: 273–277
PubMed Google Scholar
McGuinness EE, Morgan RGH, Levison DA, Frape DL, Hopwood G, Wormsley KG (1980) Влияние длительного кормления соевой мукой на поджелудочную железу крыс.Scand J Gastroenterol 15: 497–502
PubMed Google Scholar
McGuinness EE, Morgan RGH, Levison DA, Hopwood D, Wormsley KG (1981) Взаимодействие азасерина и сырой соевой муки на поджелудочной железе крысы. Scand J Gastroenterol 16: 49–56
PubMed Google Scholar
Миясака К., Грин Г.М. (1984) Эффект частичного исключения панкреатического сока на базальную секрецию поджелудочной железы крыс.Гасторентерол 86: 114–119
Google Scholar
Мур С. (1963) Об определении цистина как цистеиновой кислоты. J Biol Chem 238: 235–237
Google Scholar
Morgan RGH, Levison DA, Hopwood D, Saunders JHB, Wormsley KG (1977) Усиление действия азасерина на поджелудочную железу крысы сырой соевой мукой. Рак Letts 3: 87–90
Google Scholar
Мороз Л.А., Янг WH (1980) Ингибитор трипсина сои Куниц. Специфический аллерген в пищевой амфилаксии. New Engl J Med 302: 1126–1128
PubMed Google Scholar
Murthy SNS, Dinoso VP, Clearfield HR, Chey WY (1977) Одновременное измерение базальной поджелудочной железы, секреции желудочного сока, гастрина и секретина в плазме во время курения. Гастроэнтерол 73: 758–761
Google Scholar
Доклинические лабораторные исследования Положения о надлежащей лабораторной практике (GLP), раздел 21, часть 58 Свода федеральных нормативных актов (1978), Федеральный регистр, том 43, № 247, часть II, 22 декабря, стр. 59986–60025
Pap A, Berger Z, Varro V (1981) Трофический эффект холецистокинин-октапептида на человека — новый способ лечения хронического панкреатита? Пищеварение 21: 163–168
PubMed Google Scholar
Pour PM, Rung RG, Birt D, Gengell R, Lawson T, Nagel D, Wallcave L, Salmazi SZ (1981) Современные знания о канцерогенезе поджелудочной железы у хомяков и его значении для болезней человека.Рак 47: 1573–1587
PubMed Google Scholar
Rackis JJ (1974) Биологические и физиологические факторы в соевых бобах. J Am Oil Chem Soc 51: 161A-174A
PubMed Google Scholar
Rackis JJ, Gumbmann MR (1981) Ингибиторы протеазы: физиологические свойства и питательная ценность. В: Ory RL (ed) Antinutrients and Natural Toxicants in Foods.Westport CT: Food and Nutrition Press, стр. 203–237
Google Scholar
Rackis JJ, McGhee JE, Booth AN (1975) Биологические пороговые уровни ингибиторов трипсина сои по данным биоанализа на крысах. Cereal Chem 52: 85–92
Google Scholar
Rackis JJ, McGhee JE, Gumbmann MR, Booth AN (1979) Влияние соевых белков, содержащих ингибиторы трипсина, на долгосрочные исследования питания на крысах.J Am Oil Chem Soc 56: 162–168
PubMed Google Scholar
Roebuck BD, Yager Jr JD, Longnecker DS (1981) Диетическая модуляция индуцированного азасерином канцерогенеза поджелудочной железы у крыс. Cancer Res 41: 888–893
PubMed Google Scholar
Roebuck BD, Yager Jr JD, Longnecker DS, Wilpone SA (1981) Продвижение ненасыщенными жирами индуцированного азасерином канцерогенеза поджелудочной железы у крыс.Cancer Res 41: 3961–3966
PubMed Google Scholar
Schneeman BA, Lyman RL (1975) Факторы, участвующие в регуляции кишечной обратной связи секреции ферментов поджелудочной железы у крыс. Proc Soc Exp Biol Med 148: 897–903
PubMed Google Scholar
Senti FR (1982) Аннотированная библиография по изменениям поджелудочной железы у экспериментальных животных, получавших соевые бобы, обработанные соевые продукты, ингибитор соевого трипсина или холецистокинин-панкреозимин и антипитательные факторы в обработанных соевых продуктах.Подготовлено для Бюро пищевых продуктов, пищевых продуктов и медикаментов, Вашингтон, округ Колумбия, по контракту № FDA 223-79-2275 Бюро наук о жизни, Федерация американских обществ экспериментальной биологии, Bethesda MD, pp 1–68
Shibasaki M, Suzuki S, Tajima S, Nemoto N, Kuroume T (1980) Аллергенность основных составляющих белков соевых бобов. Int Arch Allergy Appl Immunol 61: 441–448
PubMed Google Scholar
Singh M, Webster III PD (1981) Экзокринная секреция поджелудочной железы. Клиники в Гастроэнтероле 10: 555–581
Google Scholar
Sissons JW (1982) Влияние соевых продуктов на пищеварительные процессы в желудочно-кишечном тракте недожвачных телят. Proc Nutr Soc 41: 53–61
Google Scholar
Sissons JW, Nyrup A, Kilshaw PJ, Smith RH (1982) Денатурация антигенов соевого белка этанолом.J Sci Food Agric 33: 706–710
Google Scholar
Slaff J, Toskes P, Jacobson D, Curington C (1983) Дальнейшие исследования ингибирования с обратной связью экзокринной секреции поджелудочной железы (аннотация). Clin Res 31: 477A
Google Scholar
Smith AK, Circle SJ (eds) (1972) Soybeans. Химия и технология, том I, белки. Вестпорт, Коннектикут: Avi Publishing
Google Scholar
Spangler WL, Gumbmann MR, Liener IE, Rackis JJ (1985) Исследование ингибитора трипсина USDA. III. Последовательное развитие патологии поджелудочной железы у крыс. Qual Plant Foods Hum Nutr 35:
Speck ML (ed) (1976) Сборник методов микробиологического исследования пищевых продуктов. Американская ассоциация общественного здравоохранения. Комитет Межобщества / Агентства по микробиологическим методам для пищевых продуктов, Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия
Струтерс Б.Дж., Макдональд Дж.Р., Прешер Е.Е., Хопкинс Д.Т. (1983) Влияние некоторых растительных и животных белков на поджелудочную железу крыс.J Nutr 113: 1503–1512
PubMed Google Scholar
Симпозиум: Текущий прогресс в исследованиях канцерогенеза поджелудочной железы (1975) In: Cancer Res 35: 2225–2294
Google Scholar
Симпозиум: Текущий прогресс в исследованиях канцерогенеза поджелудочной железы (1975) In: Cancer Res 35: 2225–2294
Симпозиум: Питание как причина рака (1975) In: Cancer Res 35: 3231 –3550
Google Scholar
Technicon Instrument Corporation (1974) Нитрат и нитрит натрия в мясном экстракте. Метод 230 и 230-72А. Technicon Instrument Corporation, Tarrytown NY
Google Scholar
Temler RS (1980) Изменения в поджелудочной железе крыс, получавших разные уровни соевой муки и казеина. Int J Vitam Nutr Res 50: 212–213
Google Scholar
Temler RS, Dormond CA, Simon E, Morel E (1982) Влияние на поджелудочную железу крыс кормления ингибитором сои Kunitz или повторных инъекций очищенного холецистокинина.Int J Vitam Nutr Res 52: 2230
Google Scholar
Temler RS, Dormond CA, Simon E, Morel B, Mattraux C (1984) Ответ протеаз поджелудочной железы крыс на пищевые белки, их гидролизаты и ингибитор трипсина сои. J Nutr 114: 270–278
PubMed Google Scholar
Temler RS, Simon E, Amiquet P (1983) Сравнение взаимодействий ингибиторов протеазы сои с ферментами поджелудочной железы крысы и человеческим трипсином.Фермент 30: 105–114
PubMed Google Scholar
Theuer RC, Sarett HP (1970) Пищевая ценность смесей для детского питания соевого изолята у крыс: Холин. J Agric Food Chem 18: 913–916
PubMed Google Scholar
Treffot MJ, Laugier R, Bretholz A (1980) Повышенное высвобождение гастрина при хроническом кальцифицирующем панкреатите и хроническом алкоголизме. Horm Metab Res 12: 240–242
PubMed Google Scholar
Vitoria JC, Camarero C, Sojo A, Ruiz A, Rodriquez-Soriano J (1982) Экстеропатия, связанная с рыбой, рисом и курицей.