«Детралекс» или «Троксевазин»? – meds.is
Сравнение эффективности Детралекса и Троксевазина
У Детралекса эффективность больше Троксевазина – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Детралекса более выраженный, то у Троксевазина даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Детралекса и Троксевазина тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Детралекса и Троксевазина
Безопасность препарата включает множество факторов.
При этом у Детралекса она достаточно схожа с Троксевазином. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Детралекса нет никаих рисков при применении, также как и у Троксевазина.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Детралекса и Троксевазина.
Сравнение противопоказаний Детралекса и Троксевазина
Исходя из инструкции. Количество противопоказаний у Детралекса достаточно схоже с Троксевазином и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Детралекса и Троксевазина может быть нежелательным или недопустимым.
Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Детралекса и Троксевазина может быть нежелательным или недопустимым.
Сравнение привыкания у Детралекса и Троксевазина
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Детралекса достаточно схоже со аналогичными значения у Троксевазина. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной.
Сравнение побочек Детралекса и Троксевазина
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Детралекса состояния нежелательных явлений почти такое же, как и у Троксевазина. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Детралекса схоже с Троксевазином: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Детралекса и Троксевазина
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Детралекса примерно одинаковое с Троксевазином. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2019-09-19 05:59:56
Что лучше «Детралекс» или «Троксевазин»: особенности и различия
Привычный образ жизни человека, питание, экология и ежедневные нагрузки, сказываются на состоянии сосудистых тканей. Для их улучшения, необходима комплексная терапия, с применением флеботоников, наиболее распространенными и применяемыми, среди которых, являются Детралекс и Троксевазин. Какое средство лучше и на что стоит обратить внимание при выборе? Попробуем выяснить!
Детралекс
Детралекс – ангипротективное вентонизирующее лекарственное средство, способствующее ускоренному восстановлению венозных и сосудистых тканей.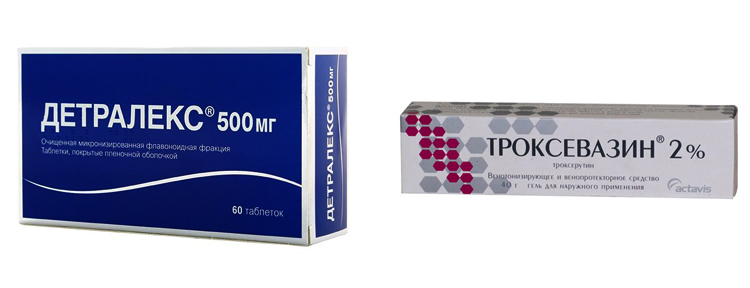 Препарат улучшает тонус сосудов, снижая при этом их проницаемость. Выпускается в виде таблеток, ярко-оранжевого цвета. Одна таблетка содержит 500 мг действующего вещества.
Препарат улучшает тонус сосудов, снижая при этом их проницаемость. Выпускается в виде таблеток, ярко-оранжевого цвета. Одна таблетка содержит 500 мг действующего вещества.
Фармакология
Действующее вещество – Диосмин, принадлежит к группе венотоников и ангиопротекторов. Под действие препарата, повышается венозный тонус, они становятся менее эластичными и не поддаются растяжению. Также повышаются геодинамические показатели, а стазовые явления сокращаются. Детралекс оказывает барьерную функцию, препятствуя лейкоцитам, садиться на стенках эндотелия. Это дает возможность снизить риски повреждения вен. Благодаря специальной обработке – микронизированию, происходит быстрая абсорбация препарата в организме, что дает возможность ему действовать сразу же после употребления.
Показания к применению
Детралекс является препаратом узкого спектра действия, поэтому основными показаниям к его применению являются:
- Венозная недостаточность и реабилитационный период.

- Венозные язвы.
- Варикозное расширение вен.
- Геморрой (острый, хронический).
Детралекс также используют при подготовке больного к хирургическому удалению вен, а также в послеоперационный (реабилитационный) период.
Противопоказания и побочные свойства
Прием Детралекса противопоказан лишь при наличии у человека индивидуальной непереносимости одного из компонентов данного препарата. Беременность и период лактации не являются противопоказаниями.
Среди побочных действий, очень редко может возникать диспепсия, диарея. Иногда, при длительной терапии можно замечать нейровегетативные нарушения организма, которые не требуют лечения, так как они со временем проходят самостоятельно.
Способ применения
При лечении варикоза, венозной недостаточности, для устранения основных симптомов (боль в ногах, судороги, отечности, трофическая язва), принимают по одной таблетке, два раза в сутки, во время приема пищи. При необходимости, спустя некоторое время, дозировку могут повысить.
Для лечения геморроя, принимают 3 три таблетки однократно, 2 раза в сутки, на протяжении первых 4 дней. Далее, дозировку понижают до двух таблеток однократного приема, также дважды в сутки.
Длительность курса терапии, определяет врач, учитывая сложность заболевания и состояние организма.
Троксевазин
Троксевазин является ангиопротекторным препаратом, который воздействует, непосредственно на вены и капилляры. Основная форма выпуска – гель, от светло желтого, до интенсивно коричневого цвета. В 1 грамме геля содержится 20 мг действующего вещества (троксерутина). Троксевазин также бывает и в капсулах – 300 мг.
Фармакология
Троксевазин наделен Р-витаменной активностью, он способен тонизировать вены, снимать воспаление и отечности нижних конечностей, препятствует свертыванию крови в поврежденных сосудах, оказывает венопротекторное и антиоксидантное действие.
Нанося гель на определенный участок, активные компоненты моментально проникают сквозь эпидермис и уже через 20 минут попадают в дерму.
Помимо того, средство предотвращает окисление гиалуроновой и аскорбиновой кислот, препятствует перекисному окислению липидов.
Показания к применению
Производители отмечают следующие показания для применения Троксевазина:
- Варикозное расширение вен.
- Тромбофлебит.
- Перифлебит.
- Венозная недостаточность (включая хроническую).
- Периодические боли нижних конечностей, отечности, ощущение тяжести в ногах, спазмы, колики, образование сосудистых звездочек.
- Боли и отечность, возникшие в результате травм (при ушибах, переломах, растяжениях).
- Геморрой.

Троксевазин также часто используют при комплексной терапии, после операции по удалению варикозных узлов и склеротерапии вен.
Противопоказания и побочные свойства
Основным противопоказанием к применению Троксевазина, является наличие аллергии на компоненты, входящие в состав препарата. Не стоит также использовать гель при наличии повреждений кожных покровов (язв, ран, царапин).
Как правило, препарат не вызывает никаких побочных эффектов, но у людей, склонных к аллергическим реакциям на медикаменты, может возникать покраснение кожи, зуд, экзема или дерматит. Все эти симптомы проходят самостоятельно, спустя некоторое время после приостановления использования данного продукта.
Способ применения
Троксевазин гель применяют наружно. Его наносят непосредственно на проблемные участки дважды в день, равномерным слоем, аккуратно втирая его до его до полного впитывания. При необходимости, гель могут наносить в качестве компресса, под бинт или эластичное белье. Терапия длится от 3 до 7 дней. Капсулы принимают вовнутрь, во время приема пищи. Универсальная терапевтическая доза для взрослого человека на сутки, составляет 2 капсулы. Курс терапии может длиться до 4 недель.
Терапия длится от 3 до 7 дней. Капсулы принимают вовнутрь, во время приема пищи. Универсальная терапевтическая доза для взрослого человека на сутки, составляет 2 капсулы. Курс терапии может длиться до 4 недель.
Что общего между Детролексом и Троксевазином?
Два данных препарата имеют много общих черт:
- Эти средства оказывают благотворное воздействие на стенки кровеносных сосудов.
- Используют во время терапии венозной недостаточности.
- Значительно снижают болезненные симптомы проявления варикозных заболеваний.
- Облегчают болезненные ощущения при геморрое.
- Содержат множество различных, но принципиально одинаковых по своему воздействию на организм, веществ.
Детролекс и Троксевазин являются максимально эффективными в своей области, лекарственными препаратами, которые завоевали множество положительных отзывов и рекомендаций как среди врачей, так и среди пациентов.
В чем отличие?
Несмотря на одну область применения, оба препарата кардинально отличаются. В первую очередь, расхождение заключается в цене, так как стоимость данных препаратов значительно отличается.
В первую очередь, расхождение заключается в цене, так как стоимость данных препаратов значительно отличается.
Но, по сути, основной их отличительной чертой является степень воздействия. Детралекс, проникая в организм, влияет на проблему, непосредственно, изнутри, он имеет быструю степень всасывания и начинает действовать моментально. К тому же, лекарство обладает кумулятивным лечебным свойством – результат от использования препарата длится долго. Троксевазин попадает в плазму крови примерно через 2-3 часа, после применения.
Он оказывает лишь кратковременное действие, направленное на поддержание сосудистой ткани в тонусе и снятие основных симптомов. Хотя его эффективность очень высока, используют Троксевазин, в основном для устранения тяжелых болезненных симптомов (боли, отечности, синяков), в качестве дополнительного средства при комплексной терапии. Если же говорить о Троксевазине в капсулах, то его абсорбция организмом составляет всего 15%, что является очень низким показателем. Действующие вещества сохраняются в крови до 8, после чего выводятся вместе с мочой.
Действующие вещества сохраняются в крови до 8, после чего выводятся вместе с мочой.
Что лучше?
Дать однозначный ответ на поставленный вопрос невозможно. Каждое заболевание в условиях определенного организма является уникальным, поэтому невозможно сказать наверняка, какое средство будет максимально эффективным. Но исходя из теоретических данных, можно с уверенностью сказать, что Детралекс превосходит Троксевазин по своим показателям. Детралекс воздействует на проблему изнутри, восстанавливая поврежденные ткани сосудов на клеточном уровне, в то время как Троксевазин борется с основными симптомами. Но стоит помнить, что принять решение, какое из данных лекарств необходимо использовать, остается за лечащим врачом, который отталкиваясь от результатов исследования, назначит оптимальную терапию.
Что лучше «Детралекс» или «Троксевазин»: особенности и различия
Содержание статьи
Детралекс – ангипротективное вентонизирующее лекарственное средство, способствующее ускоренному восстановлению венозных и сосудистых тканей. Препарат улучшает тонус сосудов, снижая при этом их проницаемость. Выпускается в виде таблеток, ярко-оранжевого цвета. Одна таблетка содержит 500 мг действующего вещества.
Препарат улучшает тонус сосудов, снижая при этом их проницаемость. Выпускается в виде таблеток, ярко-оранжевого цвета. Одна таблетка содержит 500 мг действующего вещества.Фармакология
Действующее вещество – Диосмин, принадлежит к группе венотоников и ангиопротекторов. Под действие препарата, повышается венозный тонус, они становятся менее эластичными и не поддаются растяжению. Также повышаются геодинамические показатели, а стазовые явления сокращаются. Детралекс оказывает барьерную функцию, препятствуя лейкоцитам, садиться на стенках эндотелия. Это дает возможность снизить риски повреждения вен. Благодаря специальной обработке – микронизированию, происходит быстрая абсорбация препарата в организме, что дает возможность ему действовать сразу же после употребления.
Показания к применению
Детралекс является препаратом узкого спектра действия, поэтому основными показаниям к его применению являются:
- Венозная недостаточность и реабилитационный период.

- Венозные язвы.
- Варикозное расширение вен.
- Геморрой (острый, хронический).
Детралекс также используют при подготовке больного к хирургическому удалению вен, а также в послеоперационный (реабилитационный) период.
Противопоказания и побочные свойства
Прием Детралекса противопоказан лишь при наличии у человека индивидуальной непереносимости одного из компонентов данного препарата. Беременность и период лактации не являются противопоказаниями.
Среди побочных действий, очень редко может возникать диспепсия, диарея. Иногда, при длительной терапии можно замечать нейровегетативные нарушения организма, которые не требуют лечения, так как они со временем проходят самостоятельно.
Способ применения
При лечении варикоза, венозной недостаточности, для устранения основных симптомов (боль в ногах, судороги, отечности, трофическая язва), принимают по одной таблетке, два раза в сутки, во время приема пищи. При необходимости, спустя некоторое время, дозировку могут повысить.
Для лечения геморроя, принимают 3 три таблетки однократно, 2 раза в сутки, на протяжении первых 4 дней. Далее, дозировку понижают до двух таблеток однократного приема, также дважды в сутки.
Длительность курса терапии, определяет врач, учитывая сложность заболевания и состояние организма.
Троксевазин
Троксевазин является ангиопротекторным препаратом, который воздействует, непосредственно на вены и капилляры. Основная форма выпуска – гель, от светло желтого, до интенсивно коричневого цвета. В 1 грамме геля содержится 20 мг действующего вещества (троксерутина). Троксевазин также бывает и в капсулах – 300 мг.
Фармакология
Троксевазин наделен Р-витаменной активностью, он способен тонизировать вены, снимать воспаление и отечности нижних конечностей, препятствует свертыванию крови в поврежденных сосудах, оказывает венопротекторное и антиоксидантное действие.
Нанося гель на определенный участок, активные компоненты моментально проникают сквозь эпидермис и уже через 20 минут попадают в дерму. Это дает возможность препарату очень быстро снизить проницаемость капилляров, устранить ломкость и повысить их тонус. Также средство способно облегчать геморроидальные симптомы, такие как боль, жжение, зуд, кровотечение. За счет воздействия Троксевазина на резистентность тканей, он препятствует развитию диабетической ретинопатии, снижает риск образования микротромбов в сосудах.
Это дает возможность препарату очень быстро снизить проницаемость капилляров, устранить ломкость и повысить их тонус. Также средство способно облегчать геморроидальные симптомы, такие как боль, жжение, зуд, кровотечение. За счет воздействия Троксевазина на резистентность тканей, он препятствует развитию диабетической ретинопатии, снижает риск образования микротромбов в сосудах.
Помимо того, средство предотвращает окисление гиалуроновой и аскорбиновой кислот, препятствует перекисному окислению липидов.
Показания к применению
Производители отмечают следующие показания для применения Троксевазина:
- Варикозное расширение вен.
- Тромбофлебит.
- Перифлебит.
- Венозная недостаточность (включая хроническую).
- Периодические боли нижних конечностей, отечности, ощущение тяжести в ногах, спазмы, колики, образование сосудистых звездочек.
- Боли и отечность, возникшие в результате травм (при ушибах, переломах, растяжениях).
- Геморрой.

Троксевазин также часто используют при комплексной терапии, после операции по удалению варикозных узлов и склеротерапии вен.
Противопоказания и побочные свойства
Основным противопоказанием к применению Троксевазина, является наличие аллергии на компоненты, входящие в состав препарата. Не стоит также использовать гель при наличии повреждений кожных покровов (язв, ран, царапин).
Как правило, препарат не вызывает никаких побочных эффектов, но у людей, склонных к аллергическим реакциям на медикаменты, может возникать покраснение кожи, зуд, экзема или дерматит. Все эти симптомы проходят самостоятельно, спустя некоторое время после приостановления использования данного продукта.
Способ применения
Троксевазин гель применяют наружно. Его наносят непосредственно на проблемные участки дважды в день, равномерным слоем, аккуратно втирая его до его до полного впитывания. При необходимости, гель могут наносить в качестве компресса, под бинт или эластичное белье. Терапия длится от 3 до 7 дней. Капсулы принимают вовнутрь, во время приема пищи. Универсальная терапевтическая доза для взрослого человека на сутки, составляет 2 капсулы. Курс терапии может длиться до 4 недель.
Терапия длится от 3 до 7 дней. Капсулы принимают вовнутрь, во время приема пищи. Универсальная терапевтическая доза для взрослого человека на сутки, составляет 2 капсулы. Курс терапии может длиться до 4 недель.
Что общего между Детролексом и Троксевазином?
Два данных препарата имеют много общих черт:
- Эти средства оказывают благотворное воздействие на стенки кровеносных сосудов.
- Используют во время терапии венозной недостаточности.
- Значительно снижают болезненные симптомы проявления варикозных заболеваний.
- Облегчают болезненные ощущения при геморрое.
- Содержат множество различных, но принципиально одинаковых по своему воздействию на организм, веществ.
Детролекс и Троксевазин являются максимально эффективными в своей области, лекарственными препаратами, которые завоевали множество положительных отзывов и рекомендаций как среди врачей, так и среди пациентов.
В чем отличие?
Несмотря на одну область применения, оба препарата кардинально отличаются. В первую очередь, расхождение заключается в цене, так как стоимость данных препаратов значительно отличается.
В первую очередь, расхождение заключается в цене, так как стоимость данных препаратов значительно отличается.
Но, по сути, основной их отличительной чертой является степень воздействия. Детралекс, проникая в организм, влияет на проблему, непосредственно, изнутри, он имеет быструю степень всасывания и начинает действовать моментально. К тому же, лекарство обладает кумулятивным лечебным свойством – результат от использования препарата длится долго. Троксевазин попадает в плазму крови примерно через 2-3 часа, после применения.
Он оказывает лишь кратковременное действие, направленное на поддержание сосудистой ткани в тонусе и снятие основных симптомов. Хотя его эффективность очень высока, используют Троксевазин, в основном для устранения тяжелых болезненных симптомов (боли, отечности, синяков), в качестве дополнительного средства при комплексной терапии. Если же говорить о Троксевазине в капсулах, то его абсорбция организмом составляет всего 15%, что является очень низким показателем. Действующие вещества сохраняются в крови до 8, после чего выводятся вместе с мочой.
Действующие вещества сохраняются в крови до 8, после чего выводятся вместе с мочой.
Что лучше?
Дать однозначный ответ на поставленный вопрос невозможно. Каждое заболевание в условиях определенного организма является уникальным, поэтому невозможно сказать наверняка, какое средство будет максимально эффективным. Но исходя из теоретических данных, можно с уверенностью сказать, что Детралекс превосходит Троксевазин по своим показателям. Детралекс воздействует на проблему изнутри, восстанавливая поврежденные ткани сосудов на клеточном уровне, в то время как Троксевазин борется с основными симптомами. Но стоит помнить, что принять решение, какое из данных лекарств необходимо использовать, остается за лечащим врачом, который отталкиваясь от результатов исследования, назначит оптимальную терапию.
Что лучше «Детралекс» или «Троксевазин»: особенности и различия — все разницы и отличия на BigSovets.ru
Поделитесь ссылкой и ваши друзья придут к вам за советом! Спасибо ツ
аналоги, инструкция по применению, цена, отзывы
Детралекс относится к венотонизирующим и венопротекторным средствам, которые положительно влияют на показатели венозной гемодинамики. Препарат имеет широкий ряд аналогов, похожих по показаниям и терапевтическому эффекту.
Препарат имеет широкий ряд аналогов, похожих по показаниям и терапевтическому эффекту.
Фармакологическое действие
Производитель: ЛАБОРАТОРИЯ СЕРВЬЕ ИНДАСТРИ (Франция)
Форма выпуска: таблетки, суспензия
Действующее вещество: гесперидин, диосмин
Аналоги: Венарус, Флебодиа 600, Троксевазин
Детралекс обладает свойством уменьшать растяжимость вен и застойные явления в них, снижать проницаемость капилляров и повышать тонус венозных стенок. Действие медикамента приводит к улучшению микроциркуляции и оттока лимфы.
Показания к применению Детралекса
Назначается Детралекс при следующих заболеваниях:
- венозно-лимфатическая недостаточность, сопровождающаяся болью, тяжестью, отечностью, трофическими нарушениями, судорогами в нижних конечностях;
- острый и обострение хронического геморроя.
Детралекс часто используется в составе комплексной терапии и сочетается с наружным применением медикамента в виде мази или геля.
Детралекс — инструкция по применению
Согласно инструкции по применению Детралекса, медикамент назначается при венозно-лимфатической недостаточности по 1 таблетке 2 раза в день длительно, в течение нескольких месяцев. Курс лечения определяется врачом.
При остром геморрое дозировка лекарства составляет по 3 таблетки 2 раза в день в течение 4 дней с последующим ее снижением до 2 таблеток 2 раза в день коротким курсом в 3 дня.
Как принимать Детралекс: до или после еды
Детралекс следует принимать внутрь во время еды. Таблетка глотается без нарушения ее целостности и запивается достаточным количеством воды.
Аналоги Детралекса
Фармацевтическая промышленность производит достаточное количество зарубежных и российских аналогов Детралекса в таблетках при варикозе и для лечения геморроя. В аптечную сеть поступают они в виде:
- комбинированных средств:
- синонимов;
- дженериков.
Такое разнообразие аналогов Детралекса значительно расширяет возможности врача по подбору лекарственного средства, подходящего для каждого пациента с учетом клинических проявлений болезни.
Таблица аналогов Детралекса с ценой и страной производителем.
| Препарат | Стоимость в рублях | Страна производитель |
| Детралекс | 620-2075 | Франция |
| Венарус | 550-1650 | Россия |
| Флебодиа 600 | 670-1500 | Франция |
| Троксевазин | 220-400 | Болгария |
| Флебавен | 570-1200 | Россия |
| Ангиорус | 480-920 | Россия |
| Детравенол | 500-900 | Россия |
| Антистакс | 1150-1750 | Швейцария |
| Диосмин | 550-800 | Россия |
| Дафлон | 2400-3200 | Франция |
| Диовенгес | 500-900 | Россия |
| Ангионорм | 500-600 | Россия |
| Проктогливенол | 450-480 | Франция |
| Венолайф дуо | 460-880 | Россия |
| Лиотон | 400-950 | Германия |
Стоимость лекарств имеет широкий диапазон. Можно приобрести заменители Детралекса в таблетках подешевле и подороже. Цена на них будет зависеть от производителя и ингредиентов, входящих в состав препаратов. Но показания и терапевтический эффект будут равнозначными и не зависящими от их стоимости.
Можно приобрести заменители Детралекса в таблетках подешевле и подороже. Цена на них будет зависеть от производителя и ингредиентов, входящих в состав препаратов. Но показания и терапевтический эффект будут равнозначными и не зависящими от их стоимости.
Еще чем можно заменить Детралекс для лечения венозной недостаточности и геморроя? Дополнить список аналогов лекарства можно следующими медикаментами:
- Эскузан;
- Диоридинвел;
- Курантил;
- Венолекс;
- Венозол;
- Аскорутин;
- Гепарин;
- Трентал;
- Актовегин
Из списка аналогов Детралекса по цене в рублях есть медикаменты дешевле отечественного производителя и дороже. Какой препарат стоит приобрести, даст рекомендации врач с учетом клинических проявлений и степени тяжести болезни.
Детралекс или Венарус — что лучше и эффективнее при геморрое и варикозе
Производитель: АО ФП ОБОЛЕНСКОЕ (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин, гесперидин
Венарус и Детралекс имеют одинаковые активные вещества и механизм действия. Но лучшим при варикозе и геморрое будет Детралекс. Его действие в снижении активности заболевания наблюдается уже на 1 неделе, за счет способа изготовления лекарства, то есть процедуры микроионизирования. Для аналога Венаруса этот период увеличивается до 20 дней.
Но лучшим при варикозе и геморрое будет Детралекс. Его действие в снижении активности заболевания наблюдается уже на 1 неделе, за счет способа изготовления лекарства, то есть процедуры микроионизирования. Для аналога Венаруса этот период увеличивается до 20 дней.
По отзывам врачей, использование Детралекса предпочтительнее, если необходимо быстро снять острую симптоматику течения болезни с выраженным болевым синдромом.
Эффект от применения Детралекса усиливается в сочетании с наружными средствами применения.
Детралекс или Флебодиа 600 — что лучше при варикозе и геморрое
Производитель: ИННОТЕРА ШУЗИ (Франция)
Форма выпуска: таблетки
Действующее вещество: диосмин
Флебодиа и Детралекс имеют одинаковое активное вещество. Содержание диосмина в первом составляет 600 мг, а во втором – 450 мг. Детралекс будет лучшим при длительном лечении варикозного расширения вен на ранних (1–2) стадиях развития болезни. Его действие отличается мягкостью на ЖКТ и практически не провоцирует побочных явлений.
За счет более высокой концентрации активного вещества в Флебодиа, терапевтический эффект наступает быстрее, поэтому использование аналога Детралекса предпочтительнее при геморрое.
Детралекс или Троксевазин — что лучше и эффективнее при геморрое и варикозе
Производитель: БАЛКАНФАРМА ТРОЯН АД (Болгария)
Форма выпуска: капсулы, гель для наружного применения
Действующее вещество: троксерутин
Оба препарата имеют разные активные вещества и механизм действия. Детралекс и его аналог стимулируют кровоток, положительно влияют на проницаемость сосудистой стенки и снимают отечность тканей.
Эффективнее при тромбофлебите и варикозном расширении вен будет Троксевазин, так как он способен уменьшить риск образования тромбов и гематом. Дополнительная форма в виде геля аналога Детралекса, повышает терапевтический эффект при геморрое в его комбинации с капсулами, применяемыми внутрь.
При лимфовенозной недостаточности и геморрое, по отзывам врачей, лучшим будет Детралекс, который обладает в высокой степени тонизирующим действием на сосудистую стенку, улучшением лимфотока и быстрым купированием негативной симптоматики.
Детралекс или Флебавен — что лучше при варикозе
Производитель: ООО КРКА-РУС (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин, гесперидин
Флебавен – это дженерик Детралекса, активные вещества которых и механизм действия являются равнозначными. Оба медикамента разжижают кровь, стимулируют микроциркуляцию, устраняют застойные явления в венозной сети. Разница между этими препаратами заключается в производителе и цене.
Врачи чаще рекомендуют французский Детралекс, как лекарство c более высоким качеством очистки исходных ингредиентов. Пациенты, для длительной терапии поражения венозного русла больше склоняются к выбору его заменителя Флебавену. Приобрести можно российский аналог Детралекса при варикозе дешевле, но с равнозначным терапевтическим эффектом.
Детралекс или Ангиорус — что лучше при варикозе
Производитель: ОАО СИНТЕЗ (Россия)
Форма выпуска: таблетки
Действующее вещество: гесперидин, диосмин
Французский Детралекс и его российский аналог имеют одинаковые активные вещества и механизм действия. Но в импортном средстве концентрация действующих компонентов в 2 раза больше, чем в отечественном.
Но в импортном средстве концентрация действующих компонентов в 2 раза больше, чем в отечественном.
При варикозной болезни он будет лучшим, так как высокое содержание активного вещества в Детралексе быстрее восстанавливает частично утраченную функцию венозной системы. Преимуществом Ангиоруса является его меньшая стоимость и возможность использовать аналог для профилактики или длительного лечения варикозной болезни.
Детралекс или Детравенол — что лучше при геморрое
Производитель: ООО ОЗОН (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин, геперидин
Оба медикамента содержат одинаковые активные вещества и имеют равнозначный терапевтический эффект при лечении геморроя. Детралекс будет лучшим при острых симптомах заболевания. За счет высокой концентрации действующих веществ в короткие сроки снимается негативная симптоматика в виде боли, зуда, тяжести и дискомфорта в прямой кишке.
Этот аналог Детралекса 1000 в таблетках при геморрое также снимает проявления болезни, но в более продолжительное время. Он больше подходит для профилактики и предупреждения рецидива болезни. Преимуществом Детравенола является его бюджетная стоимость, поэтому выгодно приобрести для лечения аналог Детралекса дешевле при геморрое.
Он больше подходит для профилактики и предупреждения рецидива болезни. Преимуществом Детравенола является его бюджетная стоимость, поэтому выгодно приобрести для лечения аналог Детралекса дешевле при геморрое.
Детралекс или Антистакс — что эффективнее
Производитель: ГИНСАНА С. А. (Швейцария)
Форма выпуска: капсулы, гель для наружного применения
Действующее вещество: экстракт листьев красного винограда
Оба медикамента находят применение в лечении варикозной болезни и хронической венозной недостаточности. При сравнении обоих медикаментов, приоритет в терапевтическом эффекте будет за Детралексом. Своим действием препарат быстро купирует негативную симптоматику и улучшает состояние вен.
Его аналог Антистакс больше подходит в качестве профилактики и предупреждения рецидива болезни. Натуральный компонент активного вещества проявляет свою эффективность только при длительном применении медикамента.
Детралекс или Диосмин — что лучше и эффективнее при варикозе
Производитель: ЗАО КАНОНФАРМА ПРОДАКШН (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин
Диосмин и его аналог Детралекс имеют одно одинаковое активное вещество и показания к применению. Под действием обоих лекарств стихают воспалительные явления в сосудистой стенке, исчезают болевые ощущения и тяжесть в ногах, снижается риск образования тромбов.
Под действием обоих лекарств стихают воспалительные явления в сосудистой стенке, исчезают болевые ощущения и тяжесть в ногах, снижается риск образования тромбов.
Более эффективным и лучшим при варикозной болезни будет Диосмин. В составе этого аналога содержится большее количество активного вещества (600 мг). Диосмин более удобен в применении (однократный суточный прием) и продолжительность курса лечения составляет 2 месяца, а Детралекса – 3 месяца.
Детралекс или Дафлон — что лучше
Производитель: ЛАБОРАТОРИЕС СЕРВЬЕ (Франция)
Форма выпуска: таблетки
Действующее вещество: диосмин, гесперидин
Препараты имеют одинаковые активные вещества, показания и механизм действия. Разница заключается в составе их дополнительных ингредиентов. Детралекс более эффективно стимулирует венозный тонус, что приводит к снижению опасности формирования внутрисосудистых тромбов.
Под действием медикамента скорость кровотока становится быстрее, по сравнению с его аналогом Дафлоном. Такой механизм действия Детралекса обусловлен наличием повышенной концентрации крахмала и талька в составе средства. С этими ингредиентами скорость усвоения препарата возрастает, что ведет к более эффективному действию лекарства.
Такой механизм действия Детралекса обусловлен наличием повышенной концентрации крахмала и талька в составе средства. С этими ингредиентами скорость усвоения препарата возрастает, что ведет к более эффективному действию лекарства.
Детралекс или Диовенгес — что лучше при варикозе
Производитель: НПО ФАРМВИЛАР (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин, гесперидин
Диовенгес и Детралекс имеют равнозначные показания и механизм действия за счет одинаковых активных веществ, составляющих основу лекарственных средств. Врачи, при практическом применении Детралекса, отмечают его преимущество.
Детралекс многократно и положительно зарекомендовал себя в лечении лимфовенозной недостаточности, сопровождающейся патологической симптоматикой. Он будет лучшим в лечении варикоза. Российский аналог Диовенгес имеет преимущество в стоимости лекарства, поэтому его часто выбирают пациенты для длительного курса лечения.
Ангионорм
Производитель: НПО ООО ФАРМВИЛАР (Россия)
Форма выпуска: таблетки
Действующее вещество: ангионорм
Ангионорм относится к группе ангиопротекторов и корректоров микроциркуляции. Медикамент обладает противовоспалительными и антитромботическими свойствами, оказывает тонизирующее действие на венозную стенку, стимулирует почечный диурез. Аналог Детралекса эффективен при терапии тромбоза, тромбоэмболии, тромбофлебите.
Медикамент обладает противовоспалительными и антитромботическими свойствами, оказывает тонизирующее действие на венозную стенку, стимулирует почечный диурез. Аналог Детралекса эффективен при терапии тромбоза, тромбоэмболии, тромбофлебите.
Проктогливенол
Производитель: ДЕЛФАРМ УНИНЖ САС (Франция)
Форма выпуска: суппозитории, крем ректальные
Действующее вещество: трибенозид, лидокаин
Комбинированный аналог Детралекса для лечения геморроя Проктогливенол, обладает способностью уменьшать проницаемость капилляров и стимулировать сосудистый тонус. За счет активного компонента в составе аналога, эффективно снимается негативная симптоматика в виде боли, зуда, дискомфорта и тяжести в прямой кишке.
Венолайф Дуо
Производитель: АО АКРИХИН (Россия)
Форма выпуска: таблетки
Действующее вещество: диосмин, гесперидин
Аналог Детралекса 500 обладает венотонизирующим и ангиопротективным свойством. Венолайф дуо уменьшает растяжимость вен и застой крови в них, снижает проницаемость капилляров и повышает их резистентность при нарушении микроциркуляции крови. Аналог Детралекса эффективно купирует симптомы венозной недостаточности (боли, судороги, тяжесть в ногах).
Аналог Детралекса эффективно купирует симптомы венозной недостаточности (боли, судороги, тяжесть в ногах).
Лиотон
Производитель: БЕРЛИН-ХЕМИ А. МЕНАРИНИ ГРУПП (Германия)
Форма выпуска: гель для наружного применения
Действующее вещество: гепарин натрия
Аналог Детралекса является прямым коагулянтом для наружного применения. Лиотон, проникая через кожные покровы, уменьшает воспаление, предотвращает образование тромбов, улучшает микроциркуляцию. В результате действия аналога происходит уменьшение отечности, ускоряется рассасывание тромбов, улучшается тканевой обмен.
Правильно подобранный аналог Детралекса позволит в короткие сроки купировать клинику венозной недостаточности и геморроя, значительно увеличить ремиссию и предупредить нежелательные осложнения болезни.
Ответы на вопросы
Детралекс суспензия или таблетки — что лучше, в чем разница?
Детралекс в этих формах лекарства употребляется внутрь.
Разница между ними заключается в их дозировке. Суспензия содержит 1000 мг, а таблетки 500 мг активного вещества. Лучшей формой для приема Детралекса является суспензия, которая производится в упаковке в виде саше. Она готова к употреблению и не требует дополнительно запивать ее водой.
Суспензия Детралекса приятна на вкус и не вызывает дискомфорта. Ее удобно принимать в любом месте (на работе, на отдыхе или в пути).
Детралекс разжижает кровь или нет?
Детралекс относится к венотоникам, снижающим опасность образования внутрисосудистых тромбов. Это происходит за счет разжижения крови, что ведет к нормализации ее оттока.
Детралекс 1000 или 500 — что лучше?
Медикамент в дозировке 500 мг производится в таблетках, а 1000 мг – в суспензии. Детралекс с двойной дозой активного вещества будет более эффективным за счет большей концентрации препарата в плазме крови и его воздействия на патологически измененные вены.
Детралекс и алкоголь — можно совмещать или нет?
Алкоголь не совместим с приемом Детралекса, так как обладает противоположным препарату действием и нейтрализует лекарственный эффект. Злоупотребление алкоголем и прием Детралекса провоцирует обострение болезни и ведет к ее прогрессированию.
Детралекс — это БАД или лекарство?
Детралекс не относится БАДам, а является лекарственным средством.
Детралекс — это антикоагулянт или нет?
Детралекс не является антикоагулянтом. Это венотоник, действие которого направлено на сокращение времени прохождения крови по венам, укрепление стенок капилляров и предотвращение развития варикоза.
Детралекс саше или таблетки — что лучше?
По терапевтическому и практическому применению Детралекса, лучшим является форма саше, то есть одноразовая доза 1000 мг в плотном пакетике, которую удобно принимать непосредственно из упаковки.
Детралекс — это антибиотик или нет?
Нет, Детралекс не является антибиотиком.
Детралекс повышает давление или нет?
Детралекс не оказывает действия на артериальное давление.
Когда лучше принимать Детралекс: утром или вечером?
Принимать Детралекс лучше утром во время приема пищи для снижения раздражающего действия лекарства на слизистую оболочку желудка.
что лучше детралекс или троксевазин — 25 рекомендаций на Babyblog.ru
48 ПАР ПРЕПАРАТОВ С ИДЕНТИЧНЫМ СОСТАВОМ, НО ОЧЕНЬ РАЗНОЙ ЦЕНОЙ! ☝
💊 Нурофен (120руб) = Ибупрофен (10руб)
💊 Мезим (300руб) = Панкреатин (30руб)
💊 Но-шпа (150руб) = Дротаверина гидрохлорид (30руб)
💊 Панадол(50руб) = Парацетамол (5руб)
💊 Белосалик (380руб) = Акридерм СК (40руб)
💊 Бепантен (250руб) = Декспантенол (100руб)
💊 Бетасерк(600руб) = Бетагистин (250руб)
💊 Быструмгель (180руб) = Кетопрофен (60руб)
💊 Вольтарен (300руб) = Диклофенак (40руб)
💊 Гастрозол (120руб) = Омепразол (50руб)
💊 Детралекс (580руб) = Венарус (300руб)
💊 Дифлюкан (400руб) = Флуконазол (30руб)
💊 Длянос (100руб) = Риностоп(30руб)
💊 Зантак (280руб) = Ранитидин (30руб)
💊 Зиртек (220руб) = Цетиринакс (80руб)
💊 Зовиракс (240руб) = Ацикловир (40руб)
💊 Иммунал (200руб) = Эхинацеи экстракт (50руб)
💊 Имодиум (300руб) = Лоперамид (20 руб)
💊 Йодомарин (220руб) = Калия йодид (100руб)
💊 Кавинтон (580руб) = Винпоцетин(200руб)
💊 Кларитин (180руб) = Лорагексал (60руб)
💊 Клацид (600руб) = Кларитромицин (180руб)
💊 Лазолван (320руб) = Амброксол (20руб)
💊 Ламизил (400руб) = Тербинафин (100руб)
💊 Лиотон-1000 (350руб) = Гепарин-акригель 1000 (120руб)
💊 Ломилан (150руб) = Лорагексал (50руб)
💊 Максидекс (120руб) = Дексаметазон (40руб)
💊 Мидриацил (360руб) = Тропикамид (120руб)
💊 Мирамистин (200руб) = Хлоргексидин (10руб)
💊 Мовалис (410руб) = Мелоксикам (80руб)
💊 Нейромультивит (250руб) = Пентовит (50руб)
💊 Нормодипин (620руб) = Амлодипин (40руб)
💊 Омез (180руб) = Омепразол (50руб)
💊 Панангин (140руб) = Аспаркам (10руб)
💊 Пантогам (350руб) = Пантокальцин (230руб)
💊 Ринонорм (50руб) = Риностоп (20руб)
💊 Сумамед (450руб) = Азитромицин (90руб)
💊 Трентал(200руб) = Пентоксифиллин (50руб)
💊 Трихопол (90руб) = Метронидазол (10руб)
💊 Троксевазин (220руб) = Троксерутин (110руб)
💊 Ультоп (270руб) = Омепразол (50руб)
💊 Фастум-гель (250руб) = Кетопрофен (70руб)
💊 Финлепсин (280руб) = Карбамазепин (50руб)
💊 Флюкостат (200руб) = Флуконазол (20руб)
💊 Фурамаг (380руб) = Фурагин (40руб)
💊 Хемомицин (300руб) = Азитромицин (100руб)
💊 Энап (150руб) = Эналаприл (70руб)
💊 Эрсефурил (400руб) = Фуразолидон (40руб)
Detralex Комментарии по применению и возможностям
К сожалению, сегодня удел большинства мужчин и женщин — хроническая венозная недостаточность. А у некоторых первые признаки этой патологии начинают проявляться задолго до достижения тридцатилетнего возраста. Часто это связано с хроническими заболеваниями сердечно-сосудистой системы или с врожденной слабостью венозных стенок ног, а иногда просто с большими физическими нагрузками.
Если вы уже знакомы с чувством тяжести в ногах, которое обычно возникает по вечерам после долгого рабочего дня, или замечаете отечность в ногах, это, скорее всего, первый сигнал о том, что вены на ногах плохо с работой перекачки крови по сосудам.Когда в продаже появился новый препарат Детралекс, отзывы специалистов о его возможностях показали, что безоперационная терапия сделала большой шаг вперед. Большой диапазон хронической венозной недостаточности и лидирующее положение этого заболевания среди проблем сердечно-сосудистой системы заставляет фармакологическую промышленность постоянно выпускать все новые и новые лекарственные препараты для эффективной борьбы с этим заболеванием.
Однако до недавнего времени наиболее эффективным и оперативным вмешательством был и остается радикальный метод его лечения.Появившийся новый препарат Детралекс наконец вселяет надежду на то, что победить болезнь можно без операции на венах. На внутренних стенках вен расположены специальные клапаны, не позволяющие крови течь назад под действием силы тяжести. Эти клапаны работают плавно, когда обеспечивается стабильный диаметр вены. Но если стенки венозных сосудов теряют свой характерный тонус, то диаметр вены увеличивается и клапаны уже не могут перекрывать весь просвет сосуда.
В результате в венах появляются вены, которые серьезно ухудшают естественный кровоток по сосудам, это приводит к отекам и застою крови. При приеме Детралекса отзывы пациентов указывают на
Лечение варикозного расширения вен таблетками: названия и способы применения
Существующие таблетки от варикозного расширения вен можно разделить на несколько групп:
- Флеботоники, в состав которых входят Детралекс, а также Флебодиа и Венарус;
- Антикоагулянты — такие как аспирин и Кардиомагнетик;
- Препараты, предупреждающие развитие отеков: Веносмин;
- Антиагреганты — к этой категории относятся Курантил и ацетилсалициловая кислота;
- Препараты, устраняющие гиперпигментацию кожи: Гинкор форт или Актовегин;
- Антиоксиданты, в том числе Аскорутин;
- Фибринолитики, в состав которых входит гепарин.
Детралекс
Детралекс достаточно эффективно устраняет варикозное расширение вен — препарат обладает венотонизирующими свойствами, а кроме того способствует стабильной работе венозных клапанов при однонаправленном кровотоке и улучшении функции лимфотока. Также препарат способствует снижению проницаемости капилляров и устранению воспаления. В случае систематического применения таблеток степень варикозного расширения вен на ногах уменьшается. Прием лекарства позволяет снять клинические признаки венозной недостаточности — боль в нижних конечностях, отек и ощущение тяжести и нарушения чувствительности.
[3], [4]
Флебодиа
Таблетки Флебодиа 600 способствуют снижению степени проницаемости сосудов, повышению тонуса стенок капилляров, не позволяя им расширяться, и нормализуют кровоток. Действующее вещество препарата — диосмин. Также препарат обладает противовоспалительными свойствами.
[5]
Венера
Venus на основе диосмина и гесперидина очень эффективен на ранних стадиях развития варикозного расширения вен.Этот препарат практически не имеет противопоказаний, поэтому относится к категории безопасных. При расширении вен флебологи советуют проводить лечение сезонными курсами препарата. Венарус назначают при проблемах с кровообращением в сосудах. Благотворно влияет на расширенные вены, удаляет сосудистые ростки и замедляет развитие тромбофлебита.
Троксевазин
Троксевазин содержит активный компонент троксерутин, который помогает стабилизировать стенки кровеносных сосудов.
Препарат отлично справляется с воспалительным процессом, снижает проницаемость капилляров, а также оказывает венотонизирующее действие и снимает отечность. Обычно его назначают при венозной недостаточности в хронической форме, так как позволяет устранить судороги и боль, уменьшить отек и выраженность варикозных язв и трофических нарушений.
Свойства таблеток от варикозного расширения вен изучены на примере препарата Флебодиа.
Курс лечения Детралексом — эффективное лечение варикозного расширения вен любых участков
По статистике, среди наиболее частых жалоб, с которыми пациенты обращаются к сосудистому хирургу, является заболевание вен.Фармацевтический рынок постоянно пополняется современными фармацевтическими препаратами как отечественного, так и зарубежного производства. Многие из них предназначены для лечения заболеваний только венозной системы, в том числе такого распространенного заболевания, как геморрой. Действие этих препаратов, в основном, заключается в способности укреплять стенки кровеносных сосудов, уменьшать отек и воспаление и уменьшать кровотечение, что очень важно при лечении геморроя при обострениях. Одно из таких лекарств — Детралекс.
Курс лечения Детралексом Поможет снять боль, чувство тяжести и ночные судороги в ногах при хронической венозной и лимфатической недостаточности.Также медикаментозное лечение показано при острых приступах геморроя. Детралекс Интенсив способствует лимфодренажу и восстанавливает нормальную эластичность стенок вен и микроциркуляцию, в результате чего устраняется венозный застой, уменьшаются отеки, нормализуются обменные процессы в стенках сосудов и окружающих тканях.
Большинство пациентов, прошедших лечение Детралексом, Указывают на эффективность препарата при лечении как начальной стадии варикозного расширения вен любой локализации (геморрой, варикозное расширение вен пищеварительного тракта, ног), так и при запущенные случаи заболевания.При лечении тромбофлебита и тромбоза вен препарат назначают одновременно с антиагрегантными и тромболитическими средствами, а при кровотечениях — улучшают свертываемость крови. Детралекс, воздействуя на стенки сосудов, не влияет на свойства крови, что обусловило широкую область его применения.
Рекомендуется
Что делать, если у вас потрескалась кожа на руках?
Каждый из нас хоть раз в жизни сталкивается с небольшой, но очень, при этом, потрескавшейся кожей на руках.В это время появляются ранки разного размера, которые болят и доставляют неудобства, особенно при контакте с водой или моющими средствами. …
Абсолютная безвредность препарата для беременных не доказана, однако Детралекс при беременности применяется довольно часто. Детралекс — это растительный и действенный препарат, но не всегда можно рассчитать, как он подействует во время беременности. Бывают случаи, когда риск инфицирования или кровотечения в анусе настолько велик (геморрой), что курс лечения Детралексом пациентам назначают, однако никаких осложнений у плода или матери до сих пор не выявлено.Однако при назначении препарата врач-гинеколог или акушер-гинеколог должен взвесить в первую очередь все «за» и «против» этого назначения.
Для получения стойкого эффекта при варикозном расширении вен нижних конечностей курс лечения Детралексом Следует сочетать с ношением эластичных чулок, следить за массой тела, избегать длительного стояния, компенсировать отсутствие движений при физических нагрузках. .
Детралекс выпускается в виде таблеток продолговатой формы.Во время лечения острой фазы любого заболевания вен (любого вида) препарат следует принимать по схеме: по 2-3 шт. 2 раза в день. Продолжительность лечения определяется реакцией организма на терапию. После ремиссии острого действия препарат рекомендуется принимать 2 раза в день по одной таблетке (утром и вечером) в продолжении не менее 1 месяца.
Как принимать Детралекс, в каждом конкретном случае решает врач. Особенно важно соблюдать дозы препарата при беременности.Конечно, нельзя принимать препарат при индивидуальной непереносимости его компонентов. Не рекомендуется в период лактации, так как в медицине нет данных о выделении препарата с молоком.
Побочных эффектов от Детралекса практически не наблюдалось. Редко встречающиеся проблемы при его применении включают общее недомогание, тошноту, рвоту, головную боль, диарею.
Троксевазин и давление
Содержание
- 1 Состав и форма выпуска
- 2 Действует ли «ТРОКСИВАЗИН» от повышения артериального давления?
- 3 Способ применения и дозы
- 4 Противопоказания и побочные эффекты
«ТРОКСИВАЗИН» — базовый препарат, который должен быть в любой домашней аптечке.Но от чего помогает это лекарство? Обладает противовоспалительным действием и помогает при отеках, а также при всех варикозных заболеваниях. Это лекарство используется даже при лечении геморроя. Бытует мнение, что помогает при повышенном давлении и головных болях. Это так?
Состав и форма выпуска
Состав и форма препарата могут быть 2-х видов:
- гель для наружного применения;
- капсулы для приема внутрь.
В зависимости от этого различается количество действующего вещества — троксерутина. Согласно инструкции в капсулах его содержание составляет 300 мг, а в 2% геле — 20 мл. Состав активной формулы у геля и драже разный:
| Форма | Композиция | ||||||
| Капсулированный | Моногидрат лактозы и стеарата магния в небольших количествах | ||||||
| Гель | Карбонара, динатрий этилендиаминтетрауксусная кислота 13, очищенная хлорид 914124 90 90, триалконилхлорид 90, 9 Препарат в форме геля отпускается без рецепта врача, а в капсулах по назначению врача.Не назначайте его самостоятельно. Вернуться к содержаниюПрименяется ли «ТРОКСИВАЗИН» при повышенном артериальном давлении?Препарат в виде геля обильно наносят на тыльную поверхность шеи.Повышенное давление — серьезная проблема, многих беспокоящая. Врачи назначают «ТРОКСИВАЗИН» для лечения гипертонии и головных болей. Особенность приема «Траксивазина» при высоком давлении в том, что он не снижает давление однократно, а устраняет причину его повышения: улучшает кровообращение в головном мозге по венозному типу.Кроме того, «Траксивазин» назначают в качестве терапии сосудистых нарушений сетчатки глаза. Это касается людей, страдающих сахарным диабетом, артериальной гипертонией и атеросклерозом. Это средство используется как вспомогательный препарат. При лечении высокого кровяного давления гель часто используют и обильно наносят на заднюю часть шеи. Такая терапия эффективна для людей с повышенной чувствительностью к другим лекарствам или для беременных женщин, которые запрещены для многих препаратов. Способ применения и дозыСпособ применения и дозы
В отдельных случаях врачи назначают пить по 1 капсуле 1 раз в сутки для профилактики. Гель нужно наносить на пораженный участок в небольшом количестве, плавными массирующими движениями до полного впитывания. Эту процедуру рекомендуется проводить 2 раза в день: утром и вечером. При беременности количество процедур следует сократить до 1 раза в день. Терапия с использованием длительного геля — около месяца. Категорически нельзя наносить гель на поврежденную кожу (наличие ранок или трещин), в этом случае могут появиться побочные эффекты. Вернуться к оглавлениюПротивопоказания и побочные эффекты«Траксевазин» противопоказан людям, у которых есть аллергическая реакция на компоненты препарата. Не рекомендуется употреблять лекарство людям с гастритом и язвенной болезнью, кишечными проблемами и почечной недостаточностью. Что касается применения при беременности, то «Траксивазин» противопоказан только в первом триместре. Противопоказаний к применению «Траксивазина» в период кормления грудью не выявлено. Что касается побочных эффектов, то «Траксивазин» может спровоцировать появление кожных реакций: Оксфордская вакцина против коронавируса менее эффективна, чем Pfizer и Moderna, но имеет ряд преимуществ — BGR
Третий кандидат на вакцину от нового коронавируса, который, как ожидается, представит окончательные результаты к концу года, объявил промежуточные данные в понедельник, всего на пару недель позже, чем Pfizer и Moderna.Кандидат AstraZeneca / Oxford, который был в авангарде исследований вакцины COVID-19 наряду с препаратами Pfizer и Moderna, очень эффективен для предотвращения тяжелых заболеваний. Однако его эффективность не соответствует вакцинам Pfizer и Moderna, которые колеблются на уровне 95%. Pfizer уже опубликовал свои окончательные результаты, а по промежуточным данным Moderna вакцина эффективна на 94,5%. По промежуточным данным, оксфордская вакцина эффективна всего на 70%. Это значительно ниже, чем у Pfizer и Moderna, но все же это отличная новость для разработки вакцины против коронавируса.Эксперты в области здравоохранения, такие как доктор Энтони Фаучи, надеялись на вакцины от COVID-19, которые будут эффективны не менее 70%, что намного лучше, чем вакцины от гриппа. Более того, FDA установило 50% -ный порог одобрения вакцины, а 70% намного выше него. Вдобавок ко всему, препарат Оксфорд имеет несколько преимуществ перед другими препаратами, и ученые считают, что у них уже есть способ повысить эффективность до 90%. Лучшая сделка на сегодняСэкономьте 15% на одобренных FDA масках AccuMed KN95 — NIOSH утверждает, что они не хуже масок 3M N95. Цена по прейскуранту: 26 долларов.25 Цена: 22,32 доллара США Вы экономите: 3,93 доллара США (15%) Доступно на Amazon, BGR может получить комиссию. Купить сейчас AstraZeneca и Oxford объявили, что в их испытании фазы 3 был 131 случай COVID-19. Только 30 человек, получивших лекарство, были инфицированы, по сравнению с 101 в контрольной группе. Исследователи заявили, что в результате вакцина эффективна на 70%. Также следует отметить, что ни у одного из 30 человек не развилось тяжелое заболевание или не потребовалась госпитализация.Это также важный фактор для вакцин. Как мы уже узнали, главная цель вакцин первого поколения — предотвратить тяжелую форму COVID-19, которая может привести к смерти, а не полностью предотвратить болезнь. Ведущий исследовательОксфорда профессор Эндрю Поллард сказал BBC , что он действительно доволен результатами, поскольку «это означает, что у нас есть вакцина для всего мира». Исследователи также заявили, что эффективность составила 90% при анализе около 3000 добровольцев, которые сначала получили только половину дозы, а затем, по крайней мере, через месяц после этого была введена полноценная вторая доза.По словам Полларда, это было «интригующее» открытие. Это означало бы, что «у нас будет гораздо больше доз для распределения». Этот режим дозирования также был связан со снижением передачи, говорится в пресс-релизе Oxford . Исследователи обнаружили «более низкий уровень бессимптомной инфекции у вакцинированных», но в будущем будет доступно больше данных. AstraZeneca объявила в пресс-релизе, что не было никаких событий, связанных с безопасностью вакцины, и она хорошо переносилась при обоих режимах дозирования.Но никаких побочных эффектов в заявлении компания не указала. Полные научные данные еще не опубликованы в научном журнале. В отличие от мРНК-вакцин, разработанных BioNTech и Moderna, в оксфордской вакцине используется модифицированный вирус простуды, инфицировавший шимпанзе. Вирус был изменен так, что он не может реплицироваться внутри человека-хозяина, но иммунная система все еще вырабатывает ответ на него. Полученные нейтрализующие антитела и Т-клетки также будут распознавать настоящий коронавирус SARS-CoV-2 и предотвращать его заражение клеток. Оксфордская вакцина намного дешевле в массовом производстве, чем вакцины с мРНК, и ее можно хранить при обычных температурах холодильника. Для препаратов Pfizer и Moderna требуются отрицательные температуры, что может затруднить вакцинацию на некоторых рынках. Оксфордскую вакцину можно хранить и транспортировать при температуре 2-8 градусов по Цельсию, что составляет 36-46 градусов по Фаренгейту, и ее можно хранить не менее шести месяцев. Оксфорд планирует произвести до трех миллиардов доз в 2021 году. ВакцинаOxford скоро может быть одобрена для использования в экстренных случаях в Великобритании и других странах, и вскоре могут начаться кампании вакцинации, в первую очередь нацеленные на группы риска. Промежуточные данные основаны на исследованиях в Великобритании и Бразилии, в которых приняли участие более 23 000 добровольцев. Оксфорд также набрал добровольцев в США, Японии, России, Южной Африке, Кении и Латинской Америке и планирует испытания в Европе и Азии. Всего в нем примут участие до 60 тысяч волонтеров. Крис Смит начал писать о гаджетах как хобби, и, прежде чем он это осознал, он поделился своими взглядами на технические вопросы с читателями по всему миру.Когда он не пишет о гаджетах, ему с треском не удается держаться от них подальше, хотя он отчаянно пытается. Но это не обязательно плохо. Какие стратегии вакцинации и иммунные реакции более эффективны против ВИЧ-инфекции?1. Введение1.1. ВИЧ-инфекция и вакцинацияСогласно последним сообщениям, на конец 2013 года 35 миллионов человек жили с ВИЧ-1, подавляющее большинство из которых проживали в странах Африки к югу от Сахары с динамическими эпидемиями в Азии [1].ВИЧ-инфекция приводит к постепенной потере CD4 + Т-лимфоцитов, содержащих иммунную компетенцию, и прогрессированию СПИДа. Эффективное лечение комбинированными антиретровирусными препаратами снижает вирусную нагрузку ниже определяемого уровня, но не может устранить вирус из организма. Кроме того, успеху комбинированных антиретровирусных препаратов препятствует накопление токсичности лекарств и хроническая активация иммунной системы, что приводит к повышенному риску некоторых расстройств, не связанных со СПИДом, даже если репликация вируса подавлена.Следовательно, существует большая потребность в терапевтических стратегиях в качестве альтернативы комбинированным антиретровирусным препаратам [2]. Ожидается, что стратегии вакцинации против ВИЧ станут важнейшим компонентом борьбы с эпидемией ВИЧ [3, 4]. Иммунотерапия или терапевтическая вакцинация направлена на усиление существующих иммунных ответов против ВИЧ или стимуляцию иммунных ответов. Эти иммунные ответы должны обеспечивать эффективное лечение путем контроля репликации вируса и предотвращения прогрессирования заболевания в отсутствие комбинированных антиретровирусных препаратов [2].В последнее время особый интерес вызывают рентабельные и различные подходы к вакцине против ВИЧ-1. Считается, что как антитела, так и клеточно-опосредованные иммунные ответы важны для предотвращения инфицирования ВИЧ-1 в слизистой оболочке, то есть , точке входа для передачи половым путем [1]. Подавляющее большинство инфекций ВИЧ-1 происходит на слизистой оболочке во время полового контакта. Следовательно, важно обеспечить защиту слизистого барьера от этого проникновения путем вакцинации слизистой оболочки. Некоторые пути вакцинации через слизистые оболочки, такие как кишечные пероральные или интраназальные вакцины, имеют значительные препятствия, которые ограничивают эффективность вакцины или создают риски для безопасности.Напротив, сублингвальная область рта может обеспечить простой способ вакцинации слизистой оболочки иммуногенами, но этот участок не всегда вызывает сильные иммунные ответы, особенно при использовании белковых антигенов [5]. В настоящее время вакцины, индуцирующие антитела, являются основным направлением в области профилактических вакцин против ВИЧ [6]. Кроме того, терапевтические вакцины на основе Т-клеток сфокусированы на трех стратегиях: а) для увеличения уровней индуцированных вакциной ответов, б) для усиления ответов, нацеленных только на консервативные области вируса, и в) для использования репликационно-компетентных вирусные векторы [1].Как правило, противовирусные Т-клеточные и В-клеточные ответы играют решающую роль в подавлении репликации ВИЧ во время хронической инфекции [7, 8]. Новые подходы к лечению ВИЧ включают как обычные терапевтические вакцины (, то есть , стратегии активной иммунизации с использованием иммуногенов, происходящих от ВИЧ), так и использование блокаторов контрольных точек, таких как антитела против PD-1. Эти сложные терапевтические стратегии кажутся многообещающими подходами к борьбе с ВИЧ-инфекцией [7]. Самым большим препятствием для многих вакцин является изменчивость патогена.Таким образом, исследования должны быть дополнительно сосредоточены на функционально наиболее консервативных областях белков, общих для многих вариантов, включая ускользающие мутанты, индуцирующие как антитела, так и Т-клеточные иммунные ответы. Для векторных вакцин «универсальные» субъединичные иммуногены эффективно доставляются с использованием гетерологичных схем первичной бустерной вакцинации, которые могут быть дополнительно улучшены с использованием адъювантов и подходов к доставке [9–11]. В нескольких исследованиях описана разработка вакцинных стратегий, включая улучшенные белки оболочки, содержащие мощные адъюванты, ДНК и векторы, экспрессирующие мозаику или консервативные последовательности, способные вызывать сильные релевантные иммунные ответы, такие как нейтрализующие антитела (NAb) и ненейтрализующие антитела, CD4 + и CD8 + клеточно-опосредованные иммунные ответы, иммунные ответы слизистых оболочек и иммунологическая память.Тип иммунного ответа, вызываемого различными иммуногенами, также может коррелировать с риском заражения ВИЧ. Например, антитела IgG к петле V2 gp120 связаны со сниженным риском ВИЧ-инфекции, тогда как антитела IgA, специфичные к Env, напрямую связаны с повышенным риском [12]. Как правило, комбинация двух независимых подходов, включающая индукцию широко нейтрализующих антител (bNAb) для предотвращения или уменьшения заражения и стимуляцию эффективных CTL-ответов, является в настоящее время используемой техникой для замедления прогрессирования заболевания на ранней стадии инфекции [13]. Вкратце, спустя более 20 лет после открытия ВИЧ, исследователи пытаются разработать защитную вакцину против СПИДа. Проблема заключается в отсутствии базовых знаний об иммунологических требованиях для защиты от ВИЧ. Разнообразие вирусов и ускользание от иммунных реакций являются наиболее важными проблемами при разработке эффективной вакцины против ВИЧ. В этой главе мы представим проблемы при разработке вакцины против ВИЧ биологически и иммунологически. Кроме того, будут описаны различные стратегии вакцинации, чтобы определить лучшие стратегии, уже ориентированные на ВИЧ-инфекцию.В этой строке впервые будет продемонстрирована взаимосвязь между биологией ВИЧ и иммунитетом. 2. Иммуноген-индуцированные нейтрализующие антитела (NAbs)Наиболее распространенные тесты на ВИЧ-инфекции основаны на обнаружении антител против вируса. Таким образом, эти тесты могут также обнаруживать антитела, индуцированные кандидатной вакциной против ВИЧ. Обнаружение вакцин-индуцированных антител к ВИЧ с помощью серологических тестов называется вакцино-индуцированной серореактивностью (VISR) [6]. Нейтрализующие антитела полезны для идентификации нейтрализующих эпитопов вакцины и для понимания механизма сильной и широкой перекрестной нейтрализации, тем самым обеспечивая профилактическую и терапевтическую ценность [14, 15].Было показано, что некоторые NAb обеспечивают защиту от неонатальной инфекции ВИЧ-1 [16]. Были разработаны различные типы иммуногенов Env ВИЧ-1, которые экспрессируют эпитопы широко нейтрализующих антител и их предшественников. Для тримера Env ВИЧ-1 предложены три новые структуры, которые будут более иммуногенными, чем использовавшиеся ранее иммуногены: а) минимальные иммуногены, которые являются фрагментами Env-нейтрализующих эпитопов ВИЧ-1, б) промежуточные иммуногены Env ( например, , мономерный Env gp120) и в) различные формы тримеров Env [17].На сегодняшний день эти структуры не были способны заставить иммунную систему генерировать bNAb после вакцинации. Таким образом, для успешной вакцинации против ВИЧ-1 и индукции bNAb потребуется повторная иммунизация в течение длительного времени [17]. Текущие исследования ВИЧ-положительных пациентов с использованием сильно нейтрализующих сывороток показали, что иммунная система способна вырабатывать антитела, нейтрализующие до 90% штаммов ВИЧ [18]. Нейтрализующие антитела связываются с консервативными сайтами gp120, и идентификация этих сайтов может помочь в разработке эффективных вакцин.Гликозилированные остатки (или углеводы) играют ключевую роль из-за связывания широко нейтрализующих антител с углеводами и объединения углеводных и пептидных элементов на gp120. Однако углеводы частично покрывают некоторые пептиды на поверхности оболочки, распознаваемые bNAbs. Таким образом, использование сконструированных гликопротеинов в качестве вакцин для стимуляции bNAb является предметом интереса при разработке вакцины против ВИЧ [18]. Ответы антител на гликопротеины оболочки ВИЧ-1 можно разделить на две группы: а) ненейтрализующие ответы, направленные на пептидные эпитопы, экспрессируемые на изолированных гликопротеинах оболочки, но не на нативных тримерах оболочки, ответственных за опосредование проникновения вируса в клетки-мишени; б) широко нейтрализующие ответы антител, направленные на эпитопы, экспрессируемые на тримерах нативной оболочки.В настоящее время выделено много мощных нейтрализующих антител широкого спектра действия для стимуляции профилактических и терапевтических действий на животных моделях. Эти антитела помогают нам улучшить дизайн вакцины и терапевтические стратегии против ВИЧ-1 [19]. Недавняя характеристика новых эпитопов для стимуляции широко нейтрализующих антител стимулировала исследования по синтезу новых антигенных конструкций для разработки вакцин, направленных против ВИЧ [20]. Таким образом, важным шагом в разработке вакцины является определение антител и эпитопов, связанных с широкой нейтрализацией ВИЧ.Действительно, иммуногены и / или протоколы иммунизации должны быть разработаны для увеличения созревания аффинности антител [1]. Что касается исследований, gp120 оболочки ВИЧ-1 является мишенью для нейтрализации антител против вируса. Конверт gp120 ВИЧ-1 демонстрирует большую степень вариабельности, что является серьезной проблемой для разработки вакцин против ВИЧ / СПИДа. Различные подходы использовались для повышения иммуногенности широко нейтрализующих эпитопов на gp120 ВИЧ-1 с ограниченным успехом [21].Например, иммуногенность gp120 и его эпитопов V3 увеличивалась, когда gp120 совместно инъецировали с моноклональными антителами (mAb) в сайты связывания CD4 (CD4bs). Действительно, комплекс gp120 / CD4bs является мощным иммуногеном для индукции перекрестно-реактивных функциональных NAb против эпитопов V3 [21]. Напротив, проксимальная внешняя область мембраны (MPER) субъединицы gp41 гликопротеина оболочки ВИЧ-1 (Env) включает эпитопы для распознавания bNAb в качестве важной области при разработке вакцины. Однако создание иммуногена для индукции bNAb в MPER затруднено из-за относительной недоступности MPER в нативной конформации Env [22].Следовательно, группа олигомерных иммуногенов gp41 была сконструирована для дальнейшего экспонирования MPER в подходящей конформации. Иммуногены включали различную длину N-гептады gp41 и вставку дополнительных эпитопов и гибких С-концов. Эти иммуногены использовали в двух различных стратегиях иммунизации, включая белки gp41 / gp140 и ДНК gp41 / gp160, связанные с различными адъювантами и способами. Было замечено, что иммуногены gp41 вызывают более высокие уровни MPER, чем иммуногены gp140. В стратегиях прайм-буста наилучшие ответы MPER были показаны в группах, получавших ДНК gp41, а затем белок gp41.Некоторые агенты могут влиять на иммуногенность MPER, такие как способ иммунизации, доза или адъювант. Как правило, эти данные подталкивают исследователей к разработке иммуногенов MPER с оптимизированными протоколами иммунизации [22]. Кроме того, агрегация вирионов ВИЧ-1 была обнаружена с помощью антител (IgG) к гликопротеину вирусной оболочки (Env). Нейтрализующие антитела, направленные на основание V3 и гликан-зависимый эпитоп на gp120 и на вершину тримера Env, а также ненейтрализующие антитела к кластеру эпитопа I на gp41-эктодомене могут агрегировать вирионы, но нейтрализующие антитело 2G12, которое специфично для гликан-зависимого моновалентного эпитопа на gp120, не могло агрегироваться.Эти данные потенциально могут открыть путь для разработки вакцины против ВИЧ-1 [23]. 3. Профилактические вакцины против ВИЧИсследования показали, что успешная вакцина-кандидат должна вырабатывать широкие антитела, нацеленные на белок Env. Были разработаны иммуногены, нацеленные на gp120, которые блокируют инфекцию у обезьян. Попытки вызвать персистирование антител осложнялись увеличением количества клеток-мишеней ВИЧ [24]. RV144, состоящий из первичной вакцины против канареечной оспы ALVAC-HIV (vCP1521) и бустера AIDSVAX®gp120 B / E, был первой вакциной против инфекции ВИЧ-1, полученной в клинических испытаниях [1, 25].Анализ индуцированных вакциной иммунных ответов у вакцинированных-инфицированных и вакцинированных-неинфицированных добровольцев показал, что IgG, специфичный для области V1V2 gp120, был связан со сниженным риском заражения ВИЧ-1, а Env IgA в плазме был напрямую связан с риском инфицирования. Таким образом, исследования RV144 показали, что Env необходим и, возможно, достаточен для стимуляции защитных ответов антител против ВИЧ-1, приобретенного через слизистую оболочку. Были запланированы испытания эффективности в гетеросексуальных популяциях на юге Африки и в Таиланде [1].Как правило, исследования приматов показывают, что Env является необходимым компонентом для успешной защиты от вирусных инфекций. Используются два подхода для индукции защиты, опосредованной Env-специфическими антителами: а) вакцины, которые вызывают сильные и широко реактивные нейтрализующие антитела против вирусов, которые распространены среди людей, б) вакцины, которые вызывают нейтрализацию антител только в менее распространенных штаммах ВИЧ. , но которые блокируют инфекцию ВИЧ-1 с помощью ненейтрализующих (nNAbs) механизмов [26, 27].Одни только мономерные белки оболочки ВИЧ-1 gp120 не смогли защитить людей из группы высокого риска от инфекции. Фактически, уровень и ширина выявленных NAb были недостаточными для защиты [1]. Более того, результаты показали, что IgG к линейным эпитопам в областях V2 и V3 gp120 является частью сложного взаимодействия иммунных ответов, которые вносят вклад в защиту RV144 [28]. В RV144 Env IgG3 коррелировал со снижением риска ВИЧ-инфекции, ответ, который быстро снижался по сравнению с общими ответами IgG.Действительно, уровни Env-специфических ответов IgG3 и V1 / V2 IgG3 были высокими, и, наоборот, ответы IgG4 были значительно низкими у реципиентов вакцины RV144. Эти данные показали, что V2 IgG играет роль в защите от ВИЧ-1 инфекции. Как правило, увеличение величины, аффинности, широты и, что важно, частоты и устойчивости V2- и V3-специфических антител подклассов IgG3 и IgG1 может обеспечить более высокий и надежный уровень защиты от инфекции ВИЧ-1. Индукция перекрестно-реактивного V1V2-специфического IgG поднимает гипотезу о кросс-кладовой защите.Дополнительные ревакцинации могут повысить уровень антител. Остаточные антитела против gp120 были обнаружены через 6-8 лет после вакцинации у вакцинированных против RV144. Дополнительное усиление увеличивало плазменные IgG-антитела gp120 и gp70 V1 / V2 с титрами выше, чем у RV144, при этом индуцировались слабые ответы gp120 IgA. Эти ВИЧ-специфические антитела IgG также были обнаружены в ректальном секрете, в то время как IgA не обнаруживались [29–34]. Что касается исследований, то антитела к ВИЧ, способные предотвращать бесклеточную или межклеточную передачу ВИЧ через слизистые оболочки, имеют решающее значение для разработки эффективных профилактических и терапевтических вакцин.Взаимодействие между антигенпрезентирующими клетками (APC) и ВИЧ приводит к передаче ВИЧ от клетки к клетке. В экспериментальной модели макака данные показали, что широко нейтрализующие антитела способны нейтрализовать широкий спектр штаммов ВИЧ, предотвращать передачу от клетки к клетке и защищать от инфекции [35]. Кроме того, опосредованное IgG-рецептором Fcg (FcgR) ингибирование антител на участке слизистой оболочки может играть роль в защите от передачи ВИЧ через слизистые оболочки. Напротив, IgA-антитела слизистых оболочек могут быть эффективными для защиты от передачи ВИЧ половым путем.Таким образом, определение ингибирующих эффектов антител имеет решающее значение для оценки защиты вакцин против ВИЧ [35]. Кроме того, большинство антител против различных вирусных белков описывают маркер (общий идиотоп), который распознается моноклональным антителом 1F7. Этот общий идиотип антител, индуцированных ВИЧ-1, был задействован в механизме иммунной памяти, связывающем ранние и поздние антитела, так называемый эффект обратного усиления. Этот вывод был подтвержден аутоантителами, которые связываются с идиотопом 1F7 в сыворотках ВИЧ-1-инфицированных людей.Экспрессия общего идиотопа в антителах может обеспечить стратегию стимуляции В-клеток, отобранных для выработки антител против ВИЧ-1 и ВГС, что предполагает их значение для разработки вакцины [36]. Использование сильнодействующих адъювантов может также усиливать антиген-специфические ответы антител. Несколько адъювантов были протестированы на нечеловеческих приматах и людях, что свидетельствует о значительном преимуществе белков оболочки ВИЧ, содержащих адъюванты MF59 и AS01. Исследование показало, что квасцы защищают макак от заражения вирусом обезьяньего иммунодефицита (SIV) mac251, в то время как MF59 не защищает, несмотря на его способность вызывать более высокие системные Т-клеточные и антительные ответы.Связанные с адъювантом различия в хоминге плазмобластов и индукции ключевых клеточных сигнальных путей могут объяснять эти эффекты. Состав gp120 ВИЧ-1 с MPLA и квасцами индуцировал значительно более высокие уровни нейтрализующих антител и лимфопролиферацию Т-клеток по сравнению с квасцами, MF59 или только MPLA. Важно отметить, что антитела к gp70 V1V2 (подтипы B, C и CRF01 AE) индуцировались быстрее, с большей величиной и большей стойкостью, чем gp120 с квасцами с адъювантом [37–42].Кроме того, композиция антигенов с твердыми наночастицами может продлить продолжительность ответа антител за счет увеличения локального удерживания антигена в тканях, вызывающих ответы B-клеток, усиления презентации антигена дендритными клетками (DC) и развития CD4 + Th-клеток, которые обеспечивают цитокины и сигналы, которые необходимы для инициации соматической гипермутации и созревания аффинности для эффективной памяти В-клеток [1]. Кроме того, оценивалась способность двух адъювантов слизистой оболочки, включая α-галактозилцерамид (α-GalCer) в качестве мощного стимулятора Т-клеток естественных киллеров (NK) и CpG-олигодезоксинуклеотид (CpG-ODN) в качестве агониста TLR9, для усиления иммунных ответов. против антигена оболочечного белка ВИЧ-1 клады C gp140.Результаты показали, что CD4 + и CD8 + Т-клеточные ответы в системных тканях и тканях слизистой оболочки были значительно выше у мышей, иммунизированных gp140 в присутствии либо α-GalCer, либо CpG-ODN, и дополнительно усиливались при использовании обоих адъювантов. . Кроме того, использование двух адъювантов и особенно их комбинации эффективно повышало уровни gp140-специфических сывороточных IgG и вагинальных антител IgA. Ответы Т-клеток памяти, обнаруженные через 60 дней после иммунизации, показали, что α-GalCer более эффективен, чем CpG-ODN, а комбинация адъювантов α-GalCer и CpG-ODN была более эффективной, чем любой из них по отдельности [5].Другой подход называется разработкой вакцины B-клеточного происхождения. В этой линии рекомбинантные антитела, принадлежащие членам bNAb, использовали для определения конструкций оболочки ВИЧ-1 в качестве иммуногенов в стратегии первичного бустера. Эти конструкции оболочки используют репертуар наивных B-клеток, находящихся в костном мозге и вторичных лимфоидных тканях in vivo , и впоследствии стимулируют эволюцию B-клеток до тех пор, пока не будут вызваны клетки, продуцирующие bNAb [43, 44]. Предшественники В-клеток nNAb активируются и интернализируют Env по сравнению с предшественниками В-клеток bNAb.Отчеты показали, что рациональные модификации иммуногена могут снижать активацию наивных B-клеток, которые приводят к таким nNAb, одновременно способствуя активации наивных B-клеток, что приводит к bNAb с реверсией зародышевой линии [43, 44]. У ВИЧ-инфицированных был идентифицирован ряд мощных нейтрализующих антител широкого спектра действия, хотя создание bNAb с использованием традиционных подходов к вакцинам было неясным. Исследователи протестировали однократную дозу 3BNC117 или 10-1074 (mAb, специфичные для CD4-связывающего сайта и области V3 соответственно), а также комбинацию обоих антител.Данные показали полное снижение вирусной нагрузки после инфузии у макак, инфицированных вирусом обезьяньего иммунодефицита человека (SHIV). Другой подход к генерации bNAbs состоит в том, чтобы обойти «нормальные» иммунные ответы и заставить нелимфоидные клетки продуцировать bNAbs in vivo с использованием генной терапии. Векторная иммунопрофилактика (VIP) — это метод генной терапии, при котором трансгены, кодирующие bNAb, доставляются непосредственно в мышечную ткань, где продуцируются bNAb. Два недавних исследования на животных продемонстрировали, что VIP может генерировать умеренные титры NAb, которые могут эффективно предотвращать in vivo ВИЧ-инфекцию в гуманизированной модели ВИЧ-инфекции костный мозг – тимус – печень (BLT) и модели инфекции макак с иммунодефицитом обезьян [7].Недавние открытия показали, что широко нейтрализующие антитела, доставляемые аденоассоциированным вирусом (AAV), могут подавлять репликацию ВИЧ. В самом деле, однократная инъекция AAV может вызвать долгосрочные реакции антител в качестве терапевтического подхода при отсутствии антиретровирусных препаратов. Индукция опосредованных вектором антител может ингибировать передачу от клетки к клетке и репликацию ВИЧ. Этот результат представляет собой альтернативу дизайну вакцины на основе иммуногена и новое терапевтическое вмешательство, позволяющее осуществлять определенные манипуляции с гуморальным иммунитетом [45, 46]. Проблемой для разработки иммуногена ВИЧ-1 является индукция нейтрализующих антител против устойчивых к нейтрализации вирусов (уровень 2), которые контролируют передачу вируса от человека. Растворимый рекомбинантный тример гликопротеина оболочки ВИЧ-1, обладающий нативной конформацией (BG505 SOSIP.664), мог бы индуцировать NAb мощно против вируса уровня 2 с согласованной последовательностью у кроликов, но более слабые и сходные ответы у макак. Тример также стабильно стимулировал перекрестно-реактивные NAb против более чувствительных (Tier-1) вирусов.NAbs уровня 2 распознают конформационные эпитопы, которые различаются между животными и в некоторых случаях перекрываются с эпитопами, распознаваемыми широко нейтрализующими антителами, тогда как ответы уровня 1 нацелены на линейные эпитопы V3. Второй тример, B41 SOSIP.664, также вызывал сильный аутологичный ответ на NAb уровня 2 у кроликов. Таким образом, нативные тримеры могут представлять собой многообещающую отправную точку для разработки вакцин против ВИЧ-1, направленных на индукцию bNAb [47]. Цель вакцины против ВИЧ — генерировать устойчивые и стойкие защитные антитела.Таким образом, важно индуцировать CD4 + Т-фолликулярные хелперные (TFH) клетки. Однако очень мало известно об ответе TFH на вакцинацию против ВИЧ и его относительном вкладе в величину и качество титров антител, вызванных вакциной [48]. В этой линии макакам-резус вводили ДНК / модифицированную вакцину вируса осповакцины Ankara SIV с усилением gp140 гидроксидом алюминия и без него. Исследования показали, что бустерная иммунизация модифицированным вирусом осповакцины Анкара вызывает отчетливое и временное накопление пролиферирующих CD4 T-клеток CXCR5 + и CXCR5 — в крови на 7-й день после иммунизации, и частота первых, но не последний коррелировал с TFH и ответами B-клеток в зародышевых центрах лимфатического узла.Кроме того, бустер gp140 вызывал перекос в сторону экспрессии CXCR3 на клетках TFH зародышевого центра, что было тесно связано с продолжительностью жизни, авидностью и потенциалом нейтрализации вызванного вакциной ответа антител. Однако клетки CXCR3 + предпочтительно экспрессировали корецептор ВИЧ CCR5, и индуцированные вакциной клетки CXCR3 + CXCR5 + показали умеренную положительную связь с пиковым уровнем вирусемии после инфицирования SIV251. Эти данные продемонстрировали, что схемы вакцинации, вызывающие смещенные по CXCR3-клеточные ответы TFH, способствуют персистенции и авидности антител, но могут вызывать более высокую острую виремию при раннем инфицировании [48, 49]. Обычно считается, что широко нейтрализующие антитела, специфичные для консервативных эпитопов на оболочке ВИЧ-1 (Env), необходимы для защиты от множества кладов ВИЧ-1. Недавно была разработана вакцина против ВИЧ, включающая в себя молекулярный адъювант, активирующий фактор B-клеток (BAFF) и лиганд, индуцирующий пролиферацию (APRIL), с потенциалом для облегчения созревания полиреактивных и аутореактивных B-клеток, а также для повышения аффинности и / или авидность Env-специфических антител.Результаты показали, что иммунизация мышей ДНК-вакциной, кодирующей мультитримеры BAFF или APRIL, вместе с IL-12 и мембраносвязанным Env gp140 ВИЧ-1, индуцировала нейтрализующие антитела против вирусов уровня 1 и 2. Вакцина, содержащая APRIL, была особенно эффективна для генерирования нейтрализующих антител уровня 2 после иммунизации протеином. Примечательно, что BAFF и APRIL не вызывали размножения B-клеток или увеличения общего IgG. Таким образом, мультитримеры BAFF и APRIL были предложены как перспективные молекулярные адъюванты для индукции bNAb против ВИЧ-1 инфекции [50]. 4. Стимуляция клеточно-опосредованных иммунных ответовУспешная вакцина против ВИЧ должна либо полностью предотвращать инфекцию, либо устранять первый цикл инфицированных CD4 Т-клеток до того, как образуется латентный пул ВИЧ-инфицированных клеток. Таким образом, эффективная вакцина против ВИЧ требует высоких уровней защитного иммунитета во время контакта вируса с хозяином, и она не может полагаться на иммунные ответы памяти. CD8 Т-клетки могут эффективно убивать ВИЧ-инфицированные Т-клетки, но в большинстве случаев острой ВИЧ-инфекции вирус быстро ускользает.Например, активность CTL CD8 против ВИЧ способна элиминировать инфицированные вирусом Т-клетки в условиях вакцинации аттенуированным цитомегаловирусом резуса (rhCMV), содержащим гены вируса иммунодефицита обезьян, но в условиях острой ВИЧ-инфекции передаваемый / основатель вирус обычно ускользает от контроля Т-лимфоцитов CD8 [51]. Ответы CTL, направленные на специфические белки ВИЧ (, например, , Gag), были связаны с относительным контролем репликации вируса in vivo . В модели внутривенного заражения SIVmac251 ширина распознавания эпитопа Gag CTL коррелировала с контролем пика виремии [1].Эти данные продемонстрировали, что CD8 + Т-клетки связаны с контролем и искоренением ранних ретровирусных инфекций [17]. Испытания вакцины были сосредоточены на том, могут ли вакцины, вызывающие клеточно-опосредованный иммунный ответ, предотвращать инфекцию или снижать постинфекционную вирусную нагрузку в плазме [1]. У вакцинированных с аллелями HLA, связанными с контролем ВИЧ-1, средняя вирусная нагрузка с течением времени была значительно ниже. Интересно, что наиболее консервативные эпитопы выявлялись с меньшей частотой, что позволяет предположить, что более сильные ответы на консервативные последовательности могут быть столь же важны, как и широта охвата для защиты [52, 53].Интересно отметить, что схемы первичной буст-буст-вакцинации гетерологичных векторов повышали иммунитет за счет увеличения величины, начала и многофункциональности иммунных ответов, опосредованных вставкой, по сравнению с гомологичными схемами [54]. Новый прогресс был достигнут в преодолении разнообразия ВИЧ-1 за счет индукции перекрестно-реактивных Т-клеточных ответов на ВИЧ-1 с помощью вакцин, разработанных in silico (называемых консервативными и мозаичными вакцинами) [17]. Поливалентные мозаичные иммуногены, полученные путем рекомбинации природных штаммов ВИЧ-1, были разработаны для индукции клеточных иммунных ответов, которые распознают генетически разнообразные изоляты циркулирующего вируса.Увеличение широты и глубины узнавания эпитопа может способствовать защите от заражения генетически разнообразными вирусами, а также контролю над вариантными вирусами, которые появляются по мере того, как они мутируют, не распознавая CTL. Например, мозаичные антигены Gag, Pol и Env ВИЧ-1, экспрессируемые векторами Ad26, заметно увеличивали как ширину, так и глубину без ущерба для величины антигенспецифических ответов Т-лимфоцитов по сравнению с антигенами ВИЧ-1 с консенсусной или природной последовательностью в резусе. обезьяны [55, 56].Альтернативой поливалентным вакцинам дикого типа или мозаичным вакцинам является использование иммуногенов с консервативными элементами в качестве новой и эффективной стратегии для расширения ответов против очень разнообразных патогенов, избегая при этом эпитопов-ловушек, одновременно концентрируя внимание на критических вирусных элементах, для которых существует несколько путей ускользания. Праймирование консервативными элементами, усиленное полным иммуногеном, индуцировало широкий клеточный и гуморальный иммунитет, сфокусированный на консервативных областях вируса. Напротив, полноразмерные иммуногены ВИЧ-1 вызывали большую величину и сопоставимую широту ответов Т-лимфоцитов на консервативные области ВИЧ-1 по сравнению с иммуногенами ВИЧ-1 только с консервативными областями у макак-резусов [57, 58]. Важным моментом является использование реплицирующего вектора. Компетентная к репликации вакцина на основе цитомегаловируса-резуса, экспрессирующая белки SIV, индуцировала и поддерживала высокую частоту SIV-специфических CD4 + и CD8 + ответов эффекторной памяти Т-клеток на внелимфоидных участках без измеримых ответов антител на SIV. Половина вакцинированных обезьян продемонстрировала строгий контроль над тремя путями передачи SIVmac239, включая интраректальный, интравагинальный и внутривенный. Сохранение определенных цитотоксических эпитопов действительно делает их хорошими кандидатами для глобальной вакцины против ВИЧ-1 [59, 60]. 5. Терапевтические вакцины против ВИЧНедавние исследования были сосредоточены на улучшении эффективных профилактических и терапевтических подходов к борьбе со стойкими вирусными инфекциями. Терапевтические вакцины против ВИЧ-инфекции должны быть направлены на выработку противовирусных Т-клеток CD8 (CTL), Т-клеток CD4 и нейтрализующих антител, поскольку эти иммунные ответы контролируют репликацию вируса [7, 61]. Очень важно генерировать широкие клеточные ответы, поскольку ВИЧ очень быстро мутирует, чтобы избежать иммунной системы. Кроме того, недавние исследования показали, что Т-фолликулярные хелперы представляют собой значительный источник продукции вируса и вносят вклад в общий вирусный резервуар.Поскольку эти клетки находятся в В-клеточных фолликулах / зародышевых центрах, может быть критически важно генерировать Т-клетки CD8, которые могут быть домом для В-клеточных фолликулов и оказывать на них иммунный ответ. ВИЧ-специфический ответ Т-клеток CD4 также важен для поддержания функциональных ответов Т-клеток и В-клеток CD8. Однако эти ВИЧ-специфические CD4 Т-клетки также могут служить потенциальными мишенями для репликации вируса [7]. Интересно, что CD4 T-клетки с цитолитической функцией, как было показано, связаны с усиленным вирусным контролем, хотя показано, можно ли стимулировать эти ответы вакцинацией.Функция дендритных клеток также может иметь решающее значение для создания защитного клеточного и гуморального иммунного ответа, поскольку хронические ВИЧ-инфекции связаны с нарушением функции DC. Таким образом, в терапевтических вакцинах может также потребоваться использование таких стратегий, как адъюванты, для усиления функции врожденного иммунитета [7]. Уже использовалось несколько стратегий терапевтических вакцин, таких как живые ослабленные микробы, вирусные векторы и вакцины на основе дендритных клеток, которые привели к подавлению и / или устранению инфекций.Среди них улучшенные ДНК-вакцины оказались многообещающим кандидатом для лечения инфекционных заболеваний, особенно ВИЧ-инфекции [61–63]. Некоторые стратегии были рассмотрены для улучшения иммунных ответов, стимулированных ДНК-вакцинами, таких как in vivo, эффективных систем доставки ДНК, совместная доставка с молекулярными адъювантами, а также разработка эффективных гетерологичных схем первичной бустерной вакцинации [61, 62, 64]. ДНК-вакцины использовались в качестве вакцин-кандидатов против ВИЧ из-за их способности генерировать клеточные и гуморальные иммунные ответы, отсутствия анти-векторного ответа, позволяющего повторное введение, и их способности стимулировать ответ на вакцины с вирусным вектором.Поскольку эпидемия ВИЧ необоснованно повлияла на развивающийся мир, благоприятный профиль термостабильности, а также относительная простота и низкая стоимость производства ДНК-вакцин предлагают дополнительные преимущества. In vivo Электропорация (EP) использовалась для улучшения иммунных ответов на ДНК-вакцины в качестве кандидатных вакцин против ВИЧ-1 или в схемах первичной буст-вакцинации как с белками, так и с вакцинами с вирусным вектором на нескольких животных моделях, а недавно и в клинических испытаниях на людях. [65]. Кроме того, хорошо переносилась интрадермальная электропорация ДНК ВИЧ.Сильные иммунные ответы, опосредованные клетками и антителами, вызывались режимом первичной вакцинации ВИЧ и ВИЧ-модифицированной вакцины Ankara (MVA) с использованием внутрикожной электропорации или без нее [66]. ДНК-вакцины обладают внутренним уклоном в сторону создания клеточного иммунитета против внутриклеточных патогенов. Манипулируя составом ДНК и доставкой, можно также вызвать эффективные ответы антител. Например, исследования показали, что у обезьян, иммунизированных ДНК-вакциной, развивались ВИЧ-специфические Т-клеточные иммунные ответы, которые сохранялись в течение месяцев [62]. Ранее сообщалось об использовании живых аттенуированных инвазивных бактерий в качестве носителя для вакцин на основе ДНК [67]. Было показано, что иммунизация рекомбинантными инвазивными бактериями, включая Shigella , Salmonella и Listeria , несущих вакцины плазмидной ДНК (пДНК), индуцирует защитные иммунные ответы у мышей. Использование кишечных бактерий человека особенно полезно из-за их способности инфицировать слизистую оболочку толстой кишки человека и их тропизма к активации дендритных клеток и макрофагов внутренней слизистой оболочки.Таким образом, они очень эффективны для доставки ДНК-вакцин к APC в слизистой оболочке, что приводит к стимуляции сильных системных и местных иммунных ответов. Такие реакции могут иметь решающее значение для разработки эффективной профилактической вакцины против ВИЧ, поскольку большое количество ВИЧ передается через слизистые оболочки человека [67]. Например, живой аттенуированный штамм Salmonella typhimurium был использован для пероральной доставки плазмиды и показал адъювантную роль за счет высвобождения различных цитокинов [68].Кроме того, интраназальная иммунизация мышей живыми рекомбинантными клетками Shigella индуцировала Gag-специфический клеточный иммунный ответ ВИЧ, аналогичный тому, который наблюдается при внутримышечной инъекции голой ДНК. Важно отметить, что сильный бустер-эффект был получен у мышей, примированных ДНК, что свидетельствует об эффективности бактериальных векторов в схемах первичной бустерной вакцинации [67]. Исследования показали, что новая система доставки вакцины с использованием бактериальных призраков (BG) может рассматриваться как эффективная и нетоксичная система доставки ДНК-вакцин in vitro, и , in vivo, .В этой линии была разработана новая стратегия доставки вакцины против ВИЧ с использованием бактериальных призраков Salmonella typhi, Ty21a. Данные показали, что BG Ty21a, нагруженные ДНК-вакциной gp140 ВИЧ (Ty21a BG-ДНК), легко захватываются клетками макрофагов мыши (RAW264.7), и gp140 эффективно экспрессируется в этих клетках. Ответы антител против gp120 периферических и кишечных слизистых оболочек у мышей, вакцинированных вакциной BGs – ДНК, были значительно выше, чем у мышей, иммунизированных вакциной «голая ДНК».Усиление ответа антител было связано с индуцированной BG продукцией IL-10 через путь TLR4 [69]. Аттенуированные вирусные вакцины традиционно были эффективными и относительно простыми в производстве и доставке. Вакцинация живым вирусом приводит к высокому внутриклеточному синтезу вирусных белков. Эта экспрессия на высоком уровне стимулирует сильные клеточные и гуморальные иммунные ответы и приводит к образованию долговременных В- и Т-клеток памяти. Однако аттенуированные вакцины против ВИЧ сильно реплицируются в моделях на животных, чтобы сохранить остаточную вирулентность.Недавние исследования показали, что праймирование с помощью ДНК-вакцины вызывает ответ Th2, который может быть усилен путем последующего введения вирусного вектора, кодирующего тот же ген. Эта стратегия прайм-буста вызвала сильный защитный иммунитет на нескольких моделях приматов [70]. В настоящее время иммуногенность высокоаттенуированного вируса коровьей оспы с низкой нейровирулентностью, штамма LC16m8, изучается в качестве вектора вакцины против ВИЧ. Данные показали, что рекомбинантная вакцина на основе вируса осповакцины (vLC-Env) в сочетании с ДНК-вакциной, экспрессирующей ген env ВИЧ (pCAG-Env), вызывает защитный иммунный ответ против ВИЧ-инфекции у мышей BALB / c.Вакцинация только vLC-Env вызвала гораздо более высокие ВИЧ-специфические гуморальные и клеточные иммунные ответы, чем вакцинация pCAG-Env. Праймирование с помощью pCAG-Env дополнительно усиливало иммунные ответы, индуцированные vLC-Env, особенно клеточно-опосредованный иммунный ответ. Кроме того, введение мышам дендритных клеток, инфицированных vLC-Env, вызывало сильный клеточный иммунный ответ. Эти результаты продемонстрировали, что прайминг pCAG-Env и бустинг vLC-Env представляет собой потенциального кандидата для вакцинации против ВИЧ-инфекции [70].В нескольких исследованиях использовались DC, представляющие либо аутологичный вирус, либо вирусные пептиды в качестве терапевтических вакцин (вакцин на основе DC) для макак и людей. Они также показали, что подобный подход может успешно контролировать репликацию ВИЧ у людей. Точно так же недавнее исследование показало, что эффективный ВИЧ-1-специфический иммунный ответ может быть вызван с использованием аутологичного переноса DC из моноцитов (MDDC). Таким образом, ВИЧ-специфические иммунные ответы могут быть вызваны терапевтическими вакцинациями на основе DC.В целом терапевтические вакцинации следует рассматривать как комбинированную терапию с другими иммуномодуляторами для достижения функционального излечения (, т.е. , долгосрочный контроль репликации вируса в отсутствие антиретровирусной терапии) [7]. Растет интерес к роли антител против ВИЧ-зависимой клеточной цитотоксичности (ADCC) в профилактике ВИЧ-инфекции и борьбе с ней. Исследования пассивного переноса на макаках подтвердили роль области Fc антител в предотвращении инфекции вируса иммунодефицита обезьян и человека.Испытание вакцины против ВИЧ-1 RV144 в Таиланде индуцировало антитела против ADCC к ВИЧ, которые могут играть роль в наблюдаемой частичной защите. Несколько исследований показали роль антител к ADCC в замедлении прогрессирования ВИЧ-инфекции. Однако ВИЧ эволюционирует, чтобы избежать антител к ADCC, а хронические ВИЧ-инфекции вызывают дисфункцию эффекторных клеток, таких как естественные клетки-киллеры, которые опосредуют функции ADCC. Кроме того, четыре недавних исследования показали, что белок ВИЧ-1 Vpu , способствуя высвобождению вирионов, снижает способность антител к ADCC распознавать ВИЧ-инфицированные клетки [71].Напротив, трансактиватор транскрипции ВИЧ-1 (Tat) является ключевым фактором вирулентности ВИЧ, который играет критическую роль в экспрессии вирусных генов, репликации, передаче и прогрессировании заболевания. Результаты показали, что индуцированные Tat иммунные ответы необходимы для восстановления иммунного гомеостаза, блокирования восполнения и уменьшения размера вирусного резервуара. Антитела против Tat редко встречаются при естественной инфекции и, если они присутствуют, коррелируют с бессимптомным состоянием и приводят к более низкому или отсутствию прогрессирования заболевания.Следовательно, нацеливание на Tat представляет собой вмешательство, управляемое патогенезом [72]. 6. АдъювантыХотя важность ДНК-вакцин, особенно в качестве первичной иммунизации, была хорошо доказана в различных исследованиях вакцин против ВИЧ, иммуногенность ДНК-вакцин в целом умеренная. Новый адъювант необходим для повышения иммуногенности ДНК-вакцины [73]. Несколько групп продемонстрировали возможность совместного введения плазмидной ДНК, которая экспрессирует цитокины, хемокины или костимулирующие молекулы, вместе с плазмидами, кодирующими целевые вирусные антигены [74].Эффективность ДНК-вакцин может быть повышена путем совместной доставки кодируемых плазмидой молекулярных адъювантов. ПДНК, кодирующие гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гематопоэтический фактор fms-подобный лиганд тирозинкиназы 3 (Flt-3L) и интерлейкин-12 (IL-12), могут заметно усиливать клеточно-опосредованные иммунные ответы, вызываемые вакцина на основе пДНК ВИЧ-1 env у мышей BALB / c [74]. Плазмида GM-CSF также усиливала иммунные ответы, вызываемые ДНК-вакцинами, экспрессирующими HIV-1 Gag и Nef-Tat-Vif.Кроме того, использование pGM-CSF в качестве адъюванта вакцины, по-видимому, увеличивает антиген-специфические пролиферативные ответы и процент полифункциональных Т-клеток памяти CD8 + . Совместная доставка pFlt-3L с pGM-CSF не приводила к дальнейшему увеличению адъювантной активности. Однако совместное введение pGM-CSF с pIL-12 значительно усиливало Env-специфические пролиферативные ответы и эффективность вакцины на мышиной модели заражения вирусом осповакцины по сравнению с мышами, иммунизированными вакциной pDNA env с адъювантом pGM-CSF или только pIL-12 [74].В другом исследовании совместное введение ДНК-вакцины ВИЧ-1 с pIL-12 и pGM-CSF путем местного нанесения на кожу увеличивало уровни как ВИЧ-специфического ответа цитотоксических Т-лимфоцитов, так и гиперчувствительности замедленного типа (ГЗТ). . Действительно, кожа доступна для генерации иммунных ответов как при внутрикожной инъекции, так и при местном использовании векторов доставки генов [75]. Кроме того, совместное введение плазмид, кодирующих оптимизированную по кодонам последовательность GM-CSF с ДНК-вакциной Gag ВИЧ-1, приводило к сильному антителу и ответу CTL и защитному иммунному ответу против инфекции рекомбинантным вирусом осповакцины , экспрессирующим ВИЧ-1. Кляп [76].Напротив, исследователи решительно поддерживают использование IL-6 или IL-15 в качестве цитокинового адъюванта при вакцинации ДНК против ВИЧ. Данные показали, что интраназальное введение ДНК-вакцины и pIL-15 может усиливать Th2-зависимый ВИЧ-1-специфический клеточный иммунитет. Однако совместная инъекция pIL-15 с pIL-2 или pIL-12 не показала синергетического эффекта на иммунные ответы, индуцированные ДНК-вакциной in vivo [77]. Кроме того, иммуногенность ДНК-вакцины против ВИЧ-1, экспрессирующей химерный ген Gag-gp120 (pVAX1-Gag-gp120), была увеличена путем совместной инокуляции pVAX1-IL6 мышам BALB / c [78].Исследования продемонстрировали, что внутрикадровое слияние фактора некроза опухоли альфа (TNF-α), ДНК с ДНК, кодирующей большой фрагмент gp120 ВИЧ, может усиливать иммунные ответы Th2 против антигена gp120. Кроме того, слияние в рамке считывания ДНК, кодирующей IFNγ, на 5′-конце химерной молекулы для создания трехчастичного слияния не имело дополнительного эффекта на иммуногенность [79]. Ряд исследований показал, что α-галактозилцерамид, лиганд естественных киллеров Т-клеток (NKT), применялся в качестве адъюванта для различных вакцин, включая вирусные, паразитарные и белковые вакцины.Α-GalCer был способен усиливать ответы антител к ВИЧ. Более того, совместное введение α-GalCer с субоптимальными дозами ДНК-вакцин значительно увеличивало антиген-специфические Т-клеточные ответы CD4 + и CD8 + . Уровень клеточно-опосредованных иммунных ответов у мышей, вакцинированных 5 мкг ДНК в присутствии α-GalCer, был подобен таковому у мышей, вакцинированных 50 мкг ДНК в отсутствие α-GalCer [80]. Рекомбинантные адъюванты, состоящие из слияния поверхностно-активного протеина-D (SP-D) и лиганда CD40 (CD40L) или лиганда GITR (GITRL), как ранее было показано, усиливают ДНК-вакцины Gag ВИЧ-1.Было продемонстрировано, что подобные слитые конструкции, состоящие из лигандов суперсемейства TNF (TNFSFL), включая 4-1BBL, OX40L, RANKL, LIGHT, CD70 и BAFF, также могут усиливать иммунные ответы на ДНК-вакцину Gag ВИЧ-1. Важно отметить, что конструкции SP-D-4-1BBL, SP-D-OX40L и SP-D-LIGHT увеличивали авидность Т-клеток CD8 + и пролиферацию Т-клеток CD8 + / CD4 + через 7 недель после вакцинация [81]. Кроме того, конструкции SP-D-OX40L, SP-D-LIGHT и SP-D-BAFF увеличивают секрецию Gag-специфического IL-2 в Т-клетках памяти, что свидетельствует об их способности увеличивать количество самообновляющихся Gag-специфических CD8. + и CD4 + Т-клетки.Наконец, адъюванты SP-D-OX40L и SP-D-CD70 усиливали ответы антител IgG2a, но не IgG1, у иммунизированных животных. Интересно, что белок BAFF, активирующий В-клетки, не усиливал ответы антител против Gag при введении в качестве адъюванта слияния SP-D, но усиливал ответы Т-клеток CD4 + и CD8 + . Действительно, различные слитые конструкции SP-D-TNFSFL могут усиливать иммунные ответы после ДНК-вакцинации плазмидой экспрессии Gag ВИЧ-1 [81]. Несколько исследований показали, что взаимодействия 4-1BB и 4-1BB лиганда (4-1BBL) важны для индукции устойчивых ответов CTL, а также долгоживущих Т-клеток памяти.Недавно плазмидные ДНК, экспрессирующие либо мембраносвязанную, либо растворимую форму 4-1BBL, были сконструированы для усиления вакцины Gag ДНК в качестве адъюванта. Данные показали, что ДНК 4-1BBL увеличивает Gag-специфический IgG и клеточный иммунный ответ. Важно отметить, что экспрессия Gag и 4-1BBL из одной плазмиды была критической для адъювантной активности [82]. Чтобы улучшить иммуногенность ДНК-вакцин, некоторые исследования были сосредоточены на слитном антигене иммуноглобулина (Ig). Эти отчеты показали, что плазмиды, кодирующие цитокины, слитые с Ig, имеют более высокую эффективность экспрессии и лучшую адъювантность.Кроме того, эти плазмиды обладают свойствами, которые делают их полезными, такими как увеличение периода полужизни in vivo , образование поливалентного антигена и солюбилизация гидрофобных белков [83]. Возможность усиления gp120-специфических клеточных иммунных ответов ВИЧ определяли на мышах с использованием ДНК-вакцины, кодирующей фрагмент мышиного Ig, слитый с gp120 в двух направлениях (gp120-Ig или Ig-gp120). Анализ экспрессии in vitro показал, что эффективность экспрессии белка gp120 ВИЧ была выше в клетках, трансфицированных плазмидой, кодирующей gp120-Ig (pGp120Ig), чем в клетках, трансфицированных плазмидами экспрессии gp120 и Ig-gp120 (pGp120 и pIgGp120, соответственно. ).Плазмида, кодирующая gp120-Ig, выявляла больше ВИЧ-специфичных Т-клеток CD8 + и эффекторных Т-клеток памяти CD8 + , чем pGp120 у иммунизированных мышей. Кроме того, pGp120Ig значительно снижал вирусную нагрузку после заражения вирусом осповакцины , экспрессирующим gp160 ВИЧ, вирусом осповакцины . Эти результаты показали, что ковалентная модификация антигена с помощью последовательности Ig может модулировать антиген-специфические клеточные иммунные ответы [83]. И наоборот, фракция полисахаридов и нуклеиновых кислот, экстрагированная из бациллы Mycobacterium bovis Calmette-Guérin (BCG-PSN), может быть использована в качестве нового адъюванта ДНК-вакцины для индукции мощных клеточных и гуморальных иммунных ответов против антигена Env ВИЧ-1 в организме человека. Модель мыши BALB / c.В этом эксперименте BCG-PSN смешивали с 10 мкг или 100 мкг ДНК-вакцины и вводили внутримышечно два или три раза. Коиммунизация BCG-PSN с помощью 10 мкг ДНК-вакцины могла вызывать клеточные и гуморальные иммунные ответы, которые были сопоставимы с реакциями, вызываемыми одной 100 мкг ДНК-вакциной. Более того, BCG-PSN может активировать сигнальные пути TLR и индуцировать секрецию цитокинов Th2-типа. Эти данные позволяют предположить, что BCG-PSN можно применять в качестве нового и эффективного адъюванта для ДНК-вакцинации [73]. Хемокины — это в значительной степени биоактивные воспалительные молекулы, которые играют важную роль в различных иммунных и воспалительных реакциях, действуя в основном как хемоаттрактанты и активаторы различных лейкоцитов.Кроме того, некоторые хемокины играют решающую роль в передаче и развитии вирусов ВИЧ-1 и ВИЧ-2, вызывающих СПИД. Недавние исследования показали, что хемокины и их рецепторы могут играть важную роль в дифференцировке и размножении Т-клеток в ответ на активацию иммунной системы. Эти регуляторные свойства хемокинов делают их пригодными в качестве молекулярных адъювантов [84]. Например, модуляцию и регуляцию иммунных ответов оценивали по совместной доставке двух β-хемокинов в виде кассет экспрессии генов, MIP-1α или RANTES, вместе с иммуногенными конструкциями ДНК ВИЧ-1.Данные показали, что MIP-1α оказывает наибольшее влияние на ответы антител. Кроме того, коэкспрессия MIP-1α также модулировала сдвиг иммунных ответов на Th3-тип (, т.е. , увеличение соотношения IgG1 / IgG2a). Коиммунизация RANTES также увеличивала уровни антиген-специфических ответов Th2 и CTL. Использование вакцин с хемокиновым адъювантом в качестве модуляторов вакцины против ВИЧ может быть важным из-за интересной взаимосвязи между проникновением в клетки ВИЧ и рецепторами для β-хемокинов. Действительно, β-хемокины в качестве адъювантов вакцины увеличивают продукцию β-хемокинов антиген-специфическим образом [84]. 7. Стратегии гетерологичного прайм-бустаВ большинстве современных ДНК-вакцин используются промоторы CMV, β-актина или мышечно-специфичного десмина для усиления экспрессии одного или двух слитых генов ВИЧ-1, включая Env, Gag, Pol , и Тат. ДНК-вакцины, содержащие несколько плазмид, кодирующих разные белки ВИЧ-1, использовались для получения более широкого спектра иммунитета, чем отдельные плазмиды, экспрессирующие отдельные белки. Использование этих вакцин с плазмидной ДНК оказалось безопасным и иммуногенным для макак; однако эти конструкции необходимо было усилить вирусными белками, экспрессируемыми различными векторными системами, включая рекомбинантный вирус оспы , модифицированный вирус осповакцины Анкара и аденовирус для повышения их эффективности в предотвращении СПИДа [85]. Гетерологичный режим первичного бустера использует способность иммунной системы генерировать большое количество вторичных антиген-специфичных Т-клеток после начальной стадии прайминга. В дальнейшем один и тот же антиген доставляется с использованием разных векторов. После первичной иммунизации популяции антиген-специфичных Т-клеток развиваются до умеренных уровней, а затем уменьшаются. Действительно, часть этих клеток трансформируется в антиген-специфические Т-клетки памяти. При гетерологичном бустере, поскольку векторы прайминга и бустинга различаются, Т-клетки, которые специфически нацелены на вирусный вектор, не усиливаются и не активируют механизмы контроля количества клеток, что, таким образом, способствует большему развитию популяций антиген-специфичных Т-клеток [ 82].В настоящее время несколько групп установили, что гетерологичные схемы первичной бустерной вакцинации являются наиболее эффективными стратегиями для индукции клеточного иммунного ответа [86, 87]. В режиме примирования плазмидной ДНК-вакцины и режима усиления вирусного вектора важен порядок ДНК, за которым следует рекомбинантный вирус, поскольку обратный порядок не индуцирует более высокие уровни антиген-специфичных Т-клеток CD8 + . Кажется, что цитокиновое микроокружение, созданное локальной вирусной инфекцией во время бустинга, отвечает за эффективное размножение эффекторных Т-клеток [86].В 2004 г. на 30 макаках была проведена оценка последовательной стратегии иммунизации, включающей праймирование ДНК и бустинг рекомбинантными вакцинами против вируса оспы птиц (rFPV), кодирующими несколько общих антигенов ВИЧ-1. Вакцины хорошо переносились, и наблюдалось значительное усиление реакции Т-лимфоцитов, примированных ДНК-вакциной, после бустинга rFPV. Совместная экспрессия IFNγ или IL-12 с вакцинами rFPV не усиливала дополнительно иммунные ответы [88]. Кроме того, совместная иммунизация плазмидной ДНК gp160 ВИЧ подтипа A или B и тримерного гликопротеина Env gp140 превосходила иммунизацию одним гликопротеином за счет усиления нейтрализующих антител.Эти данные показали, что совместная доставка ДНК и белка может усиливать ответ антител на Env. Следовательно, этот подход может упростить схемы вакцинации за счет индукции более высоких ответов антител с использованием меньшего количества вакцинаций, что является преимуществом для успешного дизайна вакцины против ВИЧ [89]. Отчеты показали, что совместная иммунизация ДНК-вакцины, кодирующей ВИЧ-1P24-Nef, с GM-CSF в стратегии ДНК-прайминга и пептидной бустерной иммунизации увеличивает иммуногенность вакцины-кандидата. Исследования цитокинового профиля показали, что уровни как IL-4, так и IFN-γ были увеличены.Кроме того, совместная иммунизация с GM-CSF привела к более высокому уровню общего IgG, содержащему примерно равные уровни как специфических подтипов IgG1, так и IgG2a. Взятые вместе, результаты позволяют предположить, что GM-CSF способен вызывать долгосрочную память для вакцины-кандидата от ВИЧ-1 P24-Nef [90]. В недавних исследованиях для иммунизации против ВИЧ использовались схемы ДНК / белок или ДНК / адено-вектор. Существенные механизмы гетерогенных схем прайма / бустера не совсем понятны, но праймирование ДНК приводит к гораздо более низкой экспрессии антигена по сравнению с белковыми вакцинами, и это может стимулировать ответы Т-хелперных клеток с гуморальным ответом, который впоследствии усиливается высокими дозами белка. или вирусный вектор ( e.грамм. , RV 144 протестирован в клинических испытаниях) [87]. 8. Клинические испытанияНесколько вакцин-кандидатов использовались на разных этапах клинических испытаний. Режимы иммунизации первичным вирусным вектором ДНК стали основным выбором для стимуляции иммунных ответов Т-клеток. Например, векторные вакцины на основе поксвируса , включая модифицированную вакцину осповакцины Ankara и генетически модифицированные вакцины на основе NYVAC, оказались эффективными в индукции иммунных ответов, и их можно было оценить в сочетании с праймированием ДНК в клинических испытаниях [91].Кроме того, безопасность и иммуногенность нескольких вакцин на основе Canarypox- с множественными вставками гена ВИЧ-1 были изучены на людях. Испытание фазы III, RV144, с использованием прайма Canarypox (vCP1521) и бустера AIDSVAX B / E продемонстрировало умеренную защитную эффективность в Таиланде. Защита в испытании RV144 была краткосрочной и требовала использования дополнительных бустеров у участников для улучшения реакции на отзыв и постоянной защиты среди них. AIDSVAX был также компонентом первичной вакцины (ALVAC / AIDSVAX) RV 144 в Таиланде, которая показала успешные результаты.В обоих случаях вакцины были нацелены на gp120 и были специфичны для географических регионов. Среди кандидатов в вакцины с аденовирусным вектором кандидат Ad5 с дефектом репликации показал высокую иммуногенность в клинических испытаниях фазы I и снижение вирусной нагрузки в модели SHIV / NHP. Однако эта стратегия не смогла предотвратить новые инфекции, а также снизить постинфекционные уровни вирусной РНК у вакцинированных лиц в фазе IIb. Кроме того, участники с уже существующими антителами против вектора Ad5 показали повышенную частоту инфицирования ВИЧ [91].Стратегия гетерологичного прайм-бустинга с использованием прайма ДНК и буста Ad5 рассматривалась во избежание проблемы существовавшего ранее иммунитета. Было показано, что существовавшие ранее Ad5-нейтрализующие антитела не влияли на уровни клеточно-опосредованных ответов у реципиентов первичной бустерной ДНК / rAd5 по сравнению с участниками, которые получали только rAd5. Однако, несмотря на устойчивые иммунные ответы, вызванные стратегией ДНК / Ad5 в испытаниях фазы I и фазы II, стратегия не смогла показать защиту от новых инфекций в фазе IIb [91].Как правило, первичная вакцинация — более эффективный подход по сравнению с другими стратегиями, но ее все же необходимо разработать против ВИЧ-инфекции в будущем. 9. Проблемы, связанные с вакцинами против ВИЧСуществуют некоторые серьезные проблемы, препятствующие разработке вакцины против ВИЧ, как описано ниже. На рисунке 1 кратко показаны эти проблемы. Рисунок 1.Проблемы, связанные с вакцинами для профилактики ВИЧ 9.1. Создание тримерных оболочек ВИЧ-1Остается задача разработать иммуногены ВИЧ-1, которые будут вызывать защитный иммунитет [13].Задача состоит в разработке, разработке и производстве чистого стабильного иммуногена оболочки, имитирующего антигенный профиль функционального шипа оболочки. Сконструированная тримерная оболочка не могла индуцировать bNAb у животных. Модификация тримеров, включая удаление отдельных гликанов, проксимальных к CD4-связывающей области, устранение сайта гликозилирования рядом с петлей gp41, стабилизированные линкером тримерные оболочки gp140, привели к повышению иммуногенности, но не дали желаемого bNAb.Комбинация мозаичных оболочек увеличивала величину NAbs, но не увеличивала ответ у макак. Следовательно, тримерная оболочка не индуцирует bNAb у человека [1]. Некоторые исследования показали, что bNAbs ВИЧ-1 идентифицирует четыре консервативных мишени Env для нейтрализации ВИЧ. К настоящему времени охарактеризовано более 30 bNAb, специфичных для консервативных нейтрализующих эпитопов Env [17]. 9.2. Почему вакцинация ВИЧ-конвертом не вызывает bNAb?Будет ли bNAb эффективно обеспечивать защиту от ВИЧ-инфекции у людей, остается неизвестным.Альтернативой индукции bNAb вакцинацией иммуногенами является доставка этих bnMAb вирусными векторами (, например, , вектор для переноса гена аденоассоциированного вируса (AAV), экспрессирующий антитела или иммуноадгезины, подобные антителам). Этот подход обеспечивал длительную нейтрализующую активность в сыворотке макак, обеспечивая полную защиту от внутривенного заражения вирулентным SIVmac316. Точно так же полная защита от внутривенного заражения ВИЧ-1 наблюдалась у гуманизированных мышей, получавших AAV, несущих b12, в то время как те, которые получали AAV, несущие 2G12, 4E10 и 2F5, были частично защищены [1].Недавнее исследование показало, что до 50% ВИЧ-инфицированных вырабатывают перекрестно-реактивные антитела, которые нейтрализуют 50% первичных штаммов ВИЧ. Однако когда bNAb развиваются при ВИЧ-инфекции, они возникают только через 2–4 года инфицирования. Напротив, ни одна вакцинация на сегодняшний день не вызвала высоких уровней bNAb. BNAbs нацелены на один из пяти консервативных сайтов на тримере Env ВИЧ: сайт связывания CD4, проксимальный участок мембраны gp41, сайт V3-гликана, сайт V1V2-гликана и мостиковые области gp41-gp120 [51].Каждый из этих сайтов защищен окружающими гликанами, и доступ к каждому из этих сайтов ограничен, так что для связывания этих сайтов Env можно использовать относительно немного комбинаций вариабельной тяжелой цепи антитела (VHDJH) и вариабельной легкой цепи (VL). Примером ограниченного использования VHDJH / VL является использование Vh2-2 в паре с областью 3, определяющей комплементарность VL (LCDR3) из 5 аминокислотных остатков для CD4-связывающего сайта bNAb типа VRC01, и использование Vh2-69, Vk3-20 для 4E10-подобный gp41 bNAbs. Более того, все bNAb обладают одной или несколькими необычными характеристиками, включая высокий уровень соматических мутаций и поли- или аутореактивность, которые могут привести к контролю иммунной толерантности к bNAb.Однако в модели заражения макак-резус вирусом иммунодефицита обезьяны и человека пассивная инфузия новых bNAb могла бы эффективно защитить от заражения SHIV [51]. 9.3. Эффективные адъювантыАдъюванты важны для использования рекомбинантных иммуногенов оболочки, поскольку эти белки сами по себе вызывают только слабые иммунные ответы. Для сильнодействующих вакцинных композиций, доставляемых через слизистые оболочки, включение адъювантов, контролирующих потенциал врожденных иммунных модуляторов, важно для преодоления иммунной толерантности и повышения иммуногенности совместно вводимых антигенов [25].В исследовании RV144 в качестве адъюванта использовались квасцы, которые на тот момент были единственным лицензированным адъювантом для вакцины. Однако считается, что квасцы не поддерживают устойчивый клеточный иммунный ответ. Кроме того, бактериальные токсины являются наиболее сильными кандидатами в адъюванты для слизистых оболочек, но остаются опасения по поводу их безопасности даже при мутации для снижения токсичности. Напротив, лиганды TLR 7/8 и 9 служат мощными адъювантами для парентеральных и слизистых вакцин на основе плазмидной ДНК, вирусных векторов и рекомбинантных белков [25]. В частности, CpG-содержащие синтетические олигодезоксинуклеотиды (CpG-ODN), которые активируют TLR9 на дендритных клетках, оказываются эффективными в стимуляции презентации антигена и индукции антиген-специфических иммунных ответов.Синтетический гликолипид-α-галактозилцерамид был протестирован в основном в исследованиях иммунотерапии рака из-за его способности служить лигандом и мощным активатором инвариантных естественных Т-клеток-киллеров. Кроме того, повторная доставка адъюванта α-GalCer через слизистые оболочки выполнялась при первичной и бустерной иммунизации, что приводило к повторной активации NKT-клеток и DC для прогрессивного усиления адаптивных иммунных ответов [25]. Для создания успешной вакцины против СПИДа потребуется параллельная разработка адъювантов вместе с лучшими иммуногенами ВИЧ-1.Дополнительное сравнительное тестирование потребуется для определения оптимального режима адъюванта и иммуногена, который может вызвать ответы антител, способных блокировать передачу ВИЧ-1 [92]. Флагеллин (fliC) и IL-18 (фактор, индуцирующий интерферон-γ) были разработаны в качестве адъювантов для повышения иммуногенности у ДНК-вакцинированных хозяев. Плазмида Gag ВИЧ-1 кодирует белок, несущий широкие эпитопы для CTL [93]. Иммуногенность мышей BALB / c, иммунизированных плазмидой Gag ВИЧ-1 (pVAX / Gag) в сочетании с химерной плазмидой, кодирующей IL-18, слитый с флагеллином (pcDNA3 / IL-18_fliC), или единственной плазмидой, кодирующей IL-18 (pcDNA3 / IL-18) и / или флагеллин (pcDNA3 / fliC).Слитый белок IL-18 и флагеллина эффективно индуцировал IFN-γ лимфоцитами. Во время 12-недельной иммунизации как Gag-специфический IgG в сыворотке, так и пролиферация клеток селезенки были повышены во всех группах мышей. Однако соотношение IgG2a / IgG1, продукция цитокинов Th2 (IL-2 и IFN-γ) и доля Gag-специфических CD3 + CD8 + IFN-γ-секретирующих клеток были значительно увеличены в группе мышей. -иммунизированные плазмидой pVAX / Gag и pcDNA3 / IL-18_fliC по сравнению с мышами, иммунизированными плазмидой pVAX / Gag в сочетании с плазмидой pcDNA3 / fliC или pcDNA3 / IL-18, либо с ними обоими.Данные свидетельствуют о том, что химерная плазмида, кодирующая IL-18, слитый с флагеллином, может использоваться в качестве адъювантоподобной плазмиды для улучшения иммунного ответа Th2, в частности, для индукции CD3 + CD8 + IFN-γ-секретирующих клеток в Мыши, вакцинированные плазмидой Gag [93]. 9.4. Высокая частота мутаций ВИЧ-1Высокая частота мутаций ВИЧ-1 и устойчивость к генетическому разнообразию представляли собой центральные проблемы при разработке вакцины. Поскольку иммунный ответ сам по себе является адаптивным, оптимальная последовательность ВИЧ-1 у человека также меняется со временем.В геноме ВИЧ-1 развиваются специфические мутации, которые позволяют избежать обнаружения иммунными ответами, ограниченными человеческим лейкоцитарным антигеном (HLA) класса I, в частности, CD8 + CTL. Таким образом, HLA представляет собой главную силу, движущую эволюцию и разнообразие ВИЧ-1 у людей [94] . 9,5. Ускользнувшие вариантыОсновная проблема заключается в том, как вызвать эффективные иммунные ответы против ускользнувших вариантов. Важно, чтобы вакцина на основе CTL стимулировала эффективные клеточные ответы в диапазоне аллелей HLA класса I, экспрессируемых в популяции хозяина.Эти наблюдения привели к идее, что иммуноопосредованный контроль репликации ВИЧ-1 до уровней, замедляющих прогрессирование заболевания, может быть осуществим за счет разработки вакцин, которые фокусируют ответы CTL против вирусных областей, ускользание которых невозможно [94]. На сегодняшний день первичные вакцины с аденовирусным вектором и буст-вакцины с осповектором являются одними из наиболее иммуногенных вакцин для индукции Т-клеточных ответов CD8 ВИЧ у людей. Продолжаются усилия по преодолению разнообразия ВИЧ для распознавания Т-клеточных эпитопов с помощью дизайна in silico централизованных консенсусных или мозаичных вставок генов ВИЧ на основе оптимизации охвата Т-клеточных эпитопов в штаммах ВИЧ в базе данных последовательностей ВИЧ Лос-Аламоса или на основе на консервативных эпитопах в вакцине [51]. 9.6. Экспрессия bNAb ограничена механизмами толерантности хозяина.Исследования показали, что два рекомбинантных bNAb человека, названные 2F5 и 4E10, которые связываются около мембраны вириона с Env gp41, были реактивными в анализах аутоантител человека. В последующем исследовании было показано, что 2F5 активно связывает человеческую протеин кинурениназу (KYNU), а 4E10 реагирует с фактором сплайсинга РНК млекопитающих 3B3. Номинальным эпитопом gp41 2F5 bNAb является линейный пептид ELDKWAS, и идентичная последовательность из 6 остатков присутствует в KYNU (ELDKWA).Этот мотив ELDKWA в KYNU консервативен почти у всех видов млекопитающих и отсутствует во всех белках, кроме Env ВИЧ. Таким образом, были идентифицированы аутоантигены для этих двух bNAbs, 2F5 и 4E10, что позволяет предположить, что экспрессия этих bNAb ограничена механизмами толерантности хозяина [17]. 9.7. Проблемы при разработке вакцин, нацеленных на вирусные гликановые эпитопыГенерация антител к гликанам имеет несколько проблем: а) из-за присущей слабости углеводно-белковых взаимодействий аффинность связывания должна быть увеличена за счет эффектов авидности.Например, лектины способны преодолеть эту проблему, используя взаимодействие множества доменов связывания углеводов с массивами гликановых лигандов; б) гликопротеины обычно всегда существуют в виде ряда различных гликоформ, в которых один и тот же белковый каркас гликозилирован разными гликановыми структурами. Эта микрогетерогенность ослабляет антигенный ответ на отдельные гликановые структуры. Эти множественные конформации могут быть представлены иммунной системе, еще больше ослабляя ответ; c) гликозилирование присуще всем клеткам млекопитающих, поэтому хозяин может проявлять толерантность к этим сахарам.Как правило, эти эффекты приводят к тому, что гликаны плохо иммуногенны. Основное беспокойство при создании антител против структур собственных гликанов — их потенциальная аутореактивность in vivo [95]. 9,8. Модель на животных для доклинических исследованийСуществует несколько моделей приматов, отличных от человека, с повышенной чувствительностью к ВИЧ [96]. Исследования на животных моделях в последние годы были сосредоточены на разработке моделей для изучения ключевых вопросов о проникновении ВИЧ, иммунном контроле и устойчивости, а также их использовании для тестирования терапевтических вакцин [97]. 9.9. Дизайн новых оболочечных иммуногеновОсновной проблемой для разработки В-клеточной вакцины против ВИЧ-1 является создание новых оболочечных иммуногенов, которые могут запускать отбор и размножение предшественников зародышевой линии и промежуточных В-клеток памяти, связанных с созреванием широко нейтрализующих антител ответ. Идентификация систем доставки, стратегии первичного повышения и синергетического адъюванта . |



 Разница между ними заключается в их дозировке. Суспензия содержит 1000 мг, а таблетки 500 мг активного вещества. Лучшей формой для приема Детралекса является суспензия, которая производится в упаковке в виде саше. Она готова к употреблению и не требует дополнительно запивать ее водой.
Разница между ними заключается в их дозировке. Суспензия содержит 1000 мг, а таблетки 500 мг активного вещества. Лучшей формой для приема Детралекса является суспензия, которая производится в упаковке в виде саше. Она готова к употреблению и не требует дополнительно запивать ее водой.